2. 中国科学院南京土壤研究所土壤环境与污染修复重点实验室, 南京 210008;
3. 教育部植物-土壤相互作用重点实验室, 北京 100193;
4. 农业部华北耕地保育重点实验室, 北京 100193
2. Key Laboratory of Soil Environment and Pollution Remediation, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China;
3. Key Laboratory of Plant-Soil Interactions, Ministry of Education, Beijing 100193, China;
4. Key Laboratory of Arable Land Conservation(North China), Ministry of Agriculture, Beijing 100193, China
近年来,重金属污染因其潜伏性、长期性和不可逆转性而成为全球所关注的环境问题[1]。其中,镉是毒性最大的重金属之一[2],其对人体健康的危害极大,即使在非常低的浓度下,也能诱发钙代谢紊乱、增加心脏病和癌症的发病率[3]。痛痛病、肾脏损害和肺气肿等都是镉的有害影响[4]。目前,处理水体重金属污染的方法繁多,主要包括离子交换、化学沉淀、膜过滤和吸附法等[5],这些方法在应用于大量废水的处理时大部分表现出操作繁琐和成本高昂等劣势,但吸附法因其吸附去除效率高、成本低、选择性好而被广泛应用[6],其对污染物吸附去除效果很大程度上取决于吸附剂的选择。
羟基磷灰石(Hydroxyapatite,HAP)作为骨骼中主要的无机成分,是最常用的生物材料,已经在医学中使用了40多年[7]。其作为磷灰石矿物的一员,因为具有优秀的重金属吸附能力、低水溶性、低成本和在氧化还原条件下的高稳定性而成为处理长期污染物的理想吸附材料[8]。自20世纪80年代至今已有大量HAP应用于重金属吸附去除的报道,如Cu2+、Cd2+、Zn2+和Pb2+等[8-10]。纳米羟基磷灰石表面活性常受其粒径限制:粒径越小,或能对重金属表现出更高的吸附活性[9],也因此具有极大的应用潜力。但纳米材料的实际应用仍然面临挑战,如相对高的聚集倾向。王莉丽等[11]指出,纳米羟基磷灰石粉末团聚程度非常高,这可能对其吸附效果产生影响。有研究表明,纳米羟基磷灰石在污染修复上的应用受限于其本身的聚集性[12]。但这些研究并没有关注纳米羟基磷灰石聚集特性对重金属吸附性能的影响。
表面活性剂因其结构特性而表现出良好的分散性,如Wang等[13]在石墨烯纳米片悬浮液中加入阳离子型表面活性剂十六烷基三甲基溴化铵(CTAB)后,其尺寸更小,层数更少。黄新民等[14]的研究表明,恰当选择和使用表面活性剂可以有效地分散纳米TiO2粒子。因此,本研究选取阴离子型表面活性剂十二烷基苯磺酸钠(SDBS)对纳米羟基磷灰石进行分散改性,分析改性前后纳米羟基磷灰石的差异,并深入探讨纳米羟基磷灰石的聚集特性对其Cd2+吸附特性的影响机制。
1 材料与方法 1.1 实验试剂与仪器实验采用的纳米羟基磷灰石(nHAP)粒径为60 nm,纯度>96%,购自南京埃普瑞纳米材料有限公司;十二烷基苯磺酸钠[CH3(CH2)11SO3Na,SDBS]和氯化钠(NaCl)为分析纯,购自国药集团化学试剂有限公司;氯化镉(CdCl2·2.5H2O)购自上海阿拉丁生化科技股份有限公司;实验所用水均为超纯水。
实验仪器包括:分析天平(ME,梅特勒-托利多仪器有限公司,瑞士)、超声波清洗器(KQ-300,昆山市超声仪器有限公司)、调速振荡器(HY-4H,常州市凯航仪器有限公司)、Zeta激光粒度电位仪(Zetasizer Nano-ZS90,马尔文仪器有限公司,英国)、ICP-OES(Avio200,珀金埃尔默股份有限公司,美国)。
1.2 表征分析使用透射电子显微镜(TEM,JEOL JEM-1230 JPN,日本电子株式会社,日本)测定nHAP及其表面活性剂改性材料的形态、大小和水合状态。使用X射线衍射仪(XRD,D8,布鲁克科技有限公司,德国)对样品粉体进行扫描(2θ=10°~70°),测定nHAP及其表面活性剂改性材料的晶体结构。使用傅里叶变换红外光谱仪(FTIR,Nixolet iS50,赛默飞世尔科技有限公司,美国)测定nHAP及其表面活性剂改性材料的表面官能团种类状况,扫描范围为4000~400 cm-1,扫描速度为0.2 cm-1。使用Zeta激光粒度电位仪测定nHAP及其表面活性剂改性材料的Zeta电位和流体动力学直径(Hydrodynamic diameter,Dh),表征其聚集状况。
1.3 聚集实验将nHAP按固液比1:1000溶于超纯水,向其中加入表面活性剂SDBS,使用功率为300 W的超声波清洗器对混合溶液超声10 min,配制成含有SDBS 0.05%质量浓度的nHAP悬浊液,记为S-HAP。按照上述步骤,不加入表面活性剂制得的悬浮液作为对照,标记为B-HAP。
nHAP的聚集性以纳米悬浮液中颗粒Dh值随时间的变化趋势来表征,用Zeta激光粒度电位仪在633 nm工作波长,90°散射角条件下,采用时间分辨动态光散射方法(TR-DLS)对颗粒Dh值进行测定。测定前抽取0.5 mL的B-HAP和S-HAP分别与0.5 mL 20 mmol·L-1的NaCl溶液混合,保持悬浮液与电解质溶液体积比为1:1。混合液涡旋5 s后开始测定,而后每隔30 s监测一次Dh值,至20 min时停止。
1.4 吸附实验使用CdCl2·2.5H2O配制成1000 mg·L-1的Cd2+储备液。分别量取5 mL的B-HAP和S-HAP于15 mL聚乙烯离心管中。吸附动力学实验:分别向含有B-HAP和S-HAP的离心管中加入100 mg·L-1的Cd2+溶液,设置振荡时间为1、5、10、30、60、120 min。等温吸附实验:分别向含有B-HAP和S-HAP的离心管中加入4、10、20、40、50、60、70、80 mg·L-1的Cd2+溶液,振荡时间为120 min。吸附动力学和等温吸附实验均在室温(25 ℃)和恒定pH条件下,以150 r·min-1进行振荡,每组实验重复3次。样品用0.22 μm无机滤膜过滤后使用ICP-OES测定溶液中的Cd2+浓度。
1.5 DLVO计算本实验采用DLVO理论来计算相互作用的纳米颗粒之间的总势能(Φtot),以表征纳米颗粒之间的聚集倾向,计算公式:
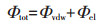
|
(1) |
式中:Φvdw为范德华引力势能;Φel为静电斥力势能。
范德华引力势能的表达式[15]:
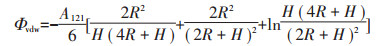
|
(2) |
式中:R为胶体半径;H为胶体与胶体之间的相互作用距离;A为Hamaker常数;A121为胶体-溶液体系的Hamaker常数,其计算公式[16]:

|
(3) |
式中:1表示纳米颗粒,2表示水;A11为HAP的Hamaker常数,6.0×10−20 J [17];A22为水的Hamaker常数,3.7×10-20 J [18]。
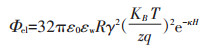
|
(4) |
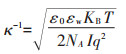
|
(5) |
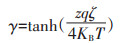
|
(6) |
式中:ε0为真空的介电常数,8.854×10-12 C2·N-1·K-1;εw为水的相对介电常数,78.55;KB为玻尔兹曼常数,1.381×10-23 C2·J·K-1;T为绝对温度,293 K;z为离子价态;q为基本电子电荷,1.602×10-19 C;I为溶液离子强度;NA为阿伏伽德罗常数,6.02×1023 mol-1;κ为德拜-休克尔参数;γ为颗粒的表面电势,目前普遍采用Zeta(ζ)电势来计算表面电势(式6),ζ电势可以通过Zeta激光粒度电位仪测得。
1.6 数据分析使用Excel 2016和SPSS 20.0进行实验数据的处理与分析,使用SigmaPlot 12.5进行模型拟合与绘图。
2 结果与讨论 2.1 B-HAP和S-HAP的性质 2.1.1 TEM分析图 1为B-HAP和S-HAP的TEM图像。图 1a显示,nHAP具有杆状结构,其颗粒间发生明显的团聚现象,团聚体直径约为900~1400 nm。图 1b显示,S-HAP中的团聚体直径为400~700 nm,团聚程度明显低于B-HAP,表明SDBS改性极大地增强了nHAP在超纯水中的稳定性。

|
图 1 B-HAP和S-HAP的TEM图像 Figure 1 TEM imagines of B-HAP and S-HAP |
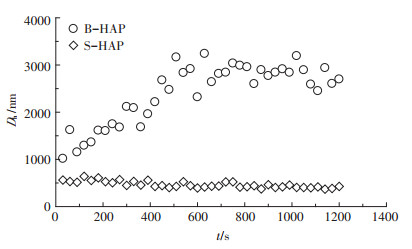
图 2为B-HAP和S-HAP在10 mmol·L-1 NaCl条件下Dh值和时间的变化关系,表征了B-HAP的聚集特性。图 2显示,B-HAP的Dh值在前600 s大致呈现出线性增大趋势,由初始1000 nm增大至2500 nm,随后保持不变。而S-HAP的Dh值随时间的变化则不明显,始终稳定在450 nm左右。比较B-HAP和S-HAP的聚集状况可知,SDBS改性不仅明显减小了nHAP的Dh值,而且极大地增强了nHAP的稳定性,表明SDBS对nHAP具有强烈的分散能力。Park等[20]用十二烷基硫酸钠(SDS)改性纳米氧化锌的研究中也得到了相似的结果。
|
图 2 B-HAP和S-HAP的聚集曲线 Figure 2 Aggregation curves of B-HAP and S-HAP |
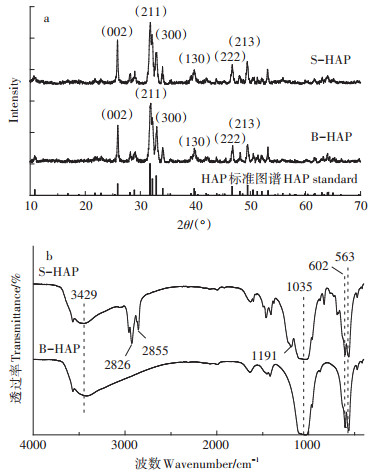
图 3a为B-HAP和S-HAP的X射线衍射图谱。B-HAP和S-HAP的2θ衍射角对应的衍射峰均与HAP的标准衍射卡片(PDF,NO.74-0566)比对结果一致。在B-HAP和S-HAP的XRD图谱中,(002)、(211)、(300)、(130)、(222)和(213)等特征峰均在相应峰位出现,且未发生明显的偏移现象,其中B-HAP和S-HAP的衍射峰峰强均较高,且两个晶面衍射峰(002)、(211)峰窄,表明这两种材料的纯度较高[21]。与B-HAP相比,S-HAP中并未观察到有新的物相生成,表明HAP为样品中的唯一结晶成分,这和已有的报道结果一致[22]。图中(002)和(300)等特征峰的减弱则可能是SDBS吸附在nHAP表面造成的[23],说明这种改性可能只是表面特性的改变,即改性只发生在nHAP的表面。
|
图 3 B-HAP和S-HAP的X射线衍射图(a)和FTIR图谱(b) Figure 3 XRD patterns (a)and FTIR sperctrum(b)of B-HAP and S-HAP |
图 3b为B-HAP和S-HAP的傅里叶变换红外光谱分析结果,表征了两种材料的表面官能团特性。B-HAP和S-HAP表面官能团种类大体上表现出一致性,其中3429 cm-1处的吸收峰是-OH伸缩振动引起的[24],1035 cm-1处的吸收峰对应PO43-的v3振动吸收峰,602 cm-1和563 cm-1处的吸收峰对应PO43-的v4振动吸收峰[25],其中-OH和PO43-均为HAP的特征谱带[21]。与B-HAP相比,S-HAP谱图中有更多的吸收峰,其在2826、2855 cm-1和1191 cm-1处出现的吸收峰分别对应于对称和不对称的-CH2及SO32-的伸缩振动[26]。而对称和不对称的-CH2及SO32-是SDBS的特征谱带,表明nHAP经SDBS改性后,引入了新的官能团。对比图 3b中B-HAP及S-HAP的FTIR谱图结果可知,两种材料的-OH及PO43-特征峰并未发生明显的偏移,且对应特征峰之间的吸收强度无显著差异,这表明nHAP经SDBS改性后,只引入了新的官能团,而并未对其本身结构产生影响,这和XRD结果是一致的。
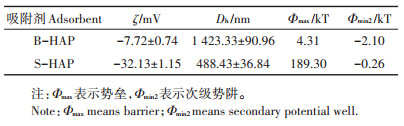
2.2 DLVO相互作用B-HAP和S-HAP的ζ、Dh值及DLVO参数如表 1所示。B-HAP和S-HAP均带负电荷,且SDBS改性后,nHAP颗粒带负电荷数量增加,其ζ电势由-7.72 mV减小至-32.13 mV,颗粒平均Dh值由1 423.33 nm减小至488.43 nm。这可能是因为SDBS为阴离子型表面活性剂,其带有大量负电荷[27],当它吸附在nHAP表面时,显著增大了nHAP表面ζ电势绝对值,颗粒间静电斥力增加,阻碍了颗粒之间的聚集作用,从而导致粒径减小。
|
|
表 1 B-HAP和S-HAP的ζ、Dh值和DLVO参数 Table 1 The Zeta potential, Dh value and calculated DLVO parameters of B-HAP and S-HAP |
现阶段关于纳米材料聚集特性对其吸附性能的影响已有一些研究。Jin等[28]指出,CTAB改性极大地抑制了纳米四氧化三铁的聚集,其吸附砷的能力是未改性纳米四氧化三铁的两倍。甘莉等[29]利用离子型表面活性剂改性纳米氧化铁的研究表明,CTAB通过抑制纳米氧化铁的聚集从而显著提高了其对于磷酸盐的吸附能力。路则洋等[30]的研究表明,CTAB对纳米氧化铁具有很好的稳定性和分散性,CTAB改性纳米氧化铁对硝酸盐的去除率达97.32%,比未改性纳米氧化铁高出23%。但这些研究并未对表面活性剂如何抑制纳米颗粒的聚集以及聚集特性如何影响吸附性能进行更进一步的分析。
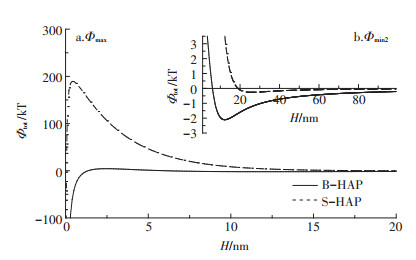
nHAP改性前后颗粒之间的DLVO势能曲线如图 4所示,表征纳米颗粒之间的Φtot值随颗粒之间H的变化关系。由图可知,H很小时,颗粒间的相互作用由范德华引力主导,在此范围内存在一个极小势能值,即初级势阱,此时纳米颗粒易发生聚沉作用;随着H逐渐增大,静电斥力和范德华引力以不同速率减小,总势能在此范围内存在一个极大值与极小值,即势垒(Φmax)和次级势阱(Φmin2)。只有颗粒的热运动能大于Φmax时,颗粒才有可能越过此Φmax,落入Φmin2,从而发生聚集;Hahn和O′ Melia[31]指出,一般Φmin2绝对值超过平均热运动能(0.5 kT),即可发生可逆性聚集,且Φmin2绝对值越大,颗粒越容易发生聚集[32]。由图 4可知,SDBS改性后,体系的Φmax值显著增大,由4.31 kT增大至189.30 kT,极大地减小了颗粒越过Φmax发生聚沉的可能性,另外,其Φmin2绝对值由2.10 kT减小至0.26 kT,小于平均热运动能,从而阻碍了nHAP颗粒在第二极小势能处的聚集。
|
图 4 B-HAP和S-HAP颗粒之间的DLVO势能曲线 Figure 4 Calculated DLVO interaction energy profiles for B-HAP and S-HAP |
TEM分析结果可知,由于DLVO作用,nHAP颗粒之间会聚集形成巨大的团聚体,这将导致彼此之间的外表面相互覆盖而失去其有效性,造成比表面积的下降。而SDBS改性后,nHAP之间的聚集现象受到了明显的抑制。这表明SDBS改性后,HAP的比表面积将会增大[20]。而da Rocha等[33]指出,HAP对Cd2+的吸附能力强弱,与其溶解能力、Ca/P等因素无关,而主要由其比表面积所控制;Zhang等[34]的研究也表明HAP对Cd2+的吸附量随其比表面积的增加而增大。
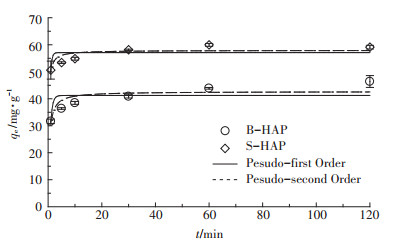
2.3 吸附动力学B-HAP和S-HAP对Cd2+的吸附量随接触时间变化关系如图 5所示。B-HAP和S-HAP对Cd2+的吸附量均随接触时间的增加而增大,在吸附反应进行1 min时B-HAP的吸附去除率为31.64%,而S-HAP的吸附效率则更快,为50.61%。这种在吸附反应前期的速率增加可能是SDBS改性使nHAP的分散度明显提高,增加了单位时间Cd2+接触nHAP的几率。甘莉等[29]的研究也得到了相似的结果。在整个吸附动力学过程中,吸附反应在前10 min表现出较快的吸附速率,往后随着接触时间的增加,吸附速率逐渐减小直至吸附反应达到平衡状态,其中S-HAP(t=1 h)比B-HAP(t=2 h)更先达至平衡。这表明,nHAP经SDBS改性后,其对Cd2+的吸附速率及吸附量均显著增加。
|
图 5 B-HAP和S-HAP对Cd2+的吸附量和时间的关系 Figure 5 Adsorption kinetics of Cd2+ on B-HAP and S-HAP |
吸附动力学是确定吸附效率的重要特征[35],因此,本研究采用拟一级(式7)和拟二级(式8)动力学模型[36]对实验的动力学数据进行拟合:
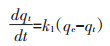
|
(7) |
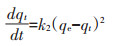
|
(8) |
式中:t为吸附反应时间,min;qt和qe分别为t时刻和吸附反应达到平衡时的吸附量,mg·kg-1;k1和k2分别为拟一级吸附速率常数(min-1)和拟二级吸附速率常数(g·mg-1·min-1)。
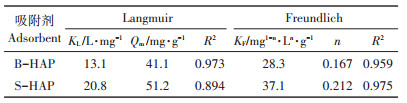
吸附动力学模型拟合结果如表 2所示。比较R2可知,拟二级动力学模型能更好地描述S-HAP和B-HAP对Cd2+的吸附动力学过程,这说明B-HAP和S-HAP对Cd2+的吸附过程可能均受化学吸附控制[37]。吸附速率常数k2值越大,表明吸附过程进行的速度越快,吸附反应达到平衡所需要的时间也越短[38]。由表 2可知,S-HAP的k2值是B-HAP的1.85倍,表明SDBS改性后,nHAP对Cd2+的吸附速率明显增强。
|
|
表 2 B-HAP和S-HAP吸附Cd2+的动力学模型拟合参数 Table 2 Parameters of kinetic models for Cd2+ adsorption on B-HAP and S-HAP |
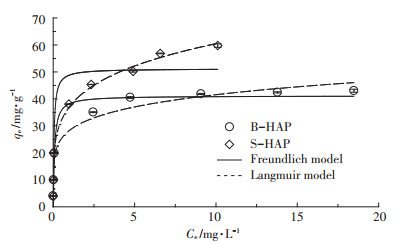
B-HAP和S-HAP对Cd2+的吸附等温线(25 ℃,2 h)如图 6所示。两种吸附材料对Cd2+的吸附量均随平衡浓度的增加而增大,其中B-HAP在平衡浓度为13 mg·L-1左右处达到吸附平衡状态,而S-HAP的吸附过程则未达到平衡。由图可知,实验条件下,S-HAP对Cd2+的最大吸附量为59.77 mg·g-1,是B-HAP的1.39倍(43.03 mg·g-1),这表明SDBS改性极大地增强了nHAP对Cd2+的吸附能力。
|
图 6 B-HAP和S-HAP对Cd2+的吸附量与平衡浓度之间的关系 Figure 6 Adsorption isotherms of Cd2+ on B-HAP and S-HAP |
分别采用Langmuir(式9)和Freundlich(式10)吸附模型对nHAP及SDBS改性材料对Cd2+的等温吸附实验数据进行拟合:
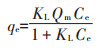
|
(9) |
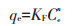
|
(10) |
式中:qe为吸附反应达到平衡时的吸附量,mg·kg-1;Qm为吸附材料对Cd2+的最大吸附量,mg·kg-1;Ce为吸附反应达到平衡时溶液中Cd2+的浓度,mg·L-1;n为经验常数;KL和KF分别为Langmuir吸附平衡常数(L·mg-1)和Freundlich吸附平衡常数(mg1-n·Ln·g-1)。
Langmuir和Freundlich吸附模型对等温吸附数据的拟合结果如表 3所示。比较R2可知,Langmuir模型和Freundlich模型均能较好地描述B-HAP对Cd2+的吸附过程,而S-HAP对Cd2+的吸附过程则更符合Freundlich吸附模型,这可能是SDBS改性对HAP吸附Cd2+的过程产生了显著影响,吸附机理偏向多层吸附[5]。Freundlich模型中KF值越大,则吸附能力越强[39]。表 2中显示S-HAP的KF值大于B-HAP,进一步说明S-HAP对Cd2+的吸附能力强于B-HAP。这表明SDBS改性明显增强了nHAP对Cd2+的吸附能力。
|
|
表 3 B-HAP和S-HAP对Cd2+的等温吸附模型参数 Table 3 Parameters of isotherm models for Cd2+ adsorption on B-HAP and S-HAP |
综上所述,SDBS通过抑制nHAP聚集,增大其比表面积,从而增强了对Cd2+的吸附能力,但Shu等[40]指出,用表面活性剂进行改性时,其本身对于污染物的吸附能力不容忽视。因此本研究分析了S-HAP对Cd2+吸附前后的FTIR谱图(图 7):吸附Cd2+后并未出现新的吸收峰,-OH(3429 cm-1处的吸收峰)、PO43-的v3(1035 cm-1的吸收峰)和v4(563 cm-1和602 cm-1)等振动吸收峰均在相应峰位出现,未发生明显变化;原有的S-HAP的对称和不对称的-CH2对应的吸收峰峰强没有明显变化,但SO32-的峰强有所减弱。Nuhoglu等[41]认为这可能是SO32-与Cd2+结合所引起的,而Lee等[42]分别用SDS、SDBS和SO(辛酸钠)等阴离子型表面活性剂对活性炭进行改性的研究也表明,活性炭表面负载的表面活性剂为其引入的官能团(SO42-、SO32-和COO-)为Cd2+吸附提供了额外的离子交换位点。SDBS改性为nHAP引入的SO32-可以和Cd2+结合从而增大nHAP的吸附能力,说明SDBS本身对于促进nHAP吸附Cd2+的贡献的确存在,但其贡献量还鲜有研究。
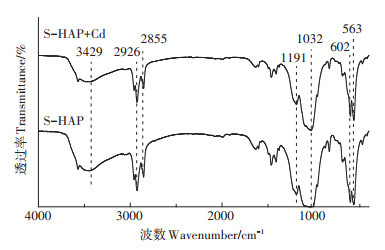
|
图 7 S-HAP吸附Cd2+前后的FTIR图谱 Figure 7 FTIR spectrum of before and after Cd2+ adsorption on S-HAP |
(1)纳米羟基磷灰石(nHAP)颗粒之间发生了明显的聚集现象,十二烷基苯磺酸钠(SDBS)附着在nHAP表面,能够极大地抑制其聚集现象的发生;SDBS改性使nHAP带有更多的负电荷,极大地增加了势垒,减小了次级势阱,有效降低颗粒间团聚的概率,增加了整个体系的稳定性。
(2)改性(S-HAP)和未改性(B-HAP)的nHAP对Cd2+的吸附动力学过程更符合拟二级动力学模型,其中S-HAP的k2值是B-HAP的1.85倍;等温吸附过程更符合Freundlich模型,S-HAP对Cd2+的吸附能力显著高于B-HAP。
(3)SDBS改性影响nHAP吸附Cd2+的可能机制主要包括:SDBS改性后极大地抑制了nHAP聚集现象的发生,从而增大了nHAP的比表面积;SDBS改性后引入的SO32-为Cd2+的吸附提供了更多的位点。
| [1] |
周建斌, 邓丛静, 陈金林, 等. 棉秆炭对镉污染土壤的修复效果[J]. 生态环境, 2008, 17(5): 1857-1860. ZHOU Jian-bin, DENG Cong-jing, CHEN Jin-lin, et al. Remediation effects of cotton stalk carbon on cadmium(Cd)contaminated soil[J]. Ecology and Environment, 2008, 17(5): 1857-1860. DOI:10.3969/j.issn.1674-5906.2008.05.028 |
| [2] |
Pal P, Pal A. Surfactant-modified chitosan beads for cadmium ion adsorption[J]. International Journal of Biological Macromolecules, 2017, 104(Pt B): 1548-1555. |
| [3] |
Liu X, Li N, Xu M M, et al. Turn on fluorescent detection for Cd2+ based on surfactant controlled squaraine aggregation[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2019, 208: 236-242. DOI:10.1016/j.saa.2018.10.012 |
| [4] |
Mobasherpour I, Salahi E, Pazouki M. Removal of divalent cadmium cations by means of synthetic nano crystallite hydroxyapatite[J]. Desalination, 2010, 266(1/2/3): 142-148. |
| [5] |
Xiao X, Yang L, Zhou D, et al. Magnetic γ-Fe2O3/Fe-doped hydroxyapatite nanostructures as high-efficiency cadmium adsorbents[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2018, 555: 548-557. |
| [6] |
Guo S, Jiao P, Dan Z, et al. Preparation of L-arginine modified magnetic adsorbent by one-step method for removal of Zn(Ⅱ)and Cd(Ⅱ) from aqueous solution[J]. Chemical Engineering Journal, 2017, 317: 999-1011. DOI:10.1016/j.cej.2017.02.136 |
| [7] |
Harun W S W, Asri R I M, Alias J, et al. A comprehensive review of hydroxyapatite-based coatings adhesion on metallic biomaterials[J]. Ceramics International, 2018, 44(2): 1250-1268. |
| [8] |
Feng Y, Gong J L, Zeng G M, et al. Adsorption of Cd(Ⅱ)and Zn(Ⅱ) from aqueous solutions using magnetic hydroxyapatite nanoparticles as adsorbents[J]. Chemical Engineering Journal, 2010, 162(2): 487-494. DOI:10.1016/j.cej.2010.05.049 |
| [9] |
Jing N, Zhou A N, Xu Q H. The synthesis of super-small nano hydroxyapatite and its high adsorptions to mixed heavy metallic ions[J]. Journal of Hazardous Materials, 2018, 353: 89-98. DOI:10.1016/j.jhazmat.2018.02.049 |
| [10] |
胡田田, 仓龙, 王玉军, 等. 铅和铜离子在纳米羟基磷灰石上的竞争吸附动力学研究[J]. 环境科学, 2012, 33(8): 2875-2881. HU Tian -tian, CANG Long, WANG Yu-jun, et al. Competitive adsorption kinetics of aqueous Pb2+ and Cu2+ on Nano-HAP surfaces[J]. Environmental Science, 2012, 33(8): 2875-2881. |
| [11] |
王莉丽, 王秀峰, 丁旭, 等. 纳米棒状羟基磷灰石的研究进展[J]. 材料导报, 2012, 26(21): 80-82. WANG Li-li, WANG Xiu -feng, DING Xu, et al. Research progress on nanorod-like hydroxuapatite crystals[J]. Materials Reports, 2012, 26(21): 80-82. DOI:10.3969/j.issn.1005-023X.2012.21.017 |
| [12] |
Wang D, Chu L, Paradelo M, et al. Transport behavior of humic acidmodified nano-hydroxyapatite in saturated packed column:Effects of Cu, ionic strength, and ionic composition[J]. Journal of Colloid and Interface Science, 2011, 360(2): 398-407. DOI:10.1016/j.jcis.2011.04.064 |
| [13] |
Wang B, Liang X. Surface decoration and dispersibility of graphene nanoplatelets in aqueous surfactant solution[J]. Journal of Nanoscience and Nanotechnology, 2019, 19(4): 2060-2069. DOI:10.1166/jnn.2019.16487 |
| [14] |
黄新民, 吴玉程, 郑玉春, 等. 表面活性剂对复合镀层中TiO2纳米颗粒分散性的影响[J]. 表面技术, 1999, 28(6): 10-12. HUANG Xin-min, WU Yu-cheng, ZHENG Yu-chun, et al. Effect of surfactant on the dispersion of TiO2 nanometer particle of electroless composit coating[J]. Surface Technology, 1999, 28(6): 10-12. |
| [15] |
Eisermann C, Damm C, Winzer B, et al. Stabilization of carbon black particles with Cetyltrimethylammoniumbromide in aqueous media[J]. Powder Technology, 2014, 253: 338-346. DOI:10.1016/j.powtec.2013.11.051 |
| [16] |
Petosa A R, Jaisi D P, Quevedo I R, et al. Aggregation and deposition of engineered nanomaterials in aquatic environments:Role of physicochemical interactions[J]. Environmental Science & Technology, 2010, 44(17): 6532-6549. |
| [17] |
Tian J, Zhang Y, Guo X, et al. Preparation and characterization of hydroxyapatite suspensions for solid freeform fabrication[J]. Ceramics International, 2002, 28(3): 299-302. |
| [18] |
Israelachvili J N. Intermolecular and surface forces[M]. San Diego: Academic Press, 1991.
|
| [19] |
Yan C, Cheng T, Shang J. Effect of bovine serum albumin on stability and transport of kaolinite colloid[J]. Water Research, 2019, 155: 204-213. DOI:10.1016/j.watres.2019.02.022 |
| [20] |
Park C M, Wang D, Han J, et al. Evaluation of the colloidal stability and adsorption performance of reduced graphene oxide-elemental silver/magnetite nanohybrids for selected toxic heavy metals in aqueous solutions[J]. Applied Surface Science, 2019, 471: 8-17. DOI:10.1016/j.apsusc.2018.11.240 |
| [21] |
张连科, 王洋, 王维大, 等. 生物炭负载纳米羟基磷灰石复合材料的制备及对铅离子的吸附特性[J]. 化工进展, 2018, 37(9): 3492-3501. ZHANG Lian-ke, WANG Yang, WANG Wei-da, et al. The preparation of biochar-supported nano-hydroxyapatite and its adsorption of Pb2+[J]. Chemical Industry and Engineering Progress, 2018, 37(9): 3492-3501. |
| [22] |
Zhang D, Zhu M, Yu J, et al. Effective removal of brilliant green from aqueous solution with magnetic Fe3O4@SDBS@LDHs composites[J]. Transactions of Nonferrous Metals Society of China, 2017, 27(12): 2673-2681. DOI:10.1016/S1003-6326(17)60296-6 |
| [23] |
Ni X, Li Z, Wang Y. Adsorption characteristics of anionic surfactant sodium dodecylbenzene sulfonate on the surface of montmorillonite minerals[J]. Frontiers in Chemistry, 2018, 6: 390-399. DOI:10.3389/fchem.2018.00390 |
| [24] |
Wei L, Ma J, Zhang W, et al. The tribological behaviors of polyacrylate/graphene oxide and polyacrylate/surfactant-modified reduced graphene oxide composite coatings on flexible leather substrates[J]. Progress in Organic Coatings, 2018, 122: 64-71. DOI:10.1016/j.porgcoat.2018.04.036 |
| [25] |
Zheng Y, Xun L, Ma Y, et al. Controlled synthesis of hydroxyapatite microspheres with hierarchical structure and high cell viability[J]. Materials Letters, 2017, 195: 18-21. DOI:10.1016/j.matlet.2017.02.056 |
| [26] |
Li Y, Wang M, Sun D, et al. Effective removal of emulsified oil from oily wastewater using surfactant-modified sepiolite[J]. Applied Clay Science, 2018, 157: 227-236. DOI:10.1016/j.clay.2018.02.014 |
| [27] |
陈宝梁.表面活性剂在土壤有机污染修复中的作用及机理[D].杭州: 浙江大学, 2004. CHEN Bao-liang. The role of surfactant in soil organic pollutant remediation and its mechanisms[D]. Hangzhou: Zhejiang University, 2004. http://cdmd.cnki.com.cn/Article/CDMD-10335-2004043835.htm |
| [28] |
Jin Y, Liu F, Tong M, et al. Removal of arsenate by cetyltrimethylammonium bromide modified magnetic nanoparticles[J]. Journal of Hazardous Materials, 2012, 227: 461-468. |
| [29] |
甘莉, 曹丹, 金晓英, 等. 离子型表面活性剂改性绿色合成单分散纳米氧化铁的制备及其吸附磷的性能[J]. 环境科学学报, 2015, 35(8): 2442-2449. GAN Li, CAO Dan, JIN Xiao-ying, et al. Surface modification of green synthesized monodisperse iron oxide nanoparticles by ionic surfactant and the application for phosphate adsorption[J]. Acta Scientiae Circumstantiae, 2015, 35(8): 2442-2449. |
| [30] |
路则洋, 曹丹, 甘莉, 等. CTAB调控绿色合成纳米氧化铁及去除亚硝酸盐[J]. 环境工程学报, 2017, 11(6): 3412-3418. LU Ze-yang, CAO Dan, GAN Li, et al. Surface modification of green synthesized iron oxide nanoparticles by CTAB and its adsorption of nitrite[J]. Chinese Journal of Environmental Engineering, 2017, 11(6): 3412-3418. |
| [31] |
Hahn M W, O'Melia C R. Deposition and reentrainment of Brownian particles in porous media under unfavorable chemical conditions:Some concepts and applications[J]. Environmental Science & Technology, 2004, 38(1): 210-220. |
| [32] |
吕雪艳, 孙媛媛, 施小清, 等. 环境因子对两种纳米金属氧化物在水体中稳定性的影响[J]. 农业环境科学学报, 2015, 34(1): 144-154. LÜ Xue-yan, SUN Yuan-yuan, SHI Xiao-qing, et al. Effects of environmental factors on stability of two metal oxide nanoparticles in aqueous medium[J]. Journal of Agro-Environment Science, 2015, 34(1): 144-154. |
| [33] |
da Rocha N C C, de Campos R C, Rossi A M, et al. Cadmium uptake by hydroxyapatite synthesized in different conditions and submitted to thermal treatment[J]. Environmental Science & Technology, 2002, 36(7): 1630-1635. |
| [34] |
Zhang Z, Li M, Chen W, et al. Immobilization of lead and cadmium from aqueous solution and contaminated sediment using nano-hydroxyapatite[J]. Environmental Pollution, 2010, 158(2): 514-519. DOI:10.1016/j.envpol.2009.08.024 |
| [35] |
Killic M, Kirbiyik C, Çepeliogullar Ö, et al. Adsorption of heavy metal ions from aqueous solutions by bio-char, a by-product of pyrolysis[J]. Applied Surface Science, 2013, 283(14): 856-862. |
| [36] |
Guo X, Du B, Wei Q, et al. Synthesis of amino functionalized magnetic graphenes composite material and its application to remove Cr(Ⅵ), Pb(Ⅱ), Hg(Ⅱ), Cd(Ⅱ)and Ni(Ⅱ)from contaminated water[J]. Journal of Hazardous Materials, 2014, 278: 211-220. DOI:10.1016/j.jhazmat.2014.05.075 |
| [37] |
Wang Z, Shen D, Fei S, et al. Phosphate adsorption on lanthanum loaded biochar[J]. Chemosphere, 2016, 150: 1-7. DOI:10.1016/j.chemosphere.2016.02.004 |
| [38] |
尹英杰, 朱司航, 徐东昊, 等. 生物炭和乙醇改性生物炭对铜的吸附研究[J]. 农业环境科学学报, 2017, 36(9): 1877-1883. YIN Ying-jie, ZHU Si-hang, XU Dong-hao, et al. Comparison of copper adsorption onto wheat biochar and ethanol-modified biochar[J]. Journal of Agro-Environment Science, 2017, 36(9): 1877-1883. |
| [39] |
朱司航, 赵晶晶, 尹英杰, 等. 针铁矿改性生物炭对砷吸附性能[J]. 环境科学, 2019, 40(6): 2773-2782. ZHU Si-hang, ZHAO Jing-jing, YIN Ying-jie, et al. Application of goethite modified biochar for arsenic removal from aqueous solution[J]. Environmental Science, 2019, 40(6): 2773-2782. |
| [40] |
Shu Y, Li L, Zhang Q, et al. Equilibrium, kinetics and thermodynamic studies for sorption of chlorobenzenes on CTMAB modified bentonite and kaolinite[J]. Journal of Hazardous Materials, 2010, 173(1/2/3): 47-53. |
| [41] |
Nuhoglu Y, Malkoc E. Thermodynamic and kinetic studies for environmentaly friendly Ni(Ⅱ)biosorption using waste pomace of olive oil factory[J]. Bioresour Technol, 2009, 99(8): 2375-2380. |
| [42] |
Lee W, Yoon S, Choe J K, et al. Anionic surfactant modification of activated carbon for enhancing adsorption of ammonium ion from aqueous solution[J]. Science of the Total Environment, 2018, 639: 1432-1439. DOI:10.1016/j.scitotenv.2018.05.250 |
 2019, Vol. 38
2019, Vol. 38