土壤重金属污染是我国乃至世界上最严峻的环境问题之一[1]。2014年原国家环境保护部和原国土资源部联合开展的全国土壤污染状况调查公告显示,我国土壤重金属超标率占全部超标点位的82.8%[2]。结合我国当前人多地少的基本国情,对大面积重金属污染土壤进行修复工作显得尤为迫切。近年来,植物修复技术因具有安全可靠、环境友好等优势已逐渐成为修复重金属污染土壤的有效途径[3],其主要利用植物及根系微生物群落吸附土壤中的污染物,通过植物提取、植物稳定、植物降解等途径达到修复土壤的效果[3-4]。
对于受到重金属污染的土壤,植物提取是一种最有效的植物修复方式[5],可用来提取重金属的植物主要包括一些重金属高耐性木本植物和超积累植物[6]。现已发现的重金属超积累植物大多存在生物量小、存活率差、生长速度缓慢、生长区域性等局限,导致其修复效果难以保证,难以在野外大规模推广,极大限制了其广泛应用[6]。与超积累植物相比,重金属高耐性木本植物具有适应性强、生物量大、生长速度快、修复效果稳定等明显优势,已有国内外多项研究表明[7],木本植物对多种重金属的提取效果与Zn/Cd超积累作物拟南芥及遏蓝菜相当,且可用于能源生产,具有一定的经济效益[8]。然而,目前的研究仅限于柳树、杨树这两个树种,优质的修复木本植物资源相对匮乏,继续筛选高效的修复植物且能兼顾经济效益对于重金属污染土壤的修复与利用具有重要意义。
南方红豆杉是一种高经济价值的木本植物,其茎、叶、枝、果实、心木、皮均可入药,树皮更是可以提取高效抗癌物质——紫杉醇[9]。有研究报道,南方红豆杉对于重金属有良好的修复效果[10]。鉴于目前我国土壤重金属污染土地面积巨大,加之南方红豆杉相较于柳树等其他木本植物具有经济价值更高、根系更发达等优势,若能探明南方红豆杉对污染土壤重金属积累特征,挖掘并拓展其在污染环境修复领域的应用潜力,则有望为重金属污染土壤的经济利用提供优质的种质资源。
定殖于植物根际的微生物在植物修复过程中发挥着重要作用[11]。此类微生物通常具有金属耐受性,并可以通过以下几种机制促进污染土壤中植物的生长:诱导毛状根的形成,进而增加根表面积;对土壤中金属离子的活化作用,促进植物对金属离子的吸收;产生一些植物激素或植物可利用的代谢物,促进植物生长[12]。且大部分树种根系与土壤微生物可以形成其根际特殊环境,从而起到植物-微生物联合作用的效果[13]。在前期研究中发现,柳树等木本植物对于土壤重金属的耐性和吸收与根际微生物有密切的联系。有研究[14]从重金属Zn/Cd污染土壤上种植的柳树根际分离了44个根际菌株,通过培养实验发现这些细菌对于Zn/Cd均具有抗性,且主要与1-氨基环丙基-1-羧酸脱氨酶(ACCD)、吲哚乙酸以及铁载体的产生过程相关,此类物质被报道都与重金属的解毒、活化过程有密切联系[15-17]。还有研究[18]将3种柳树品种种植于受重金属污染的垃圾填埋场,并于种植后4个月和16个月对根际真菌和细菌群落、土壤理化性质、植物含量进行分析,结果表明柳树对于Zn的积累与根际细菌、真菌具有显著的相关性。可见,木本植物的根际细菌在植物对重金属的耐性和吸收方面发挥着重要作用。然而,以往的研究多局限于实验室研究,在试验大田修复实践中的探究很少,且大部分研究集中在柳树、杨树等植物上,对于具有高经济价值的木本植物根际微生物的研究更是十分匮乏。
综上,本文以高经济价值木本植物南方红豆杉(Taxus wallichiana var. mairei)为研究材料,通过田间试验,探究了南方红豆杉在Cd/Cu复合重金属污染中高价值部位的重金属含量,并采用高通量测序手段探究了重金属复合污染条件下南方红豆杉根际、非根际土壤的细菌群落特征。旨在为重金属污染土壤的充分利用寻找新型高价值植物,并为其在重金属污染土壤上的利用提供重要的理论依据。
1 材料与方法 1.1 研究区概况试验基地位于浙江省临安市白果县河桥镇学川村土壤修复试验基地(30°04′ 55.4″ N,119°02′ 56.4″ E),气候条件属于亚热带季风气候。
试验材料为南方红豆杉。供试土壤的理化性质如下:土壤pH 5.90,有机质含量25.25 g·kg-1,容重1.27 g·cm-3,土壤全量Cd含量3.63 mg·kg-1,有效态Cd含量0.59 mg · kg-1,土壤全量Cu含量71.13 mg · kg-1,有效态Cu含量29.45 mg·kg-1。
1.2 试验方法于2016年3月将南方红豆杉苗均匀随机地种植于重金属修复示范区内,定时浇水,2018年3月进行土壤、植物取样。
1.2.1 样品采集及元素测定挖出植物的部分根系,抖落根系上附着的土壤,仍旧黏附在根表的土壤连同根系浸泡于50 mL无菌磷酸盐缓冲液中(PBS),洗脱下的土壤作为根际土壤,选择远离植物根系的区域作为非根际土壤。所有样品储存于-80 ℃冰箱中用于DNA提取。同时将部分根际土和非根际土样品风干,用于测定重金属含量。称取0.1 g土壤样品,加入5 mL HNO3+1 mL HClO4+1 mL HF于密闭的聚四氟乙烯罐中,180 ℃消煮12 h,用于土壤重金属总量的测定。土壤重金属有效态含量采用DTPA-TEA溶液浸提法,水土比为3:1,具体方法参照土壤农化分析[19];使用pH计测定土壤/水溶液混合物(土水比为1:5)中的土壤pH值。
分别采集南方红豆杉根、茎、叶和树皮。用自来水冲洗干净后用去离子水清洗,65 ℃烘干至恒质量,称取0.1 g植物样品,加入5 mL HNO3和1 mL H2O2于180 ℃消煮8 h,用于测定南方红豆杉各部位的重金属含量。
土壤和植物消煮液根据仪器测定要求先进行一定倍数的稀释,然后采用ICP-MS(Agilent 7500a)测定,分别使用土壤(GBW 07429)和标准米粉(IRMM-804)参照物进行质量控制。土壤重金属有效态浸提液采用ICP-OES(Agailent 7500a)测定。试验数据使用SPSS 18.0进行统计和分析,采用Origin 8.5进行绘图。
1.2.2 土壤DNA提取每个处理取土壤0.5 g,使用德国QIAGEN公司的土壤试剂盒(PowerSoil DNA Isolation Kit)进行土壤DNA的提取,步骤依据厂家试剂盒的使用说明。用分光光度计(SmartSpecTMPlus,Bio-Rad)测定DNA的浓度和质量(A260/A280比值)。
1.2.3 16S测序数据分析和处理使用FLASH软件对16S rRNA序列进行拼接后,通过QIIME(Version 1.9.0)进行后续分析[20],使用USEARCH工具去除嵌合体序列。将得到的高质量有效序列采用UCLUST方法聚类成可操作分类单元(Operational taxonomic units,OTUs)。使用97%的识别阈值,将OTU代表序列与Greengenes数据库(13_ 8_release)比对,完成对物种的注释[21]。
在QIIME(Version 1.9.0)平台中计算α-多样性。α-多样性通过Shannon指数、Oberved species可观测物种数目指数、PD_Whloe_tree指数、Chao 1指数来评估,通过Origin 8.5进行绘图。β-多样性基于样品间的Bray-Curtis(布雷-柯蒂斯)距离进行计算。通过R软件(Version 3.5.1)“ape”包中的“pcoa”功能对红豆杉细菌群落结构进行主坐标分析(PCoA),基于BrayCurtis距离进行样品间的相似度分析。使用R软件“limma”包中的“edgeR”函数进行根际区间之间差异细菌的挑选,使用“ggplot2”完成对差异细菌火山图的绘制。在http://huttenhower.sph.harvard.edu/galaxy/网站上进行最小判别分析(Least discriminant analysis,LDA)以确定根际和非根际区间中的显著差异种属(属水平)[22]。
使用PICRUSt(Phylogenetic Investigation of Communities by Reconstruction of Unobserved States)进行红豆杉不同根际区间细菌功能的预测[23]。首先使用在QIIME中的pick_closed_reference_otus.py脚本,以Greengenes(13_5_release)替换Greengenes数据库(13_8_release)作为参考数据库,使用97%的识别阈值,重新生成的OTU table在http://huttenhower.sph.harvard.edu/galaxy网站PICRUSt功能模块进行Normalize By Copy Number,将得到的结果进行Predict Metagenome,得到KEGG通路3个层级分类,并计算出预测结果评价NSTI值。利用STAMP软件进行红豆杉根际区间之间差异功能的筛选并完成绘图。
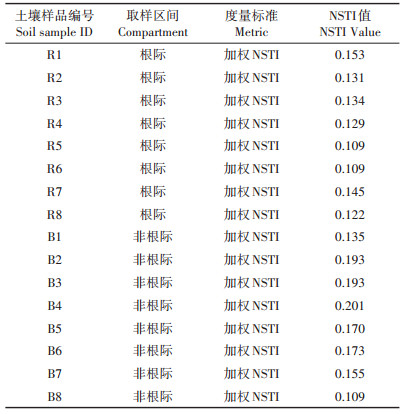
2 结果与分析 2.1 南方红豆杉不同部位Cd、Cu含量特征南方红豆杉根中Cd含量显著高于叶片、树皮和茎,达到18.4 mg·kg-1,叶片、树皮、茎中的Cd含量均低于5 mg·kg-1(图 1A)。根部是Cu含量最高的部位,达到36.01 mg·kg-1,显著高于地上部叶片、树皮和茎,叶片是Cu含量最低的部位,仅为6.24 mg·kg-1(图 1B)。结果表明重度复合污染土壤没有降低南方红豆杉的经济价值。
|
不同小写字母表示处理之间差异显著(P<0.05) The difference lowercase letters indicate significant differences (P < 0.05) 图 1 南方红豆杉不同部位Cd和Cu的浓度 Figure 1 The Cd and Cu concentrations in different tissues of Taxus wallichiana var. mairei |
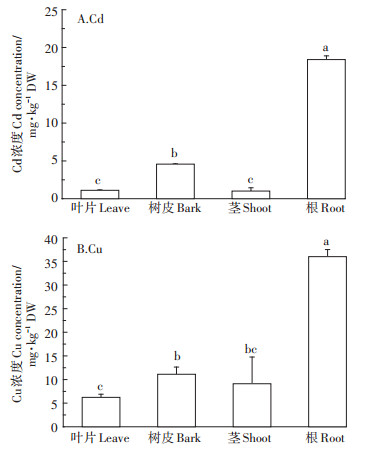
由图 2A可知,南方红豆杉根际土壤总Cd含量为2.95 mg·kg-1,与非根际土壤相比下降了18.8%。南方红豆杉的种植同样显著降低了根际土壤Cu含量,与非根际土壤相比,根际土壤Cu含量降低了39.19 mg· kg-1。进一步测定了南方红豆杉根际与非根际土壤重金属有效态含量。由图 2B和图 2C可知,与非根际土壤相比,南方红豆杉的种植使根际土壤Cd、Cu有效态含量分别显著降低0.17、16.67 mg·kg-1。上述结果表明,南方红豆杉对于根际土壤Cd、Cu的萃取效果明显。
|
*表示处理之间在0.05水平上差异显著。下同 Asterisks indicate significant difference among treatments(P < 0.05). The same below 图 2 南方红豆杉根际与非根际土壤重金属含量 Figure 2 The heavy metal concentrations of Taxus wallichiana var. mairei in rhizosphere and bulk soil |
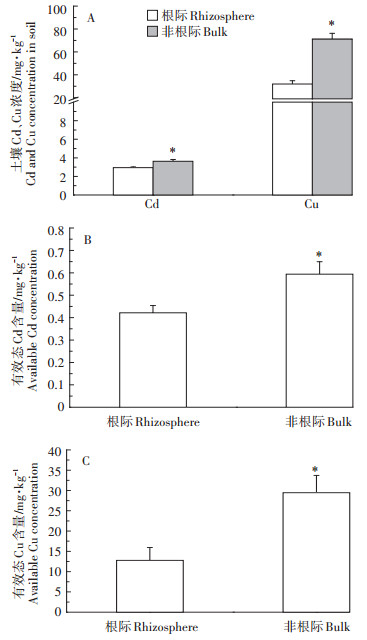
α -多样性指群落内的物种丰度和均匀度。Chao1指数用来估计群落中含OTU数目,物种数目(Obereved specices)则表明实际测量出的OTU数目,PD_whole_tree指数表征观察的种属数,香农指数(Shannon)用来估算样品中微生物的多样性指数。将南方红豆杉根际和非根际区间细菌群落的α-多样性进行比较,发现根际和非根际的α-多样性差异显著,Shannon、Chao 1、Obereved specices、PD_whole_tree 4个指数分别平均降低18.4%、17.2%、24.9%、16.7%。以上结果表明南方红豆杉的种植显著降低了根际区间的丰富度和均匀度(图 3)。
|
图 3 南方红豆杉根际和非根际土壤细菌群落α-多样性的箱型图 Figure 3 Box plots of α-diversity indices of the bacteria communities of Taxus wallichiana var. mairei in rhizosphere and bulk soils |
由图 4可知,南方红豆杉根际与非根际细菌群落结构差异显著。细菌群落结构的PCoA分析(图 4A)和基于布雷-柯蒂斯相似度的聚类分析(图 4B)结果表明:根际和非根际之间的细菌群落结构存在明显差异。PCoA分析显示,第一坐标轴的差异是由取样区间造成,即根系是群落变异的最大来源(32.6%)。
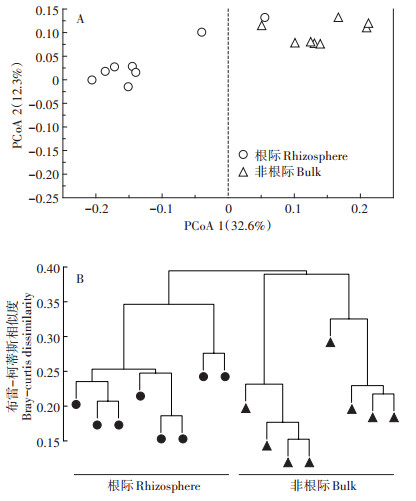
|
图 4 南方红豆杉根际和非根际土壤细菌群落结构分析 Figure 4 The bacteria community composition of Taxus wallichiana var. mairei in rhizosphere and bulk soils |
通过对南方红豆杉根际和非根际的丰度大于0.5% OTU进行显著性差异检验(图 5A),发现根际和非根际分别富集了大量特异细菌物种。根际和非根际区间的优势菌丰度在门水平上(变形菌Proteobacteria在纲水平上表示)有着显著的差异。与非根际区间相比,根际区间酸杆菌门Acidobacteria、δ-变形菌纲Deltaproteobacteria明显下降,α-变形菌纲Alphaproteobacteria、β-变形菌纲Betaproteobacteria、γ-变形菌纲Gammaproteobacteria、绿湾菌门Firmicutes丰度明显上升(图 5B)。结果表明南方红豆杉的种植使得根际土壤细菌优势菌群组成发生明显改变。
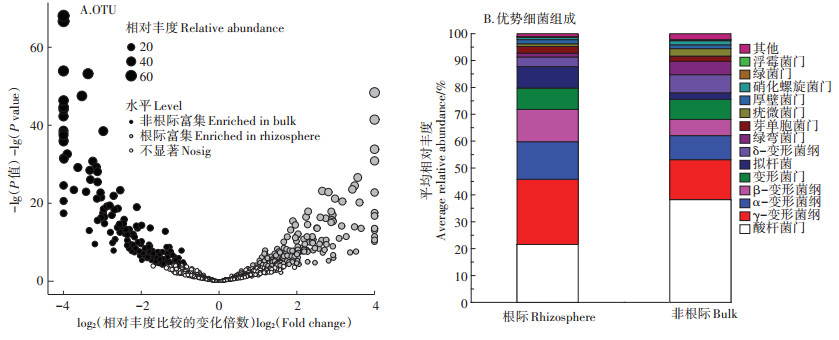
|
图 5 南方红豆杉根际和非根际土壤细菌群落的差异菌种 Figure 5 Differences in bacterial communities between rhizosphere and bulk soils of Taxus wallichiana var. mairei |
LDA分析用来挖掘南方红豆杉根际主要判别类群(图 6A)。与非根际土壤相比,南方红豆杉的根际土壤细菌群落结构组成明显不同,南方红豆杉根际Alphaproteobacteria纲(Sphingobium、Kaistobacter)、Betaproteobacteria纲(Oxalobacteraceae、Comamonadaceae)、Gammaproteobacteria纲(Acinetobacter)和Bacteroidetes门(Sphingobacteriaceae)尤为丰富(图 6A),这些菌属在南方红豆杉根际土壤中的平均丰度是在非根际区间中的数倍(图 6B),其中Betaproteobacteria纲Oxalobacteraceae在南方红豆杉根际细菌群落组成中占比最大(3.74%),其丰度是非根际的2.61倍(图 6B)。
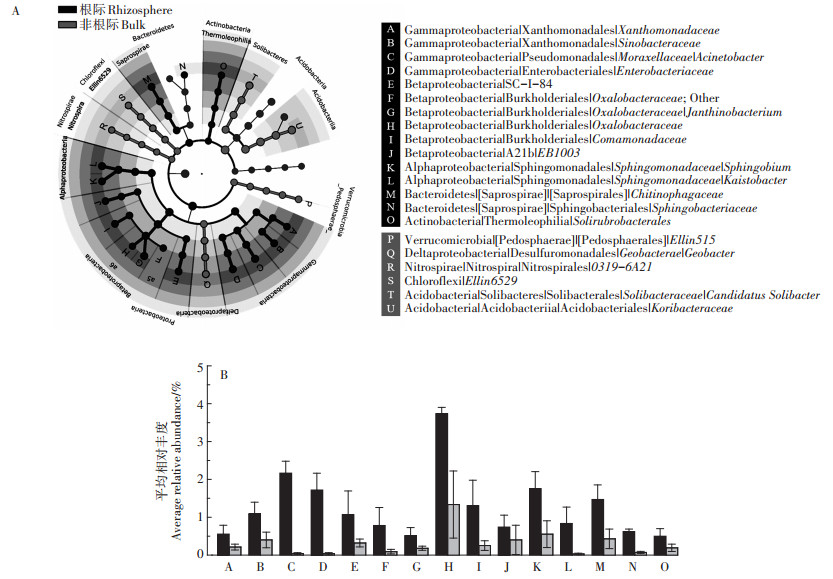
|
A.南方红豆杉根际与非根际细菌群落组成的最小判别分析(LDA),差异细菌种属用字母标示并进行分类注释;B.南方红豆杉根际15种特异细菌(A图中标注)的平均相对丰度 A.Least discriminant analysis(LDA)effect size taxonomic cladogram to compare samples collected from the rhizosphere and bulk soils. B.The average relative abundance of fifteen taxa(A~O)in rhizosphere showed in figure 6A 图 6 南方红豆杉根际特异细菌种类 Figure 6 Special taxa from the rhizosphere compartment of Taxus wallichiana var. mairei |
PICRUSt用来预测南方红豆杉根际与非根际细菌群落的基因功能,并通过NSTI值(The nearest sequenced taxon index)评价其预测的准确性。本研究所有土壤样品的NSTI值列于表 1,范围在0.109~ 0.201之间。多数样品的NSTI值低于之前报道过的土壤样本的参考值0.17。与非根际土壤相比较,南方红豆杉根际中与ABC转运蛋白家族、谷胱甘肽代谢、赖氨酸降解、缬氨酸、亮氨酸、异亮氨酸降解、磷酸转移酶系统(PTS)、磷酸盐及次磷酸盐代谢相关的功能基因相对丰度较高(图 7)。
|
|
表 1 评估PICRUSt准确性的NSTI值 Table 1 The Nearest Sequenced Taxon Index(NSTI)score of each sample to evaluate the accuracy of PICRUSt |
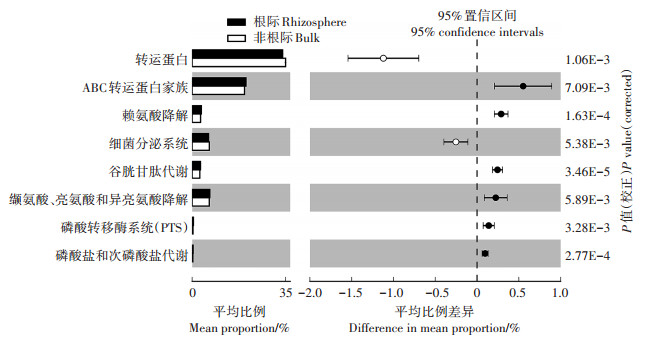
|
图 7 PICRUSt预测南方红豆杉根际与非根际区间的关键功能基因差异表达 Figure 7 The difference relative abundance of key functional gene families between rhizosphere and bulk soils predicted by PICRUSt |
紫杉醇的提取部位主要为红豆杉的皮、茎、叶[24]。在本研究中,南方红豆杉Cd、Cu含量最高的部位均为根部,其叶片、树皮、茎部Cd含量分别为根部的6%、24.8%、5.5%。Cu含量也呈现出类似的现象,叶片、树皮、茎Cu含量分别是根部的17.3%、30.7%、25.2%(图 1)。廖启林等[25]在Cd浓度为4.67 mg·kg-1的土壤上种植的苏柳795,其树根、树皮、茎、叶的Cd含量分别为7.19、13.4、13.4、14.0 mg·kg-1,与本研究土壤总Cd浓度相差不大的情况下,南方红豆杉表现出了明显的地上部Cd低积累特征。目前将植物对重金属的吸收机制分为3类,即富集型(Accumulation)、根部囤积型(Root comparments)、规避型(Excluders)[26]。其中根部囤积型可将重金属囤积于根部,仅有少量向地上部转移,减少对光合、呼吸、生殖系统的伤害。南方红豆杉由根部向地上部转运重金属的能力较弱,使得可用部分的重金属含量远低于根部,在保证其具有良好提取效果的前提下没有降低南方红豆杉的经济价值。当前针对中、重度重金属污染土壤采取的处置方式主要为:停止农业生产活动,利用工程物理技术、土壤化学淋洗或钝化等治理模式进行修复[27]。因此在本研究中,南方红豆杉在重度复合污染土壤上表现出的金属积累特征,为在重金属污染土壤上红豆杉的种植利用提供了重要的理论依据。
在本研究中,供试土壤的Cd含量为3.63 mg· kg-1,Cu含量为82.21 mg·kg-1,根据我国土壤环境质量标准,其分别达到了国家三级和二级污染标准[28],属于Cd重度、Cu轻度复合污染土壤。南方红豆杉对根际土壤重金属含量的降低效果显著(图 2)。南方红豆杉种植两年后,根际土壤总Cd、Cu含量及有效态含量较非根际土壤均显著降低(图 2)。鉴于我国土壤重金属污染土地面积巨大,且多以复合污染为主[2],南方红豆杉对根际土壤重金属浓度的降低效果使其具有巨大的修复应用潜力。
木本植物种植和根系生长所引起的根际细菌群落变化已被多次报道[14-17]。根际特殊环境所塑造的细菌群体在土壤-植物根土界面系统中发挥着不可替代的作用[29]。根际环境的特异性改变导致特定的根际细菌群落演替,而特定的根际细菌群落不仅可以通过化学转化、螯合和土壤pH值降低引起的质子化、螯合物的释放或氧化还原变化等过程导致金属的活化[29],还可通过由细菌等介导的生物沉淀或生物吸附从而降低根际重金属的有效性[30-31]。因此本研究使用高通量测序的方法来探究可能影响南方红豆杉对重金属吸收积累的根际细菌群落。在本研究中,南方红豆杉的根系生长显著降低了根际区域的细菌多样性,这是种属丰富度和均匀度共同降低的结果[32]。无论是均匀度还是多样性,根际细菌α-多样性都显著低于非根际(图 3)。植物根际对于定殖在其周围的微生物具有一定的选择性,会改变物种的丰富度,减少种属的均匀度,从而导致α-多样性参数值的下降[33]。利用PCoA和Bray-Curtis相似度的聚类分析分别将样品间差异降维为二维空间距离和分类差异,研究结果表明:南方红豆杉的根际和非根际细菌群落结构差异显著,取样区间是造成群落差异的最大变异来源(图 4)。这可能是植物根系分泌物介导植物根系与根际微生物群落之间的相互作用造成的[34]。植物根际会分泌大量的可溶性糖、氨基酸或次生代谢产物,这些物质会被根际细菌所利用[35],使得能够利用根际分泌物的细菌丰度得到一定的提高(图 5A),导致根际和非根际的细菌群落结构出现较大差异。
本研究发现南方红豆杉根际和非根际区间细菌群落组成有着较大的差异(图 5B),通过LDA分析发现,在南方红豆杉的根际特异富集了一些特异细菌,包括Alphaproteobacteria、Betaproteobacteria、Gammaproteobacteria和Bacteroidetes门的一些属(图 6A),这些细菌已被鉴定为对植物具有促生作用,如Gammaproteobacteria纲的Acinetobacter已被报道为植物促生菌,能够分泌吲哚乙酸和铁载体,可参与根际重金属活化以及改善植物对营养元素的吸收[36-37]。Gammaproteobacteria纲的Enterobacteriaceae和Alphaproteobacteria纲的Sphingobium被多次报道具有分泌铁载体的能力,在活化根际重金属过程中发挥重要作用[37]。另外本研究还发现,在红豆杉根际募集的多种促生菌中,以抗病菌种类居多,如Betaproteobacteria纲的Oxalobacteraceae、Comamonadaceae,Alphaproteobacteria纲的Kaistobacter以及Bacteroidetes门的Sphingobacteriaceae均具有抑制真菌生长,保护植物根系免受真菌感染的作用[38-40],该类细菌的高效定殖是由于南方红豆杉在遭受重金属胁迫时根系较脆弱,其易遭受病原菌或真菌感染,因此诱导根际特异富集此类具有抗病作用的细菌。而非根际只募集了少数Deltaproteobacteria纲和Acidobacteria门的一些属。
PICRUSt分析使我们进一步预测了根际细菌群落的基因功能。南方红豆杉根际与非根际相比,氨基酸(赖氨酸、缬氨酸、亮氨酸及异亮氨酸)代谢基因丰度显著提升(图 7),这可能跟植物根系分泌物、脱落物、代谢物等引起的根际有机物质增多有关[40]。ABC转运蛋白在南方红豆杉根际中显著表达(图 7)。有研究表明,微生物ABC转运蛋白可能在抵抗和转运重金属方面发挥一些作用[41]。结合在南方红豆杉根际募集的特异细菌,我们推测南方红豆杉根际组装的特异细菌群落可以在活化运输重金属、分泌促生物质及改善植物养分元素吸收、抵抗真菌及病原菌入侵等方面发挥重要作用。当然这些预测的初步结果还应该通过宏基因组等方法进一步验证,以更好地理解南方红豆杉根际细菌群落的功能。
综上,南方红豆杉的种植可以显著降低其根际的Cd和Cu含量,且南方红豆杉高价值部位重金属Cd和Cu含量偏低,分别是根部的24.8%和30.7%,说明重度复合污染土壤没有降低南方红豆杉的经济价值。南方红豆杉能够显著改变重度复合污染土壤的细菌多样性,根际和非根际细菌群落结构差异显著。南方红豆杉根际能特异募集一些重金属活化菌及促生细菌,其中重金属活化菌可能通过分泌铁载体来活化根际重金属,促进根系对Cd和Cu的吸收,促生细菌则可能通过抵抗真菌入侵、改善植物根系对营养元素的吸收等方式实现其促生效果。
4 结论(1)南方红豆杉根部Cd和Cu的含量最高,树皮次之;根际土壤中的Cd、Cu含量显著降低。
(2)种植前后对比研究发现,根际土壤细菌α-多样性显著降低,Shannon、Chao 1、Obereved specices、PD_whole_tree指数分别平均降低18.4%、17.2%、24.9%、16.7%;根际与非根际之间细菌群落结构差异显著,根系是细菌群落变异的最大来源(32.6%)。
(3)与非根际土壤相比,南方红豆杉的根际土壤细菌群落结构组成明显不同,南方红豆杉根际Alphaproteobacteria纲(Sphingobium、Kaistobacter)、Betaproteobacteria纲(Oxalobacteraceae、Comamonadaceae)、Gammaproteobacteria纲(Acinetobacter)和Bacteroidetes门(Sphingobacteriaceae)尤为丰富。PICRUSt分析表明南方红豆杉根际中有着丰度更高的与转运蛋白、氨基酸代谢、磷酸盐代谢相关的预测功能基因。
| [1] |
Babula P, Adam V, Opatrilova R, et al. Uncommon heavy metals, metalloids and their plant toxicity:A review[J]. Environmental Chemistry Letters, 2008, 6(4): 189-213. DOI:10.1007/s10311-008-0159-9 |
| [2] |
环境保护部和国土资源部.全国土壤污染状况调查公报[EB/OL].[2017-10-01]. http://www.mlr.gov.cn/xwdt/jrxw/201404/t20140417_1312998.htm Ministry of Environmental Protection and Ministry of Land and Resources of PRC. National soil pollution status survey bulletin[EB/OL].[2017-10-01]. http://www.mlr.gov.cn/xwdt/jrxw/201404/t20140417_1312998.htm |
| [3] |
Baker A J M, McGrath S P, Sidoli C M D. The possibility of in situ heavy metal decontamination of polluted soils using crops of metal-accumulating plants[J]. Resources Conservation and Recycling, 1994, 11(1/2/3/4): 41-49. |
| [4] |
Moffat A S. Plants proving their worth in toxic metal clean up[J]. Science, 1995, 269(5222): 302-303. DOI:10.1126/science.269.5222.302 |
| [5] |
Mcgrath S P, Zhao F J. Phytoextraction of metals and metalloids from contaminated soils[J]. Current Opinion in Biotechnology, 2003, 14(3): 277-282. DOI:10.1016/S0958-1669(03)00060-0 |
| [6] |
何军良, 祝亚平, 朱密, 等. 土壤中重金属污染的植物修复强化技术概览[J]. 安全与环境工程, 2019, 26(1): 58-63. HE Jun-liang, ZHU Ya-ping, ZHU Mi, et al. Enhanced phytoremediation technology of heavy metal contaminated soil:A review[J]. Safety and Encironment Engineering, 2019, 26(1): 58-63. |
| [7] |
Fischerová Z, Tlustoš P, Száková J, et al. A comparison of phytoremediation capability of selected plant species for given trace elements[J]. Environmental Pollution, 2006, 144(1): 93-100. DOI:10.1016/j.envpol.2006.01.005 |
| [8] |
赵凤亮, 杨卫东. 柳树(Salix spp.)在污染环境修复中的应用[J]. 浙江农业学报, 2017, 29(2): 300-306. ZHAO Feng-liang, YANG Wei-dong. Review on application of willows (Salix spp.)in remediation of contaminated environment[J]. Acta Agriculturae Zhejiangensis, 2017, 29(2): 300-306. DOI:10.3969/j.issn.1004-1524.2017.02.17 |
| [9] |
王玉震, 仝川, 柯春婷. 红豆杉植株紫杉醇含量研究进展(综述)[J]. 亚热带植物植物科学, 2008, 37(4): 59-63. WANG Yu-zhen, TONG Chuan, KE Chun-ting. Review on taxol content from natural Taxus spp.[J]. Subtropical Plant Science, 2008, 37(4): 59-63. |
| [10] |
林姜歆, 卢立晃, 侯晓梅, 等. 红豆杉修复茶园有害重金属的检测分析[J]. 中国质量技术监督, 2016, 7: 62-63. LIN Jiang-xin, LU Li -huang, HOU Xiao-mei, et al. Detection and analysis of harmful heavy metals in the restoration of tea plantation by Taxus[J]. China Quality and Technical Supervision, 2016, 7: 62-63. |
| [11] |
Visioli G, D'Egidio S, Sanangelantoni A M. The bacterial rhizobiome of hyperaccumulators:Future perspectives based on omics analysis and advanced microscopy[J]. Frontiers in Plant Science, 2015, 5. DOI:10.3389/fpls.2014.00752 |
| [12] |
Rajkumar M, Sandhya S, Prasad M N V, et al. Perspectives of plantassociated microbes in heavy metal phytoremediation[J]. Biotechnology Advances, 2012, 30(6): 1562-1574. DOI:10.1016/j.biotechadv.2012.04.011 |
| [13] |
王树凤.柳树对重金属铅、镉响应的基因型差异及其耐性机制研究[D].杭州: 浙江大学, 2015. WANG Shu-feng. Study on the genotypic variations in Pb/Cd responses and the tolerance mechanisms in Salix intrgra[D]. Hangzhou: Zhejiang University, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10335-1015320362.htm |
| [14] |
Kuffner M, De Maria S, Puschenreiter M, et al. Culturable bacteria from Zn-and Cd-accumulating Salix caprea with differential effects on plant growth and heavy metal availability[J]. Journal of Applied Microbiology, 2010, 108(4): 1471-1484. DOI:10.1111/j.1365-2672.2010.04670.x |
| [15] |
Sessitsch A, Puschenreiter M. Endophytes and rhizosphere bacteria of plants growing in heavy metal containing soils[M]//Dion P, Nautiyal C S. Microbiology of extreme soils, 2008: 317-332.
|
| [16] |
D van der Lelie, Corbisier P, Diels L, et al. The role of bacteria in the phytoremediation of heavy metals[M]//Phytoremediation of contaminated soil and water, 2000: 265-281.
|
| [17] |
Gadd G M. Microbial influence on metal mobility and application for bioremediation[J]. Geoderma, 2004, 122(1): 109-119. |
| [18] |
Bell T H, Cloutier-Hurteau B, Al-Otaibi F, et al. Early rhizosphere microbiome composition is related to the growth and Zn uptake of willows introduced to a former landfill[J]. Environmental Microbiology, 2015, 17(8): 3025-3038. DOI:10.1111/1462-2920.12900 |
| [19] |
鲍士旦. 土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2007. BAO Shi -dan. Soil agro -chemistrical analysis[M]. 3rd ed. Beijing: China Agriculture Press, 2007. |
| [20] |
Caporaso J G, Kuczynski J, Stombaugh J, et al. QⅡME allows analysis of high-throughput community sequencing data[J]. Nat Methods, 2010, 7(5): 335-336. DOI:10.1038/nmeth.f.303 |
| [21] |
Caporaso J G, Bittinger K, Bushman F D, et al. PyNAST:A flexible tool for aligning sequences to a template alignment[J]. Bioinformatics, 2010, 26(2): 266-267. DOI:10.1093/bioinformatics/btp636 |
| [22] |
Segata N, Izard J, Waldron L, et al. Metagenomic biomarker discovery and explanation[J]. Genome Biology, 2011(12): R60. |
| [23] |
Langille M G I, Zaneveld J, Caporaso J G, et al. Predictive functional profiling of microbial communities using 16S rRNA marker gene sequences[J]. Nature Biotechnology, 2013, 31: 814-817. DOI:10.1038/nbt.2676 |
| [24] |
陈易展, 刘蔚漪, 张玉薇, 等. 南方红豆杉濒危现状分析与保护对策[J]. 林业勘察设计, 2018, 3: 66-69. CHEN Yi-zhan, LIU Wei-yi, ZHANG Yu-wei, et al. Analysis on the current situation of endangered Taxus wallichiana var. maireia and protection countermeasures[J]. Forestry Survey and Design, 2018, 3: 66-69. |
| [25] |
廖启林, 刘聪, 华明, 等. 栽种柳树修复镉污染土壤的研究[J]. 地质学刊, 2015, 39(4): 665-672. LIAO Qi-lin, LIU Cong, HUA Ming, et al. Experimental effect of Cdcontaminated soil remediation with willows[J]. Journal of Geology, 2015, 39(4): 665-672. DOI:10.3969/j.issn.1674-3636.2015.04.665 |
| [26] |
刘维涛, 周启星, 孙约兵. 大白菜(Brassica pekinensis L.)对镉富集基因型差异的研究[J]. 应用基础与工程科学学报, 2010, 18(2): 226-235. LIU Wei-tao, ZHOU Qi-xing, SUN Yue-bing. Adsorption of a nonylphenol ether on pesticides particlesin aqueous suspensions[J]. Journal of Basic Science and Engineering, 2010, 18(2): 226-235. DOI:10.3969/j.issn.1005-0930.2010.02.0005 |
| [27] |
王进进, 杨行健, 胡峥. 基于风险等级的重金属污染耕地土壤修复技术集成体系研究[J]. 农业环境科学学报, 2019, 38(2): 249-256. WANG Jin-jin, YANG Xing-jian, HU Zheng, et al. Research on the risk level-based technology integration for the remediation of heavy metals polluted farmland[J]. Journal of Agro-Environment Science, 2019, 38(2): 249-256. |
| [28] |
中华人民共和国生态环境部.中国土壤环境质量标准. GB 15618-2018[S].北京: 中国环境科学出版社, 2018. Ministry of Ecology and Environment of PRC. Environmental quality standard for soils. GB 15618-2018[S]. Beijing: China Environmental Science Press, 2018. |
| [29] |
Sessitsch A, Kuffner M, Kidd P, et al. The role of plant-associated bacteria in the mobilization and phytoextraction of trace elements in contaminated soils[J]. Soil Biology & Biochemistry, 2013, 60: 182-194. |
| [30] |
Abdu N, Abdullahi A A, Abdulkadir A. Heavy metals and soil microbes[J]. Environ Chem Lett, 2017, 15: 65-84. DOI:10.1007/s10311-016-0587-x |
| [31] |
Zhuang X L, Chen J, Shim H, et al. New advances in plant growthpromoting rhizobacteria for bioremediation[J]. Environ Int, 2007(33): 406-413. |
| [32] |
Li W C, Wong M H. Interaction of Cd/Zn hyperaccumulating plant(Sedum alfredii)and rhizosphere bacteria on metal uptake and removal of phenanthrene[J]. Journal of Hazardous Materials, 2012, 209: 421-433. |
| [33] |
Shi S, Nuccio E, Herman D J, et al. Successional trajectories of rhizosphere bacterial communities over consecutive seasons[J]. MBio, 2015, 6(4): e00746-15. |
| [34] |
Badri D V, Weir T L, et al. Rhizosphere chemical dialogues:Plant-microbe interactions[J]. Curr Opin Biotechnol, 2009, 20(6): 642-650. DOI:10.1016/j.copbio.2009.09.014 |
| [35] |
Huang X F, Chaparro J M, Reardon K F, et al. Rhizosphere interactions:Root exudates, microbes, and microbial communities[J]. Botany, 2014, 92(4): 267-275. DOI:10.1139/cjb-2013-0225 |
| [36] |
Long X X, Chen X M, Wong J W-C, et al. Feasibility of enhanced phytoextraction of Zn contaminated soil with Zn mobilizing and plant growth promoting endophytic bacteria[J]. Trans Nonferrous Met Soc China, 2013, 23(8): 2389-2396. DOI:10.1016/S1003-6326(13)62746-6 |
| [37] |
Vurukonda S S K P, Giovanardi D, Stefani E. Plant growth promoting and biocontrol activity of Streptomyces spp.as endophytes[J]. Int J Mol Sci, 2018, 19(4): 952-960. DOI:10.3390/ijms19040952 |
| [38] |
Leveau J H, Uroz S, de Boer W. The bacterial genus Collimonas:Mycophagy, weathering and other adaptive solutions to life in oligotrophic soil environments[J]. Environ Microbiol, 2010, 12(2): 281-292. DOI:10.1111/j.1462-2920.2009.02010.x |
| [39] |
Johnsen M G, Hansen O C, Stougaard P. Isolation, characterization and heterologous expression of a novel chitosanase from Janthinobacterium sp.strain 4239[J]. Microb Cell Fact, 2010, 9: 5. DOI:10.1186/1475-2859-9-5 |
| [40] |
Chapelle E, Mendes R, Bakker P A, et al. Fungal invasion of the rhizosphere microbiome[J]. ISME J, 2016, 10(1): 265-268. DOI:10.1038/ismej.2015.82 |
| [41] |
Heodoulou F L, Kerr I D. ABC transporter research:Going strong 40 years on[J]. Biochemical Society Transactions, 2015, 43(5): 1033-1040. DOI:10.1042/BST20150139 |
 2019, Vol. 38
2019, Vol. 38