2. 沈阳大学区域污染环境生态修复教育部重点实验室, 沈阳 110044
2. Key Laboratory of Regional Environment and EcoRemediation, Ministry of Education, Shenyang University, Shenyang 110044, China
多环芳烃(Polycyclic aromatic hydrocarbons,简称PAHs),是指由两个及两个以上苯环稠合而成的一类化合物,其所有的碳原子和氢原子都处于同一平面内,是世界上最早发现的一类化学致癌物[1]。PAHs通过废水排放、废物沥滤、意外排放、大气沉降等最终进入土壤环境,并且在土壤中残留时间长、累积量大,可通过食物链进入人体,危害人体健康及生态环境[2-4]。微生物修复是土壤PAHs去除的主要且有效途径[5],但游离微生物难以适应复杂环境而不能有效发挥作用,导致应用结果与试验结果有较大出入,而微生物固定化技术是解决上述问题的一种有效方法[6-7]。固定化载体的选择和耐低温高效PAHs降解菌的筛选是微生物固定化技术修复北方寒冷地区受PAHs污染的冻融土壤的关键[8]。生物质材料不仅对持久性有机污染物吸附能力强,并易通过改性成为良好的吸附材料[9-10],且可以作为良好的微生物固定化载体,引起了广泛关注。丝瓜络是丝瓜成熟种子的维管束,又名丝瓜瓤,是一种天然、低成本、无毒、可生物降解的材料,储存量巨大,且具有较大的比表面积和孔隙度,使其成为高效的吸附材料及微生物固定化载体[11-12]。
微生物修复中微生物菌体起吸附和降解的双重作用,由于土壤体系复杂,难以区分吸附和降解之间的关系[13],有关微生物修复土壤PAHs的连续生物吸附和生物降解的研究鲜有报道。而生物吸附和生物降解的共同作用可达到更好地削减有机污染物的效果[14]。宋蕾等[15]考察了活性炭固定化微生物对土壤中1,2,4-TCB的降解效果及活性炭对土壤中1,2,4- TCB的吸附特性,发现活性炭-微生物系统对土壤中1,2,4-TCB的降解效果优于活性炭和游离微生物,活性炭对土壤中1,2,4-TCB的吸附过程比较符合准二级动力学模型。
本文选取课题组分离、培养的假单胞菌(Pseudomonas sp. SDR4,简称S4)、毛霉真菌(Mucormucedo sp. SDR1,简称S1)为代表,研究固定化微生物对土壤PAHs的生物吸附以及生物降解的共同作用,探讨固定化微生物对土壤PAHs的吸附机理和降解动力学关系,以期为准确了解生物修复过程中PAHs的生物吸附-降解行为提供理论依据。
1 材料与方法 1.1 材料 1.1.1 试验材料微生物载体:丝瓜络购自中国科学院沈阳生态站。其元素组成:C含量43.21%,N含量0.91%,H含量8.99%,O含量46.89%。经改性后元素组成:C含量46.53%,N含量1.00%,H含量7.88%,O含量44.58%。
供试土壤:土壤取自中国科学院沈阳生态试验站0~20 cm表层清洁土,为草甸棕壤,磨碎,过100目筛备用。其基本理化性状:pH为6.72,有机碳为17.8 g· kg-1,全氮为1.1 g·kg-1,全磷为0.35 g·kg-1,阳离子交换量(CEC)为45.04 mg·kg-1。
1.1.2 试验药品菲(Phe)纯度>95%;芘(Pyr)纯度>98%。均购自百灵威科技有限公司。
1.1.3 培养基营养培养基:牛肉膏5 g,蛋白胨10 g,葡萄糖10 g,酵母粉5 g,NaCl 5 g,琼脂20 g,蒸馏水1000 mL,pH为7.1~7.2,121 ℃灭菌20 min。
固定化增殖培养基:蔗糖4 g,酵母膏3%,KH2PO4 0.5 g,(NH4) 2HPO4 2 g,MgSO4·H2O 0.25 g,pH 6.0~6.5,121 ℃灭菌20 min。
1.1.4 供试菌株假单胞菌(Pseudomonas sp.SDR4,简称S4)、毛霉真菌(Mucormucedo sp.SDR1,简称S1)由本课题组分离、培养。筛选自污灌区受PAHs污染的表层(0~10 cm)冻融土壤,以Phe、Pyr为唯一碳源的培养基筛选分离得到,并在15 ℃低温培养。
1.2 试验方法 1.2.1 微生物固定化方法及SEM表征将条状丝瓜络用蒸馏水冲洗以除去灰尘,于65 ℃烘箱烘干,然后用粉粹机碾磨并过筛(40目),得到丝瓜络粉末,经高压高温(130 ℃,0.125 MPa)改性5 h,蒸馏水冲洗,120 ℃下烘箱烘干,得到改性丝瓜络微生物载体。
将S1和S4分别接种于营养培养基中,15 ℃,110 r·min-1摇床培养30~40 h,制得两种菌悬液密度为:6× 108 cfu·g-1。将S1与S4按体积比1:1接种于营养培养基中,相同条件下混合培养3 d,制备复合菌剂。称取改性丝瓜络微生物载体126组,每组40 mg。
其中18组做空白对照,108组均用固定化增殖培养基。浸润12 h,按10%量分别接种S1、S4、S1+S4,放置于低温光照培养箱(15 ℃),适量的补充增殖培养基,避光培养7 d。培养结束后用去离子水洗涤固定化微生物数次,便制得固定化微生物。
采用扫描电子显微镜(SEM)观察表面特征。
1.2.2 模拟PAHs生物吸附-降解试验取部分以上固定化微生物于高压蒸汽灭菌器中灭活,作为死体对照。
将土壤分装于培养瓶中,每瓶4 g,置于高压蒸汽灭菌器灭菌30 min。将配制好的初始浓度均为120 mg·L-1的Phe、Pyr混合物的丙酮溶液拌入土壤中,配制Phe、Pyr初始含量均为30 mg·kg-1的污染土壤,充分搅拌均匀,放置过夜待丙酮完全挥发。试验方法设计如表 1所示,试验设计3组平行。将样品放置于恒温培养箱15 ℃下培养60 d,每10 d取样检测,分析其吸附量及降解量。
|
|
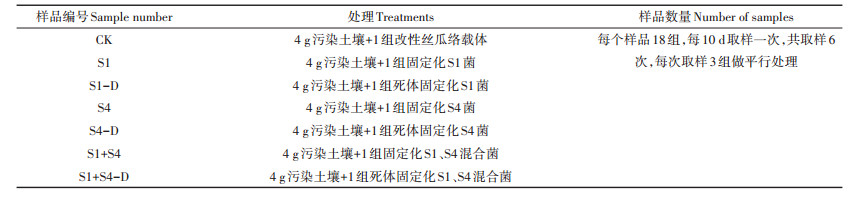
表 1 固定化微生物吸附-降解土壤PAHs试验处 Table 1 Experimental treatment of soil PAHs by immobilized microorganism adsorption-degradation |
土壤及固定化微生物PAHs浓度提取方法:采用超声提取,HPLC法测定。提取方式为:经离心,将分离出的土样、改性丝瓜络或固定化微生物装入100 mL玻璃瓶中,加入30 mL丙酮,20 mL二氯甲烷,15 mL 15%的氯化钠溶液,盖盖后超声波萃取8 h。取出上层液体转移至硅胶净化柱中净化,用50 mL正己烷/二氯甲烷(体积比为9:1)淋洗,收集滤出液,浓缩至约1 mL,用柔和氮气吹干,1 mL乙腈定容用HPLC测定PAHs。
1.2.4 PAHs的检测PAHs含量用HPLC法测定。色谱条件:色谱柱为多环芳烃分析专用柱ZORBAXEclipsePAH(4.6 m× 250 mm×5 μg);柱温25 ℃;流动相为乙腈和水,乙腈:水=60%:40%,流速1.0 mL·min-1,进样量为10 μL,各种PAHs以色谱峰保留时间定性,外标法定量(Phe与Pyr标准溶液均设置为5、10、20、40、60、80 μg · mL-1),本方法中目标化合物的检出限为0.1~2.0 ng· L-1,方法回收率79.56%~92.48%。
1.3 数据处理以下数据均用Oringin 8.0进行拟合分析。
为了更好地分析土壤中Phe与Pyr在样品上的动力学过程,采用准一级动力学和准二级动力学方程对吸附动力学数据进行拟合,线性表达公式如下:
准一级动力学方程:
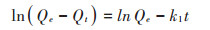
|
(1) |
准二级动力学方程:
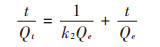
|
(2) |
式中:k1为准一级吸附速率常数,d-1,k2为准二级吸附速率常数,μg·d-1,Qe表示平衡吸附量,μg;Qt为t时刻吸附量,μg。
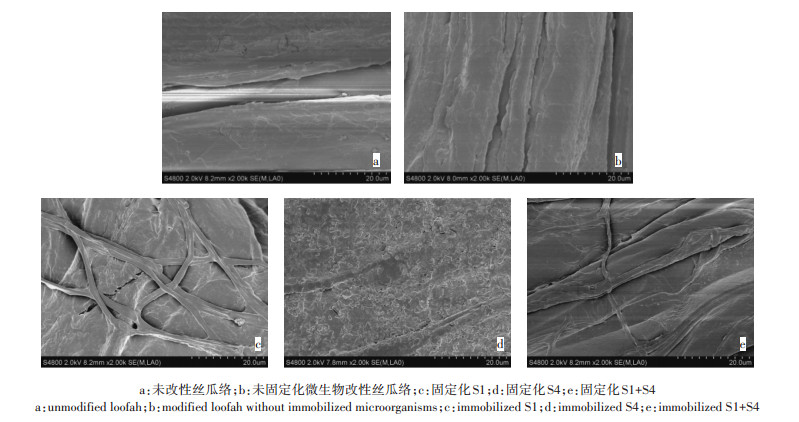
2 结果与讨论 2.1 改性丝瓜络及固定化微生物SEM分析对改性丝瓜络载体与改性丝瓜络固定化微生物进行SEM表征,如图 1所示。如图 1(b)所示,丝瓜络经改性后表面褶皱明显增多,表面积显著增大,吸附能力增强,能够为固定化微生物提供更多的吸附点位,有利于增加固定化微生物的数量,提高降解效率。如图 1 (c)所示,丝状真菌S1生长繁密,纵横交错成网状,有利于增大与污染物的接触面积,增强吸附及降解能力。如图 1(d)所示,细菌S4附着于丝瓜络表面及孔隙之中,有利于细菌S4在土壤中的生长繁殖。如图 1(e)所示,细菌S4附着于丝瓜络表面及孔隙之中的同时,还附着于丝状真菌S1菌丝表面,随真菌菌丝移动,可以更大程度地接触污染物,发挥细菌-真菌对污染物协同降解作用。
|
图 1 固定化微生物SEM图 Figure 1 SEM image of immobilized microorganisms |
对CK中Phe与Pyr的检测,结果表明PAHs在灭菌土壤中不易自然挥发与光解。在本试验条件下,60 d后CK样品中Phe与Pyr仍分别含有88.56%、92.55%。表明挥发损失与自然降解所造成的污染物非生物损失很小。所以在本试验条件下,试验组土壤Phe与Pyr含量的减少,应该是固定化微生物吸附降解的结果。以下数据处理均不计自然挥发等非生物损失量,将其排除在外。
2.3 死体固定化微生物对PAHs的吸附量及动力学 2.3.1 死体固定化微生物对PAHs的吸附量死体固定化微生物对PAHs的吸附量,如图 2所示。4组样品对Phe与Pyr的吸附量曲线趋向一致,在前10 d吸附速率最快,CK、S1-D、S4-D、S1+S4-D对Phe的吸附速度分别为0.37、0.45、0.37、0.49 μg·d-1;对Pyr的吸附速度分别为0.26、0.28、0.27、0.30 μg·d-1。随时间的迁移,吸附速率逐渐降低。60 d后达到动态吸附平衡,CK、S1-D、S4-D、S1+S4-D对Phe的动态平衡吸附量分别为5.28、6.82、5.73、7.46 μg;对Pyr的动态平衡吸附量分别为4.17、4.72、4.53、5.00 μg;固定化微生物整体吸附剂对Phe与Pyr的吸附量高于未固定化微生物载体。

|
图 2 死体固定化微生物对PAHs的吸附量 Figure 2 Adsorption of PAHs by lethal immobilized microorganisms |
本试验中,死体固定化微生物对土壤PAHs的吸附过程是PAHs横向迁移的过程,而吸附是控制土壤PAHs迁移的主要机制[16],故将此过程以吸附的理论解释。S1-D、S4-D、S1+S4-D对Phe与Pyr的吸附量较CK大,表明固定化微生物能增大整体比表面积,增强吸附能力。S1+S4-D对Phe与Pyr的吸附量高于S1-D、S4-D,表明固定化混合菌吸附能力强于固定化单菌。S1-D对Phe与Pyr的吸附量高于S4-D,这可能是由于丝状真菌细胞壁中含有几丁质和纤维素的纤维状结构,有利于有机分子在其表面富集。
从整体吸附过程看,4种样品对Phe与Pyr的吸附过程均可以分为快速吸附(1~10 d) -缓慢吸附(10~ 40 d) -平衡吸附(40~60 d)3个阶段。早有研究证明,丝瓜络对有机污染物的吸附作用以单分子层吸附为主[17-18],微生物死体对非极性有机污染物的吸附机制为分配作用[19];而本文8条吸附曲线都是单一和连续的,表明Phe与Pyr在吸附剂表面可看作单分子层吸附[20]。这可能是由于固定化载体的吸附量远大于死体微生物的吸附量,从而使死体微生物的吸附特征无法影响固定化载体的吸附特征。
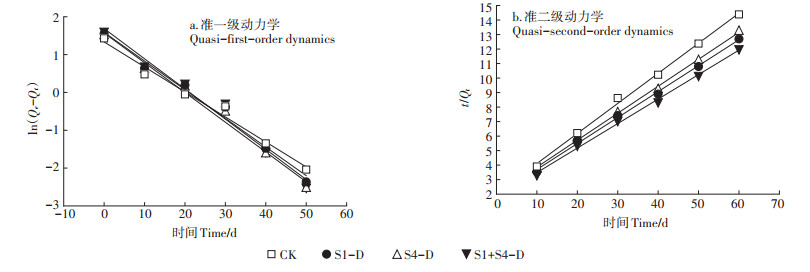
2.3.2 死体固定化微生物对PAHs的吸附动力学为了更好地分析土壤中Phe与Pyr在4种样品上的动力学过程,分别采用描述外部传质过程的准一级动力学(1)和主要描述化学吸附过程的准二级动力学方程(2)对吸附动力学数据进行拟合,拟合结果如图 3、图 4所示,拟合参数见表 2。

|
图 3 死体固定化微生物对Phe的吸附动力学 Figure 3 Adsorption kinetics of Phe by lethal immobilized microorganisms |
|
图 4 死体固定化微生物对Pyr的吸附动力学 Figure 4 Adsorption kinetics of Pyr by lethal immobilized microorganisms |
|
|
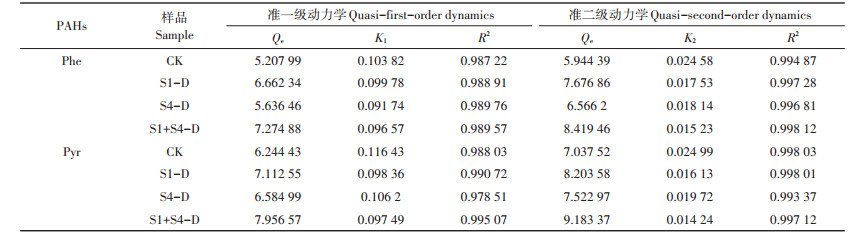
表 2 死体固定化微生物吸附动力学拟合参数 Table 2 Fitting parameters of adsorption kinetics by lethal immobilized microorganisms |
准二级动力学模型拟合结果R2均大于0.99,较准一级动力学模型拟合效果好,且准二级动力学模型拟合平衡吸附量Qe较准一级动力学模型更接近于实际试验值,说明4种样品对土壤中Phe与Pyr的吸附过程服从于准二级动力学模型。
如图 3、图 4所示。准一级动力学模型仅适合描述4种样品对土壤中Phe与Pyr的吸附过程中快速吸附和平衡吸附阶段。而对于中间的缓慢吸附过程,则不适合用准一级动力学模型来描述,说明外部传质对吸附过程具有控制作用[21]。Phe与Pyr从土壤向各个样品组分的迁移过程中,经历了解吸、水膜扩散、吸附剂颗粒表面扩散和吸附剂内部微孔扩散等多个过程,因此准二级动力学模型更好地描述了死体固定化微生物对PAHs的吸附动力学过程。准二级动力学模型是基于化学吸附的假设,化学吸附涉及到吸附剂与吸附质之间存在电子共用或电子转移[22-23],因此可以判断化学作用是控制吸附速率的主要因素。
2.4 活体固定化微生物对PAHs的吸附量及动力学 2.4.1 活体固定化微生物对PAHs的吸附量活体固定化微生物对PAHs的吸附量如图 5所示。4种样品对土壤中Phe与Pyr的吸附速率缓慢,吸附量随时间变化曲线基本呈直线。60 d后,S1、S4、S1+S4对Phe的动态吸附量分别为2.32、2.01、2.76 μg;S1、S4、S1+S4对Pyr的动态吸附量分别为2.79、2.41、3.14 μg。

|
图 5 活体固定化微生物对PAHs的吸附量 Figure 5 Adsorption of PAHs by living immobilized microorganisms |
由于微生物的降解作用会阻碍Phe与Pyr在土壤中的迁移[24-25],故与死体固定化微生物对Phe与Pyr的吸附量相比,活体固定化微生物对Phe与Pyr的吸附量大幅下降。另外微生物能降解自身吸附的PAHs[26],随着土壤体系中Phe与Pyr含量的减少,吸附在微生物菌体上的Phe与Pyr也将被降解。
2.4.2 活体固定化微生物对PAHs的吸附动力学为了更好地分析土壤中Phe与Pyr在4种样品上的动力学过程,分别采用公式(1)和公式(2)对吸附动力学数据进行拟合,拟合参数见表 3。
|
|
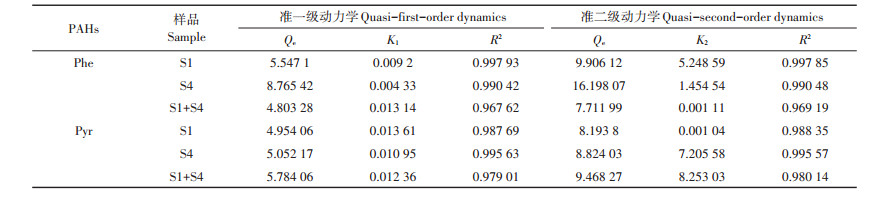
表 3 活体固定化微生物吸附动力学拟合参数 Table 3 Fitting parameters of adsorption kinetics by living immobilized microorganisms |
如表 3所示,由于微生物的降解作用,与死体固定化微生物相比,活体固定化微生物对土壤中Phe与Pyr的准一级吸附动力学与准二级动力学拟合结果R2相差较小,没有明显地服从于准一级动力学或准二级动力学。活体固定化微生物对土壤中Phe的准一级吸附动力学拟合结果R2大于准二级吸附动力学,趋向于服从准一级动力学模型;活体固定化微生物对土壤中Pyr的准一级动力学拟合结果R2小于准二级动力学,趋向于服从准二级动力学模型。这可能是由于S1、S4、S1 + S4对Phe的降解能力高于Pyr(见本文2.5.1)。由此可见,微生物的降解能力越强,对阻碍PAHs在土壤中迁移的影响越大。刘凌等[27]通过对“Alcoa公司采用土地生物处理的方法来处理土壤中的PAHs”建立数学模型发现,在微生物高降解率作用下,有机污染物在外部水相中生物降解的速度远比其解吸、扩散的速度快。也就是说,在其他条件一致时,当降解效率高到一个临界点时,将使得微生物对PAHs的降解效率高于PAHs在土壤中的迁移效率。
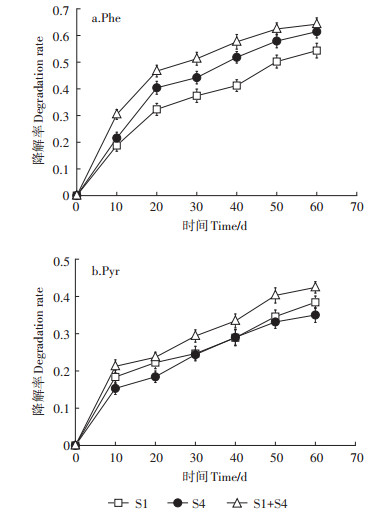
2.5 微生物对PAHs的降解能力及动力学 2.5.1 微生物对PAHs的降解能力差减法计算微生物对PAHs的降解率,即降解率=(总量-自然损失-活体固定化微生物对PAHs的吸附量-土壤中剩余量) /总量×100%,结果如图 6所示。试验进行60 d后,3组样品对Phe与Pyr均有不同程度的降解,S1、S4、S1 + S4对Phe的降解率分别为54.34%、61.45%、64.23%,对Pyr的降解率分别为38.42%、35.02%、42.43%。3组样品中,Phe的降解速率随时间变化趋势一致,0~20 d为降解初期,20 d时S1、S4、S1 + S4对Phe的降解率分别达到32.32%、40.42%、46.67%;20~50 d降解速率有所降低,为降解中期;50 d后,降解缓慢,Phe的含量下降不明显,为降解后期。3组样品中,Pyr的降解速率随时间变化趋势也一致,0~10 d为降解前期,10 d时S1、S4、S1+S4对Pyr的降解率分别达到18.38%、15.32%、21.24%;10~50 d为降解中期,50 d后,降解缓慢,Pyr的含量下降不明显,为降解后期。固定化混合菌对Phe与Pyr的降解率高于固定化单菌。
|
图 6 微生物对PAHs的降解率 Figure 6 Degradation rate of PAHs by microorganisms |
固定化微生物对PAHs的降解能力优于游离菌[8],丝瓜络具备横截面的格子框架及其高孔隙率,是一种高潜力的细胞固定化载体[28]。同时,丝瓜络作为载体具有强大的吸附能力,对微生物及PAHs降解酶有很强的吸附力,高孔隙度能保证吸附固定大量微生物,为菌体创造良好的生活环境,避免菌体与恶劣土壤环境的直接接触[29]。
研究结果表明,S4对Phe的降解能力强于S1,而S4对Pyr的降解能力弱于S1。S1+S4对Phe与Pyr的降解率均高于S1、S4,表明S1、S4在降解Phe与Pyr的过程中起到协同作用。陈凯等[30]认为丝状真菌与细菌混合后降解原油,微生物数量显著增加,且降解效率明显提高,说明混合菌中真菌与细菌存在协同作用。3组样品对Phe的降解率明显高于Pyr,这是由于微生物降解过程中主要利用土壤中游离的PAHs,而Pyr的环数多于Phe,其正辛醇-水分配系数大于Phe,更易吸附在土壤有机质中,不易解吸,导致Pyr从土壤向游离水中的迁移率低[31],无法被微生物更有效地利用,因此Phe的降解率高于Pyr。
整个试验过程中,3种样品对Phe与Pyr的降解速度都呈现出先快后慢的趋势,是由于各个阶段的降解机制不同造成的。在降解初期,PAHs浓度较高,此时微生物对PAHs的降解作用伴随着一系列的物理、化学变化,在多种作用的协调下,降解速率快。降解中期,PAHs的降解速率减缓的原因可能有:(1)微生物降解作用占据主要地位,物理化学作用降低,使总作用强度降低[32];(2)微生物降解过程中产生的中间产物还未完全被降解,与未降解的PAHs产生竞争作用。降解后期,降解速率缓慢,PAHs含量下降不明显,可能因为:(1) PAHs长时间残留于土壤中,一部分被土壤有机质不可逆屏蔽,另一部分可逆吸附于土壤固定相的PAHs解吸速率缓慢[27],导致降解速率缓慢;(2) PAHs扩散转运速率远低于微生物对其降解速率,导致微生物缺乏营养供应,生长不良[33]。
2.5.2 微生物对PAHs的降解动力学建立Monod模型,推导后得到动力学方程式:
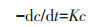
|
式中:c为多环芳烃浓度,mg·kg-1;t为反应时间,d;K为动力学常数。Phe与Pyr的降解反应符合一级动力学特征,拟合参数见表 4。
|
|
表 4 微生物对PAHs的降解动力学方程及参数 Table 4 Kinetic equations and parameters of degradation of PAHs by microorganisms |
由表 4可见,Phe经S1、S4、S1+S4处理后的降解半衰期分别为38.88、29.41、25.63 d,其中S1+S4最短。Pyr经S1、S4、S1 + S4处理后的降解半衰期分别为64.76、69.02、59.28 d,其中S1+S4最短。说明经丝瓜络固定化混合菌较固定化单菌降解效率高,极大提高Phe与Pyr的降解速度,半衰期变短。
3 结论(1) 固定化微生物能增大载体的吸附量,固定化真菌吸附能力大于固定化细菌,固定化混合菌吸附能力大于固定化单菌。固定化微生物吸附曲线是单一和连续的,表明Phe与Pyr在吸附剂表面可看作单分子层吸附。
(2) 丝瓜络固定化载体及死体固定化微生物S1- D、S4-D、S1+S4-D对土壤中Phe与Pyr的吸附过程服从于准二级动力学模型。外部传质对死体固定化微生物吸附PAHs过程具有控制作用,且化学作用是控制此吸附过程吸附速率的主要因素。
(3) 微生物的降解作用会阻碍Phe与Pyr在土壤中的迁移,且提高微生物的降解能力,能增加对土壤中PAHs迁移的影响;在其他条件一致时,当降解效率高到一个临界点时,将使得微生物对PAHs的降解效率高于PAHs在土壤中的迁移效率。
(4) 试验60 d,S1、S4、S1+S4对Phe的降解率分别为54.34%、61.45%、64.23%,对Pyr的降解率分别为38.42%、35.02%、42.43%。混合菌中真菌与细菌存在协同作用,因而固定化混合菌降解能力大于固定化单菌。Monod模型可以清晰地分析固定化微生物对土壤PAHs降解的动力学过程。通过Monod模型证实,土壤中Phe与Pyr经S1+S4处理后的降解半衰期最短,分别为25.63、59.28 d。
| [1] |
Harkov R, Greenberg A, Darack F, et al. Summertime variations in polycyclic aromatic hydro-carbons at four sites in New Jersey[J]. Environmental Science & Technology, 1984, 18(4): 287-291. |
| [2] |
Xu P J, Tao B, Ye Z Q, et al. Polycyclic aromatic hydrocarbon concentrations, compositions, sources, and associated carcinogenic risks to humans in farmland soils and riverine sediments from Guiyu, China[J]. Journal of Environmental Sciences, 2016, 48: 102-111. |
| [3] |
杨悦锁, 陈煜, 李盼盼, 等. 土壤、地下水中重金属和多环芳烃复合污染及修复研究进展[J]. 化工学报, 2017, 68(6): 2219-2232. YANG Yue-suo, CHEN Yu, LI Pan-pan, et al. Research progress on co-contamination and remediation of heavy metals and polycyclic aromatic hydrocarbons in soil and groundwater[J]. CIESC Journal, 2017, 68(6): 2219-2232. |
| [4] |
费佳佳, 张枝焕, 万甜甜, 等. 有机碳含量对多环芳烃在土壤剖面残留及迁移的影响[J]. 环境科学, 2017, 38(9): 3871-3881. FEI Jia-jia, ZHANG Zhi-huan, WAN Tian-tian, et al. Effects of organic carbon content on the residue and migration of polycyclic aromatic hydrocarbons in soil profiles[J]. Environmental Science, 2017, 38(9): 3871-3881. |
| [5] |
倪妮, 宋洋, 王芳, 等. 多环芳烃污染土壤生物联合强化修复研究进展[J]. 土壤学报, 2016, 53(3): 561-571. NI Ni, SONG Yang, WANG Fang, et al. A review of researches on intensified bio-remediation of polycyclic aromatic hydrocarbons contaminated soils[J]. Acta Pedologica Sinica, 2016, 53(3): 561-571. |
| [6] |
李婷, 任源, 韦朝海. 固定化Lysinibacillus cresolivorans的PVASA-PHB-AC复合载体制备及间甲酚的降解[J]. 环境科学, 2013, 34(7): 2899-2905. LI Ting, REN Yuan, WEI Chao-hai. Preparation of PVA-SA-PHBAC composite carrier and m-cresol biodegradation by immobilized Lysinibacillus cresolivorans[J]. Environmental Science, 2013, 34(7): 2899-2905. |
| [7] |
Youssef M, El-Shatoury E H, Ali S S, et al. Enhancement of phenol degradation by free and immobilized mixed culture of Providencia stuartii PL4 and Pseudomonas aeruginosa PDM isolated from activated sludge[J]. Bioremediation Journal, 2019, 23(2): 1-19. |
| [8] |
巩春娟, 苏丹, 王鑫, 等. 不同载体材料固定化耐低温混合菌修复PAHs污染土壤[J]. 生态学杂志, 2018, 37(12): 3713-3720. GONG Chun-juan, SU Dan, WANG Xin, et al. Impacts of cold-resistant mixed strains immobilized by different carrier materials on remediation of PAHs polluted soils[J]. Chinese Journal of Ecology, 2018, 37(12): 3713-3720. |
| [9] |
Li Y, Chen B, Zhu L. Enhanced sorption of polycyclic aromatic hydrocarbons from aqueous solution by modified pine bark[J]. Bioresource Technology, 2010, 101(19): 7307-7313. |
| [10] |
Huang L, Boving T B, Xing B. Sorption of PAHs by aspen wood fibers as affected by chemical alterations[J]. Environmental Science & Technology, 2006, 40(10): 3279-3284. |
| [11] |
Wang W, Wu Y. Combination of zero-valent iron and anaerobic microorganisms immobilized in luffa sponge for degrading 1, 1, 1-trichloroethane and the relevant microbial community analysis[J]. Applied Microbiology and Biotechnology, 2017, 101(2): 783-796. |
| [12] |
Mohammed I, Werner A, Schubert M, et al. Enzymatic decolourization of water using loofa sponge as cellular carrier:Immobilization and dye degradation performance[J]. Canadian Journal of Chemical Engineering, 2018, 96(11): 2321-2333. |
| [13] |
Chen B, Wang Y, Hu D. Biosorption and biodegradation of polycyclic aromatic hydrocarbons in aqueous solutions by a consortium of whiterot fungi[J]. Journal of Hazardous Materials, 2010, 179(1/2/3): 845-851. |
| [14] |
Yesilada O, Yildirim S C, Birhanli E, et al. The evaluation of pregrown mycelial pellets in decolorization of textile dyes during repeated batch process[J]. World Journal of Microbiology & Biotechnology, 2010, 26(1): 33-39. |
| [15] |
宋蕾, 邢丽. 活性炭-微生物对土壤中1, 2, 4-三氯苯的吸附降解[J]. 农业环境科学学报, 2015, 34(8): 1535-1541. SONG Lei, XING Li. Adsorption and degradation of 1, 2, 4-trichlorobenzene by activated carbon-microorganisms in soil[J]. Journal of Agro-Environment Science, 2015, 34(8): 1535-1541. |
| [16] |
蔡婷, 张枝焕, 王新伟, 等. 有机碳含量对土壤剖面中多环芳烃纵向迁移的影响[J]. 环境科学学报, 2019, 39(3): 880-890. CAI Ting, ZHANG Zhi-huan, WANG Xin-wei, et al. Effects of total content of organic carbon(TOC)on the vertical migration of polycyclic aromatic hydrocarbons(PAHs)in soil profiles[J]. Acta Scientiae Circumstantiae, 2019, 39(3): 880-890. |
| [17] |
张燕军, 苗明升, 孔强, 等. 改性丝瓜络纤维对水体日落黄的吸附特性[J]. 环境工程学报, 2014, 8(12): 5277-5283. ZHANG Yan-jun, MIAO Ming-sheng, KONG Qiang, et al. Asorption of Sun Yellow from aqueous solution by chemically modified luffa cylindrica fiber[J]. Chinese Journal of Environmental Engineering, 2014, 8(12): 5277-5283. |
| [18] |
Mashkoor F, Nasar A. Preparation, characterization and adsorption studies of the chemically modified luffa aegyptica peel as a potential adsorbent for the removal of malachite green from aqueous solution[J]. Journal of Molecular Liquids, 2019, 274(15): 315-327. |
| [19] |
丁洁, 王银善, 沈学优, 等. 白腐真菌体对菲和芘的吸附-脱附作用及影响因素[J]. 环境科学学报, 2010, 30(4): 825-831. DING Jie, WANG Yin-shan, SHEN Xue-you, et al. Bioremediation tests on biosorption-desorption of phenanthrene and pyrene by whiterot fungi[J]. Acta Scientiae Circumstantiae, 2010, 30(4): 825-831. |
| [20] |
Núria Fiol, Escudero C, Villaescusa I. Chromium sorption and Cr(Ⅵ) reduction to Cr(Ⅲ)by grape stalks and yohimbe bark[J]. Bioresource Technology, 2008, 99(11): 5030-5036. |
| [21] |
周强, 段钰锋, 冒咏秋, 等. 活性炭汞吸附动力学及吸附机制研究[J]. 中国电机工程学报, 2013, 33(29): 10-17, 2. ZHOU Qiang, DUAN Yu-feng, MAO Yong-qiu, et al. Kinetics and mechanism of activated carbon adsorption for mercury removal[J]. Proceedings of the CSEE, 2013, 33(29): 10-17, 2. |
| [22] |
李文静, 李军, 张彦灼, 等. NaCl改性沸石对水中氨氮的吸附机制[J]. 中国环境科学, 2016, 36(12): 3567-3575. LI Wen-jing, LI Jun, ZHANG Yan-zhuo, et al. Adsorption mechanism of ammonium from aqueous solutions by NaCl modified zeolite[J]. China Environmental Science, 2016, 36(12): 3567-3575. |
| [23] |
高如琴, 刘迪, 谷一鸣, 等. 硅藻土/玉米秸秆木质陶瓷制备及其对废水中四环素吸附动力学[J]. 农业工程学报, 2019, 35(3): 204-210. GAO Ru-qin, LIU Di, GU Yi-ming, et al. Preparation of diatomite/corn straw woodceramics and its adsorption kinetics for tetracycline in wastewater[J]. Transactions of the Chinese Society of Agricultural Engineering, 2019, 35(3): 204-210. |
| [24] |
郑蕾, 谭文捷, 丁爱中, 等. 微生物作用下多环芳烃在土壤中的迁移特征[J]. 化工学报, 2010, 61(1): 200-207. ZHENG Lei, TAN Wen-jie, DING Ai-zhong, et al. Transport of PAHs in soils with action of microorganisms[J]. CIESC Journal, 2010, 61(1): 200-207. |
| [25] |
Chang J S, Cha D K, Radosevich M, et al. Effects of biosurfactant-producing bacteria on biodegradation and transport of phenanthrene in subsurface soil[J]. Journal of Environmental Science & Health Part A Toxic/Hazardous Substances & Environmental Engineering, 2015, 50(6): 611-616. |
| [26] |
丁洁, 陈宝梁, 朱利中. 黄孢原毛平革菌菌球对多环芳烃的生物吸附和生物降解作用[J]. 科学通报, 2012, 57(24): 2276-2284. DING Jie, CHEN Bao-liang, ZHU Li-zhong. Biosorption and biodegradation of polycyclic aromatic hydrocarbons by Phanerochaete chrysosporium in aqueous solution[J]. Chin Sci Bull, 2012, 57(24): 2276-2284. |
| [27] |
刘凌, 崔广柏. 土地生物处理过程中多环芳烃降解模型及应用[J]. 土壤学报, 2001, 38(4): 558-568. LIU Ling, CUI Guang-bai. Biodegradation of PAHs in soil-water-microbes system[J]. Acta Pedologica Sinica, 2001, 38(4): 558-568. |
| [28] |
王天杰, 苏丹, 普聿, 等. 丝瓜络在环境污染治理中的应用研究进展[J]. 环境影响评价, 2019, 41(2): 75-79. WANG Tian-jie, SU Dan, PU Yu, et al. Research progress on application of luffa sponge in environmental pollution control[J]. Environmental Impact Assessment, 2019, 41(2): 75-79. |
| [29] |
Leigh M B, Fletcher J S, Fu X, et al. Root turnover:An important source of microbial substrates in rhizosphere remediation of recalcitrant contaminants[J]. Environmental Science & Technology, 2002, 36(7): 1579-1583. |
| [30] |
陈凯, 靳冰冰, 姚明庆, 等. 热区高效石油降解菌降解性能的研究[J]. 环境工程, 2014, 32(7): 63-66, 35. CHEN Kai, JIN Bing-bing, YAO Ming-qing, et al. Degradation performances and screening of highly efficient petroleum degrading bacteria[J]. Environmental Engineering, 2014, 32(7): 63-66, 35. |
| [31] |
张俊叶, 俞菲, 俞元春. 城市土壤多环芳烃污染研究进展[J]. 土壤通报, 2018, 49(1): 243-252. ZHANG Jun-ye, YU Fei, YU Yuan-chun. Polycyclic aromatic hydrocarbons pollution in urban soils:A review[J]. Chinese Journal of Soil Science, 2018, 49(1): 243-252. |
| [32] |
周宇, 马刚平, 张向伟, 等. 多环芳烃类污染土壤强化生物修复技术研究及应用[J]. 环境工程, 2017, 35(12): 184-188. ZHOU Yu, MA Gang-ping, ZHANG Xiang-wei, et al. Research and application of strengthened bioremediation on the PAHs contaminated soil[J]. Environmental Engineering, 2017, 35(12): 184-188. |
| [33] |
苏丹, 巩春娟, 王鑫, 等. 耐冷腐植酸吸附态PAHs降解菌筛选及其降解特性[J]. 环境科学学报, 2017, 37(10): 3943-3950. SU Dan, GONG Chun-juan, WANG Xin, et al. Isolation and charactrizaton of cold-resistance, PAHs-degrading bacterium[J]. Acta Scientiae Circumstantiae, 2017, 37(10): 3943-3950. |
 2020, Vol. 39
2020, Vol. 39