苯酚是石油化工、塑料生产、医药合成等行业的原料,具有长效性和生物积累性,是工业生产中的主要污染物之一,目前世界范围内均普遍存在农田苯酚污染的情况[1]。苯酚等土壤有机污染物可以被植物的根系吸收并由蒸腾拉力输送到作物地上部位,影响农作物的生长和品质[2],例如:土壤污染可导致甘薯中苯酚含量增加48%以上[3],高浓度苯酚将严重限制植物的生长[2]。禾谷镰刀菌是多种粮食作物的致病菌,导致农作物的根腐、茎腐、萎蔫等,造成玉米、水稻大量减产,有些年份甚至导致减产70%以上[4]。并且随着污染的持续增加,土壤苯酚污染和镰刀菌病害同时发生的概率必然增加。
多数传统的物理、化学方法例如淋洗法、热脱附法、化学氧化法虽能修复苯酚污染土壤,但此类方法破坏土壤质地,影响农业土壤的可耕作性,并且修复费用高昂,不适于农田土壤苯酚污染的修复[5-6]。化学农药虽可有效控制禾谷镰刀菌病害的发生,但化学农药的生产、存储、使用等环节存在明显的环境、健康风险,目前部分欧美国家已加大对化学农药使用的管控,禁用部分风险较大、难降解化学农药的使用[7]。微生物如红球菌(Rhodococcus sp.) [8]、假单胞菌(Pseudmonas sp.) [9]等具有动植物所不具备的代谢途径,可快速降解土壤中的苯酚,部分种类的红球菌属微生物其苯酚的降解效率最高可达80%~100%[8]。苯酚降解菌可以苯酚作为碳源进行生命活动,在降解苯酚的同时避免对环境形成二次污染,具有绿色环保的特点[10]。微生物可通过竞争抑制、分泌抗生素等方式抑制其他微生物的生长,目前被广泛研究用于制备生物防治药剂、提取活性物质等[11],生防菌可有效防控粮食作物如马铃薯和玉米[12]的镰刀菌病害。由于代谢的复杂性,部分微生物可同时具备多种生物学功能,例如红球菌属微生物同时具有降解单环和双环芳烃化合物的功能[13],铜绿假单胞菌(Pseudomonas aeruginosa)不仅能降解苯酚,也可促进植物生长[14]。据上述背景推测存在可同时降解苯酚和抑制其他微生物生长的微生物,但目前该方面的研究报道较少。
本研究拟通过微生物学方法,从高浓度苯酚污染土壤中富集、筛选高活性苯酚降解菌,并从得到的苯酚降解菌中筛选具备抑制禾谷镰刀菌的“多功能菌”,通过分子生物学法对其进行初步鉴定,进一步通过温室栽培试验验证其降解苯酚、防治禾谷镰刀菌病害功能,为苯酚污染修复、禾谷镰刀菌病害防治提供有潜力的菌株资源。
1 材料与方法 1.1 苯酚降解菌的筛选 1.1.1 土壤样品的采集及处理采集昆明市郊某纸品厂排污渠中的10个黑色沉积物样品100 g,仔细清除样品中的杂物后混合均匀,带回实验室常温保存并尽快用于后续研究。
1.1.2 苯酚降解菌的富集培养本研究通过往LB液体培养基中添加苯酚制备富集培养基,LB培养基的基本成分为:胰蛋白胨10 g·L-1、酵母浸出粉5 g·L-1、NaCl 5 g·L-1,pH值7.0。进一步通过在LB培养基中添加不同量的苯酚形成100、200、400、800 mg·L-1苯酚浓度梯度,采用该培养基通过逐级富集方法富集土壤样品中的苯酚降解菌。具体做法为:取上述土壤样品1 g接种于苯酚含量为100 mg·L-1的培养基200 mL中,25 ℃、180 r·min-1摇床培养7 d后取1 mL培养液接种于200 mg·L-1苯酚培养基中,后续培养过程所用方法与上述过程相同。于800 mg·L-1苯酚培养基中富集培养的菌液用于后续筛选过程。
1.1.3 苯酚降解菌的筛选、纯化、优选使用苯酚筛选培养基筛选上述富集培养基中的苯酚降解菌,苯酚筛选培养基成分如下:K2HPO4 0.40 g·L-1、KH2PO4 0.20 g·L-1、NaCl 0.10 g·L-1、MgSO4 0.10 g·L-1、MnSO4·H2O 0.01 g·L-1、(NH4) 2 SO4 0.40 g·L-1、苯酚0.50 g·L-1。苯酚降解菌的筛选方法具体步骤为:将上述富集培养液通过梯度稀释法稀释为10-4,通过平板涂布法将稀释液均匀地涂布到苯酚筛选培养基平板上,培养5 d后挑取菌落较大、生长旺盛的菌落进行2次纯化,纯化得到的菌株在苯酚培养固体基中通过相同培养方法优选生长旺盛的9种菌株用于后续生防效果研究。
1.1.4 同时具备苯酚降解和生防功能的“多功能菌”筛选本研究针对几种粮食作物主要的致病菌禾谷镰刀菌(Fusarium graminearum),通过平板对峙法筛选能够抑制该种致病菌的菌株。具体步骤为:将浸有生防菌液的滤纸放在平板上静置30 min,用5 mm直径打孔器将镰刀菌菌饼置换入平板中央,培养5 d后测量抑菌圈的大小。将其中抑菌活性最高的3种菌分别命名为PBC01、PBC02、PBC03用于后续研究。本研究按照以下方法计算上述3种菌株的抑菌率:
抑菌率=(对照组指示菌菌落直径-处理组指示菌菌落直径)/(对照组生防菌菌落直径-滤纸直径) × 100%。
将上述具有生防功能的3种菌接种于200 mL苯酚浓度为500 mg·L-1的苯酚培养基中,菌种的接种量约为2.0×106 cfu·mL-1,每种菌株平行培养3次。接种后的摇瓶置于恒温摇床中25 ℃、180 r·min-1培养,通过连续取样的方式测定培养液中苯酚的含量,取样的时间间隔为10 h,每次取样尽快完成,以减少苯酚的挥发性损失。为减少培养过程中苯酚的损失,本研究的培养瓶采用橡胶塞密封,外用牛皮纸包裹。溶液中残留的苯酚经过离心、取上清液,按照何小丽等[15]的方法采用改进的4-氨基安替吡林法测定苯酚含量。
1.2 菌株的分子生物学鉴定将筛选出的生防作用较强的菌株接种于LB液体培养基中,25 ℃、180 r·min-1摇床培养48 h后离心,用于提取菌株的DNA。使用正向引物27f(5′ - AGAGTTTGATCCTGGCTCAG-3′)和反向引物1492R (5′-ACGGCTACCTTGTTACGACTT-3′),按照参考方法扩增[16]菌株的16s rRNA基因,扩增后的DNA片段纯化后交生物公司测序。
采用BioEdit软件(BioEdit v7.2.6.1)对测序结果和参比序列进行分析,使用MEGA软件(MEGA 7.0.26)制作序列的N-J系统发育树,通过Bootstrap法对系统发育树进行评估。
1.3 温室栽培试验为验证“多功能菌”在田间降解苯酚及同时防止禾谷镰刀菌病害的功能,本研究在温室中设置对比试验。温室试验土壤采自云南师范大学植物园抛荒地,土壤的采集深度为0~20 cm,将采集的栽培土壤去除杂物、风干、破碎、过5目筛备用。本研究所有处理均设置4个重复,每个重复均使用上述土壤1 kg装于10 cm×8 cm× 8 cm (上径×下径×高)的塑料花盆中。
为探究“多功能菌”降解土壤苯酚的功能,本研究设置植物+苯酚+禾谷镰刀菌+ “多功能菌”处理组(PPFP):盆内种植3株玉米,土壤中的苯酚浓度为500 mg·kg-1,添加禾谷镰刀菌孢子的数量约为5×106 cfu·kg-1,“多功能菌”的添加量约为1×107 cfu·kg-1;植物+苯酚+镰刀菌+水处理组(PPFW):该组除未添加“多功能菌”外其他均与PPFP组相同;苯酚+禾谷镰刀菌+ “多功能菌”处理组(PFP):该组除未种植玉米外,其他处理均与PPFP组相同;为探究“多功能菌”对禾谷镰刀菌病害的生防功能,本研究另外设置对照处理组(CK):除不添加苯酚、禾谷镰刀菌、“多功能菌”,其他均与PPFP处理相同。本研究为控制培养基营养对试验结果的影响,添加禾谷镰刀菌孢子、“多功能菌”之前均进行3次“离心-水洗”过程,通过无菌水重悬后均匀倒入栽培土壤中。为减少试验过程中土壤苯酚的挥发,盆口使用多层保鲜膜密封,植物通过保鲜膜上的孔长出后再使用保鲜膜加密孔上的缝隙。土壤残留苯酚通过乙酸乙酯萃取、浓缩后,采用气相色谱法测定含量,进而求出土壤中苯酚的浓度(HJ 703—2014)。
分别于玉米种植第10、20、30、40 d测定玉米的株高。于收获前使用SPAD-502 Plus(KONICA MINOLTA,Japan)测定第3伸展叶叶绿素含量。种植40 d后收获整株玉米,仔细清洗收获后玉米植株上的泥沙,而后置于恒温干燥箱72 ℃烘干48 h,称量玉米的单株质量。株高、叶绿素含量、单株生物量均按照每盆内3株玉米的均值作为1个重复。
1.4 数据分析与统计应用Excel软件(Excel 2016)对数据进行分析和制图,应用R软件(R x64 3.5.0)通过单因素方差分析法检验不同菌株苯酚降解速率、抑菌率和不同处理间玉米株高、叶绿素含量、单株生物量的差异。
2 结果与分析 2.1 “多功能菌”的活性及鉴定在禾谷镰刀菌长满整个平板的5 d时间里,优选得到的9株菌种中有3种能够明显抑制禾谷镰刀菌的活性,均能够在平板对峙试验开始5 d后形成明显的抑菌现象。其中PBC01菌株的抑菌率为79.38%,显著高于PBC02菌株的47.05%(P<0.05),高于PBC03菌株的61.85% (图 1)。

|
不同字母代表不同处理间存在显著差异(P<0.05)。下同 Different characters in this figure represented significant differents among different treatments (P < 0.05). The same below 图 1 不同菌株对禾谷镰刀菌的抑菌率 Figure 1 Inhibition rate of different strains to F. graminearum |
在密闭培养瓶中,上述3种菌株在浓度为500 mg·L-1的苯酚培养基中具有明显的降解苯酚活性,溶液中苯酚的浓度均呈下降趋势,经过70 h的培养PBC01、PBC02、PBC03分别将苯酚浓度降解至2.16、148.97、107.96 mg·L-1,PBC01菌株具有更显著的苯酚降解活性(P<0.01),PBC01菌株在整个培养过程中,其降解苯酚的速率均明显高于PBC02、PBC03菌株(图 2)。表明PBC01菌株同时具有相对较高的苯酚降解活性和对禾谷镰刀菌的生防功能,本研究选择该菌株进行后续温室试验。
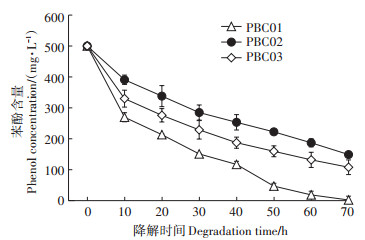
|
图 2 不同菌株降解苯酚速率 Figure 2 Degradation rate of phenol by different strains |
PBC01菌株16s rDNA测序结果上传至NCBI后获得的序列登陆号为MT012079,经序列比对,选择同源性较近的菌株作为参比菌株构建进化树,该菌株被鉴定为Rhodococcus sp.,其系统发育树如图 3所示。

|
图 3 基于16s rRNA基因“多功能菌”的系统发育树 Figure 3 Phylogenetic tree of "multifunctional bacteria" based on 16S rRNA gene |
经过40 d的种植PPFP、PPFW、PFP处理土壤中苯酚含量均明显降低,其中PPFP处理土壤中苯酚浓度最低为79 mg · kg-1,PFP处理组的浓度为105.33 mg·kg-1,均显著低于PPFW处理的262.67 mg·kg-1(P<0.01)。这说明PBC01菌株施入土壤后能明显提高土壤中苯酚的降解速率,显著增加土壤对苯酚的自净能力。植物的种植在一定程度上增加了土壤中苯酚降解菌的活性,但对PBC01降解苯酚的活性并无显著的促进作用,降解苯酚的作用主要来自于PBC01菌株(图 4)。
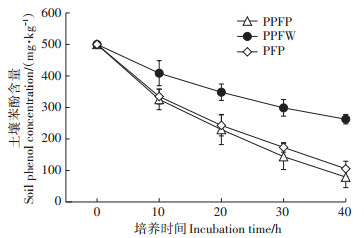
|
图 4 不同处理土壤中苯酚含量变化 Figure 4 Change of phenol content in soil of different treatments |
图 5表明,在40 d的栽培过程中PPFP和CK处理玉米的株高均明显高于PPFW处理,在40 d时这2个处理组的株高分别为58.37 cm和61.70 cm,显著高于PPFW处理组的37.63 cm(P<0.05)。这说明PBC01菌株可显著降低苯酚、禾谷镰刀菌对玉米株高的影响。
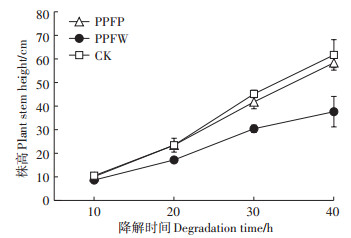
|
图 5 不同处理植物株高变化 Figure 5 Changes of plant height under different treatments |
图 6表明,盆培40 d时PPFP和CK处理组玉米的叶绿素含量无显著差异,分别为33.50和33.33,均显著高于PPFW处理组的22.93(P<0.05)。这说明PBC01菌株的使用可显著降低苯酚、禾谷镰刀菌对玉米叶绿素含量的影响。

|
图 6 不同处理植物叶绿素含量 Figure 6 Chlorophyll content of plants under different treatments |
栽培40 d时PPFP和CK处理组玉米的单株生物量分别为1.79 g和1.92 g,二者无显著差异,但均显著高于PPFW处理组的0.97 g(P<0.05)。这说明PBC01菌株的施用可显著降低苯酚、禾谷镰刀菌对玉米单株生物量的影响(图 7)。
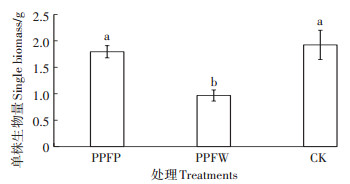
|
图 7 不同处理植物单株生物量 Figure 7 Single biomass of plant under different treatments |
土壤苯酚污染通过植物的根系吸收、扩散等方式进入植物体内[2],破坏植物的酶系统,影响植物的正常新陈代谢[17]。本研究分离获得的PBC01菌株在苯酚培养基中70 h内能够将溶液中的苯酚降解99.57%,在40 d内能够将土壤中高浓度苯酚降解84.20%,这与其他研究结果类似[18]。微生物具有多种苯酚代谢通路,例如可通过苯酚羟化酶将苯酚转化为邻苯二酚,然后由邻苯二酚2,3-双加氧酶通过中间途径将其转化为2-羟基黏液半醛方式分解环境中的苯酚,利用分解苯酚获得的能量进行新陈代谢[19]。目前研究发现的苯酚降解菌种类较多,包括部分假单胞菌属(Pseudmonas) [9]、不动杆菌属(Acinetobacter) [19]等,这说明环境中有大量能够降解苯酚的微生物。本研究中PPFW处理组苯酚含量也明显降低,说明土壤对苯酚具有一定的自净能力,这或许是由于土壤中存在一定量具有降解苯酚功能的微生物[14]。本研究筛选获得的苯酚降解菌为Rhodococcus sp.,目前已有一些研究表明Rhodococcus sp.能够降解苯酚,并且该菌属具有较高的苯酚降解速率,可在短时间内降解溶液中的大部分苯酚[8, 18]。由于苯酚污染物对植物的新陈代谢具有显著的抑制作用,对其去除可显著降低土壤中苯酚对植物生长的负效应[17],PBC01菌株的施用显著降低了土壤中苯酚的含量(图 4),进而降低了苯酚对玉米的株高、叶绿素含量、生物量的抑制(图 5~图 7)。
PBC01菌株具有明显的生防功能,在平板对峙试验中能抑制禾谷镰刀菌生长(图 1),在土壤中仍能够显著限制禾谷镰刀菌对玉米生长的影响(图 5~图 7)。生防菌通过对营养、生存空间的竞争、分泌抗生素等方式限制致病微生物的生长[11],在土壤颗粒、植物根际、植物根内生存,限制致病微生物在土壤中的生长、繁殖,在植物根部形成“防火墙”从而限制土传致病微生物对植物的侵染[7, 20]。本研究发现的PBC01菌株具有较快的生长速率,5 d内在培养平板上形成了较大直径的菌落,或许该种菌株能通过快速生长限制禾谷镰刀菌的生长。平板对峙试验中PBC01菌株在培养平板上形成了明显的抑菌圈,该种菌株可能通过向胞外分泌抗生素的方式致畸、裂解禾谷镰刀菌的菌丝,从而限制禾谷镰刀菌的生长[7]。施入土壤后,PBC01菌株显著限制了禾谷镰刀菌对玉米生长的影响,这或许由于该种菌能够在土壤颗粒、植物根际较好地定殖,利用土壤中的苯酚、植物根部分泌的营养生存,限制禾谷镰刀菌的生长,从而减少其对植物生长的影响。
本研究发现的PBC01菌株同时具有良好的降解苯酚和对禾谷镰刀菌的生防功能,虽然此类研究结果较少,但同时具有多种生理功能的“多功能菌”的研究较多。Wang等[14]的研究分离获得的“多功能菌”同时具备分解土壤中苯酚和促进植物生长的功能,一种红球菌能同时降解苯酚和吡啶,同时对Cr6+具有还原作用[13],凤尾蕨根际微生物万古霉素假单胞菌(Pseudomonas vancouverensis)可通过分泌生长素、铁载体的方式促进凤尾蕨的生长,同时具有促进砷转化的功能[21],从堆肥中分离出的100种微生物中25种同时具有促进植物生长、生防或促进堆肥腐解的功能[22],这说明同时具有多种功能的微生物在自然界普遍存在。自然界微生物的多样性据估计超过50万种,微生物具有有别于动植物的独特代谢通路,并且微生物之间普遍存在基因的水平转移,这可能是导致上述微生物同时具备多种环境生物学、生理生态学功能的原因[23-24]。
4 结论本研究分离获得了能同时降解苯酚和生物防治禾谷镰刀菌病害的多功能菌株Rhodococcus zopfii sp. PBC01,该种微生物在实验室内70 h能降解培养液中99.57%的苯酚,同时对禾谷镰刀菌的抑制率达到79.38%。该种菌株在温室栽培试验中也具有良好的效果,可显著降低禾谷镰刀菌对玉米生长的影响,将土壤苯酚浓度由500 mg·kg-1降低至79 mg·kg-1,这或许是由于该种菌株同时具有苯酚代谢途径和分泌抗生素的功能,具体原因仍需要进一步研究。自然界中或许普遍存在具有多种生理生态功能的微生物,本研究可为土壤苯酚污染、农业病害综合问题的解决提供一种思路。
| [1] |
Anyanwu M E. Phenol in an urban aquatic ecosystem and its bioaccumulation in the african catfish(claria gariepinus)[D]. Owerri: Federal University of Technology, 2018: 12-14.
|
| [2] |
Trapp S, Legind C N. Uptake of organic contaminants from soil into vegetables and fruits[M]//Dealing with contaminated sites: From theory towards practical application, Dordrecht: Springer, 2011: 369-408.
|
| [3] |
Antonious G F, Dennis S O, Unrine J M, et al. Ascorbic acid, β-carotene, sugars, phenols, and heavy metals in sweet potatoes grown in soil fertilized with municipal sewage sludge[J]. Journal of Environmental Science and Health, Part B, 2011, 46(2): 112-121. |
| [4] |
喻大昭. 麦类赤霉病研究进展[J]. 植物保护, 2009, 35(3): 1-6. YU Da-zhao. Advances in the research of Fusarium head blight of wheat and barley[J]. Plant Protection, 2009, 35(3): 1-6. |
| [5] |
刘志培, 刘双江. 我国污染土壤生物修复技术的发展及现状[J]. 生物工程学报, 2015, 31(6): 901-916. LIU Zhi-pei, LIU Shuang-jiang. Development of bioremediation in China:A review[J]. Chinese Journal of Biotechnology, 2015, 31(6): 901-916. |
| [6] |
周际海, 袁颖红, 朱志保, 等. 土壤有机污染物生物修复技术研究进展[J]. 生态环境学报, 2015, 24(2): 343-351. ZHOU Ji-hai, YUAN Ying-hong, ZHU Zhi-bao, et al. A review on bioremediation technologies of organic pollutants contaminated soils[J]. Ecology and Environment Sciences, 2015, 24(2): 343-351. |
| [7] |
Arseneault T, Filion M. Biocontrol through antibiosis:Exploring the role played by subinhibitory concentrations of antibiotics in soil and their impact on plant pathogens[J]. Canadian Journal of Plant Pathology, 2017, 39(3): 267-274. DOI:10.1080/07060661.2017.1354335 |
| [8] |
Arif N M, Ahmad S A, Syed M A, et al. Isolation and characterization of a phenol-degrading Rhodococcus sp. strain AQ5NOL 2 KCTC 11961BP[J]. Journal of Basic Microbiology, 2013, 53(1): 9-19. |
| [9] |
Polymenakou P N, Stephanou E G. Effect of temperature and additional carbon sources on phenol degradation by an indigenous soil Pseudomonad[J]. Biodegradation, 2005, 16(5): 403-413. DOI:10.1007/s10532-004-3333-1 |
| [10] |
范荣桂, 高海娟, 李贤, 等. 含酚废水综合治理新技术及其研究进展[J]. 水处理技术, 2013, 39(4): 5-8, 19. FAN Rong-gui, GAO Hai-juan, LI Xian, et al. New techniques and research progress on phenol-containing wastewater treatment[J]. Technology of Water Treatment, 2013, 39(4): 5-8, 19. |
| [11] |
Ab Rahman S F S, Singh E, Pieterse C M J, et al. Emerging microbial biocontrol strategies for plant pathogens[J]. Plant Science, 2018, 267: 102-111. DOI:10.1016/j.plantsci.2017.11.012 |
| [12] |
Raza W, Ling N, Zhang R, et al. Success evaluation of the biological control of Fusarium wilts of cucumber, banana, and tomato since 2000 and future research strategies[J]. Critical Reviews in Biotechnology, 2017, 37(2): 202-212. DOI:10.3109/07388551.2015.1130683 |
| [13] |
Sun J Q, Xu L, Tang Y Q, et al. Degradation of pyridine by one Rhodococcus strain in the presence of chromium(Ⅵ)or phenol[J]. Journal of Hazardous Materials, 2011, 191(1): 62-68. |
| [14] |
Wang Y, Song J, Zhao W, et al. In situ degradation of phenol and promotion of plant growth in contaminated environments by a single Pseudomonas aeruginosa strain[J]. Journal of Hazardous Materials, 2011, 192(1): 354-360. |
| [15] |
何小丽, 陈晨, 傅盈盈, 等. 一株苯酚降解菌的筛选及其降解特性的初步研究[J]. 生物学杂志, 2010, 27(1): 31-34. HE Xiao-li, CHEN Chen, FU Ying-ying, et al. Isolation of a phenoldegrading strain and its preliminary degrading potential[J]. Journal of Biology, 2010, 27(1): 31-34. |
| [16] |
Suzuki M T, Giovannoni S J. Bias caused by template annealing in the amplification of mixtures of 16S rRNA genes by PCR[J]. Applied and Environmental Microbiology, 1996, 62(2): 625-630. |
| [17] |
Ucisik A S, Trapp S. Uptake, removal, accumulation, and phytotoxicity of phenol in willow trees(Salix viminalis)[J]. Environmental Toxicology and Chemistry, 2006, 25(9): 2455-2460. DOI:10.1897/05-457R.1 |
| [18] |
Mohammad Nawawi N, Ahmad S A, Shukor M, et al. Statistical optimisation for improvement of phenol degradation by Rhodococcus sp. NAM 81[J]. Journal of Environmental Biology, 2015, 37: 443-451. |
| [19] |
Ahmad S A, Shamaan N A, Syed M A, et al. Meta-cleavage pathway of phenol degradation by Acinetobacter sp. strain AQ5NOL 1[J]. Rendiconti Lincei, 2017, 28(1): 1-9. DOI:10.1007/s12210-016-0554-2 |
| [20] |
Lecomte C, Alabouvette C, Edel-Hermann V, et al. Biological control of ornamental plant diseases caused by Fusarium oxysporum:A review[J]. Biological Control, 2016, 101: 17-30. DOI:10.1016/j.biocontrol.2016.06.004 |
| [21] |
Yang C, Ho Y N, Makita R, et al. A multifunctional rhizobacterial strain with wide application in different ferns facilitates arsenic phytoremediation[J]. Science of the Total Environment, 2019, 134504. |
| [22] |
Chin C F S, Furuya Y, Zainudin M H M, et al. Novel multifunctional plant growth-promoting bacteria in co-compost of palm oil industry waste[J]. Journal of Bioscience and Bioengineering, 2017, 124(5): 506-513. DOI:10.1016/j.jbiosc.2017.05.016 |
| [23] |
Raaijmakers J M, Mazzola M. Diversity and natural functions of antibiotics produced by beneficial and plant pathogenic bacteria[J]. Annual Review of Phytopathology, 2012, 50: 403-424. DOI:10.1146/annurev-phyto-081211-172908 |
| [24] |
Singer A C, Crowley D E, Thompson I P, et al. Secondary plant metabolites in phytoremediation and biotransformation[J]. Trends in Biotechnology, 2003, 21(3): 123-130. DOI:10.1016/S0167-7799(02)00041-0 |
 2020, Vol. 39
2020, Vol. 39


