木质素是自然界中含量仅次于纤维素的第二大高分子聚合物,全球每年可利用的木质素约为3 000亿t[1]。木质素是由松柏醇、介子醇和香豆醇3种苯丙烷单体通过碳-碳键和醚键等连接形成的无定形聚合物[2]。作为自然界中唯一可再生的芳香族化合物来源,木质素近年来受到越来越多的关注。基于其独特的结构性质,木质素可广泛用于生产分散剂、抗紫外涂层和碳纤维等化工原料以及生物基材料[3]。此外,近几年研究者们致力于开发催化裂解、水解、氧化和还原等方法将木质素解聚成单体,再转化成为高值产品[4]。这些方法大多数要求分离获得的木质素能保留其天然结构(如β芳醚键)。尽管如此,目前木质素的商业化利用率不足5%[5],绝大多数被作为低价值燃料直接用于产热或发电。
以农作物秸秆等为原料的第二代生物燃料(也称纤维素乙醇)是近年来生物质能源的重要发展方向。在纤维素乙醇的生产过程中,大部分纤维素和半纤维素被酶水解后,会产生大量富含木质素的酶解残渣(约占原料总量的25%~35%)[6]。采用适当的方法从中回收木质素,用于生产高值化学品,可显著地提高原料的利用率。酶水解条件相对温和,对木质素结构的影响很小[7],故酶解残渣木质素适合于上述高值利用;但是其中糖类和灰分等杂质会严重影响木质素的热化学转化效率。因此,发展经济可行又能满足木质素利用要求的分离方法就显得尤为重要。目前,常用的木质素分离回收方法包括化学分离法和溶剂萃取法等。传统的化学制浆方法或秸秆预处理技术均会不同程度地改变木质素的天然结构,如稀酸预处理或碱法制浆过程极易破坏天然木质素的β芳醚键,使其发生缩合反应形成极难被断裂的C-C键[8-11],不利于后续的解聚反应。有机溶剂萃取法对木质素的修饰较小且选择性高,但溶剂难以回收且成本过高是其大规模商业化应用的主要阻碍。
厌氧消化是一种成熟的有机废弃物处理技术,近年来被广泛用于降解农作物秸秆、能源植物等纤维素类原料来生产沼气。厌氧发酵微生物中的水解菌能专门作用于纤维素的分解,而几乎不降解木质素聚合物[12]。另一方面,由于纤维素原料具有天然抗降解性,水解是其厌氧消化的限速步骤,会直接影响甲烷生成[13]。课题组前期的研究[14-15]表明,在优化的发酵条件下,酶解残渣中未分解的纤维素和半纤维素可以被厌氧微生物有效降解并转化为沼气。基于此,本文提出利用厌氧消化的方法从酶解残渣中富集木质素。如前所述,木质素的分离过程会极大地影响其结构和性质,进而决定其质量和应用价值,而目前探求厌氧消化对酶解残渣木质素影响的相关研究较少。因此,本文考察了厌氧消化对秸秆酶解残渣组成成分的影响,并采用多种表征手段对比分析了厌氧消化前后木质素的结构和热化学性质,旨在考察厌氧消化处理玉米秸秆酶解残渣对木质素的影响,为酶解残渣木质素的进一步纯化提供参考依据。
1 材料与方法 1.1 试验材料本试验采用的玉米秸秆酶解残渣(Unhydrolyzed solid,UHS)由美国密歇根州立大学生物质转化实验室提供,其主要成分包括:木质素(64.68%)、葡聚糖(8.44%)、木聚糖(4.18%)和灰分(4.44%)。其制备方法为:首先将玉米秸秆在优化的氨纤维爆破(Ammonia fiber expansion,AFEX)[16]条件下进行预处理,然后利用复合纤维素酶水解168 h,详细的预处理和酶水解条件参照文献[17]进行。酶水解后通过离心分离去除水解液得到酶解残渣,并用去离子水洗涤两次,去除残留的可溶性糖和其他杂质,最后将得到的酶解残渣在80 ℃下烘干过夜,研磨过80目筛备用。
1.2 厌氧消化厌氧消化试验采用课题组前期确立的优化发酵条件[14-15]:以餐厨垃圾厌氧消化污泥作为接种物,温度35 ℃,体系总固体量(Total solids,TS)=2%,按挥发性固体(Volatile solids,Vs)计算接种物:底物=2:1,调节初始pH至7.2左右。接种物和底物(酶解残渣)的性质:TS分别为1.48%和94.55%,VS分别为1.11%和91.42%,接种物VS添加量为2.70 g,底物VS添加量为1.35 g,其详细组成成分见表 1。厌氧消化在总体积为610 mL的厌氧瓶中进行,实际发酵液体积为250 mL,装样混合后利用氮气吹脱排空。试验共设置24个样品,分别用于第0、2、4、8、16、22 d及发酵终点取样测定固体成分,每个时间点设置3个平行样;以只添加接种物为对照组。发酵周期为34 d,每2 d测定甲烷含量及气体组分。分别在第0、2、4、8、16、22 d将发酵的血清瓶取出并停止发酵,再将发酵残余固体烘干备用。发酵结束后将厌氧消化残渣(Anaerobic digested unhydrolyzed solid,ADUHS)和对照组取出,将所有固体样品烘干、研磨过80目筛。
|
|
表 1 接种物、酶解残渣和厌氧消化残渣的主要组成成分(%) Table 1 The main composition of inoculum, UHS and ADUHS (%) |
结合Meyer等[18]和Holtman等[19]的方法略微调整后制备表征木质素(STD lignin)。首先将酶解残渣和厌氧消化残渣用二恶烷:水(96:4,V/V)在摇床中以100 r·min-1、27 ℃、黑暗条件下萃取24 h。同一样品重复萃取3次,每次溶剂的用量为200 mL·g-1固体。每次萃取后采用减压法除去溶剂。然后将固体木质素溶于少量90%乙酸中并在去离子水(约乙酸用量的20倍)中沉淀。将沉淀的木质素离心分离除去上清后冷冻干燥,再溶于尽可能少的1,2-二氯乙烷:乙醇(2:1,V/V)中。最后在正己烷中沉淀分离,再用冷正己烷洗涤。将样品在40 ℃条件下干燥过夜。
1.4 分析方法 1.4.1 固体样品的成分分析按照美国国家可再生能源实验室(NREL)建立的标准方法分析固体样品中的纤维素、半纤维素、木质素和灰分[20-22]。使用高效液相色谱(HPLC)分析酸水解液中的葡萄糖、木糖和阿拉伯糖。HPLC系统为Agilent Technologies 1200 series,配备Aminex HPX - 87H色谱柱,检测器为RID,柱温箱和检测器的温度均为35 ℃。流动相为5 mmol·L-1 H2SO4水溶液,流速为0.6 mL·min-1。
1.4.2 元素分析称取0.2 g样品加入5 mL浓硫酸,设置不加样品组为对照,隔夜放置后,按照以下步骤进行消解:在加热至120 ℃保持30 min后取出混合均匀,此后每升温60 ℃均保持30 min然后取出混合均匀,直至300 ℃保持30 min后滴加0.5 mL过氧化氢;之后保持300 ℃并每隔20~30 min滴加一次过氧化氢直至样品完全澄清、完全消解为止;消解完成后稀释,再采用电感耦合等离子体发射光谱仪(ICP-OES)测定微量元素,仪器为德国耶拿的Plasma PQ9000。
1.4.3 甲烷产量分析采用压力法测定沼气产量。利用气相色谱测定沼气成分,色谱条件如下:仪器型号为GC 122,色谱柱为TDX - 01,检测器为热导检测器,柱箱温度135 ℃,进样器温度135 ℃,检测器温度150 ℃,载气为氢气,压力150 kPa,流速0.12 L·min-1,进样体积为500 μL。
1.4.4 凝胶色谱分析根据文献报道的乙酰化处理方式[4, 18],对样品进行乙酰化处理:将15 mg样品溶解于2 mL无水乙酸和吡啶(1:1,V/V)混合溶液中,并在室温下搅拌过夜,再加入5 mL无水乙醇搅拌30 min使其冷却,旋转蒸发除去溶剂,多次重复上述步骤,直到乙酸和吡啶被全部去除。将乙酰化的样品溶解到少量的氯仿中,然后逐滴加入到乙醚中以沉淀样品。离心分离固体,重复洗涤和分离步骤3次确保除去氯仿,再将样品于40 ℃下真空干燥过夜。
将乙酰化处理好的样品溶解到0.5 mg·mL-1的四氢呋喃(Tetrahydrofuran,THF)中,再用0.45 μm尼龙膜过滤。凝胶色谱分析(Gel chromatography,GPC)使用Water 1515系统进行,配有视差折光检测器和两个MIXED-C 7.5X300柱。色谱条件为:温度35 ℃,洗脱液THF,流速1 mL·min-1。最后采用分子量范围为1.5×103~3.6×106 g·mol-1的6种窄分布的聚苯乙烯标品制备标准曲线。
1.4.5 热重分析称取5 mg样品(±0.001),使用TGAr Q500热重分析仪器分析木质素样品的热力学性质。在氮气氛围中以20 ℃·min-1升温速率加热样品,测试温度为室温到800 ℃。
1.4.6 傅里叶红外分析称取30 mg样品采用1%的KBr压片法制片,检测仪器为Thermo Nicolet 6700,扫描次数为16次,分辨率为4。
1.4.7 核磁氢谱分析取30 mg木质素样品,溶解于0.5 mL的DMSO-d6中,使用Bruker AV Ⅱ-600 MHz超导核磁对样品进行检测,测试温度为室温,扫描次数为32次。
2 结果与讨论 2.1 厌氧消化过程秸秆酶解残渣中主要成分变化及物料平衡为了考察发酵过程酶解残渣中木质素和聚糖的降解情况,分析了厌氧消化残渣的主要组成成分随时间的变化(图 1),图中各时间点的组成折算成基于发酵初始时刻固体总量的相对值。从图中可以看出,固体残渣的总量随着厌氧消化的进行逐渐减少。第0 d到第8 d,葡聚糖的相对含量从0.044 g·g-1(ADUHS)下降到0.036 g · g-1,在此后的26 d,进一步下降到0.028 g·g-1,然后基本保持稳定。在厌氧消化过程木聚糖的相对含量从0.026 g·g-1缓慢降低到0.021 g· g-1。相反,在整个过程不溶性木质素和灰分的相对含量基本不变,分别为0.43 g·g-1和0.21 g·g-1。秸秆酶解残渣中的糖类主要是不能被真菌酶制剂所分解的难降解性糖类,从结果可以看出大部分的残糖能逐渐被厌氧微生物降解。从图中也可以看出,酶解残渣中糖类的降解程度主要取决于发酵时间。与其他的木质素分离方法[4, 18]相比,本研究采用的生物方法虽然需要的时间更长(至少8~15 d),但对酶解残渣中的残糖去除较为彻底,这有助于减少糖类对木质素热化学转化的影响。
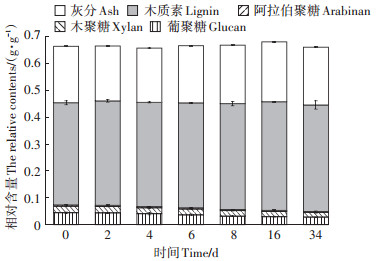
|
图 1 厌氧消化过程消化残渣中主要组成成分变化 Figure 1 The change of ADUHS main composition during anaerobic digestion |
酶解残渣中的聚糖被降解后进一步转化为沼气。在本试验条件下,整个产气过程约持续34 d:前10 d左右随着聚糖被迅速消耗,产气速率较快,累计甲烷产量迅速增加;此后糖耗速率逐渐变慢,产气在22 d左右进入平缓期直至结束。厌氧消化结束时约有42%的聚糖被降解,最终累计产生甲烷103.20 mL· g-1VS(UHS)。
秸秆酶解残渣以及厌氧消化残渣的主要成分含量如表 1所示。由于引入了接种物且接种物中木质素和聚糖含量均低于酶解残渣,导致初始时刻固体残渣中聚糖的含量较酶解残渣降低,但同时也导致了木质素的含量下降(表 1)。通过厌氧消化将残糖进一步降解后,发酵终点厌氧消化残渣中的聚糖和木质素的含量分别为5%和40%(表 1)。从表 1中也可以看出,厌氧消化残渣中灰分含量高于酶解残渣,对比接种物的组成成分可知,消化残渣中大部分的灰分来自于接种物。本研究采用的接种物为餐厨垃圾消化污泥,而餐厨垃圾具有高盐的特性,在厌氧处理过程中盐分可能被累积,因此使用该种污泥作为接种物难免会引入大量灰分。采用ICP对灰分的组成进行了分析,结果显示接种物的引入会导致Ca、Fe、K、Mg、Mn、Zn和Al等元素的含量有所增加,但消化残渣中不含有极难除去的Si元素,这一特性有利于后续对木质素的进一步分离纯化。
图 2显示了厌氧消化过程的质量平衡,以处理100 g酶解残渣为基础,接种比例RI/S(基于VS)为2:1。从图中可以看出,厌氧消化后固体总量有所减少,主要是由于酶解残渣中的聚糖被降解为甲烷和二氧化碳。消化前后固体残渣中的木质素总量基本保持恒定,说明该过程几乎不存在木质素的质量损失,因此木质素的回收率可以接近100%。
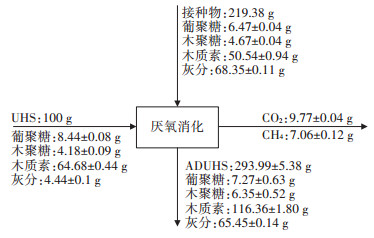
|
图 2 厌氧消化处理秸秆酶解残渣过程的物料平衡 Figure 2 Mass balance in the process of UHS anaerobic digestion |
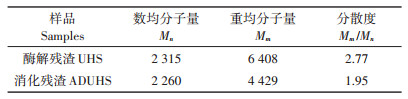
木质素的分子量大小是决定其物理性质、机械性能以及流体行为的重要参数,从而影响其应用。常见的化学方法或高温萃取等分离手段通常会引起木质素分子间的裂解或缩合等反应,导致分离木质素的分子量发生变化。本研究利用凝胶色谱法(GPC)分析厌氧消化前后残渣中木质素的分子量变化。其相对分子质量及分布如表 2所示。比较两者数据发现:消化残渣中木质素重均分子量(Mm)有所下降,由6 408降低为4 429,表明厌氧消化对木质素的分子量存在一定的影响。这种变化一方面可能是由于引入了含有木质素的接种物;另一方面可能是厌氧微生物的作用导致木质素具有更小的形态和体积,使其分子量减少。但由于消化前后木质素的总量未发生改变,这种作用可能仅会影响木质素的分子量大小。表中酶解残渣中木质素的分散度为2.77,这与文献中报告的二恶烷萃取木质素数值相似[18]。此外,经过厌氧消化后固体残渣中的木质素分散度有所下降,表明其分子量分布范围变窄,结构更加均一化。而分子量大小和结构均一的高聚物片段往往具有相似的性质,因此这种均一化、碎片化现象可能更利于木质素后续的分离和利用。
|
|
表 2 酶解残渣和消化残渣中木质素的相对分子质量及分布 Table 2 The relative molecular mass and distribution of lignin in UHS and ADUHS |
木质素的热化学性质是影响其热化学转化效率的另一重要因素。采用热重分析对比了两种木质素的热稳定性,结果见图 3。总体来看两种木质素的热分解趋势极其相似:大部分的质量损失均出现在200~500 ℃,并在300~400 ℃质量损失速率达到最大;600 ℃过后残余质量几乎不变。但从图中可以看出,消化残渣木质素的热损失量始终大于酶解残渣木质素,表明酶解残渣木质素比消化残渣木质素更加耐高温。其次,消化残渣木质素热分解速率相较于酶解残渣木质素更快。结合GPC的结果分析,可能是由于消化残渣木质素的分子量更低,导致其热稳定性有所下降。但分子量的变化对热稳定性的影响有限,在达到800 ℃质量趋于恒定后,酶解残渣木质素残留量仅比消化残渣木质素多6%左右。
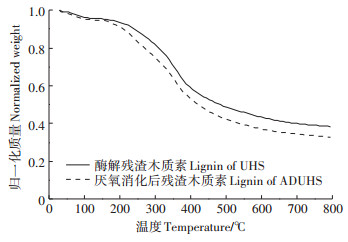
|
图 3 酶解残渣木质素和消化残渣木质素的热重曲线 Figure 3 The TGA curves of the lignin from UHS and ADUHS |
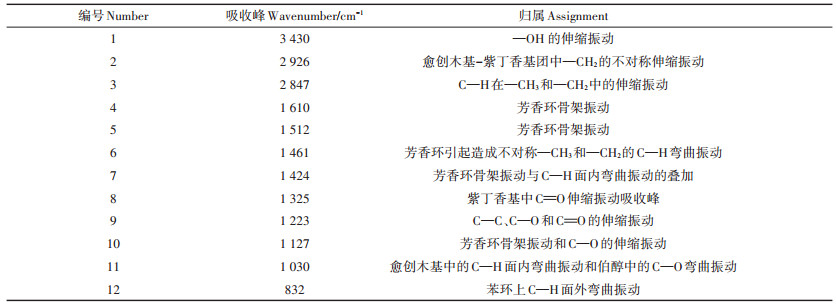
两种木质素的红外光谱结果如图 4所示,根据相关报道[23-26]得出图 4中对应的红外吸收峰归属(表 3)。从图中可以看出,两种木质素的红外吸收谱图十分相似,只是在一些吸收峰强度上存在细微差异,在3 430、2 926、2 847 cm-1和1 030 cm-1处的吸收峰有不明显的区别。图中3 430 cm-1处的峰为—OH的伸缩振动吸收峰;2 926 cm-1和2 847 cm-1处的峰为C—H的伸缩振动吸收峰;其中较为关键的1 610、1 512、1 461 cm-1和1 424 cm-1 4处的峰为芳香环特征吸收峰,谱图显示两种木质素在该区域的吸收强度并无明显区别,表明木质素的主要结构未因厌氧处理而发生改变;1 325 cm-1为紫丁香基中C=O伸缩振动吸收峰;1 223 cm-1处的峰可能为C—C、C—O或C=O的伸缩振动吸收峰;1 127 cm-1处的峰为芳香环骨架振动吸收峰;1 030 cm-1处的峰为愈创木基特征吸收峰;832 cm-1处峰为芳香环特征吸收峰。从红外光谱看出,厌氧消化前后固体残渣中木质素在分子结构上不存在显著差异,表明厌氧消化对木质素的结构影响较小,能够较好地保留木质素的结构。
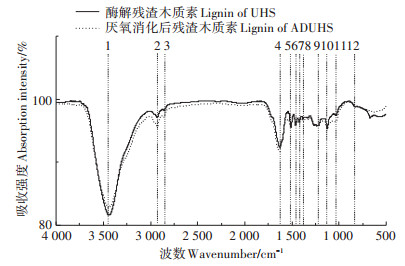
|
图 4 酶解残渣和消化残渣中木质素的红外谱图 Figure 4 The FTIR spectra of lignin from UHS and ADUHS |
|
|
表 3 The FTIR spectra of lignin from UHS and ADUHS Table 3 The FTIR spectra of lignin from UHS and ADUHS |
木质素中的含氢官能团(芳香环、羟基、甲氧基等)决定了木质素的化学性质,根据相关报道[26-29],利用一维核磁氢谱对两种木质素的结构进行表征,考察厌氧处理对这些官能团造成的潜在影响。图 5为两种木质素的1H-NMR谱图,可以发现两种木质素的峰形和出峰位置均十分相似。其中图 5中δ=8.4~6.0区域内的化学位移归属于愈创木基、紫丁香基和对羟基苯基中芳香环的质子,即木质素基本单元的质子;δ= 5.2~4.5区域内的化学位移归属于β-O-4中的质子;δ=3.9~3.2区域内的化学位移归属于甲氧基中的质子;δ=2.5为溶剂(DMSO-d6)的峰;δ=2.5~2.2区域内的化学位移归属于酚羟基中的质子;δ=2.2~1.5区域内的化学位移归属于脂肪族羟基中的质子;δ=1.5~0的化学位移归属于脂肪族侧链中的质子。对比谱图可以看出位于δ=6.75和δ=5.2处的峰形,出峰位置几乎未改变,说明酶解残渣和消化残渣中木质素都是以愈疮木基团和β-O-4为主要结构,且厌氧消化后这些主要官能团仅略微减少,因此厌氧处理较好地保留了木质素的主要官能团结构。
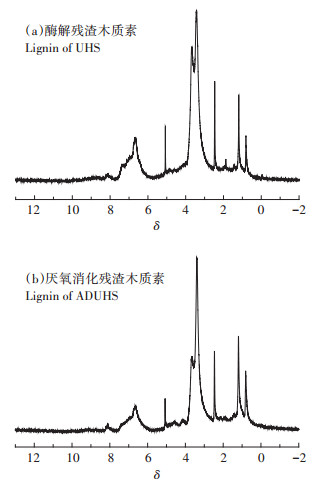
|
图 5 酶解残渣与消化残渣木质素的1H-NMR谱图 Figure 5 The 1H-NMR spectra of lignin from UHS and ADUHS |
(1)采用厌氧消化的方法处理秸秆酶解残渣,消化残渣中聚糖含量显著降低而木质素总量基本不变。但厌氧过程引入的接种物导致消化残渣木质素灰分升高。
(2)厌氧处理后木质素的热化学性质和结构无明显变化。凝胶渗透色谱结果显示处理后木质素的分子量有所降低,但热重分析结果表明消化前后木质素热化学稳定性无显著变化。综合红外光谱和一维核磁共振氢谱结果显示,消化残渣中木质素的主要链接键仍为β-O-4键,且厌氧处理前后木质素的结构相差不大,该方法能够较好地保留木质素的结构。
| [1] |
Becker J, Wittmann C. A field of dreams:Lignin valorization into chemicals, materials, fuels, and health-care products[J]. Biotechnology Advances, 2019, 37(6): 1-24. |
| [2] |
Parsell T, Yohe S, Degenstein J, et al. A synergistic biorefinery based on catalytic conversion of lignin prior to cellulose starting from lignocellulosic biomass[J]. Green Chemistry, 2015, 17: 1492-1499. DOI:10.1039/C4GC01911C |
| [3] |
Wolfgang G, Lassser G. Lignin:Historical, biological, and materials perspectives[M]. Washington D C: American Chemical Society, 1999: 392-421.
|
| [4] |
Da Costa Sousa L, Foston M, Bokade V, et al. Isolation and characterization of new lignin streams derived from extractive-ammonia(EA) pretreatment[J]. Green Chemistry, 2016, 18(15): 4205-4215. DOI:10.1039/C6GC00298F |
| [5] |
Ragauskas A J, Beckham G T, Biddy M J, et al. Lignin valorization:Improving lignin processing in the biorefinery[J]. Science, 2014, 344(6185): 1246843. DOI:10.1126/science.1246843 |
| [6] |
Xu C, Arancon R A D, Labidi J, et al. Lignin depolymerisation strategies:Towards valuable chemicals and fuels[J]. Chemical Society Reviews, 2014, 43(22): 7485-7500. DOI:10.1039/C4CS00235K |
| [7] |
Li C Z, Xiao C, Wang A Q, et al. Catalytic transformation of lignin for the production of chemicals and fuels[J]. Chemical Reviews, 2015, 115(21): 11529-11624. |
| [8] |
中野准三.高洁, 译.木质素的化学(基础与应用)[M].北京: 轻工业出版社, 1980: 45-58. NAKANO Junzo. GAO Jie, translated. Lignin chemistry: Foundations and applications[M]. Beijing: China Light Industry Press, 1980: 45-58. |
| [9] |
朱建良, 王倩倩, 杨晓瑞, 等. 木质素化学分离的研究进展[J]. 南京工业大学学报(自然科学版), 2018, 40(3): 122-130. ZHU Jian-liang, WANG Qian-qian, YANG Xiao-rui, et al. Research progress in chemical separation of lignin[J]. Journal of Nanjing Tech University (Natural Science Edition), 2018, 40(3): 122-130. |
| [10] |
Del Río J C, Gutiérrez A, Rodríguez I, et al. Composition of nonwoody plant lignins and cinnamic acids by Py-GC/MS, Py/TMAH and FT-IR[J]. Journal of Analytical and Applied Pyrolysis, 2007, 79(1/2): 39-46. |
| [11] |
Zu S, Li W, Zhang M, et al. Pretreatment of corn stover for sugar production using dilute hydrochloric acid followed by lime[J]. Bioresource Technology, 2014, 152: 364-370. DOI:10.1016/j.biortech.2013.11.034 |
| [12] |
Chandra R, Takeuchi H, Hasegawa T. Methane production from lignocellulosic agricultural crop wastes:A review in context to second generation of biofuel production[J]. Renewable & Sustainable Energy Reviews, 2012, 16(3): 1462-1476. |
| [13] |
杨世关, 李继红, 孟卓, 等. 木质纤维素原料厌氧生物降解研究进展[J]. 农业工程学报, 2006, 22((增刊1): 120-124. YANG Shi-guan, LI Ji-hong, MENG Zhuo, et al. Review on anaerobic biodegradation of lignocellulose[J]. Transactions of the CSAE, 2006, 22(Suppl 1): 120-124. |
| [14] |
陈世平, 汤晓玉, 肖泽仪, 等. 玉米秸秆水解残渣厌氧消化的产气性能[J]. 农业环境科学报, 2016, 35(3): 584-589. CHEN Shi-ping, TANG Xiao-yu, XIAO Ze-yi, et al. Biogas production of unhydrolyzed solid from corn stover hydrolysate by anaerobic digestion[J]. Journal of Agro-Environment Science, 2016, 35(3): 584-589. |
| [15] |
朱桃, 祝其丽, 李强, 等. 厌氧分解木质纤维素水解残渣中难降解性糖类研究[J]. 中国沼气, 2018, 36(2): 43-47. ZHU Tao, ZHU Qi-li, LI Qiang, et al. Anaerobic degradation of refractory carbohydrates in lignocellulose hydrolysis residue[J]. China Biogas, 2018, 36(2): 43-47. |
| [16] |
Sundaram V, Muthukumarappan K, Gent S. Understanding the impacts of AFEXTM pretreatment and densification on the fast pyrolysis of corn stover, prairie cord grass, and switchgrass[J]. Applied Biochemistry & Biotechnology, 2017, 181(3): 1060-1079. |
| [17] |
Gunawan C, Xue S, Pattathil S, et al. Comprehensive characterization of non-cellulosic recalcitrant cell wall carbohydrates in unhydrolyzed solids from AFEX-pretreated corn stover[J]. Biotechnology for Biofuels, 2017, 10(1): 1-14. DOI:10.1186/s13068-016-0693-9 |
| [18] |
Meyer J R, Waghmode S B, He J, et al. Isolation of lignin from Ammonia Fiber Expansion(AFEX)pretreated biorefinery waste[J]. Biomass and Bioenergy, 2018, 119: 446-455. DOI:10.1016/j.biombioe.2018.09.017 |
| [19] |
Holtman K M, Chang H, Jameel H, et al. Quantitative 13C NMR characterization of milled wood lignins isolated by different milling techniques[J]. Journal of Wood Chemistry and Technology, 2006, 26(1): 21-34. DOI:10.1080/02773810600582152 |
| [20] |
National Renewable Energy Laboratory. Determination of total solids in biomass and total dissolved solids in liquid process samples[R]. Golden: National Renewable Energy Laboratory, 2008: 1-9.
|
| [21] |
National Renewable Energy Laboratory. Determination of ash in biomass[R]. Golden: National Renewable Energy Laboratory, 2005: 1-12.
|
| [22] |
National Renewable Energy Laboratory. Determination of structural carbohydrates and lignin in biomass[R]. Golden: National Renewable Energy Laboratory, 2008: 1-16.
|
| [23] |
Hage R E, Brosse N, Chrusciel L, et al. Characterization of milled wood lignin and ethanol organosolv lignin from miscanthus[J]. Polymer Degradation and Stability, 2009, 94(10): 1632-1638. DOI:10.1016/j.polymdegradstab.2009.07.007 |
| [24] |
Faix O. Classification of lignins from different botanical origins by FT-IR spectroscopy[J]. Holzforschung, 1991, 45(s1): 21-28. DOI:10.1515/hfsg.1991.45.s1.21 |
| [25] |
Cequier E, Aguilera J, Balcells M, et al. Extraction and characterization of lignin from olive pomace:A comparison study among ionic liquid, sulfuric acid, and alkaline treatments[J]. Biomass Conversion and Biorefinery, 2019, 9(2): 241-252. DOI:10.1007/s13399-019-00400-w |
| [26] |
Sun X F, Sun R C, Fowler P, et al. Extraction and characterization of original lignin and hemicelluloses from wheat straw[J]. Journal of Agricultural and Food Chemistry, 2005, 53(4): 860-870. DOI:10.1021/jf040456q |
| [27] |
张通, 白富栋, 李政, 等. 酶解秸秆残渣中木质素提取方法的研究[J]. 化学研究与应用, 2018, 30(6): 901-906. ZHANG Tong, BAI Fu-dong, LI Zheng, et al. Extraction methods of lignin from fermentation residue[J]. Chemical Research and Application, 2018, 30(6): 901-906. |
| [28] |
王健, 张秀梅, 周亚男. 纤维素酶/稀酸处理法分离毛竹木质素[J]. 浙江理工大学学报(自然科学版), 2017, 37(3): 371-375. WANG Jian, ZHANG Xiu-mei, ZHOU Ya-nan. Isolation of lignin from bamboo by the method of cellulase/hydrolysis-mild acidolysis[J]. Journal of Zhejiang Sci-Tech University(Natural Sciences), 2017, 37(3): 371-375. |
| [29] |
Guerra A, Mendonca R, Ferraz A, et al. Structural characterization of lignin during Pinus taeda wood treatment with Ceriporiopsis subvermispora[J]. Applied and Environmental Microbiology, 2004, 70(7): 4073-4078. DOI:10.1128/AEM.70.7.4073-4078.2004 |
 2020, Vol. 39
2020, Vol. 39