2. 南京师范大学地理科学学院, 南京 210023;
3. 江苏省物质循环与污染控制重点实验室, 南京 210023;
4. 中国科学院遗传与发育生物学研究所农业资源研究中心, 石家庄 050022
2. School of Geography Science, Nanjing Normal University, Nanjing 210023, China;
3. Jiangsu Provincial Key Laboratory of Materials Cycling and Pollution Control, Nanjing 210023, China;
4. Center for Agricultural Resources Research, IGDB, CAS, Shijiazhuang 050022, China
在土壤及沉积物环境中普遍含有产电细菌和有机质“燃料”,因此在土壤中构建微生物燃料电池(MFC)可原位产生少量电能。如果能提高土壤MFC的产电能力,实现在野外驱动传感器运行、发射救援信号等用途,将具有广阔的应用前景[1]。土壤MFC阳极位于淹水土壤中,阴极位于上覆水中。土壤中的产电细菌分解有机质,并将电子传递给胞外的阳极,电子通过导线到达阴极,与上覆水中的溶解氧发生还原反应。在这一过程中,细菌细胞内的NADH作为电子供体,O2作为电子受体,从而在土壤MFC导线上形成电流。阳极反应为NADH=NAD++H++2e,φ=-0.32 V;阴极反应为O2+4H++4e=2H2O,φ=+1.229 V。因此以O2作为电子受体时,MFC的理论最大电势差约为1.55 V。但由于土壤MFC内阻较高,土壤有机质含量和产电细菌数量有限,其开路电压远低于1.55 V。Deng等[2]以碳布作为电极材料在淹水土壤中构建土壤MFC,其中单个MFC开路电压约为500 mV;为了提高土壤MFC的电压输出,Wolińska等[3]向土壤中添加葡萄糖等不同碳源;Yu等[4]采用Fe3O4修饰阳极。当土壤MFC电路上连接1 000 W负载时,采用上述措施仅能获得300 mV左右的输出电压。因此,要让土壤MFC输出1 V以上电压,实现驱动小功率电器,需要串联多个土壤MFCs。本课题组以碳毡作为阳极,铂网作为阴极构建土壤MFC,并将3个土壤MFCs串联,实现了最高1.596 V的输出电压和144.16 µW的输出功率,驱动电子钟稳定运行80 h[5],初步实现了土壤MFC驱动小功率电器的目标。但目前涉及土壤MFC发电的研究较少,而基于有机废水、河流和海洋底泥的MFC通过串联实现驱动小型传感器[6-8],有望在所属的环境中实现原位供电。土壤MFC存在内阻较高,以及串联电池引发电压反转和阳极性能有限等问题[9],需要加以解决,才能进一步提升土壤MFC产电能力,实现更长时间稳定驱动小功率电器。另外,考虑到传统的碳基材料如碳纸、碳布、碳毡等质地柔软,用于构建土壤微生物燃料电池时,需要挖开土壤进行埋设[10],增加了操作的复杂性。因此,研究者主要对产电性能和MFC装置实用性两个方向进行改进:一方面通过改进阳极材料,提升阳极导电性、比表面积、孔隙率[11],从而显著提高土壤MFC产电能力[12-15]。另一方面,使用硬质的阳极材料,便于直接插入土壤产电,提高土壤MFC的实用性。
本研究的目的是:阐明作者发明的石墨-无机硅胶复合阳极以及土壤MFC的产电性能,包括长时间稳定驱动小功率电器的能力;揭示阳极表面活跃的产电细菌组成,回答“谁在产电”的问题。为了实现上述目的,本研究将石墨-无机硅胶复合阳极(专利公开号CN110943230A)[16]埋设在水稻土中,铂网作为阴极置于上覆水中构建并运行土壤MFC。将两个土壤MFCs串联驱动一台电子钟稳定运行30 d,之后对土壤MFC进行电化学指标检测,包括阳极电荷传递电阻、极化曲线和最大功率密度。检测结束后,提取阳极表面土壤的RNA,对反转录后的16S rRNA进行测序,从属的水平上揭示土壤中活跃的产电细菌组成和多样性。
1 材料与方法 1.1 供试土壤2018年7月于南京市江宁区水稻田(32°05′ 18″ N,118°28′59″ E)进行土壤样品采集(深度0~20 cm)。土壤采集后研磨过2 mm筛并充分混匀,土壤过筛后保存在4 ℃冰箱中,用于后续“土壤微生物燃料电池构建和运行”实验,部分过筛的土壤经风干后进行理化分析[17]。土壤pH采用pH计(FE20,Mettler Toledo,Switzerland)按土水比1:2.5测定;土壤电导率采用电导率仪(DDSJ-308F,上海雷磁)按土水比1:5测定;土壤可溶性有机碳采用TOC分析仪(TOC-L,Shimadzu,Kyoto,Japan)测定;土壤总氮采用元素分析仪(Vario EL Ⅲ Elementar,Germany)测定。土壤理化性质如下:土壤pH 7.26,土壤电导率105.41 μS·cm−1,土壤可溶性有机碳162.55 mg·kg−1,土壤总氮2.98 g·kg−1。
1.2 阳极材料制备与表征将厚2 mm的碳毡切割成0.5 cm×1.0 cm的长方体,在10%的H2SO4溶液中浸泡30 min,酸洗完成后在去离子水中超声清洗30 min;置于广口玻璃瓶中60 ℃干燥2 h。称取处理后的碳毡0.1 g置于50 mL密度为1.50 g·cm-3的硅酸钠溶液中,使用电动搅拌机(TH-A 100 W,常州国宇仪器)搅拌20 min,超声分散成碳纤维。称取16 g 3 000目的石墨粉(货号C-01-1,戈贵金属)加入上述溶液中,搅拌混匀30 min得到无机硅胶-石墨混合溶液。将所得无机硅胶-石墨混合物注入圆柱形硅胶模具(直径5 cm,高度10 cm),室温不低于25 ℃条件下放置于通风处24 h。
向无机硅胶-石墨混合物中垂直插入6根长度10 cm钛丝,间距1.5 cm,放入烘箱程序性升温,加热固化。升温程序为:40 ℃加热6 h,80 ℃加热1 h,120 ℃加热4 h,自然冷却至室温。固化物置于30%硫酸中浸泡12 h。于40 Hz条件下在去离子水中超声清洗4次,得到石墨-无机硅胶复合阳极。采用扫描电镜(JSM-5610 LV,Japan)观察阳极材料断面的微观结构,用精密蚀刻涂层系统断面喷金,加速电压25 kV[18]。采用比表面与孔隙度分析仪(Micromeritics ASAP2050,US)检测电极材料的比表面积。
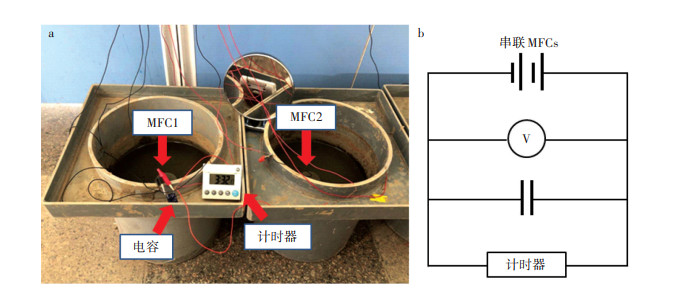
1.3 土壤微生物燃料电池构建和运行在两个PE材质容器(直径30 cm,高度25.5 cm)中分别构建土壤MFC,命名为MFC1、MFC2。过程如下:每个容器装入10 kg土壤(干土质量),缓慢加水至水面高于土壤表面7 cm。将1.2中制备的无机硅胶-石墨复合阳极插入淹水土壤中,阳极上表面位于土壤表面以下3 cm处。阴极(铂网,直径4.5 cm)浸没于上覆水中。采用便携式溶解氧仪(JPBJ-608,上海仪电)检测上覆水中溶解氧浓度,为6.51 mg·L-1。每个土壤MFC的阳极和阴极连接1 000 Ω的外阻,驯化产电细菌,电压稳定后去掉外阻并串联MFC1和MFC2。当串联MFCs的开路电压(OCV)高于1.5 V时,连接电容(1 F)充电。充电完成后将电子计时器(额定电压1.0 V,额定功率18 μW)与电容并联,计时器开始运行(图 1)。在室温下土壤MFC驱动计时器连续运行30 d,使用数据采集卡(7660B,北京中泰研创)每15 min记录一次电压数据;采用电子温度计(T12R-EX,深圳英斯特)每2 h记录一次气温数据。电子计时器运行30 d后,断开电路进行电化学性能测试并提取阳极表面土壤的RNA。
|
a.镜子显示计时器的空电池盒,表示干电池被替换成土壤MFCs;b.电路图 a. The mirror shows the battery box of the timer, indicating that the battery has been replaced with MFCs; b. Circuit diagram 图 1 串联的土壤微生物燃料电池(MFC1和MFC2) Figure 1 Serially connected soil microbial fuel cells(MFC1 and MFC2) |
电子计时器运行结束后,按从高到低的顺序(20、10、5、1 k和500、100、50、10 Ω)依次改变单个MFC和串联MFCs的外阻,获得单个MFC和串联MFCs的极化曲线和功率密度曲线[19]。电流密度j(mA·m-2)和功率密度P(mW·m-2)按下列公式计算:
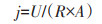
|
(1) |
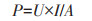
|
(2) |
式中:U为电压,V;R为外电阻,Ω;I为电流,A;A为阳极的表面积,m2。
采用电化学工作站进行电化学阻抗谱分析(Versa STAT4,Princeton applied research,Oak Ridge,US),检测单个MFC的阳极电荷传递电阻。将阳极作为工作电极,阴极作为对电极和参比电极[20]。EIS参数为频率范围10 m~100 kHz,振幅10 mV。采用ZSimDemo 3.30软件选择等效电路拟合Nyquist曲线,获得阳极电荷传递电阻阻值。
1.5 RNA的提取和测序电化学性能测试结束后,采用RNA快速提取试剂盒(Fast RNA SPIN Kit for Soil,MP)从阳极表面土壤中提取RNA。提取完成后采用27F/907R引物进行PCR,确认RNA中不含DNA[21]。RNA提取后立即反转录成cDNA。10 μL反转录体系中含有2 μL 5 × PrimeScriptTM RT Master Mix,1 μL总RNA和7 μL无RNase蒸馏水。该体系在37 ℃下培养15 min,升温至85 ℃维持5 s,使逆转录酶失活,提取的cDNA使用前保存在-80 ℃冰箱中。
采用引物515F(5′-GTG CCA GCM GCC GCG G-3′)/907R(5′ -CCG TCA ATT CMT TTR AGT TT-3′)对反转录后的16S rRNA V4~V5区域进行PCR扩增[22]。PCR体系的体积为25 μL,包括1 μL DNA模板、各1 μL上下游引物、2.5 μL 10×buffer(含Mg2+)、4 μL 10 mmol·L-1 dNTPs(每种各2.5 mmol·L-1)以及2.5 U Taq酶。热循环条件95 ℃ 3 min。40个循环扩增包括95 ℃ 10 s、55 ℃ 20 s、72 ℃ 30 s[23],电泳观察扩增产物。在Illumina Miseq平台(上海美吉)对反转录后的16S rRNA V4~V5区域进行高通量测序。
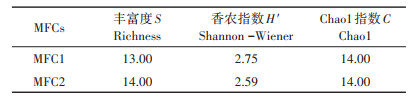
1.6 多样性指数阳极表面产电细菌多样性评估使用Richness物种丰富度(S)、Shannon-Wiener指数(H′)、Chao1(C)指数为参数,计算公式如下:

|
(3) |
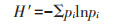
|
(4) |
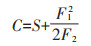
|
(5) |
式中:n为个体数(丰度)大于0的物种类型总数;pi为物种i的相对丰度;F1为仅包含1个个体的物种数;F2为仅包含2个个体的物种数。
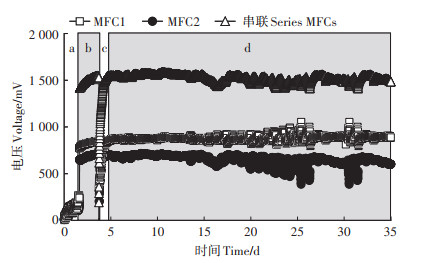
2 结果与分析 2.1 土壤微生物燃料电池的运行土壤MFC阳极的扫描电镜结果显示,石墨-无机硅胶复合阳极结构呈堆叠蜂窝状,石墨片间有碳纤维连接(图 2)。阳极材料比表面积为31.85 m2·g-1。阳极表面产电细菌驯化42.5 h后土壤MFCs电压达到稳定水平,其中MFC1和MFC2的1 000 Ω外阻两端电压分别为(242.2±1)mV和(191.4±1)mV(图 3);开路电压分别为770.9 mV和648.6 mV。MFC1和MFC2串联初始的开路电压为1 407.9 mV。串联48 h后,串联MFCs的开路电压逐渐上升到1 540.1 mV。此时,采用串联MFCs对一个电容(1 F)进行充电。电容连接到MFCs后,串联开路电压急剧下降至183.9 mV,随后逐渐上升。电容充电15.25 h后,串联MFCs的电压上升到1 487.3 mV。将一个电子计时器与电容及串联MFCs并联(图 1),此时串联MFCs及电容同时为电子计时器供电,驱动其连续稳定计时30 d(2019年9月28日—2019年10月28日),期间MFCs串联电压一直稳定在1 403.3~1 579.9 mV,室内温度变化范围为15.5~31.1 ℃。

|
图 2 复合阳极材料的SEM图像(×700倍) Figure 2 SEM image of composite anode material(×700 times) |
|
a.驯化阶段;b.串联阶段;c.电容充电阶段;d.计时器运行阶段 a.Acclimation; b.Serially connection; c.Capacitor charging; d.Timer running 图 3 MFCs的电压曲线 Figure 3 Voltage curves of MFCs in four stages |
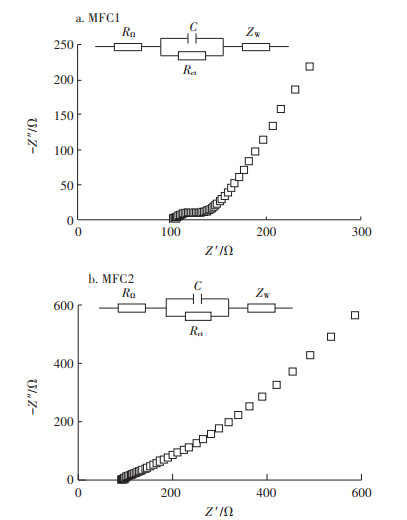
图 4为MFC1和MFC2阳极内阻的Nyquist图以及等效电路图。MFC1和MFC2的阳极等效电路都为欧姆内阻(RΩ)串联电容(C)和阳极电荷传递电阻(Rct)的并联电路。通过等效电路计算出MFC1和MFC2阳极电荷传递电阻分别为16.46 Ω和16.80 Ω,欧姆阻抗分别为102.00 Ω和102.50 Ω。
|
图 4 MFC1和MFC2的阳极Nyquist图以及等效电路图 Figure 4 Nyquist plots and equivalent circuits for anodes of MFC1 and MFC2 |
图 5为MFC1、MFC2以及串联电路极化曲线和功率密度曲线。MFC1和MFC2负载1 000 Ω外阻时达到最大功率密度,分别为3.54 mW·m-2和2.39 mW· m-2。MFC1和MFC2串联电路负载5 000 Ω外阻时,达到最大功率密度5.45 mW·m-2。

|
图 5 MFC1、MFC2和串联MFCs的极化曲线和功率密度曲线 Figure 5 Polarization curves and power density curves of MFC1, MFC2 and serially connected MFCs |
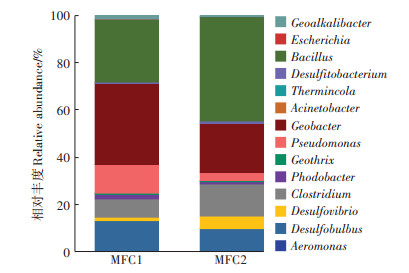
基于16S rRNA的测序结果(图 6)表明,MFCs阳极表面的土壤中有14个活跃的产电细菌相关属,包括气单胞菌属(Aeromonas)、脱硫球茎菌属(Desulfobulbus)、脱硫弧菌属(Desulfovibrio)、梭菌属(Clostridium)、红杆菌属(Rhodobacter)、地发菌属(Geothrix)、假单胞菌属(Pseudomonas)、地杆菌属(Geobacter)、不动杆菌(Acinetobacter)、脱亚硫酸菌属(Desulfitobacterium)、芽孢杆菌属(Bacillus)、大肠杆菌属(Escherichia),以及Thermincola和Geoalkalibacter。表 1显示产电细菌相关属的多样性指数。MFC1和MFC2阳极上产电细菌相关属的16S rRNA数量占全部细菌的5.97%和4.97%。在至少一个MFC中,占产电细菌相关属16S rRNA总量10%的产电细菌相关属包括地杆菌属(Geobacter)(MFC1中占32.59%,MFC2中占19.54%)、芽孢杆菌属(Bacillus)(MFC1中占25.46%,MFC2中占41.97%)、梭菌属(Clostridium) (MFC1中占6.97%,MFC2中占12.60%)、脱硫球茎菌属(Desulfobulbus)(MFC1中占12.32%,MFC2中占8.98%)和假单胞菌属(Pseudomonas)(MFC1中占11.45%)。
|
图 6 两个土壤MFCs阳极中检测到的活跃的产电细菌相关属的相对丰度 Figure 6 The relative abundance of the active exoelectrogenic bacteria-associated genera detected from the anodes of the two individual soil MFCs |
|
|
表 1 阳极表面土壤中的产电细菌多样性指数 Table 1 Exoelectrogenic bacteria diversity index of paddy soil on anode surface |
本研究采用自主发明的一种石墨-无机硅胶阳极材料构建土壤MFCs,在淹水水稻土中利用产电细菌分解有机质产生的电能稳定运行电子计时器30 d。实现这一结果经历了4个步骤,包括产电细菌的驯化、串联土壤MFCs、电容充电,以及驱动电器。新型阳极材料的MFC性能在上述4个环节中均表现良好,相比于作者前期研究[3],本研究土壤MFCs的产电性能取得了以下进展:(1)阳极电荷传递电阻较低,且阳极比表面积较高,表明该阳极材料有利于产电细菌附着并具有较高的电子传递效率;(2)产电菌的驯化时间(55 h)远低于作者前期研究中的110 h及其他MFC的驯化时间[24],且驱动电子计时器运行30 d,远超出作者前期研究中的80 h;(3)采用两个土壤MFCs串联实现上述高产电性能,而作者前期研究需要3个土壤MFCs串联,串联MFCs数量的减少降低了电压反转的风险。除了产电性能优越之外,本研究发明的刚性阳极材料能直接插入底泥产电,操作方便;而以往研究[5, 10]多采用柔软的碳毡阳极,需要挖开底泥埋设后才能产电,操作繁琐。以往研究也表明土壤长期产电不会造成土壤有机质的显著降低[25],因此土壤MFC在水稻土中能够长期稳定地驱动用电器。本研究串联土壤MFCs开路电压稳定在1.5 V左右,最大输出功率158.42 µW,可运行该功率以下的小功率用电器,包括微瓦级低功耗传感器及移动显示器等。由于土壤内阻较高,且土壤中有机质含量和产电细菌数量有限,因此本研究获得的最大功率密度受到限制。相同电极面积下,土壤MFCs的输出功率远低于基于液体培养基或者有机废水的MFC的输出功率(功率密度可达数百mW·m-2以上)[26]。但是土壤MFC的功率密度还可以进一步提升,措施包括在土壤中种植水稻(Oryza sativa)、互花米草(Spartina anglica)、狼尾草(Pennisetum setaceum)等禾本科植物以增加土壤有机质[27];在阴极表面附着小球藻(Chlorella vulgaris)以提高O2浓度[28];采用硼/氮/磷/硫掺杂电极、纳米材料电极、3D多孔电极等以促进阳极和阴极的催化反应[29]等。而且土壤MFC的优势在于实现野外条件下的长时间原位供电,不用更换培养基和接种产电细菌;土壤MFC以土壤有机质为电子供体,水中的溶解氧为电子受体,发电过程产物是H2O,发电成本低、不产生污染。
电化学检测结果显示本研究采用的阳极电荷传递电阻小于17.0 Ω,远低于采用碳毡作为阳极材料的阳极电荷传递电阻36.03、77.10 Ω[5, 30]。MFC的产电性能和阳极电荷传递电阻直接相关,阳极作为产电细菌的载体,极大地影响微生物与电极之间的电子传递[31]。较低的电荷传递电阻有利于微生物将电能传递到用电系统中[32]。扫描电镜图像和产电细菌多样性进一步表明本研究中采用的石墨-无机硅胶阳极材料具有蜂窝状三维立体结构,以及较大的比表面积,有利于电极表面细菌的附着与生长,提高电子传递速率[33]。
串联MFCs在运行过程中容易出现电压反转,导致串联失败[34]。电压反转的原因包括:内阻过高[35]、MFC长时间运行中底物缺乏[36]、微生物催化效果不佳[37]、电流密度过高[38]。本研究串联MFCs运行的全过程中,未出现电压反转现象,这可能是在MFC与用电器之间使用电容器连接的原因。根据公式(6):
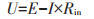
|
(6) |
式中:U为输出电压,V;E为串联MFCs的电动势,V;I为电流,A;Rin为内阻,Ω。虽然本研究中阳极电荷传递电阻较低,但阴极受制于铂催化O2得电子速率的影响,在作者团队之前研究中多次测试得到阴极电荷传递电阻大约为400 Ω[39],因此经过串联后土壤MFCs内阻至少达到800 Ω,远高于一个干电池的内阻。若串联土壤MFCs直接与计时器连接,当电流产生时,会出现剧烈压降,甚至电压变负,导致驱动计时器失败。采用电容器可以储存电能是一种避免电压反转,实现MFC正常驱动电器的有效方法。
产电细菌是MFC系统中电能的直接生产者。土壤中的产电细菌通过细胞色素c等多种蛋白将分解有机质产生的电子跨膜传递至阳极表面。在胞外电子传递过程中,产电细菌既可以通过直接电子传递方式,也可以通过分泌中介体等间接电子传递方式将电子传递到阳极表面[40-41],产电细菌活性直接影响MFC的产电性能[42]。由于至今尚未发现产电细菌共有的特征基因,因此无法借助通用引物和PCR来揭示产电细菌多样性。以往大多数研究采用模式产电细菌地杆菌属(Geobacter)和希瓦氏菌属(Shewanella),或者地杆菌科(Geobacteraceae)来代表所有产电细菌[43-44]。而作者团队曾经从不同的土壤中分离鉴定了11株属于梭菌属(Clostridium)的产电细菌[25],并且基于16S rRNA基因的定量分析显示在土壤中,梭菌属和地杆菌属的细菌数量相当,相反,希瓦氏菌属在土壤中数量很少[17, 23]。目前为止,已报道约100种产电细菌菌种,分布于57个属[45-46]。作者团队将这57个属定义为产电细菌相关属,通过对全国范围不同土壤16S rRNA基因测序,发现土壤中含有16个产电细菌相关属,实现从属的水平揭示产电细菌的组成[23]。尽管这一方法存在一定偏差,例如一些产电细菌相关属中只有一部分菌种被鉴定为产电细菌。但该方法仍能近似表征土壤产电细菌组成和多样性,相比仅用地杆菌科来代表土壤产电细菌前进了一大步。本研究发现阳极表面土壤中的活性产电细菌相关属共14个,高于作者先前碳毡阳极研究中发现的10个产电细菌相关属[5]。产电细菌相关属的多样性的提高表明石墨无机硅胶阳极有利于产电细菌的附着和生长。本研究两个土壤MFCs的产电细菌多样性以及电化学性能并不完全一致,主要是土壤和MFC装置的误差所致。
石墨无机硅胶阳极表面的土壤中,最主要的活性产电细菌相关属包括地杆菌属(Geobacter)、芽孢杆菌属(Bacillus)、梭菌属(Clostridium)、脱硫球茎菌属(Desulfobulbus)和假单胞菌属(Pseudomonas)。在之前的研究中对全国8个不同地区(其中包括本研究的采样地)水稻土中产电细菌相关属进行了16S rRNA基因测序,发现地杆菌属(Geobacter)、梭菌属(Clostridium)和假单胞菌属(Pseudomonas)在数量上是优势产电菌群,而芽孢杆菌属(Bacillus)数量上并不占优势[23]。但是本研究经过30 d的产电过程,芽孢杆菌(Bacillus)和地杆菌(Geobacter)成为阳极表面最活跃的产电细菌相关属,表明这两个属具有较高的产电活性。其中,地杆菌属(Geobacter)的大量菌种已被确定为产电细菌且在水稻土中广泛存在,包括G. anodireducens、G. bemidjiensis、G. bremensis、G. chapellei、G. humireducens、G. hydrogenophilus、G. lovleyi、G. metallireducens、G. sulfurreducens和G. uraniireducens[44]。芽孢杆菌属(Bacillus)中已获报道的产电细菌为B. subtilis、B. infernus和B. thermoamylovorans[47],其中B. subtilis已从水稻土中分离培养[48]。属于梭菌属(Clostridium)的产电细菌包括C. acetobutylicum、C. beijerinckii、C. butyricum、C. propionicum和C. sporogenes,这些菌种都存在于水稻土中[49];属于假单胞菌属(Pseudomonas)的产电细菌包括P. aeruginosa、P. alcaliphila、P. fluorescens和P. stutzeri。除P. alcaliphila之外,其他3个菌种都从水稻土中获得分离[50-52]。脱硫球茎菌属(Desulfobulbus)中目前仅报道一种产电细菌D. propionicus,存在于淡水沉积物中[53]。由于不可培养的原因,目前所发现的产电细菌菌种也许只占所有产电细菌的极少部分。土壤作为微生物的“大本营”,有望从其中分离出更多的产电细菌菌株。
土壤及沉积物中的产电细菌展现出多种潜在应用,除了原位驱动小功率电器[5, 8]之外,还能够产生电信号原位在线监测污染事件[17, 54],以及用于环境修复,例如脱硫弧菌还原铬(Ⅵ)[55];地杆菌、芽孢杆菌和假单胞菌还原铀(Ⅵ)、钒(Ⅴ)等[56-58]。对这些潜在应用加以进一步探索,有望在新能源、环境监测和修复领域产生新技术。
4 结论本研究发明的石墨-无机硅胶复合阳极的电荷传递电阻约为16 Ω。以该阳极构建的单个土壤MFC最大功率密度约为3 mW·m-2,两个土壤MFCs串联电路的最大功率密度为5.45 mW·m-2,最大输出功率158.42 µW,最高输出电压1 579.9 mV,实现驱动电子计时器稳定运行30 d,因此石墨-无机硅胶复合阳极适用于土壤MFC。同时本研究土壤中活跃的产电细菌相关属有14个,其中地杆菌属(Geobacter)、芽孢杆菌属(Bacillus)、梭菌属(Clostridium)、脱硫球茎菌属(Desulfobulbus)和假单胞菌属(Pseudomonas)为最活跃的产电细菌相关属。
| [1] |
Kumar S S, Kumar V, Kumar R, et al. Microbial fuel cells as a sustainable platform technology for bioenergy, biosensing, environmental monitoring, and other low power device applications[J]. Fuel, 2019, 255: 115682. |
| [2] |
Deng H, Wu C Y, Zhang F, et al. Factors affecting the performance of single-chamber soil microbial fuel cells for power generation[J]. Pedosphere, 2014, 24(3): 330-338. |
| [3] |
Wolińska A, Stępniewska Z, Bielecka A, et al. Bioelectricity production from soil using microbial fuel cells[J]. Applied Biochemistry & Biotechnology, 2014, 173(8): 2287. |
| [4] |
Yu B, Li Y H, Feng L. Enhancing the performance of soil microbial fuel cells by using a bentonite-Fe and Fe3O4 modified anode[J]. Journal of Hazardous Materials, 2019, 377: 70-77. |
| [5] |
Lu Y, Liu L, Wu S, et al. Electricity generation from paddy soil for powering an electronic timer and an analysis of active exoelectrogenic bacteria[J]. AMB Express, 2019, 9(1): 57. |
| [6] |
An B M, Heo Y, Maitlo H A, et al. Scaled-up dual anode/cathode microbial fuel cell stack for actual ethanolamine wastewater treatment[J]. Bioresource Technology, 2016, 68-73. |
| [7] |
Azari M A G, Gheshlaghi R, Mahdavi M A, et al. Electricity generation from river sediments using a partitioned open channel sediment microbial fuel cell[J]. International Journal of Hydrogen Energy, 2017, 42(8): 5252-5260. |
| [8] |
付玉彬, 李建海, 赵仲凯, 等. 海底生物燃料电池作为电源驱动小型电子器件的应用研究[J]. 中国海洋大学学报(自然科学版), 2012, 42(6): 93-98. FU Yu-bin, LI Jian-hai, ZHAO Zhong-kai, et al. Application research of marine sediment microbial fuel cell as power supply to drive small electronic equipments[J]. Periodical of Ocean University of China, 2012, 42(6): 93-98. |
| [9] |
Kim T, Yeo J, Yang Y, et al. Boosting voltage without electrochemical degradation using energy-harvesting circuits and power management system-coupled multiple microbial fuel cells[J]. Journal of Power Sources, 2019, 410/411: 171-178. |
| [10] |
Kaku N, Yonezawa N, Kodama Y, et al. Plant/microbe cooperation for electricity generation in a rice paddy field[J]. Applied Microbiology and Biotechnology, 2008, 79(1): 43-49. |
| [11] |
Hsu L, Chadwick B, Kagan J, et al. Scale up considerations for sediment microbial fuel cells[J]. RSC Advances, 2013, 3(36): 15947. |
| [12] |
Cheng S, Liu H, Logan B E. Increased power generation in a continuous flow MFC with advective flow through the porous anode and reduced electrode spacing[J]. Environmental Science & Technology, 2006, 40(7): 2426-2432. |
| [13] |
You S, Ma M, Wang W, et al. 3D macroporous nitrogen-enriched graphitic carbon scaffold for efficient bioelectricity generation in microbial fuel cells[J]. Advanced Energy Materials, 2016, 7(4): 1601364. |
| [14] |
Hindatu Y, Annuar M S M, Gumel A M. Mini-review:Anode modification for improved performance of microbial fuel cell[J]. Renewable and Sustainable Energy Reviews, 2017, 73: 236-248. |
| [15] |
Lu M, Qian Y, Yang C, et al. Nitrogen-enriched pseudographitic anode derived from silk cocoon with tunable flexibility for microbial fuel cells[J]. Nano Energy, 2017, 32: 382-388. |
| [16] |
周丰武, 鲁雨, 邓欢, 等.一种微生物燃料电池阳极及其制备方法: CN110943230A[P]. 2020-03-31. ZHOU Feng-wu, LU Yu, DENG Huan, et al. Microbial fuel cell anode and preparation method thereof: CN110943230A[P]. 2020-03-31. |
| [17] |
Wu S S, Deng H, Han C, et al. A novel sediment microbial fuel cell based sensor for on-line and in situ monitoring copper shock in water[J]. Electroanalysis, 2018, 30: 2668-2675. |
| [18] |
Gao X, Zhang Y, Li X, et al. Novel graphite sheet used as an anodic material for high-performance microbial fuel cells[J]. Materials Letters, 2013, 105: 24-27. |
| [19] |
Li X, Wang X, Zhao Q, et al. Carbon fiber enhanced bioelectricity generation in soil microbial fuel cells[J]. Biosensors and Bioelectronics, 2016, 85: 135-141. |
| [20] |
Luo S, He Z. Ni-coated carbon fiber as an alternative cathode electrode material to improve cost efficiency of microbial fuel cells[J]. Electrochimica Acta, 2016, 222: 338-346. |
| [21] |
Chen Y, Dumont M G, Cébron A, et al. Identification of active methanotrophs in a landfill cover soil through detection of expression of 16S rRNA and functional genes[J]. Environmental Microbiology, 2007, 9(11): 2855-2869. |
| [22] |
Yusoff M Z M, Hu A, Feng C, et al. Influence of pretreated activated sludge for electricity generation in microbial fuel cell application[J]. Bioresource Technology, 2013, 145: 90-96. |
| [23] |
Wang J, Deng H, Wu S S, et al. Assessment of abundance and diversity of exoelectrogenic bacteria in soil under different land use types[J]. Catena, 2019, 172: 572-580. |
| [24] |
李辉, 方正. 驯化期外电路对微生物燃料电池的影响[J]. 华文科技大学学报(自然科学版), 2013, 41(11): 32-36. LI Hui, FANG Zheng. Effect of external circuits on microbial fuel cell during acclimated period[J]. Journal of Huazhong University of Science and Technology (Natural Science Edition), 2013, 41(11): 32-36. |
| [25] |
Jiang Y B, Zhong W H, Han C, et al. Characterization of electricity generated by soil in microbial fuel cells and the isolation of soil source exoelectrogenic bacteria[J]. Frontiers in Microbiology, 2016, 7: 1776. |
| [26] |
Mathuriya A S, Yakhmi J V. Microbial fuel cells:Applications for generation of electrical power and beyond[J]. Critical Reviews in Microbiology, 2016, 42(1): 127-143. |
| [27] |
Kouzuma A, Kaku N, Watanabe K. Microbial electricity generation in rice paddy fields:Recent advances and perspectives in rhizosphere microbial fuel cells[J]. Appl Microbiol Biotechnol, 2014, 98: 9521-9526. |
| [28] |
Saba B, Christy A D, Yu Z, et al. Sustainable power generation from bacterio-algal microbial fuel cells(MFCs):An overview[J]. Renewable & Sustainable Energy Reviews, 2017, 73: 75-84. |
| [29] |
Du Y, Ma F X, Xu Y C, et al. Nitrogen-doped carbon nanotubes/reduced graphene oxide nanosheet hybrids towards enhanced cathodic oxygen reduction and power generation of microbial fuel cells[J]. Nano Energy, 2019, 533-539. |
| [30] |
Yin Y, Huang G T, Zhou N B, et al. Increasing power generation of microbial fuel cells with a nano-CeO2 modified anode[J]. Energy Sources Part A:Recovery Utilization and Environmental Effects, 2016, 38(9): 1212-1218. |
| [31] |
Qiao Y, Li C M, Bao S J, et al. Carbon nanotube/polyaniline composite as anode material for microbial fuel cells[J]. Power Sources, 2007, 170: 79-84. |
| [32] |
黄力华, 李秀芬, 任月萍, 等. 石墨烯掺杂聚苯胺阳极提高微生物燃料电池性能[J]. 环境科学, 2017, 38(4): 1717-1725. HUANG Li-hua, LI Xiu-fen, REN Yue-ping, et al. Performance improvement of microbial fuel cell with polyaniline dopped graphene anode[J]. Environmental Science, 2017, 38(4): 1717-1725. |
| [33] |
Liu J, Qiao Y, Guo C X, et al. Graphene/carbon cloth anode for highperformance mediatorless microbial fuel cells[J]. Bioresource Technology, 2012, 114: 275-280. |
| [34] |
An J, Gao Y H, Lee H S. Induction of cathodic voltage reversal and hydrogen peroxide synthesis in a serially stacked microbial fuel cell[J]. Journal of Environmental Management, 2019, 241: 84-90. |
| [35] |
Lee Y S, An J, Kim B, et al. Serially connectable sediment microbial fuel cells using dipole graphite solids and voltage reversal suppression[J]. Energy Technology, 2017, 5: 1946-1952. |
| [36] |
Oh S E, Logan B E. Voltage reversal during microbial fuel cell stack operation[J]. Journal of Power Sources, 2007, 167(1): 11-17. |
| [37] |
Aelterman P, Rabaey K, Pham H T, et al. Continuous electricity generation at high voltages and currents using stacked microbial fuel cells[J]. Environmental Science & Technology, 2006, 440(10): 3388-3394. |
| [38] |
Huang R H, Mo B, Zhao F, et al. Voltage reversal of microbial fuel cells stacked in serial[J]. Key Engineering Materials, 2014, 609-610: 1422-1427. |
| [39] |
吴少松, 邓欢, 刘丽, 等. 沉积物产电信号原位在线监测水体铜污染研究[J]. 环境科学学报, 2018, 38(6): 2454-2461. WU Shao-song, DENG Huan, LIU Li, et al. Using electrical signals generated by sediments to in situ and on-line monitor copper pollution in water[J]. Acta Scientiae Circumstantiae, 2018, 38(6): 2454-2461. |
| [40] |
Clarke T A, Richardson D J. Structure of a bacterial cell surface decaheme electron conduit[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(23): 9384-9389. |
| [41] |
Watanabe K, Manefield M, Lee M, et al. Electron shuttles in biotechnology[J]. Current Opinion in Biotechnology, 2009, 20(6): 633-641. |
| [42] |
Koch C, Harnisch F. What is the essence of microbial electroactivity?[J]. Frontiers in Microbiology, 2016, 7: 1890. |
| [43] |
Ishii S, Suzuki S, Norden-Krichmar T M, et al. Identifying the microbial communities and operational conditions for optimized wastewater treatment in microbial fuel cells[J]. Water Research, 2013, 47(19): 7120-7130. |
| [44] |
Schilirò T, Tommasi T, Armato C, et al. The study of electrochemically active planktonic microbes in microbial fuel cells in relation to different carbon-based anode materials[J]. Energy, 2016, 106: 277-284. |
| [45] |
Koch C, Harnisch F. Is there a specific ecological niche for electroactive microorganisms?[J]. ChemElectroChem, 2016, 3: 1282-1295. |
| [46] |
Abbas S Z, Rafatullah M, Ismail N, et al. A review on sediment microbial fuel cells as a new source of sustainable energy and heavy metal remediation:Mechanisms and future prospective[J]. Energy Research, 2017, 41: 1242-1264. |
| [47] |
Wang G W, Chen T H, Yue Z B, et al. Isolation and characterization of, Pseudomonas stutzeri capable of reducing Fe(Ⅲ)and nitrate from skarn-type copper mine tailings[J]. Geomicrobiology Journal, 2014, 31(6): 509-518. |
| [48] |
Watanabe K, Sakai J, Hayano K. Bacterial extracellular protease activities in field soils under different fertilizer managements[J]. Canadian Journal of Microbiology, 2003, 49(5): 305. |
| [49] |
Deng H, Xue H J, Zhong W H. A novel exoelectrogenic bacterium phylogenetically related to clostridium sporogenes isolated from copper contaminated soil[J]. Electroanalysis, 2017, 29: 1294-1300. |
| [50] |
Satapute P, Kaliwal B. Biodegradation of the fungicide propiconazole by Pseudomonas aeruginosa PS-4 strain isolated from a paddy soil[J]. Annals of Microbiology, 2016, 66(4): 1355-1365. |
| [51] |
Li S, Li X, Li F. Fe(ll)oxidation and nitrate reduction by a denitrifying bacterium, Pseudomonas stutzeri LS-2, isolated from paddy soil[J]. Journal of Soil & Sediments, 2018, 18(4): 1668-1678. |
| [52] |
Saranraj P, Sivasakthivelan P, Siva Sakthi S. Prevalence and production of plant growth promoting substance by Pseudomonas fluorescens isolates from paddy rhizosphere soil of cuddalore district[J]. African Journal of Basic & Applied Sciences, 2013, 5(2): 95-101. |
| [53] |
Baldwin D S, Hall K C, Rees G N, et al. Development of a protocol for recognizing sulfidic sediments(potential acid sulfate soils)in freshwater wetlands[J]. Ecological Management & Restoration, 2010, 8(1): 56-60. |
| [54] |
刘丽, 吴少松, 杨楚瑶, 等. DH-I型SMFC传感器产电信号对连续多次镉污染的响应研究[J]. 环境科学学报, 2019, 39(7): 2224-2230. LIU Li, WU Shao-song, YANG Chu-yao, et al. The response of electrical signals generated by DH-I type sediment microbial fuel cell based sensors to multipal cadmium pollution[J]. Acta Scientiae Circumstantiae, 2019, 39(7): 2224-2230. |
| [55] |
唐朱睿, 黄彩红, 高如泰, 等. 胞外呼吸菌在污染物迁移与转化过程中的应用进展[J]. 农业资源与环境学报, 2017, 34(4): 299-308. TANG Zhu-rui, HUANG Cai-hong, GAO Ru-tai, et al. Review on dxtracellular respiratory bacteria and its application in migration and transformation of pollutants[J]. Journal of Agricultural Resources & Environment, 2017, 34(4): 299-308. |
| [56] |
Zhang B G, Qiu R, Lu L, et al. Autotrophic vanadium(Ⅴ)bioreduction in groundwater by elemental sulfur and zerovalent iron[J]. Environmental Science & Technology, 2018, 52(13): 7434-7442. |
| [57] |
Zhang B G, Wang S, Diao M H, et al. Microbial community responses to vanadium distributions in mining geological environments and bioremediation assessment[J]. Journal of Geophysical Research:Biogeosciences, 2019, 124: 601-615. |
| [58] |
Zeng Q, Huang L, Ma J, et al. Bio-reduction of ferrihydrite-montmorillonite-organic matter complexes:Effect of montmorillonite and fate of organic matter[J]. Geochimica et Cosmochimica Acta, 2020, 276: 327-344. |
 2020, Vol. 39
2020, Vol. 39