四环素类抗生素是世界上使用最广泛、用量最大的抗生素之一,包括金霉素、土霉素、四环素和强力霉素等,其在降低禽畜呼吸道、肠道、尿道、皮肤感染等疾病控制方面起到了非常重要的作用[1]。由于抗生素在禽畜体内代谢不完全,大量的抗生素(30%~ 90%)通过粪尿形式排出体外。据报道,畜禽粪便中四环素的含量高达98.20~354.00 mg·kg-1,这些畜禽粪便被用作粪肥施入土壤,导致农田土壤中的四环素类抗生素残留量达29.70~8400 µg·kg-1,部分土壤超过欧盟提出的抗生素生态毒害效应的触发值(100 µg·g-1)[2]。抗生素在环境中的积累,使致病菌产生抗性基因,对水生动物、土壤微生物、土壤酶和人类健康造成不良影响[3-4]。抗生素污染土壤的整治与修复成为当前研究的热点课题。
蚯蚓被誉为“生态系统的工程师”,是土壤中最大的无脊椎动物。蚯蚓通过挖穴、取食、排便、蠕动等活动可改变土壤透气性、团粒结构,改善土壤理化性质,为污染物去除提供良好的环境条件[5]。蚯蚓肠道能将一些难分解的物质转化为易被微生物利用的有机物排出体外,加速土壤有机质的转化速率[6-7]。同时,蚯蚓分泌物中富含氨基酸、多糖类和生物酶等成分,为微生物提供了营养物质,刺激了土著微生物的数量和活性[8]。已有大量研究表明,蚯蚓可以显著提高有机污染物DDT、PCP和阿特拉津污染土壤的自净能力,加速有机污染的生物降解[9-11]。另外,蚯蚓对抗生素有较高的耐受性,只有在150 mg·kg-1的浓度条件下才会产生毒副作用[12]。现阶段已有许多学者在蚯蚓对抗生素解毒防御机理、抗性基因的传播和消减等方面做了大量的研究[13-15],但关于抗生素污染土壤中蚯蚓通过改变何种环境因子影响土壤酶活性和微生物群落结构,提高四环素污染土壤的自净能力和土壤肥力方面研究非常有限。
土壤酶和微生物可参与土壤中诸多复杂生物化学过程。土壤酶活性反映了生化进程的强度和方向[16-17]。例如:脲酶和酸性磷酸酶可分别水解尿素和有机磷,向植物和其他土壤生物提供无机氮和磷元素[18]。微生物是土壤酶的主要来源之一,主要负责土壤中的物质循环、能量转化和污染物降解等诸多复杂的生物化学过程,能对环境变化做出快速反应[19]。微生物群落的变化影响着土壤酶的活性[20]。因此,深入了解四环素污染下土壤酶活性和微生物群落结构,对改善四环素污染土壤的自净能力和土壤肥力方面有重要意义。
针对上述问题,本研究以赤子爱胜蚓(Eisenia foetida)和壮伟环毛蚓(Amynthas robustus)两种不同生态型蚯蚓为工程生物,以粤西地区砖红壤为供试土壤,研究两种不同生态型蚯蚓对四环素污染土壤中蔗糖酶、酸性磷酸酶、脲酶、过氧化氢酶和脱氢酶活性的影响。运用高通量测序测定不同处理中的细菌群落结构,运用冗余分析方法对土壤酶活性和土壤理化性质进行相关性研究,以期明确不同生态型蚯蚓通过改变何种环境因子,影响四环素污染土壤的酶活性和细菌群落结构,为探明蚯蚓对四环素污染胁迫的土壤自净能力和土壤肥力的改善作用提供理论支持。
1 材料与方法 1.1 供试材料本试验供试蚯蚓为赤子爱胜蚓(表层种)和壮伟环毛蚓(内层种),购自许氏蚯蚓养殖基地(广西南宁)。试验前所有蚯蚓在试验土壤中驯化两周,试验时选取健壮、大小相当、具有环带的成年蚯蚓,用无菌水清洗干净放置于装有湿润滤纸的烧杯中,在黑暗培养箱中25 ℃培养24 h,使其排出体内粪便。
供试土壤为砖红壤,采自湛江市麻章区郊外旱地(110°17′13″ E,21°10′49″ N)。除去地表石子、植被等杂物后,用采样器采集深度为0~20 cm的土壤,混匀,自然风干后,过20目筛备用。供试土壤未发现四环素污染,土壤pH为5.37,有机质含量为22.94 g· kg-1,碱解氮为78.69 mg · kg-1,速效磷为18.88 mg · kg-1,速效钾为179.56 mg·kg-1。
试验试剂盐酸四环素,产自美国Sigma公司,纯度为98%。试验过程中所用的其他试剂均为分析纯。
1.2 土壤处理与蚯蚓培养将采集的土壤分成两个平行(灭菌土壤和非灭菌土壤,简称灭菌土和自然土)。其中一平行置于高温高压灭菌锅内,于121 ℃灭菌2 h,用平板划线法判断是否灭菌完全。
在无菌操作台上,取灭菌土和自然土各3 kg,分别装入6个经酒精灭菌的塑料瓶中,每个塑料瓶装土1 kg。用无菌水将土壤含水量调至43%(m/m,称质量补水法),每千克土加入5 mg四环素,充分混匀后贴上标签,室温平衡24 h后放入蚯蚓。试验设计如下:自然土+15条赤子爱胜蚓(NE)、自然土+8条壮伟环毛蚓(NA)、灭菌土+15条赤子爱胜蚓(SE)、灭菌土+8条壮伟环毛蚓(SA),剩余的1份自然土(CK)和1份灭菌土(CO)不加蚯蚓,作为对照组,每组处理设置3个重复。
塑料瓶用纱布封盖,保证透气性并且防止蚯蚓逃跑,将塑料瓶放至25 ℃恒温培养室避光培养40 d,分别于培养0、10、20、30 d及40 d时取样,测定土壤蔗糖酶、脲酶、过氧化氢酶、脱氢酶和酸性磷酸酶的活性,并于培养的第40 d测定土壤pH、有机质和腐殖质各组分(胡敏酸、胡敏素和富里酸)的质量分数。
1.3 土壤养分的测定土壤pH的测定:土壤的pH采用电位法测定[21],具体方法为称取5 g土样过2 mm筛,加入12.5 mL去二氧化碳蒸馏水(煮沸),搅拌充分后静置2 h,取上清液,用校准过的雷磁pH计(型号:PHSJ-3F,上海仪电科学仪器股份有限公司)进行测定。
有机质的测定:土壤有机质采用重铬酸钾容量法进行测定[22],在加热的条件下,用过量的重铬酸钾-硫酸溶液氧化有机碳,使有机质中的碳氧化成二氧化碳,然后用标准硫酸亚铁铵溶液滴定剩余的重铬酸钾,由消耗的重铬酸钾量按校正系数计算出有机碳的质量分数。
腐殖质的测定:土壤的腐殖质由胡敏酸、富里酸和胡敏素组成,其质量分数采用参考文献[23]中的方法进行测定。用焦磷酸钠和氢氧化钠混合液对土壤中的腐殖质进行提取,然后用重铬酸钾氧化外加热法测定溶液中胡敏酸碳量、富里酸碳量和胡敏素碳量。
1.4 酶活性的测定土壤酶活性根据关松荫的《土壤酶及其研究法》进行测定[24],具体方法如下:
(1)蔗糖酶活性的测定:采用3,5-二硝基水杨酸比色法,以蔗糖为基质,3,5-二硝基水杨酸与还原糖共热被还原成棕红色的氨基化合物3-氨基-5-硝基水杨酸,利用分光光度计在508 nm波长下进行比色测定。在一定范围内还原糖的量和反应液的颜色深度成正比,因此可求得样品中的蔗糖酶活性,其活性以每日每克土生成葡萄糖的量表示,单位为mg·g-1·d-1。
(2)酸性磷酸酶活性的测定:采用磷酸苯二钠比色法,以磷酸苯二钠为基质,醋酸盐溶液为缓冲液,土壤磷酸酶与基质反应释放出酚。酚与氯代二溴对苯醌亚胺试剂显示蓝色,颜色深浅与酚量相关,利用分光光度计在660 nm处比色,测出游离酚量。酸性磷酸酶活性以每日每克土壤中释放的酚量表示,单位为mg·g-1·d-1。
(3)脲酶活性的测定:采用靛酚蓝比色法,以尿素为基质,根据酶促的产物-氨在碱性基质中,与苯酚及次氯酸钠作用生成蓝色的靛酚。靛酚蓝的生成数量与氨浓度呈正比,利用分光光度计在578 nm处进行比色分析,脲酶活性以每日每克土壤生成铵态氮的量表示,单位为mg·g-1·d-1。
(4)过氧化氢酶活性的测定:采用高锰酸钾滴定法测定,过氧化氢酶能使过氧化氢分解生成水和氧气。往土壤中加入定量的过氧化氢,作用一段时间后,用高锰酸钾溶液滴定土壤中剩余的过氧化氢量,土壤过氧化氢加入量与剩余量之差即为被酶催化反应消耗的过氧化氢,由此测得酶活性。酶活性以每20 min每克土壤消耗0.1 mol·L-1高锰酸钾溶液的体积表示,单位为mL·g-1·20 min-1。
(5)脱氢酶活性的测定:采用氯化三苯基四氮唑(TTC)还原法,用三苯基四唑氯化物作为氢的受体生成红色三苯基甲䐶(TPF),TPF的量与红色深浅有关。利用分光光度计在485 nm处进行比色测定,脱氢酶以每日每克土生成的TPF的量表示,单位为μg·g-1·d-1。
1.5 土壤细菌群落高通量分析利用土壤DNA提取试剂盒:BioFast Soil Genomic DNA extraction kit(BIOER,中国杭州)对培养40 d的土样微生物总DNA进行提取,使用核酸蛋白定量检测仪测定样品DNA的浓度。随后利用338F-806R引物对提取的总DNA进行PCR扩增(338F引物:5′ - ACTCCTACGGGAGGCAGCA-3 ′,806R引物:5 ′ - GGACTACHVGGGTWTCTAAT-3 ′),扩增区域为V3~V4区。对扩增后的产物进行回收,最后送至北京百迈客生物科技有限公司的IIIumina MiSeq测序平台进行测序。
1.6 数据处理高通量测序所得数据用Flash软件进行拼接,对拼接得到的序列进行过滤,随后使用Uchime软件鉴定并去除嵌合体序列,得到最终有效数据。使用Qi⁃ ime软件中对序列在97%的相似度水平下进行聚类、获得OTU,并基于细菌分类学数据库对OTU进行分类学注释。
试验理化数据利用SPSS 19.0进行单因素方差分析,测定数据以平均值+标准差的形式表示,不同处理之间采用Duncan′ s法进行多重比较(P < 0.05),利用Origin 9.0进行作图。利用Canoco 5.0中的线性模型RDA分析土壤酶活性及环境因子相关关系。
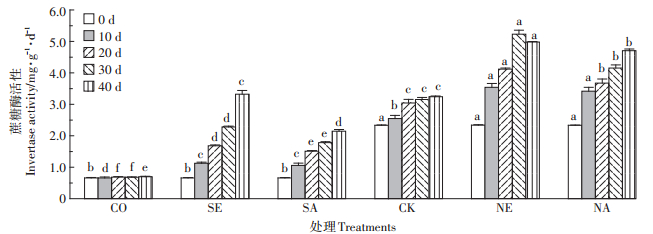
2 结果与分析 2.1 蚯蚓对四环素污染土壤蔗糖酶活性的影响图 1显示,自然染毒土壤(CK)的蔗糖酶活性较高,随着培养时间的延长,其活性缓慢上升。对土壤进行灭菌后,土壤蔗糖酶活性显著下降,并且在培养期间无明显变化。与CO处理相比,SE和SA处理蔗糖酶活性呈显著上升趋势。与CK处理相比,NE处理中蔗糖酶活性呈“促进-抑制”的趋势,在培养30 d时达到最大值5.23 mg·g-1·d-1,随后下降。NA处理中,蔗糖酶活性被显著激活,但其激活作用小于NE处理。试验结束后,灭菌土壤处理组,添加蚯蚓处理SA和SE中蔗糖酶活性分别为2.15、3.32 mg·g-1·d-1,显著高于对照CO(0.70 mg·g-1·d-1)。自然土壤处理组中,添加蚯蚓处理NE和NA中蔗糖酶活性分别为4.98、4.71 mg·g-1·d-1,显著高于对照CK(3.24 mg·g-1·d-1)。两种生态型蚯蚓均可显著提高四环素污染土壤蔗糖酶活性,有利于有机质的转化和土壤碳循环的进行,其中赤子爱胜蚓的促进作用优于壮伟环毛蚓。
|
图中不同小写字母表示处理间差异显著(P<0.05)。下同 The different lowercase letters indicate significant differences among treatments(P<0.05).The same below 图 1 两种生态蚯蚓对四环素污染土壤蔗糖酶活性的影响 Figure 1 Effects of two ecological earthworms on invertase activity in tetracycline contaminated soil |
图 2表明,CO处理中的脲酶活性显著低于CK处理,并且在培养周期内变化幅度较小。CK处理中脲酶活性略有增长,40 d时酶活性仅较0 d时提高了22.2%。与CO相比,在培养周期内,SA处理使脲酶活性提高了20.0%~269.6%,并且在培养30 d之后,其酶活性恢复并超过自然染毒土壤(CK)的水平。SE处理使酶活性提高了5.0%~139.1%。与CK处理相比,在培养周期内,NA处理脲酶激活率为31.5%~157.6%,NE处理的激活率为24.1%~83.3%。试验结束后,灭菌土壤处理组,添加蚯蚓处理SA和SE中脲酶活性分别为0.85、0.55 mg ·g-1·d-1,显著高于对照CO(0.23 mg·g-1·d-1)。自然土壤处理组中,添加蚯蚓处理NE和NA中脲酶活性分别为1.21、1.70 mg·g-1·d-1,显著高于对照CK(0.66 mg·g-1·d-1)。由此可见,两种生态型蚯蚓的添加可使脲酶活性提高,进一步促进四环素污染土壤中尿素的转化,提高氮素的利用率。其中,壮伟环毛蚓对脲酶的促进作用强于赤子爱胜蚓,说明内层种蚯蚓在四环素污染下更有利于促进土壤氮的循环。

|
图 2 两种生态蚯蚓对四环素污染土壤脲酶活性的影响 Figure 2 Effects of two ecological earthworms on urease activity in tetracycline contaminated soil |
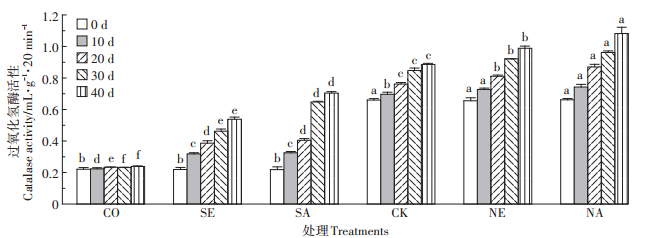
培养周期内,CO处理中土壤过氧化氢酶活性变化不大,CK处理40 d的过氧化氢酶活性较培养0 d(0.66 mL·g-1·20 min-1)时提高了34.8%,增长缓慢。与CO处理相比,培养周期内,SE处理使过氧化氢酶活性提高了45.5%~125.0%,SA处理提高了50%~ 191.7%。在自然土壤处理组中,培养20 d内NE和NA处理酶活性差异不显著,随后NA中的酶活性显著高于NE(P < 0.05)。试验结束后,灭菌土壤处理组,添加蚯蚓处理SA和SE中过氧化氢酶活性分别为0.70、0.54 mL·g-1·20 min-1,显著高于对照CO(0.24 mL·g-1·20 min-1)。自然土壤处理组中,添加蚯蚓处理NE和NA中过氧化氢酶活性分别为0.99、1.08 mL· g-1·20 min-1,显著高于对照CK(0.89 mL·g-1·20 min-1)(图 3)。由此可得,蚯蚓单独作用或与四环素污染土壤中的土著微生物共同作用均可促进过氧化氢酶活性。这是由于蚯蚓促进了自然处理组和灭菌处理组土壤中微生物的活性,催化了四环素污染土壤中过氧化氢的生物转化。其中壮伟环毛蚓的促进作用强于赤子爱胜蚓。
|
图 3 两种生态蚯蚓对四环素污染土壤过氧化氢酶活性的影响 Figure 3 Effects of two ecological earthworms on catalase activity in tetracycline contaminated soil |
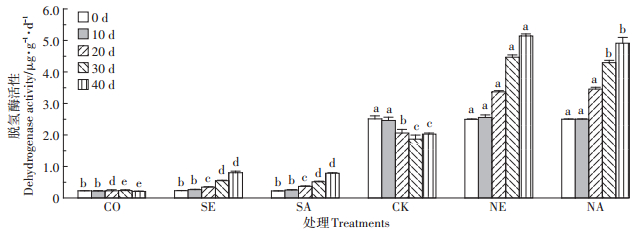
从图 4中可以看出,在四环素污染下,CO处理中脱氢酶活性较低,且在培养周期内变化幅度较小。CK处理酶活性呈先下降后上升的趋势,在培养第30 d,脱氢酶活性由培养0 d时的2.51 µg·g-1·d-1降至1.87 µg·g-1·d-1,酶活性最低,在40 d时酶活性回升。与CO处理相比,在培养周期内,SE处理使脱氢酶活性提高了18.2%~281.0%,SA处理提高了13.6%~ 271.4%。与CK处理相比,在培养10 d和20 d时,NE和NA处理对脱氢酶活性的影响差异不显著(P> 0.05)。在培养后期,NE处理脱氢酶活性显著高于NA。试验结束后,灭菌土壤处理组,添加蚯蚓处理SA和SE中脱氢酶活性分别为0.78、0.80 µg·g-1·d-1,显著高于对照CO(0.21 µg·g-1·d-1)。自然土壤处理组中,添加蚯蚓处理NE和NA中脱氢酶活性分别为5.14、4.91 µg·g-1·d-1,显著高于对照CK(2.03 µg·g-1· d-1)。两种生态型蚯蚓的加入均可促进土壤中四环素的脱氢转化,解除四环素对脱氢酶的抑制作用,使得酶活性呈显著上升趋势。
|
图 4 两种生态蚯蚓对四环素污染土壤脱氢酶活性的影响 Figure 4 Effects of two ecological earthworms on dehydrogenase activity in tetracycline contaminated soil |
从图 5中可以看出,CO处理中酸性磷酸酶活性显著低于CK,且在培养周期内变化幅度较小。CK处理中酶活性呈先促进后抑制的作用,在培养20 d时,酶活性达最大值,为0.23 mg·g-1·d-1,随后逐渐降低。与CK处理相比,NE处理分别使酸性磷酸酶活性降低了10.5%~21.7%,NA处理降低了11.8%~26.1%。与CO处理相比,培养周期内,SE和SA处理均使酸性磷酸酶活性降低了25%~50%。试验结束后,灭菌土壤处理组,添加蚯蚓处理SA和SE中酸性磷酸酶活性均为0.02 mg·g-1·d-1,显著低于对照CO(0.04 µg·g-1· d-1)。自然土壤处理组中,添加蚯蚓处理NE和NA中酸性磷酸酶活性均为0.15 mg·g-1·d-1,显著低于对照CK(0.17 mg·g-1·d-1)。两种生态型蚯蚓均显著抑制了土壤酸性磷酸酶活性,这可能是蚯蚓生命活动产生的分泌物与微生物协同作用导致的。
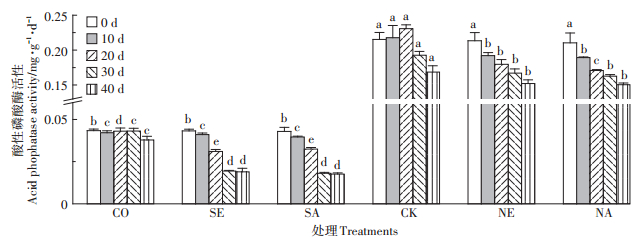
|
图 5 两种生态蚯蚓对四环素污染土壤酸性磷酸酶活性的影响 Figure 5 Effects of two ecological earthworms on acid phosphatase activity in tetracycline contaminated soil |
在门水平上,把相对丰度前30的细菌门选为优势细菌门,剩余的归为其他(Others)。从图 6中可以看出,不添加蚯蚓的处理CK以变形菌门(Proteobacte⁃ ria)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloro⁃ flexi)、放线菌门(Actinobacteria)、酸杆菌门(Acido⁃ bacteria)、芽单胞菌门(Gemmatimonadetes)、GAL15、疣微菌门(Verrucomicrobia)和Rokubacteria为主,约占样品总丰度的97.68%。添加蚯蚓的处理SE、SA、NE和NA中以变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria)为主要的细菌门类,约占细菌总群落的83.56%~98.43%。与CK处理相比,NE和NA处理使变形菌门(Proteobacte⁃ ria)、拟杆菌门(Bacteroidetes)和厚壁菌门(Fir⁃ micutes)的丰度提高了121.0%~175.8%、1 216.9%~ 1 283.2%、133.9%~164.1%,使绿弯菌门(Chloroflexi)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、芽单胞菌门(Gemmatimonadetes)和GAL15等细菌的丰度降低了80.8%~96.6%、35.7%~60.5%、73.1%~ 96.0%、80.9%~94.5%、80.7%~99.6%。同时,两种生态型蚯蚓的添加,引入了CK处理组中没有的细菌门类:梭杆菌门(Fusobacteria)和软壁菌门(Tenericutes)。由此可得,蚯蚓的加入改变了四环素污染土壤原有的细菌群落结构。
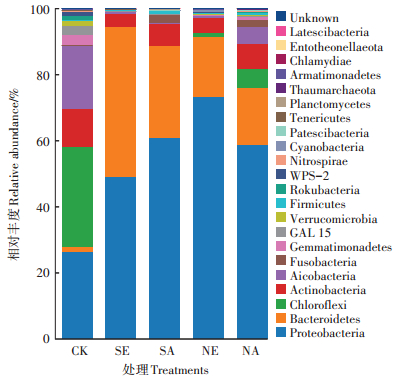
|
图 6 不同处理在门水平(丰度>1%)的细菌群落结构 Figure 6 Bacterial community structure at phylum level with different treatments |
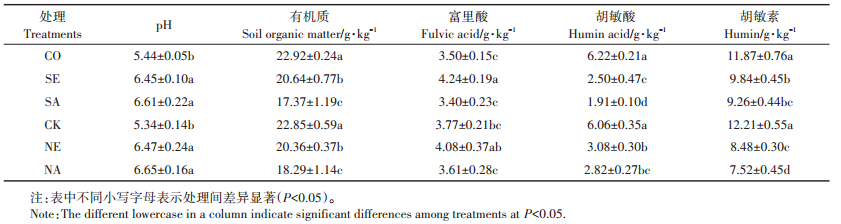
试验结束时,相关的土壤理化指标见表 1,与CO、CK处理相比,SE、SA、NE、NA处理使土壤pH值增加了1.10~1.33个单位,有机质、胡敏酸和胡敏素质量分数分别降低了9.9%~24.2%、49.2%~69.3%、17.1%~ 38.4%。蚯蚓的添加使样品中的pH显著提高,有机质、胡敏酸和胡敏素质量分数显著下降(P < 0.05)。与CO处理相比,SE处理使富里酸质量分数增加了21.1%,SA处理降低了2.9%。与CK处理相比,NE处理富里酸质量分数增加了8.2%,NA处理中富里酸质量分数降低了4.2%,但NE、NA处理与CK处理之间差异不显著(P>0.05)。
|
|
表 1 不同处理对土壤中pH、有机质和腐殖质各组分的影响 Table 1 Effects of different treatments on pH, carbon organic matter and humus components in soil |
运用Canoco 5.0软件对各处理培养40 d时的土壤酶活性和腐殖质、pH、有机质之间的相关性进行分析,得到土壤酶活性与环境因子的二维降序图(图 7)。可见,第一轴能够解释所有信息的65.18%,第二轴能解释7.56%,累计解释信息量为72.74%。由此可知,土壤酶活性与土壤因子的关系主要是由第一轴决定的。由图 7可看出,pH、胡敏酸、有机质和胡敏素的箭头连线最长,可知pH、胡敏酸、有机质与胡敏素对土壤酶活性差异性起到较好的解释。脲酶、蔗糖酶、过氧化氢酶、脱氢酶与pH、富里酸间夹角较小且方向一致,均呈正相关关系,与胡敏素、胡敏酸、有机质呈负相关关系。酸性磷酸酶与pH、胡敏素呈负相关关系,与富里酸、有机质、胡敏酸呈正相关关系。
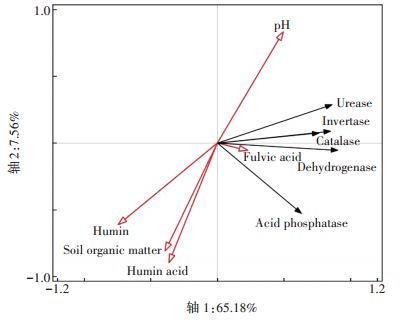
|
图 7 土壤酶活性与环境因子的冗余分析(RDA) Figure 7 RDA (redundancy analysis)for environmental factors associated with ecology characteristics of soil enzymatic activities |
土壤酶参与土壤中诸多复杂生物化学过程,是指示土壤自净能力和土壤肥力的关键生物学指标。土壤蔗糖酶是一种能将蔗糖水解为葡萄糖和果糖,增加土壤中易溶性营养物质,为微生物提供能源的水解酶[25]。土壤脲酶是唯一对尿素的转化具有重要影响的酶,能够破坏C-N键,催化尿素分解生成氨、二氧化碳和水,为植物提供氮素营养[20]。过氧化氢酶是将过氧化氢分解成水和氧气,降低过氧化氢危害的胞外酶[26]。脱氢酶是一种能催化电子传输系统中有机物质脱氢,使土壤中有机污染物降解的胞内酶[27]。酸性磷酸酶是一类参与土壤磷循环,促进土壤有机磷化合物分解的胞内酶,其活性高低直接影响着土壤中生物有效性磷的质量分数[28]。土壤微生物是控制土壤酶分解转化的主体,对土壤酶的种类和活性起着决定作用[29]。蚯蚓的加入促进了四环素污染土壤中变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)丰度的增加。这三类细菌均被证实为四环素、磺胺类抗生素污染土壤中的主要菌群,具有耐药性和降解抗生素的能力[30-32]。此外Parke等[33]指出变形菌门(Proteobacteria)中的细菌具有异常巨大的基因组,这使得该细菌门具有将大多数化合物作为唯一碳源的能力。厚壁菌门(Firmicutes)被指出与10 mg·kg-1磺胺噻唑污染土壤具有较高酶活性有关[34]。此外,本研究中,蚯蚓处理降低了四环素污染土壤中绿弯菌门(Chloroflexi)、放线菌门(Actinobacte⁃ ria)、酸杆菌门(Acidobacteria)和芽单胞菌门(Gemma⁃ timonadetes)等细菌门类的丰度。据报道,这些细菌群落均具有耐药性,能在抗生素污染的环境中生存[35-36],这导致它们在四环素污染土壤中具有较高的丰度。蚯蚓对这些细菌生长的抑制,减少了土壤细菌菌群之间的竞争,给了其他优势菌生长繁殖的机会。由此可得,蚯蚓的加入改变了四环素污染土壤中的微生物群落结构,促进了土壤中四环素降解菌群丰度的提高,进一步加速了微生物对四环素的消耗,催化了四环素的脱氢和生化转化,降低了土壤中四环素对微生物的毒害,从而使得蚯蚓处理组中,蔗糖酶、脲酶、过氧化氢酶和脱氢酶活性的提高。同时有研究表明,磷酸酶活性与放线菌数量密切相关[37]。因此,蚯蚓对四环素污染土壤部分微生物群落丰度的降低导致了酸性磷酸酶活性下降。
3.2 蚯蚓处理过程中环境因子与酶活性的相关性冗余分析结果表明,蔗糖酶、脲酶、过氧化氢酶和脱氢酶活性与pH、富里酸均呈正相关关系,而与胡敏素、有机质、胡敏酸呈负相关关系。酸性磷酸酶与pH、胡敏素呈负相关关系,与富里酸、有机质、胡敏酸呈正相关关系。本试验所用土壤有机质含量较低,且无外源添加,在资源有限的环境中,蚯蚓的加入改变了微生物的群落结构,使四环素的降解菌群和耐受菌群丰度增加,提高了对土壤中碳源和氮源的利用率,使得胡敏素和胡敏酸被分解,胡敏酸的一级分解产物——富里酸质量分数增加[38]。由于有机质的矿化分解,有机组分含量降低,被吸附固定的四环素减少,游离的四环素增多[39]。蚯蚓的加入促进了土壤中降解菌群的增加,促进了四环素污染土壤中微生物代谢,使土壤过氧化氢酶和脱氢酶活性增强。土壤pH是影响微生物活性的重要因子,蚯蚓频繁的取食、挖掘活动生成大量含碳酸钙或含氮类的碱性排泄物,可以显著提高四环素污染土壤的pH值[40-41]。由于土壤中H+会抑制土壤微生物活性,OH-可以促进土壤微生物的活性[42],因而蚯蚓的加入,有利于四环素污染土壤中蔗糖酶、脲酶、过氧化氢酶和脱氢酶活性增加。与上述4种酶不同,本研究中四环素对酸性磷酸酶活性起抑制作用,蚯蚓的加入使得这种抑制作用增强。研究表明,酸性磷酸酶活性的最适pH值为5.5,高于该pH值时,酶的构象发生改变,致使酶活性降低[43]。蚯蚓的加入使四环素污染土壤pH值显著升高,并趋向于中性。此外,有研究报道,酸性磷酸酶活性与有机磷质量分数呈正相关关系[44]。本试验中,土壤中有机质、胡敏素、胡敏酸质量分数的减少,使有机磷质量分数降低,磷酸酶作用的底物减少,从而酶活性降低。
3.3 不同生态型蚯蚓对土壤酶活性的差异性本研究还发现不同生态型蚯蚓对四环素污染土壤蔗糖酶、脲酶和过氧化氢酶活性的作用效果存在差异性,但对脱氢酶和酸性磷酸酶的作用在蚯蚓品种之间不显著。赤子爱胜蚓对蔗糖酶的促进作用较为明显,而壮伟环毛蚓对脲酶和过氧化氢酶活性作用较显著。由于赤子爱胜蚓生活在地表 0~5 cm间,属于表栖型蚯蚓,主要以地表的枯枝落叶和腐殖质为食,从而更能刺激与土壤碳循环紧密联系的蔗糖酶的活性,加速有机质的矿化分解[45]。壮伟环毛蚓为内栖型蚯蚓,内层种的蚯蚓有蚓道,其强烈的取食、肠道消化和生物打扰更有利于土壤团聚体的形成和土壤透气性的增加,导致好氧微生物数量增多[46]。马建辉等[47]研究表明脲酶活性与土壤团聚体结构呈显著或极显著的正相关关系。王笑[48]研究表明内栖型蚯蚓具有扩大微生物生物量氮与促进有机氮矿化的双重功能,且内栖型蚯蚓更有利于团聚体结构的形成。Margesin等[49]发现过氧化氢酶活性与土壤呼吸作用、好氧微生物的活动、数量有着密切的联系。因此培养周期内,加入壮尾环毛蚓的处理中脲酶和过氧化氢酶活性高于加入赤子爱胜蚓的处理。
4 结论(1)两种生态型蚯蚓通过提高土壤pH值、加速有机质和腐殖质(胡敏酸和胡敏素)矿化分解,改变四环素污染土壤中的细菌群落结构,进而提升土壤蔗糖酶、脲酶、过氧化氢酶和脱氢酶活性,抑制土壤酸性磷酸酶活性。
(2)两种生态型蚯蚓均可显著改变四环素污染土壤中原有的细菌群落结构,提高土壤中具有抗生素耐药性和降解抗生素能力的变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)微生物群落丰度,降低绿弯菌门(Chloroflexi)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)和芽单胞菌门(Gemmatimonadetes)的微生物群落丰度。
(3)两种生态型蚯蚓对四环素污染土壤酶活性存在差异,其中赤子爱胜蚓对土壤蔗糖酶促进作用显著优于壮伟环毛蚓,而壮伟环毛蚓对脲酶和过氧化氢酶的促进作用优于赤子爱胜蚓。
| [1] |
Pérez-Rodríguez M, Pellerano R G, Pezza L, et al. An overview of the main foodstuff sample preparation technologies for tetracycline residue determination[J]. Talanta, 2018, 182: 1-21. |
| [2] |
迟荪琳, 王卫中, 徐卫红, 等. 四环素类抗生素对不同蔬菜生长的影响及其富集转运特征[J]. 环境科学, 2018, 39(2): 935-943. CHI Sun-lin, WANG Wei-zhong, XU Wei-hong, et al. Effects of tetracycline antibiotics on growth and characteristics of enrichment and transformation in two vegetables[J]. Environmental Science, 2018, 39(2): 935-943. |
| [3] |
Ngigi A N, Ok Y S, Thiele-Bruhn S. Biochar-mediated sorption of antibiotics in pig manure[J]. Journal of Hazardous Materials, 2019, 364: 663-670. |
| [4] |
Wei R, He T, Zhang S, et al. Occurrence of seventeen veterinary antibiotics and resistant bacterias in manure-fertilized vegetable farm soil in four provinces of China[J]. Chemosphere, 2019, 215: 234-240. |
| [5] |
Forey E, Chauvat M, Coulibaly S F M, et al. Inoculation of an ecosystem engineer(Earthworm:Lumbricus terrestris) during experimental grassland restoration:Consequences for above and belowground soil compartments[J]. Applied Soil Ecology, 2018, 125: 148-155. |
| [6] |
Frazão J, De Goede R G M, Capowiez Y, et al. Soil structure formation and organic matter distribution as affected by earthworm species interactions and crop residue placement[J]. Geoderma, 2019, 338: 453-463. |
| [7] |
Singh S, Singh J, Vig A P. Earthworm as ecological engineers to change the physico-chemical properties of soil:Soil vs vermicast[J]. Ecological Engineering, 2016, 90: 1-5. |
| [8] |
徐晓燕, 何应森, 龙孝燕, 等. 接种蚯蚓对土壤过氧化氢酶和转化酶活性的影响[J]. 广东农业科学, 2011, 38(12): 75-77. XU Xiao-yan, HE Ying-sen, LONG Xiao-yan, et al. Effects of earthworm inoculation on soil catalase and invertase activities[J]. Guangdong Agricultural Sciences, 2011, 38(12): 75-77. |
| [9] |
Shi Y J, Zhang Q B, Huang D Q, et al. Survival, growth, detoxifying and antioxidative responses of earthworms(Eisenia fetida)exposed to soils with industrial DDT contamination[J]. Pesticide Biochemistry and Physiology, 2016, 128: 22-29. |
| [10] |
Lin Z, Zhen Z, Wu Z H, et al. The impact on the soil microbial community and enzyme activity of two earthworm species during the bioremediation of pentachlorophenol-contaminated soils[J]. Journal of Hazardous Materials, 2016, 301: 35-45. |
| [11] |
Lin Z, Zhen Z, Ren L, et al. Effects of two ecological earthworm species on atrazine degradation performance and bacterial community structure in red soil[J]. Chemosphere, 2018, 196: 467-475. |
| [12] |
徐永刚, 宇万太, 马强, 等. 环境中抗生素及其生态毒性效应研究进展[J]. 生态毒理学报, 2015, 10(3): 11-27. XU Yong-gang, YU Wan-tai, MA Qiang, et al. Advances in studies on environmental antibiotics and their ecotoxic effects[J]. Asian Journal of Ecotoxicology, 2015, 10(3): 11-27. |
| [13] |
Ding J, Zhu D, Hong B, et al. Long-term application of organic fertilization causes the accumulation of antibiotic resistome in earthworm gut microbiota[J]. Environment International, 2019, 124: 145-152. |
| [14] |
Huang K, Xia H, Wu Y, et al. Effects of earthworms on the fate of tetracycline and fluoroquinolone resistance genes of sewage sludge during vermicomposting[J]. Bioresource Technology, 2018, 259: 32-39. |
| [15] |
Wang C, Rong H, Liu H, et al. Detoxification mechanisms, defense responses, and toxicity threshold in the earthworm Eisenia foetida exposed to ciprofloxacin-polluted soils[J]. Science of the Total Environment, 2018, 612: 442-449. |
| [16] |
Feng C, Ma Y, Jin X, et al. Soil enzyme activities increase following restoration of degraded subtropical forests[J]. Geoderma, 2019, 351: 180-187. |
| [17] |
Wang Z, Tian H, Tan X, et al. Long-term As contamination alters soil enzyme functional stability in response to additional heat disturbance[J]. Chemosphere, 2019, 229: 471-480. |
| [18] |
Adetunji A T, Lewu F B, Mulidzi R, et al. The biological activities of β-glucosidase, phosphatase and urease as soil quality indicators:A review[J]. Journal of Soil Science and Plant Nutrition, 2017, 17(3): 794-807. |
| [19] |
Du Z K, Zhu Y Y, Zhu L S, et al. Effects of the herbicide mesotrione on soil enzyme activity and microbial communities[J]. Ecotoxicology and Environmental Safety, 2018, 164: 571-578. |
| [20] |
Teng Y, Zhou Q X. Response of soil enzymes, functional bacterial groups, and microbial communities exposed to sudan Ⅰ-Ⅳ[J]. Ecotoxicology and Environmental Safety, 2018, 166: 328-335. |
| [21] |
王瑞琨. 用电位法测定土壤pH值[J]. 山西化工, 2018, 38(3): 64-65, 76. WANG Rui-kun. Determination of soil pH by potentiometry[J]. Shanxi Ghemical Industry, 2018, 38(3): 64-65, 76. |
| [22] |
李国栋, 解成岩, 赵永哲. 土样制备对土壤有机质测定的影响[J]. 黑龙江环境通报, 2018, 42(3): 16-18. LI Guo-dong, XIE Cheng-yan, ZHAO Yong-zhe. Influence of soil sample preparation on soil organic matter determination[J]. Heilongjiang Environmental Journal, 2018, 42(3): 16-18. |
| [23] |
中国标准出版社第二编辑室.环境监测方法标准汇编: 土壤环境与固体废物[M].北京: 中国标准出版, 2007: 430-437. China Standard Publishing House Second Editor's Office. Compilation of standards for environmental monitoring methods: Soil environment and solid waste[M]. Beijing: China Standards Press, 2007: 430-437. |
| [24] |
关松荫. 土壤酶及其研究方法[M]. 北京: 农业出版社, 1986: 260-340. GUAN Song-yin. Soil enzyme and its research methods[M]. Beijing: Agriculture Press, 1986: 260-340. |
| [25] |
Madakka M, Jayaraju N, Rangaswamy V. Changes in the metabolic activities of two agricultural soils as influenced by the pesticides and insecticides combination[J]. Applied Soil Ecology, 2017, 120: 169-178. |
| [26] |
Kaushal J, Mehandia S, Singh G, et al. Catalase enzyme:Application in bioremediation and food industry[J]. Biocatalysis and Agricultural Biotechnology, 2018, 16: 192-199. |
| [27] |
张晨, 张丽红, 李亚宁, 等. 典型磺胺类抗生素对土壤脱氢酶和过氧化氢酶活性的影响[J]. 安全与环境学报, 2018, 18(6): 2379-2382. ZHANG Chen, ZHANG Li-hong, LI Ya-ning, et al. Impact of the typical sulfonamides on the enzyme activities of the soil[J]. Journal of Safety and Environment, 2018, 18(6): 2379-2382. |
| [28] |
Liu G M, Zhang X C, Wang X P, et al. Soil enzymes as indicators of saline soil fertility under various soil amendments[J]. Agriculture, Ecosystems & Environment, 2017, 237: 274-279. |
| [29] |
Burns R G, Deforest J L, Marxsen J, et al. Soil enzymes in a changing environment:Current knowledge and future directions[J]. Soil Biology and Biochemistry, 2013, 58: 216-234. |
| [30] |
Vaz-Moreira I, Nunes O C, Manaia C M. Bacterial diversity and antibiotic resistance in water habitats:Searching the links with the human microbiome[J]. FEMS Microbiology Reviews, 2014, 38: 761-778. |
| [31] |
Islas-Espinoza M, Reid B J, Wexler M, et al. Soil bacterial consortia and previous exposure enhance the biodegradation of sulfonamides from pig manure[J]. Microbial Ecology, 2012, 64: 140-151. |
| [32] |
Novo A, André S, Viana P, et al. Antibiotic resistance, antimicrobial residues and bacterial community composition in urban wastewater[J]. Water Research, 2013, 47: 1875-1887. |
| [33] |
Parke J L, Gurian-Sherman D. Diversity of the Burkholderia cepacia complex and implications for risk assessment of biological control strains[J]. Annual Review of Phytopathology, 2001, 39: 225-258. |
| [34] |
Caban J R, Samy S K, Kim J H, et al. Green manure amendment enhances microbial activity and diversity in antibiotic-contaminated soil[J]. Applied Soil Ecology, 2018, 129: 72-76. |
| [35] |
Song T W, Li S S, Jin J F, et al. Enhanced hydrolyzed polyacrylamide removal from water by an aerobicbiofilm reactor-ozone reactor-aerobic biofilm reactor hybrid treatment system:Performance, key enzymes and functional microorganisms[J]. Bioresource Technology, 2019, 291: 121811. |
| [36] |
Duan M L, Guan J, Wang X J, et al. Factors that affect the occurrence and distribution of antibiotic resistance genes in soils from livestock and poultry farms[J]. Ecotoxicology and Environmental Safety, 2019, 180: 114-122. |
| [37] |
Chen J, Gao H, Wang P F, et al. Effects of decabromodiphenyl ether on activity, abundance, and community composition of phosphorus mineralizing bacteria in eutrophic lake sediments[J]. Science of the Total Environment, 2019, 695: 133785. |
| [38] |
俄胜哲, 时小娟, 车宗贤, 等. 有机物料对灌漠土结合态腐殖质及其组分的影响[J]. 土壤学报, 2019(6): 1-13. E Sheng-zhe, SHI Xiao-juan, CHE Zong-xian, et al. Effects of organic materials on binding humus and its components in desert irrigation[J]. Acta Pedologica Sinica, 2019(6): 1-13. |
| [39] |
Chen K L, Liu L C, Chen W R. Adsorption of sulfamethoxazole and sulfapyridine antibiotics in high organic content soils[J]. Environmental Pollution, 2017, 231: 1163-1171. |
| [40] |
鲁艳红, 廖育林, 聂军, 等. 我国南方红壤酸化问题及改良修复技术研究进展[J]. 湖南农业科学, 2015(3): 148-151. LU Yan-hong, LIAO Yu-lin, NIE Jun, et al. Status of red soil acidification and its amelioration technologies in south China[J]. Hunan Agricultural Sciences, 2015(3): 148-151. |
| [41] |
张池, 陈旭飞, 周波, 等. 华南地区壮伟环毛蚓(Amynthas robustus)和皮质远盲蚓(Amynthas corticis)对土壤酶活性和微生物学特征的影响[J]. 中国农业科学, 2012, 45(13): 2658-2667. ZHANG Chi, CHEN Xu-fei, ZHOU Bo, et al. Effects of earthworms collected from south China on soil enzyme activities and microbial characteristics[J]. Scientia Agricultura Sinica, 2012, 45(13): 2658-2667. |
| [42] |
Bezdicek D F, Beaver T, Granatstein D. Subsoil ridge tillage and lime effects on soil microbial activity, soil pH, erosion, and wheat and pea yield in the Pacific Northwest, USA[J]. Soil and Tillage Research, 2003, 74(1): 55-63. |
| [43] |
徐冬梅, 刘广深, 许中坚, 等. 模拟酸雨对土壤酸性磷酸酶活性的影响及机理[J]. 中国环境科学, 2003, 23(2): 65-68. XU Dong-mei, LIU Guang-shen, XU Zhong-jian, et al. Effects and mechanism of simulated acid rain on the activities of soil acid phosphatase[J]. Scientia Agricultura Sinica, 2003, 23(2): 65-68. |
| [44] |
耿玉清, 白翠霞, 赵广亮, 等. 土壤磷酸酶活性及其与有机磷组分的相关性[J]. 北京林业大学学报, 2008, 30(增刊2): 139-143. GENG Yu-qing, BAI Cui-xia, ZHAO Guang-liang, et al. Soil phosphatase activity and its correlation with organophosphorus components[J]. Journal of Beijing Forestry University, 2008, 30(Suppl 2): 139-143. |
| [45] |
Hoeffner K, Santonja M, Cluzeau D, et al. Epi-anecic rather than strict-anecic earthworms enhance soil enzymatic activities[J]. Soil Biology and Biochemistry, 2019, 132: 93-100. |
| [46] |
张池, 周波, 吴家龙, 等. 蚯蚓在我国南方土壤修复中的应用[J]. 生物多样性, 2018, 26(10): 1091-1102. ZHANG Chi, ZHOU Bo, WU Jia-long, et al. Application of earthworms on soil remediation in southern China[J]. Biodiversity Science, 2018, 26(10): 1091-1102. |
| [47] |
马建辉, 叶旭红, 韩昌东, 等. 膜下滴灌不同灌水控制下限对设施土壤团聚体养分、酶活性和球囊霉素含量的影响[J]. 应用生态学报, 2018, 29(8): 2713-2720. MA Jian-hui, YE Xu-hong, HAN Chang-dong, et al. Effects of different low limits of irrigation on nutrients, enzyme activity and glomalinrelated soil protein in soil aggregates of drip irrigation under plastic film[J]. Chinese Journal of Applied Ecology, 2018, 29(8): 2713-2720. |
| [48] |
王笑.不同生态型蚯蚓对土壤群落结构和功能的影响[D].南京: 南京农业大学, 2016. WANG Xiao. Effects of different ecological earthworms on soil community structure and function[D]. Nanjing: Nanjing Agricultural University, 2016. |
| [49] |
Margesin R, Walder G, Schinner F. The impact of hydrocarbon remediation(diesel oil and polycyclic aromatic hydrocarbons)on enzyme activities and microbial properties of soil[J]. Acta Biotechnol, 2000, 20: 313-333. |
 2020, Vol. 39
2020, Vol. 39