2. 哈尔滨工业大学环境学院, 哈尔滨 150090
2. School of Environment, Harbin Institute of Technology, Harbin 150090, China
随着工农业的迅猛发展,大量有毒有害的难降解污染物进入环境中。作为一类典型的难降解有机污染物,多环芳烃(Polycyclic aromatic hydrocarbons,PAHs)的降解引起了研究者的广泛关注[1-3]。PAHs广泛存在于各种生境中[4-5]。PAHs自身的高亲脂性、高毒性、持久性、生物积累性,是使其成为威胁生态系统安全稳定和人类健康的重要因素。因此,如何将PAHs从环境中去除已成为研究的热点问题之一。
在自然条件下,PAHs很难被降解,而且降解的难易程度与分子量大小呈正相关[6]。生物方法是当前主要的PAHs污染修复技术之一。白腐真菌是一类可以引起木质白色腐烂的丝状真菌,其除了能降解木质素外,一些白腐真菌对复杂有机物也有很强的降解能力[7-8]。近年来,白腐真菌被广泛用于去除环境中的PAHs。例如,Chen等[9]的研究发现,白腐真菌(CW-1)对菲和芘的去除率分别为70%~80%和90%。Hadibarata等[10]的研究表明,经过30 d的连续培养后,大约63%的芘被白腐真菌(Armillaria sp. F022)转化。白腐真菌(Pseudotrametes gibbosa)以芘作为唯一碳源在18 d内将28.3%芘去除,且加入其他底物后可显著提高芘的去除率[11]。白腐真菌降解PAHs主要是通过木质素降解酶系转化途径[12]。该酶系统中的主要功能酶包括漆酶、锰过氧化物酶(MnP)、木质素过氧化物酶(Lip)。其中,漆酶是一种含铜多酚氧化酶,它的催化过程不需要H2O2的参与,可在碳、氮存在下由菌体分泌,且具有较高的氧化还原电位(780 mV)和很宽的底物范围[13-14]。研究表明,从Trametes versicolor中分离的漆酶具有对多种PAHs降解的能力,且加入1-羟基苯并三唑后,PAHs的降解率接近100%[15]。Cho等[16]的研究也表明,在氧化还原介体存在的条件下,白腐真菌(Coriolus hirsutus)分泌的漆酶可以催化氧化5种PAHs。
尽管白腐真菌降解PAHs的研究已有报道,但有关生物吸附和生物降解在白腐真菌去除PAHs过程中所起的作用及强化PAHs降解的研究相对较少。因此,本研究在解析白腐真菌(黄孢原毛平革菌,Phanerochaete chrysosporium)对萘、菲、芘的吸附、降解特性基础上,研究了Tween 80和Cu2+对白腐真菌降解PAHs的影响及相应的漆酶活性,阐明了Tween 80和Cu2+强化白腐真菌降解PAHs的酶学机制,为进一步提高白腐真菌降解PAHs的效率,促进其工业化应用奠定了理论基础。
1 材料与方法 1.1 菌株和培养基实验选用的白腐真菌购自中国科学院微生物研究所菌种保藏中心,黄孢原毛平革菌(P.chrysosporium)纯菌(编号BNCC 145491)分离自腐烂的木片。
PDA培养基:将去皮马铃薯200 g,切块、放入蒸馏水中煮沸30 min,用双层纱布过滤,再加入10 g C6H12O6、3 g KH2PO4、1.5 g MgSO4、10 mg维生素B1、20 g琼脂,定容至1 L,121 ℃高压灭菌15 min,冷却、备用。PDB培养基:与PDA培养基相似,去掉琼脂即可。
1.2 白腐真菌菌球的制备将白腐真菌涂布于PDA培养基上,在35 ℃条件下恒温培养。待菌丝长满后,用少量无菌蒸馏水冲洗,得到孢子悬液,置于4 ℃冰箱中保存。取1 mL孢子悬液接种于150 mL PDB培养基中,35 ℃、120 r· min-1条件下振荡培养7 d,形成直径4 mm左右的白腐真菌自固定菌球,备用。
1.3 萘、菲、芘溶液的配制试验用废水为人工配制,萘、菲、芘浓度的设置参考以往的研究[9]。将300 mg萘、10 mg菲、1 mg芘溶于100 mL丙酮溶液中,作为混合母液保存于4 ℃冰箱,备用。
1.4 白腐真菌对萘、菲、芘的去除试验 1.4.1 挥发性试验取1.0 mL萘、菲、芘混合母液置于250 mL三角瓶中,隔夜待丙酮完全挥发以后,加入100 mL蒸馏水。设置21个平行样,置于35 ℃、120 r·min-1避光条件下恒温振荡培养,定期取3个样品测定培养液中萘、菲、芘的浓度。
挥发率=(A0-At)/A0×100%
式中:A0为萘、菲、芘的初始浓度,mg·L-1;At为t时刻培养液中残留萘、菲、芘的浓度,mg·L-1。
1.4.2 吸附、降解试验设置4组试验:(1)PDB+PAHs(空白对照);(2)灭活菌+蒸馏水+PAHs(检测灭活菌的吸附特征);(3)活菌+蒸馏水+PAHs(检测活菌的吸附特征);(4)活菌+ PDB+PAHs(检测活菌的降解特征)。取1.0 mL萘、菲、芘混合母液置于250 mL三角瓶中,隔夜待丙酮完全挥发以后,进行吸附和降解试验。加入100 mL蒸馏水或PDB培养基、0.2 g(干质量)有活性或灭活白腐真菌。每组试验设置21个平行样,置于35 ℃、120 r· min-1避光条件下恒温振荡培养,定期从每组试验中取3个样品测定培养液中萘、菲、芘的浓度及白腐真菌生物质中萘、菲、芘的含量。
将3个待测样品在4000 r·min-1条件下离心15 min,将上清置于分液漏斗中,加入10 mL二氯甲烷,进行萃取,重复3次。将3次萃取液合并,用旋转蒸发仪干燥后将其溶于5mL正己烷中,然后转移至装有2 g硅胶的玻璃柱净化,并用15 mL正己烷和二氯甲烷(1:1,V:V)混合液淋洗,洗脱液收集至圆底烧瓶,再次蒸干后,用4 mL乙腈溶解,过0.22 μm滤膜后用于测定溶液中残留PAHs。采用超声萃取法提取白腐真菌生物质中的残留PAHs。在白腐真菌生物质中加入10 mL丙酮和正己烷的混合物(1:1,V:V)超声萃取30 min,重复3次。其余步骤同上。
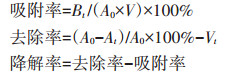
|
式中:Bt为t时刻白腐真菌生物质中萘、菲、芘的含量,mg;A0为萘、菲、芘的初始浓度,mg·L-1;At为t时刻培养液中残留萘、菲、芘的浓度,mg·L-1;V 为培养液体积,L;Vt为t时刻萘、菲、芘的累积挥发率,%。
1.4.3 Tween 80和Cu2+对萘、菲、芘去除的影响采用单因素试验(每个因素6个水平)考察Tween 80和Cu2+对萘、菲、芘去除的影响。取1.5 mL萘、菲、芘混合母液置于250 mL三角瓶中,隔夜待丙酮完全挥发以后,加入100 mL PDB培养基、0.2 g(干质量)白腐真菌以及不同浓度的表面活性剂或CuSO4。Tween 80的浓度为0(对照)、0.2、0.4、0.6、0.8、1.0 g · L-1。Cu2+的浓度为0(对照)、0.01、0.05、0.25、1.25、5.0 mmol·L-1。每组试验设置3个平行样,置于35 ℃、120 r·min-1避光条件下恒温振荡培养,10 d后测定培养液中萘、菲、芘的浓度及相应的漆酶活性。
1.5 白腐真菌对萘、菲、芘的吸附动力学分析白腐真菌对污染物的吸附过程通常符合伪一级动力学和伪二级动力学模型[7]。本研究中,白腐真菌对萘、菲、芘的吸附进程更适合伪一级动力学模型。因此,本研究用伪一级动力学方程拟合吸附动力学参数。将试验所得数据用统计软件Origin 9.0拟合出相关动力学参数。
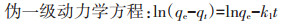
|
(1) |
式中:qe为平衡吸附量,mg·g-1;qt为t 时刻的吸附量, mg·g-1;k1为一级速率常数。
1.6 萘、菲、芘浓度及漆酶活性的测定 1.6.1 萘、菲、芘含量测定萘、菲、芘的定量检测采用反相高效液相色谱检测。洗脱程序:流动相包括水和乙腈,乙腈占流动相成分的80%,流速为1.0 mL·min-1,柱温为30 ℃,时间为20 min。
1.6.2 漆酶活性测定采用漆酶试剂盒(北京索莱宝科技有限公司)进行测定。漆酶通常为胞外酶,直接从培养液中取样测定;在30 ℃水浴中反应,测定420 nm处3 min内吸光度的差异。反应总体积为1 mL,包括150 μL适当稀释的待测酶液和850 μL工作液。漆酶活性定义为每升液体每分钟氧化1 μmol底物ABTS所需的酶量为一个酶活力单位。
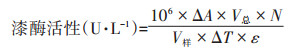
|
式中:ΔA为3 min内吸光度差异;V总为反应总体积,1 mL;N 为稀释倍数;ε 为ABTS摩尔消光系数,3.6×104 L·mol-1·cm-1;V 样为反应体系中酶液体积,0.15 mL;ΔT为反应时间,3 min。
1.7 生物量测定及数据统计分析生物量测定采用菌体干质量法[17]。试验结果的统计分析采用SPSS 22.0软件进行。
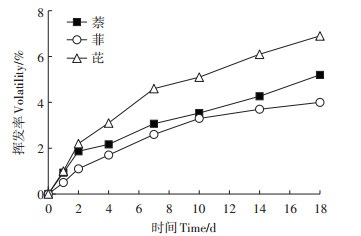
2 结果与讨论 2.1 白腐真菌对萘、菲、芘的吸附特性 2.1.1 萘、菲、芘的挥发性PAHs普遍具有挥发性。为了更加准确地分析白腐真菌对萘、菲、芘的吸附和降解特征,首先测定了这3种PAHs的挥发性,结果如图 1所示。在萘、菲、芘的初始浓度分别为30、1、0.1 mg·L-1和35 ℃条件下,3种PAHs的累积挥发率相应增加,18 d时的累积挥发率分别为5.2%、4.0%和7.0%。本研究中,白腐真菌对萘、菲、芘的吸附率和降解率均已排除其挥发率的影响。
|
图 1 萘、菲、芘的挥发特征 Figure 1 The volatility of naphthalene, phenanthrene and pyrene |
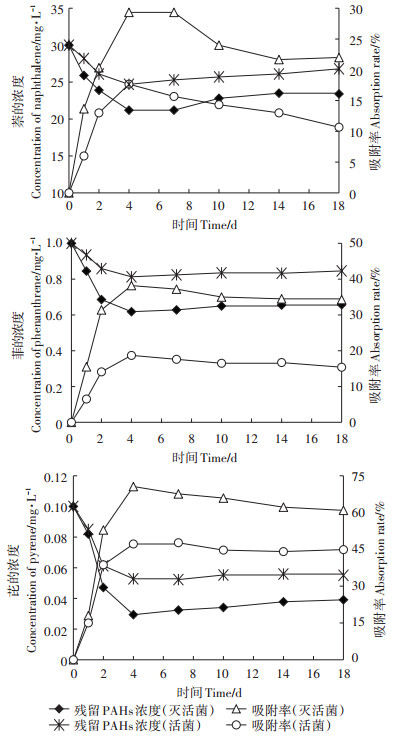
作为污染物生物修复的主要过程之一,生物吸附在PAHs的去除中起着重要作用[9]。如图 2所示,白腐真菌对3种PAHs的吸附能力表现出相同的变化趋势。当萘的初始浓度为30 mg·L-1时,灭活菌和活菌对萘的吸附率均在第4 d时达到最大值,分别为29.3 %和17.7%。以往的研究也表明,白腐真菌对萘的吸附率在20%左右[18]。白腐真菌对菲和芘的吸附也是在第4 d时达到最大值,其吸附率分别为18.7%和47.2%(活菌),以及38.2%和70.6%(灭活菌)。丁洁等[19]的研究表明,白腐真菌活菌在第3 d时对菲和芘的生物吸附率分别为19.7%和52.2%。而侯树宇等[20]的研究中,白腐真菌活菌对芘的最大吸附率仅为14.4 %。以往的研究表明,分配作用是白腐真菌对PAHs生物吸附的主要机制,且分配作用的大小与PAHs的分配系数呈正相关[21]。
|
图 2 白腐真菌对萘、菲、芘的吸附特性 Figure 2 The biosorption of white rot fungi on naphthalene, phenanthrene and pyrene |
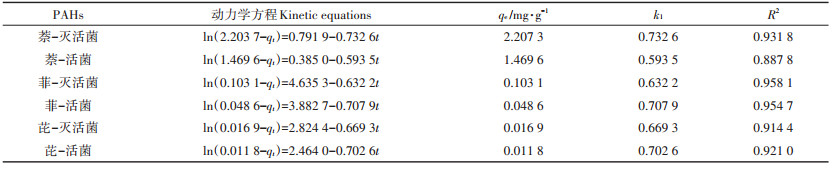
吸附动力学特征表明(表 1),白腐真菌灭活菌体和活菌对萘、菲、芘吸附的伪一级动力学拟合相关系数R2均在0.88以上,表明白腐真菌对这3种PAHs的吸附过程符合伪一级动力学模型。白腐真菌灭活菌体对萘、菲、芘的平衡吸附量分别为2.207 3、0.103 1 mg·g-1和0.016 9 mg·g-1,显著高于活菌的平衡吸附量。本研究发现,白腐真菌灭活菌体和活菌对3种PAHs的平衡吸附量依次为萘 > 菲 > 芘。相反,小麦根系对它们的亲和力由大到小依次为芘、菲、萘[22]。由此可见,不同的吸附材料对PAHs的吸附能力不同。
|
|
表 1 白腐真菌吸附PAHs的动力学参数 Table 1 Kinetic parameters of adsorption of PAHs by white rot fungi |
由图 2和表 1可知,当萘、菲、芘的初始浓度分别为30、1 mg·L-1和0.1 mg·L-1时,灭活的白腐真菌对萘、菲、芘的吸附性能高于活菌的吸附性能。以往的研究也表明,白腐真菌灭活菌对萘、菲、芘的吸附性高于活菌的吸附性[9, 21]。分析认为,一方面菌体在经过高压灭活以后会改变其原有的蛋白质结构,通透性变好,使得菌体对污染物的吸附性能增强[21];另一方面,灭活真菌的吸附作用主要是细胞壁表面的快速吸附,而活菌的吸附作用还可能与微生物的代谢活动、对污染物的趋避行为、对环境的应激反应等因素有关,与生物降解、生物积累和矿化等作用密不可分的关系导致活菌吸附率偏低[9, 21]。
2.2 白腐真菌对萘、菲、芘的降解特性白腐真菌活菌对PAHs的去除是在吸附和降解的共同作用下完成的[9]。由图 3可知,在第1 d,只有少量萘被白腐真菌降解,其降解率为3.5%,而白腐真菌对萘的吸附率却达到了6%。随着培养时间延长至第4 d,萘的累计去除率达到了29.1%(其中降解率为11.4 %,而吸附率为17.7%)。当培养至第7 d时,萘的降解率达到了23.1%,而吸附率却比第4 d时减少了11.3 %。随着培养时间的不断延长,萘的降解率持续增加,而吸附率表现出相反的变化趋势。在第18 d时,白腐真菌对萘的总去除率达到了46.9%,其中降解率为36.3%,吸附率为10.6%。由此可见,培养初期(第1~4 d),白腐真菌在对萘的去除过程中吸附作用占据主导地位,其贡献率在60%以上。随后白腐真菌对萘的吸附能力逐渐降低并最终稳定在10.6%左右。相反,白腐真菌对萘的降解率逐渐提高,在培养18 d后,白腐真菌对萘的降解率达到了36.3%,占总去除率的77.3%。
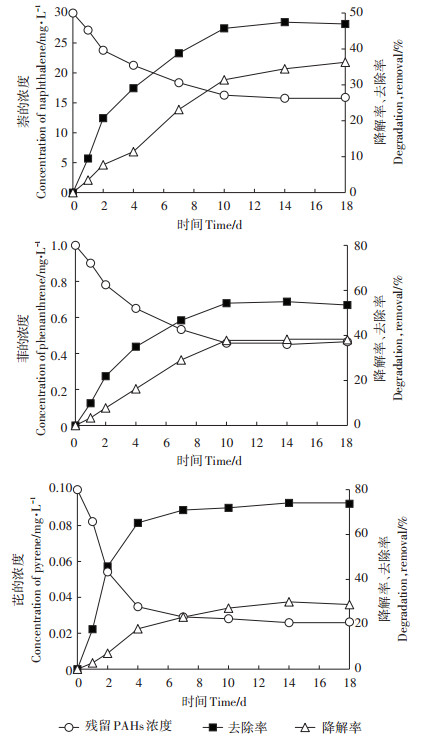
|
图 3 白腐真菌对萘、菲、芘的降解特性 Figure 3 The degradation of white rot fungi on naphthalene, phenanthrene and pyrene |
与萘的降解特性相似,菲的降解率随着培养时间的延长而逐渐增加(图 3)。在第1~4 d时,生物吸附是白腐真菌去除菲的主要途径,其吸附率比同一时间的降解率高出14.7%~91.2%。随后,生物降解成为白腐真菌去除菲的主要途径,对菲的去除贡献率为62.3 %~71.2%。尽管白腐真菌对芘的累计降解率也随培养时间的延长而逐步提高,但吸附作用始终是白腐真菌去除芘的主要过程,而生物降解对芘去除的贡献率仅为15.5%~40.5%。丁洁等[21]的研究也发现,白腐真菌对菲和芘的生物降解作用随着培养时间的延长而逐渐增大。这可能是由于白腐真菌对PAHs的吸附由分配作用主导,且吸附-脱附过程是可逆的,随着培养液中PAHs总量的减少,吸附在菌体上的PAHs可能脱附出来而发生降解[9]。因此,培养后期生物吸附作用逐渐减少而生物降解作用逐渐增强。经过18 d的连续培养后,在生物吸附和生物降解的共同作用下,白腐真菌对菲和芘的总去除率分别达到了53.5 %和73.7%。Acevedo等[23]的研究发现,白腐真菌对土壤菲和芘的去除率分别为62.0%和60%。侯树宇等[20]的研究表明,白腐真菌(P. chrysosporium)单独培养可去除59.5%的芘;当与细菌共培养时,去除率高达99.5%。相反,也有研究表明,白腐真菌(Pseudotrametes gibbosa)在18 d时对芘的去除率仅为28.3%[24]。另外,本研究表明,在培养后期,降解率与吸附率的比值从大到小依次为萘 > 菲 > 芘。其中的主要原因是分子量的增加使得其水溶性下降,脂溶性提高更容易被吸附,而分子量的增大也使得其生物学毒性增强,抑制了白腐真菌的代谢活性[25]。
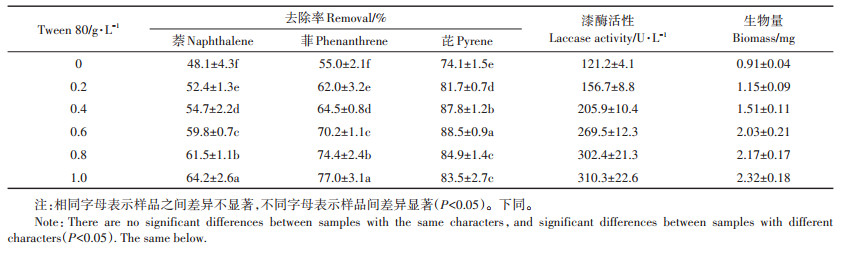
2.3 Tween 80对多环芳烃去除的影响表面活性剂具有固定的亲水亲油基团,在溶液的表面能够定向排列,并且具有增溶、分散、乳化或破乳、降低界面张力的作用[26-27]。由表 2可知,Tween 80强化了白腐真菌对萘、菲、芘的去除能力。在对照条件下,白腐真菌对萘、菲、芘的去除率分别为48.1%、55.0 %、74.1%。白腐真菌对萘和菲的去除率随Tween 80浓度的增加而增加。Tween 80浓度为1.0 g·L-1时,白腐真菌对萘和菲的去除率分别比对照提高了33.5%和40.0%。白腐真菌对芘的去除能力随着Tween 80浓度的增加而呈现先增加后降低的趋势。在Tween 80浓度为0.6 g·L-1条件下,白腐真菌对芘的去除率达到了最大值(88.5%),比对照提高了19.4%。陈静等[26]的研究发现,当Tween 80为2 mg·L-1时,土壤中PAHs的去除率比对照提高了3.5倍。Hickey等[28]通过添加0.5 g·L-1的Tween 80,使荧蒽的降解率从62.4%提高到79.6%。而Wong等[29]发现,添加3 mol·L-1的Tween 80会严重抑制菲的降解。这是由于高浓度表面活性剂产生了毒性,抑制了白腐真菌的活性,从而降低了PAHs的降解率[26]。
|
|
表 2 不同浓度Tween 80条件下PAHs的去除率和漆酶活性 Table 2 The removal of PAHs and laccase activity under different concentration of Tween 80 |
漆酶是白腐真菌降解PAHs的关键酶之一。在降解PAHs的过程中,漆酶氧化PAHs产生相应的醌类物质[14]。如表 2所示,漆酶活性与PAHs的去除率成正比。在对照条件下,白腐真菌的漆酶活性为121.2 U·L-1。随着Tween80浓度的增加,白腐真菌漆酶活性不断提高,并在Tween 80浓度为1.0 g·L-1时达到最大值,为310.3 U·L-1。除了能提高白腐真菌的漆酶活性外,Tween 80还使其生物量提高了0.24~1.55倍,白腐真菌数量的增加可以提高其对PAHs的生物吸附和生物降解作用。陈静等[26]的研究也表明,Tween 80可以显著提高白腐真菌的生长速率。另外,有研究表明,Tween 80可以提高PAHs在溶液中的溶解度,从而提高它们的去除率[29]。
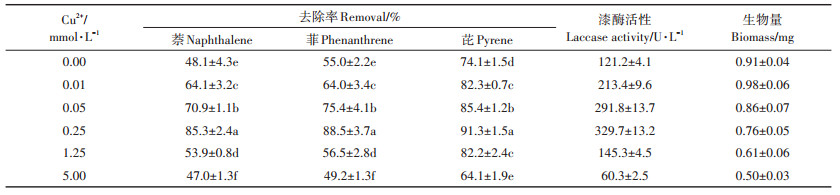
2.4 Cu2+对多环芳烃去除的影响Cu2+是一种常见的重金属离子,它的存在对PAHs的生物吸附和生物降解有一定的调控作用[21]。因此,本研究也考察了不同浓度Cu2+对白腐真菌降解萘、菲、芘及相应漆酶活性的影响。如表 3所示,低浓度Cu2+(0.01 mmol·L-1)对白腐真菌的生长没有明显影响,但是当Cu2+浓度≥0.05 mmol·L-1时,白腐真菌的生长受到明显抑制,且随着Cu2+浓度的增加,抑制作用不断增强。这与以往的研究结果一致[21]。在Cu2+ 浓度为5.0 mmol·L-1条件下,白腐真菌的生物量比对照减少了45.1%。尽管当Cu2+浓度≤1.25 mmol·L-1,白腐真菌的生长受到一定程度的抑制,然而漆酶活性却比对照提高了76%~172%。作为漆酶的辅助因子,Cu2+不仅可以诱导漆酶的产生,同时也可以提高它的活性[8]。何峰[14]的研究发现,当Cu2+浓度为1 mmol·L-1 时,白腐真菌(Ganoderma sp. En3)的漆酶活性比对照提高了3.83倍。Yang等[30]发现,当Cu2+浓度为0.5 mmol·L-1和1 mmol·L-1时,白腐真菌(Trametes velutina)的漆酶活性显著高于对照,且漆酶基因的转录水平分别是对照组的6.3倍和9.5倍。
由表 3可知,当Cu2+浓度从0.01 mmol·L-1提高至5.0 mmol·L-1时,白腐真菌对萘、菲、芘的去除率均呈现先增加后降低的趋势。在Cu2+浓度为0.25 mmol· L-1条件下,白腐真菌对萘、菲、芘的去除率达到最大值,分别为85.3%、88.5%和91.3%,比对照提高了23.2 %~77.3%(P < 0.05)。当Cu2+浓度继续提高时,白腐真菌对萘、菲、芘的去除率逐渐下降。在Cu2+浓度为5.0 mmol·L-1条件下,白腐真菌对萘、菲、芘的去除率受到抑制,低于对照组。已有研究表明,低浓度Cu2+(≤1.25 mmol·L-1)不仅能提高白腐真菌对PAHs的吸附作用,同时也可以提高它的降解能力;而高浓度Cu2+在白腐真菌上累积后会产生毒性作用,降低白腐真菌对PAHs的转化率[19]。例如,丁洁等[21]的研究发现,当Cu2+浓度在0.01~0.5 mmol·L-1时,白腐真菌对菲的吸附率随Cu2+浓度的增大而增强,且当Cu2+浓度≤1.25 mmol·L-1时,白腐真菌对菲和芘的降解率也明显高于对照。Ting等[8]的研究也证实,1 mmol · L-1Cu2+使白腐真菌(G. lucidum)对菲和芘的去除率分别比对照提高了37%和81%,相应地,漆酶活性提高了7.5%。Cu2+强化PAHs的吸附作用主要是通过提高PAHs在白腐真菌上的分配系数,以及PAHs和Cu2+-π的形成实现的[19]。而Cu2+强化白腐真菌对PAHs的生物降解作用主要通过提高漆酶活性来实现。
|
|
表 3 Cu2+对PAHs的去除率和漆酶活性的影响 Table 3 The effects of Cu2+ on removal of PAHs and laccase activity |
(1)在萘、菲、芘的初始浓度分别为30、1、0.1 mg· L-1和35 ℃条件下,白腐真菌灭活菌对其的最大吸附率分别为29.3%、38.2%和70.6%,而活菌的最大吸附率分别为17.7%、18.7%和47.2%。
(2)白腐真菌对PAHs的去除是在吸附和降解的共同作用下完成的。经过18 d的培养后,萘、菲、芘的去除率分别达到了46.9%、53.5%和73.7%。
(3)Tween 80提高了白腐真菌的生物量和漆酶活性,进而提高了PAHs的去除率;当Tween 80浓度为1.0 g·L-1时,白腐真菌对萘和菲的去除率达到最大值,分别比对照提高了33.5%和40.0%,而菲的去除率在Tween 80浓度为0.6 g·L-1时达到最大值。
(4)低浓度Cu2+(≤0.25mmol·L-1)可提高漆酶活性,进而强化白腐真菌对萘、菲、芘的去除能力;而当Cu2+≥1.25 mmol·L-1时,漆酶活性显著降低,导致萘、菲、芘的去除率急剧下降。
| [1] |
满小媛, 宁寻安, 路星雯, 等. 超声/Fe0/EDTA体系对印染污泥中多环芳烃的降解[J]. 环境科学学报, 2018, 38(3): 1049-1055. MAN Xiao-yuan, NING Xun-an, LU Xing-wen, et al. Degradation of polycyclic aromatic hydrocarbons from textile dyeing sludge by strasound/Fe0/EDTA system[J]. Acta Scientiae Circumstantiae, 2018, 38(3): 1049-1055. |
| [2] |
苏梦缘, 王红旗, 李艺, 等. 多环芳烃降解菌菌群构建及其适宜降解环境条件的确定[J]. 环境工程学报, 2017, 11(2): 1192-1198. SU Meng-yuan, WANG Hong-qi, LI Yi, et al. Construction of microbial consortia for PAHs degradation and appropriate environmental condition for degradation[J]. Chinese Journal of Environmental Engineering, 2017, 11(2): 1192-1198. |
| [3] |
巫桂芬, 龙明华, 乔双雨, 等. 不同栽培环境下豇豆体内多环芳烃源解析及风险评估[J]. 农业环境科学学报, 2018, 37(12): 2651-2659. WU Gui-fen, LONG Ming-hua, QIAO Shuang-yu, et al. Source analysis and risk assessment of PAHs in Vigna unguiculata(Linn.) Walp in different culture environments[J]. Journal of Agro-Environment Science, 2018, 37(12): 2651-2659. DOI:10.11654/jaes.2018-1075 |
| [4] |
李嘉康, 宋雪英, 魏建兵, 等. 沈北新区土壤中多环芳烃污染特征及源解析[J]. 环境科学, 2018, 39(1): 379-388. LI Jia-kang, SONG Xue-ying, WEI Jian-bing, et al. Pollution characteristics and source apportionment of polycyclic aromatic hydrocarbons in soils of Shenyang north new area[J]. Environmental Science, 2018, 39(1): 379-388. |
| [5] |
李欣红, 史咲頔, 马瑾, 等. 浙江省农田土壤多环芳烃污染及风险评价[J]. 农业环境科学学报, 2019, 38(7): 1531-1540. LI Xin-hong, SHI Xiao-di, MA Jin, et al. Contamination and risk assessment of polycyclic aromatic hydrocarbons in farmland soils of Zhejiang Province, China[J]. Journal of Agro-Environment Science, 2019, 38(7): 1531-1540. |
| [6] |
Haritash A K, Kaushik C P. Biodegradation aspects of polycyclic aromatic hydrocarbons(PAHs):A review[J]. Journal of Hazardous Materials, 2009, 169(1/2/3): 1-15. |
| [7] |
王震, 李群, 王帆, 等. 白腐真菌对四氯化碳的降解及吸附性能研究[J]. 环境科学与技术, 2017, 40(2): 150-157. WANG Zhen, LI Qun, WANG Fan, et al. Degradation and adsorption of carbon tetrachloride by white-rot fungi[J]. Environmental Science and Technology, 2017, 40(2): 150-157. |
| [8] |
Ting W T E, Yuan S Y, Wu S D, et al. Biodegradation of phenanthrene and pyrene by Ganoderma lucidum[J]. International Biodeterioration and Biodegradation, 2011, 65(1): 238-242. DOI:10.1016/j.ibiod.2010.11.007 |
| [9] |
Chen B, Wang Y, Hu D. Biosorption and biodegradation of polycyclic aromatic hydrocarbons in aqueous solutions by a consortium of whiterot fungi[J]. Journal of Hazardous Materials, 2010, 179: 845-851. DOI:10.1016/j.jhazmat.2010.03.082 |
| [10] |
Hadibarata T, Kristanti R A. Biodegradation and metabolite transformation of pyrene by basidiomycetes fungal isolate Armillaria sp. F022[J]. Bioprocess and Biosystems Engineering, 2013, 36: 461-468. DOI:10.1007/s00449-012-0803-4 |
| [11] |
Wen J, Gao D, Zhang B, et al. Co-metabolic degradation of pyrene by indigenous white-rot fungus Pseudotrametes gibbosa from the northeast China[J]. International Biodeterioration and Biodegradation, 2011, 65(4): 600-604. DOI:10.1016/j.ibiod.2011.03.003 |
| [12] |
李烜桢, 林先贵. 白腐真菌修复多环芳烃污染土壤及其降解机理的研究进展[J]. 安全与环境学报, 2009, 9(6): 71-76. LI Xuan-zhen, LIN Xian-gui. Research advance review in remediation of polycyclic aromatic hydrocarbons contaminated soils by white rot fungi and its degradation mechanism[J]. Journal of Safety and Environment, 2009, 9(6): 71-76. DOI:10.3969/j.issn.1009-6094.2009.06.019 |
| [13] |
侯红漫, 周集体, 陈丽. 白腐菌漆酶特性及异生芳香化合物的降解[J]. 林产化学与工业, 2003, 23(1): 89-94. HOU Hong-man, ZHOU Ji-ti, CHEN Li. Characteristics of laccases in white-rot fungi and degradation of aromatic xenobiotic compounds[J]. Chemistry and Industry of Forest Products, 2003, 23(1): 89-94. DOI:10.3321/j.issn:0253-2417.2003.01.021 |
| [14] |
何峰.白腐真菌Ganoderma sp. En3漆酶同工酶的性质及其对染料和多环芳烃降解研究[D].武汉: 华中科技大学, 2015. HE Feng. Study on the properties of purified laccase isoenzymes from Ganoderma sp. En3 and degradation of synthetic dyes and polycyclic aromatic hydrocarbons[D]. Wuhan: Huazhong University of Science and Technology, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10487-1015906056.htm |
| [15] |
Majcherczyk A, Johannes C, Hüttermann A. Oxidation of polycyclic aromatic hydrocarbons(PAH)by laccase of Trametes versicolor[J]. Enzyme and Microbial Technology, 1998, 22(5): 335-341. DOI:10.1016/S0141-0229(97)00199-3 |
| [16] |
Cho S J, Park S J, Lim J S, et al. Oxidation of polycyclic aromatic hydrocarbons by laccase of Coriolus hirsutus[J]. Biotechnology Letters, 2002, 24(16): 1337-1340. DOI:10.1023/A:1019896316366 |
| [17] |
杜丽娜, 高大文. 青顶拟多孔菌对单一和复合多环芳烃的降解特性[J]. 中国环境科学, 2011, 31(2): 277-282. DU Li-na, GAO Da-wen. Degradation characteristics of single and mixted PAHs by Polyporellus picipes[J]. China Environmental Science, 2011, 31(2): 277-282. |
| [18] |
Liao W L, Tseng D H. Biotreatment of naphthalene by PAH-acclimated pure culture with white-rot fungus Phanerochaete chrysosporium[J]. Water Science and Technology, 1996, 34(10): 73-79. DOI:10.2166/wst.1996.0241 |
| [19] |
丁洁, 陈宝梁, 朱利中. 黄孢原毛平革菌菌球对多环芳烃的生物吸附和生物降解作用[J]. 科学通报, 2012, 57(24): 2276-2284. DING Jie, CHEN Bao-liang, ZHU Li-zhong. Biosorption and biodegradation of polycyclic aromatic hydrocarbons by Phanerochaete chrysosporium in aqueous solution[J]. Chinese Science Bulletin, 2012, 57(24): 2276-2284. |
| [20] |
侯树宇, 张清敏, 多淼, 等. 白腐真菌和细菌对芘的协同生物降解研究[J]. 农业环境科学学报, 2005, 24(2): 318-321. HOU Shu-yu, ZHANG Qing-min, DUO Miao, et al. Coordinated biodegradation of pyrene by a consortium of white rot fungus and bacteria[J]. Journal of Agro-Environment Science, 2005, 24(2): 318-321. DOI:10.3321/j.issn:1672-2043.2005.02.024 |
| [21] |
丁洁.白腐真菌对多环芳烃的生物吸附与生物降解及其修复作用[D].杭州: 浙江大学, 2012. DING Jie. Biosorption and biodegradation of PAHs by white rot fungi and bioremediation[D]. Hangzhou: Zhejiang University, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10335-1012318136.htm |
| [22] |
易修, 袁嘉韩, 顾锁娣, 等. 小麦根系吸收萘、菲、芘的动力学特征[J]. 环境科学学报, 2013, 33(4): 1135-1140. YI Xiu, YUAN Jia-han, GU Suo-di, et al. Kinetic characteristics of naphthalene, phenanthrene and pyrene uptake by wheat roots[J]. Acta Scientiae Circumstantiae, 2013, 33(4): 1135-1140. |
| [23] |
Acevedo F, Pizzul L, Castillo M P, et al. Degradation of polycyclic aromatic hydrocarbons by the Chilean white rot fungus Anthracophyllum discolor[J]. Journal of Hazardous Materials, 2011, 185(1): 212-219. DOI:10.1016/j.jhazmat.2010.09.020 |
| [24] |
温继伟, 高大文. 偏肿拟栓菌共代谢降解芘条件的优化[J]. 中国环境科学, 2011, 31(9): 1516-1522. WEN Ji-wei, GAO Da-wen. Optimization of culture condition for pyrene co-metabolism by Pseudotrametes gibbosa[J]. China Environmental Science, 2011, 31(9): 1516-1522. |
| [25] |
丁洁, 王银善, 沈学优, 等. 白腐真菌体对菲和芘的吸附-脱附作用及影响因素[J]. 环境科学学报, 2010, 30(4): 825-831. DING Jie, WANG Yin-shan, SHEN Xue-you, et al. Bioremediation tests on biosorption-desorption of phenanthrene and pyrene by whiterot fungi[J]. Acta Scientiae Circumstantiae, 2010, 30(4): 825-831. |
| [26] |
陈静, 王学军, 胡俊栋, 等. 表面活性剂对白腐真菌降解多环芳烃的影响[J]. 环境科学, 2006, 27(1): 154-159. CHEN Jing, WANG Xue-jun, HU Jun-dong, et al. Effect of surfactants on biodegradation of PAHs by white-rot fungi[J]. Environmental Science, 2006, 27(1): 154-159. |
| [27] |
丁娟, 罗坤, 周娟, 等. 表面活性剂Tween 80和β-环糊精对白腐菌降解多环芳烃的影响[J]. 南京大学学报, 2007, 43(5): 561-566. DING Juan, LUO Kun, ZHOU Juan, et al. The effect of surfactants Tween 80 and β-cyclodextrin on the degradation of polycyclic aromatic hydrocarbons by white rot fungus[J]. Journal of Nanjing University (Natural Sciences), 2007, 43(5): 561-566. DOI:10.3321/j.issn:0469-5097.2007.05.015 |
| [28] |
Hickey A M, Gordon L, Dobson A D W, et al. Effect of surfactants on fluoranthene degradation by Pseudomonas alcaligenes PA-10[J]. Applied Microbiology and Biotechnology, 2007, 74(4): 851-856. DOI:10.1007/s00253-006-0719-5 |
| [29] |
Wong J W C, Fang M, Zhao Z, et al. Effects of surfactants on solubilization and degradation of phenanthrene under thermophilic conditions[J]. Journal of Environmental Quality, 2004, 33(6): 2015-2025. DOI:10.2134/jeq2004.2015 |
| [30] |
Yang Y, Wei F, Zhuo R, et al. Enhancing the laccase production and laccase gene expression in the white-rot fungus Trametes velutina 5930 with great potential for biotechnological applications by different metal ions and aromatic compounds[J]. PLoS One, 2013, 8(11): e79307. DOI:10.1371/journal.pone.0079307 |
 2020, Vol. 39
2020, Vol. 39