2. 上海市市容环境运输处有限公司, 上海 200060;
3. 上海老港废弃物处置有限公司, 上海 201302
2. Shanghai City Environment and Transportation Department Co., Ltd., Shanghai 200060, China;
3. Shanghai Laogang Waste Disposal Co., Ltd., Shanghai 201302, China
作为一种广谱杀虫除草剂,有机磷农药(Organophosphorus pesticides,OPs)被广泛用于控制我国和世界其他地区的农业害虫[1],确保农作物的正常生长。OPs在全球有300~400个品种,其杀虫谱广、药效好,已经成为杀虫剂市场最重要的部分。广泛使用的OPs及其普遍偏低的农药利用率[2],使其在土壤中大量残余。土壤中存在的OPs会通过灌溉水下渗或大气降水等过程,迁移进入到水生生态系统中。相比于有机氯农药,OPs曾因其易降解性和较强的亲水性而被认为是一类安全高效的农药[3]。然而后来研究发现,OPs能够在水环境中持久存在,近年来,OPs在我国和其他国家的沉积底泥中被大量检出。Lan等[4]在我国东海的沉积底泥里检出三唑磷含量范围为nd~32.10 ng·g-1;Wu等[5]在巢湖底泥中检出OPs总量范围为0.27~23.33 ng·g-1;Akoto等[6]在加纳河流中检出甲基嘧啶磷的含量范围为0.01~0.17 μg·g-1。OPs的基本作用机制是能够通过皮肤接触、食品食用和呼吸吸入等途径进入人体,从而抑制乙酰胆碱酯酶,使乙酰胆碱积聚,危害神经系统[7],长期食用或接触含有OPs残留物的物质,会造成慢性中毒。OPs对人类健康造成了极大的威胁,全世界范围内每年就有数百万个OPs中毒案例[8]。
目前关于OPs污染土壤修复的研究较多,常见的修复方法包括热脱附法[9]、微生物法[10]和高级氧化法[11]等。但是关于OPs污染底泥的修复研究很少,例如Amaya等[12]利用香蒲对含有甲基对硫磷的污染底泥进行修复,14 d内88%的甲基对硫磷被去除。
针对目前处理底泥OPs污染研究较少的情况,本试验采用微生物降解技术进行底泥OPs去除研究。目前,底泥中微生物降解技术的运用主要以消除底泥黑臭[13-14]以及去除多环芳烃[15-16]等持久性有机污染物为主,该技术的原理是利用细菌、真菌等微生物以底泥中的污染物作为营养物质进行生长繁殖,从而达到去除有机污染、修复污染底泥的目的[17]。土工布袋是利用聚合化纤合成材料制成的袋状产品,工程上用混凝土或砂浆灌入袋中,待其固结达到一定强度后,用于沿海海岸和河道的护坡。本研究以OPs模拟污染底泥为研究对象,首次采用土工布袋作为其降解反应发生的容器,主要采用好氧菌群和厌氧菌群两类微生物混合菌剂对OPs进行降解。研究了不同菌群降解污染底泥的反应动力学和半衰期,并计算了马拉硫磷、喹硫磷、二嗪磷和乐果4种OPs污染物分子的最低空轨道能(ELUMO)、分子的最高占据轨道能(EHOMO)和两者的差值EGAP(EGAP=ELUMO-EHOMO)这3种量化参数,从分子的微观结构对降解行为进行解释,并探究利用土工布袋实现OPs污染底泥资源化再利用的可行性。
1 材料与方法 1.1 试验材料 1.1.1 微生物菌剂本试验采用扬州海诚生物生产的两类混合菌剂,分别为好氧菌菌剂和厌氧菌菌剂。两种微生物菌剂均是将筛选的菌株培养后与载体、保护剂复合而成。其中:载体为沸石灰;保护剂为1%(m/V)的海藻酸钠;好氧菌菌剂主要包括不动杆菌属、芽孢杆菌属、酵母菌属等,厌氧菌菌剂主要包括产甲烷菌属、假单胞菌属、乳酸菌属等,有效活菌为200亿«kg-1。
1.1.2 供试底泥试验所用的底泥取自上海交通大学闵行校区思源湖。采用彼得森采泥器进行采集,采泥厚度为10.00~15.00 cm。底泥经分析测试,不含有此次试验研究的4种OPs污染物,底泥的其他理化性质见表 1。
|
|
表 1 供试底泥的部分理化性质 Table 1 Partial physical and chemical properties of the test sediment |
试验仪器:冷冻干燥仪(北京亚星仪科);Thermo ScientificTM DionexTM ASETM 350加速溶剂萃取装置(美国Thermo公司);Turbo Vap多功能全自动浓缩仪(瑞典Biotage公司);QP-2020型气相色谱质谱联用仪(日本岛津公司)。
试验试剂:喹硫磷(分析纯)、二嗪磷(分析纯)、乐果(分析纯)均购于北京伊诺凯科技有限公司;马拉硫磷(分析纯)购于上海百灵威化学技术有限公司;丙酮(色谱纯)和二氯甲烷(色谱纯)购于国药集团。
1.2 加速溶剂萃取与GC-MS操作条件加速溶剂萃取条件:萃取溶剂为丙酮和二氯甲烷(1:1,V/V);萃取温度80 ℃;萃取压力10.34 MPa;静态萃取时间10 min;冲洗体积60%;静态萃取3次。
色谱条件:载气为高纯氦气;流速1 mL·min-1;色谱柱程序升温为初温95 ℃,保持15 min,然后以20 ℃·min-1升至190 ℃,再以5 ℃«min-1升至230 ℃,最后以25 ℃·min-1升至250 ℃并保持5 min;进样方式为不分流进样,进样量为1 μL。
质谱条件:接口温度280 ℃,电子轰击(EI)离子源,电子能量70 eV,离子温度230 ℃,四极杆温度150 ℃,质量扫描70~350 μL,溶剂延迟3 min,采用选择离子方式(SM)检测。
1.3 模拟污染底泥的配制将马拉硫磷、喹硫磷、二嗪磷和乐果试剂溶于丙酮溶液,配制成4种OPs浓度均为0.50 mg·mL-1的混合溶液,保存于4 ℃冰箱内备用。将采集的底泥风干后研磨过2.00 mm筛网,将配制的OPs混合溶液稀释至0.05 mg·mL-1。取200 g过筛底泥于烧杯内,将底泥和200 mL稀释的含有4种OPs的丙酮溶液(0.05 mg·mL-1)进行充分搅拌,之后将底泥置于通风橱内挥发,风干48 h待丙酮完全挥发后,得到4种OPs污染浓度均为50.00 mg·kg-1的模拟污染底泥。将模拟污染底泥放于棕色瓶中,保存于4 ℃冰箱内备用。
1.4 微生物的投加取200.00 g模拟污染底泥,加入800.00 g水充分搅拌,待呈泥浆状后,测得含水率为85.70%,将其装入长20.00 cm、宽15.00 cm的聚丙烯土工布袋中。试验分为3组,每组3个平行样:第一组,每个投加0.50 g好氧菌菌剂;第二组,每个投加0.50 g厌氧菌菌剂;第三组为空白组。投入菌剂后充分搅拌,将土工布袋封住,放置于阴凉避光处保存。
1.5 分析方法含水率的测定:从土工布袋底泥内部取部分底泥,称取质量后放入烘箱内,在105 ℃下烘干4 h至恒质量后,称取底泥的质量,计算其对应的含水率。
OPs含量的测定:从底泥内部取部分底泥,冷冻干燥后,研磨过1.00 mm筛网,称取2.00 g过筛底泥于萃取池内,进行加速溶剂萃取;萃取结束后,将所得萃取液在40 ℃下氮吹至近干,用二氯甲烷定容至1.00 mL,转移至进样小瓶内进行GC-MS定量检测,计算微生物对4种OPs的降解率,降解率的计算公式为:
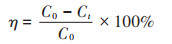
|
式中:η为OPs降解率,%;C0为OPs的初始浓度,mg·kg-1;Ct为t时刻OPs的浓度,mg·kg-1。
1.6 方法质量控制本试验采用风干后过筛的底泥,用1.3的方法分别配制4种OPs加标量均为2.50 mg·kg-1和25.00 mg·kg-1的样品,每种样品均按分析方法做6次平行样。在高浓度和低浓度下,4种OPs的加标回收率均大于80.00%,相对标准偏差均小于10%,不影响定量分析。
1.7 量子化学参数计算方法本研究采用量子化学计算软件Materials Studio 7.0将4种OPs的结构优化后,运用DMol3模块中的梯度近似方法(B3LYP),对化合物分子的最低空轨道能(ELUMO)、最高占据轨道能(EHOMO)和两者的差值EGAP(EGAP=ELUMO-EHOMO)进行计算。
2 结果与讨论 2.1 两种菌群对OPs污染底泥的脱水与降解效果在土工布袋内,原含水率为85.70%的模拟污染底泥,经过25 d后,投入菌剂的污染底泥的含水率分别为3.81%(好氧菌群)和2.93%(厌氧菌群),低于不投加菌剂的空白组的含水率4.38%(P < 0.05)。试验结果表明,将底泥装入土工布袋内能够使底泥的含水率在一段时间内迅速降低,脱水效果显著。
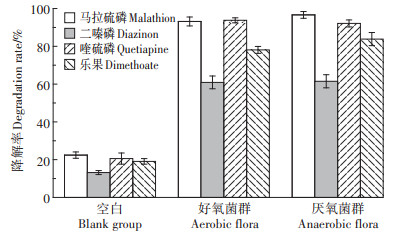
在实验室模拟条件下,好氧菌群和厌氧菌群降解模拟污染底泥中OPs的结果如图 1所示。培养25 d后,好氧菌群和厌氧菌群对浓度均为50.00 mg·kg-1的OPs的降解效果总体差异不大。两种菌群对马拉硫磷和喹硫磷的降解率均高于90.00%,其中,好氧菌群对喹硫磷的降解率达到93.78%。本次试验所用的好氧菌群混合菌剂中含有的芽孢杆菌属是我国棉田中喹硫磷的主要降解菌种,喹硫磷在芽孢杆菌属作用下的主要降解产物为C8H6N2O、C8H6N2O2S和C4H11O3PS[18]。厌氧菌群对乐果的降解效果高于好氧菌群,在25 d后乐果对厌氧菌群的降解率为83.84%。农药的微生物降解作用实际上是酶促反应,微生物本身含有或者能够产生可降解该农药的酶系基因[19],厌氧菌群中微生物可能产生了能够打开乐果P-S键的磷酸酶,从而获得了对乐果更高的降解效率[20]。两类菌群对二嗪磷的降解效果较低,只有60.91%(好氧菌群)和61.50%(厌氧菌群)。不投加任何菌剂的空白样中,4种OPs的降解率均低于25.00%。试验表明,向土工布袋内投加菌剂来降解袋内OPs污染底泥具有良好的效果。
|
图 1 两种菌群对OPs的降解效果 Figure 1 Degradation effect of two kinds of flora on OPs |
好氧菌群降解OPs的时间-含量曲线见图 2。1~5 d内,OPs的降解速度缓慢,这可能是由于高浓度的底物抑制了微生物的活性,影响了酶促反应的进行,从而限制了微生物对污染物的降解[21];同时,OPs具有较大的生物毒性,会对菌体的生长造成影响,好氧菌群对OPs污染物需要一定的适应时间。段海明等[22]对OPs污染物甲基对硫磷的微生物降解研究中也发现,菌株能够高效降解相对较低浓度的甲基对硫磷,但对高浓度的甲基对硫磷降解率较低。5~10 d,OPs的浓度显著降低,其中喹硫磷的浓度下降了32.36%,马拉硫磷的浓度降低了39.36%,这可能是由于好氧菌群适应OPs浓度后快速繁殖,菌体和OPs充分接触,使得更多的污染物被降解。10~25 d,OPs的降解速度缓慢并逐渐达到平衡,这是由于密封的土工布袋内氧气逐渐减少,部分好氧菌因缺氧以及营养物质的缺失而死亡。

|
图 2 好氧菌群降解4种OPs(50 mg·kg-1)的时间-含量曲线 Figure 2 Time-content profile for the degradation of four OPs(50 mg·kg-1)by aerobic bacteria |
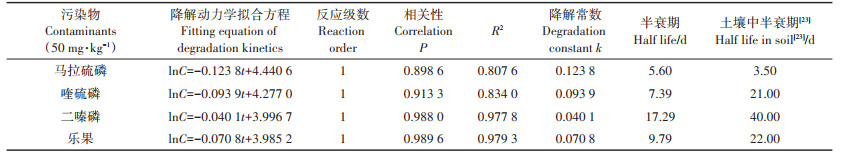
根据图 2进行拟合,可得到好氧菌群对OPs的降解动力学拟合方程和半衰期,结果见表 2。好氧菌群降解OPs的动力学与一级动力学拟合效果良好,各处理R2均大于0.90。4种OPs在土壤中的自然降解半衰期分别为3.50 d(马拉硫磷)、21 d(喹硫磷)、40 d(二嗪磷)和22 d(乐果)[23]。由表 2可见,由于好氧菌群混合菌剂的加入,喹硫磷、二嗪磷和乐果的半衰期都明显缩短,而马拉硫磷的半衰期延长了2.38 d。土壤中农药的半衰期取决于农药类型、土壤类型、菌体种类、土壤pH和温度等多个条件,马拉硫磷半衰期延长的原因还有待进一步研究。
|
|
表 2 好氧菌群降解OPs的动力学拟合方程 Table 2 Kinetic fitting results for the degradation of four OPs(50 mg·kg-1)by aerobic bacteria |
在实验室模拟条件下,厌氧菌群降解OPs的过程如图 3所示。0~5 d内,高浓度的OPs对厌氧菌群产生了一定的抑制作用。其中,马拉硫磷和二嗪磷在5 d内的降解率均低于10%,低于好氧菌群同期的降解效果。5~25 d内,厌氧菌群对新环境逐渐适应,降解OPs的速率有所提高,厌氧菌群在每个阶段降解OPs的速率差异不大。最终降解率:马拉硫磷(96.64%)>喹硫磷(92.13%)>乐果(83.84%)>二嗪磷(61.50%)。由表 3可见,厌氧菌群降解OPs的动力学与一级动力学拟合良好,这与好氧菌群一致。4种OPs污染物在厌氧菌群的降解作用下半衰期缩短得更多(马拉硫磷除外),这可能是由于密封的土工布袋内缺氧的环境更利于厌氧菌群的生长。利用厌氧菌降解土壤中OPs污染物的研究较少,Zhang等[24]采用乳酸菌对脱脂乳中的OPs进行降解研究发现,乳酸菌使二嗪磷的降解速度提高了225.40%,使马拉硫磷的降解速度提高了29.70%,相对于马拉硫磷,二嗪磷更稳定,不易被降解。同样,在本试验中,二嗪磷的降解率也低于马拉硫磷。

|
图 3 厌氧菌群降解4种OPs(50 mg·kg-1)的时间-含量曲线 Figure 3 Time-content profile for the degradation of four OPs(50 mg·kg-1)by anaerobic flora |
|
|
表 3 厌氧菌群降解OPs的动力学拟合方程 Table 3 Kinetic fitting results for the degradation of four OPs(50 mg·kg-1)by anaerobic flora |
在好氧菌群和厌氧菌群对4种OPs污染物的降解试验中,二嗪磷和乐果的降解效果均低于马拉硫磷和喹硫磷,对此本研究通过计算4种化合物的分子结构参数对其进行了进一步的探讨。ELUMO、EHOMO和两者的差值EGAP是轨道前线理论里重要的描述符。前线轨道认为,分子的最低空轨道能(ELUMO)是分子得到电子能力的量度,ELUMO越低,分子接受电子的能力越强;分子的最高占据轨道能(EHOMO)是分子给电子能力的量度,EHOMO越低,轨道中电子越稳定,分子给电子能力越弱;两者的差值EGAP是分子稳定性的重要指标,EGAP值越大,分子的稳定性越强,越不容易发生化学反应[25]。
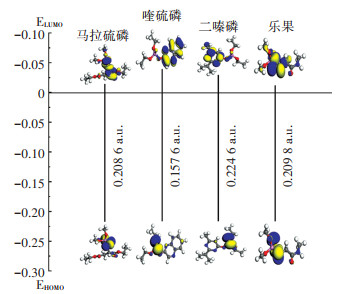
图 4是4种OPs的ELUMO、EHOMO和EGAP值的情况,4种OPs污染物的EGAP值大小为二嗪磷>乐果>马拉硫磷>喹硫磷。二嗪磷的EGAP值最大,性质最稳定,最不容易发生化学反应,这与本研究的结果相对应,即4种OPs污染物中,二嗪磷在两类菌群的降解试验中,降解率均为最低。
|
图 4 4种OPs的ELUMO、EHOMO和EGAP值 Figure 4 ELUMO, EHOMO and EGAP value of four OPs |
(1)好氧菌和厌氧菌菌剂在25 d内均能有效降解OPs,且降解效果差异不大。除二嗪磷外,两种菌剂对马拉硫磷、喹硫磷、乐果的降解率均在75.00%以上。两种菌剂降解OPs的降解动力学均与一级动力学方程拟合良好。除马拉硫磷外,其余3种OPs污染物的半衰期明显缩短。
(2)二嗪磷的EGAP值最高,性质最稳定,最不易发生化学反应,这可能是二嗪磷在两类菌剂的作用下降解率均为最低的原因。该研究结果提示,量化参数可能有助于从分子结构角度解释OPs生物降解的难易程度。
(3)在土工布袋内进行底泥修复试验,能够显著降低袋内底泥的含水率和农药污染程度,满足土工布袋的工程化要求,这一研究为疏浚底泥的处理和资源化再利用提供了新的思路,也为今后的工程应用提供了一定的理论基础。但是,本研究是在实验室人工设定的试验条件下进行的,这与实际的工程应用有较大差异。此外,降解OPs的最适菌种和降解条件还有待进一步研究。
| [1] |
Li F, Yuan Y, Meng P, et al. Probabilistic acute risk assessment of cumulative exposure to organophosphorus and carbamate pesticides from dietary vegetables and fruits in Shanghai populations[J]. Food Additives & Contaminants:Part A, 2017, 34(5): 819-831. |
| [2] |
张娜娜, 姜博, 邢奕, 等. 有机磷农药污染土壤的微生物降解研究进展[J]. 土壤, 2018, 50(4): 645-655. ZHANG Na-na, JIANG Bo, XING Yi, et al. Microbial degradation of organophosphorus pesticide contaminated soils[J]. Soils, 2018, 50(4): 645-655. |
| [3] |
丁佳栋, 熊鸿斌, 张硕, 等. 巢湖沉积物OPs和SPs的生态风险评价[J]. 合肥工业大学学报(自然科学版), 2016, 39(4): 523-528. DING Jia-dong, XIONG Hong-bin, ZHANG Shuo, et al. Ecological risk evaluation of organophosphate pesticides and synthetic pyrethroids insecticides in surface sediment from Chaohu Lake[J]. Journal of Hefei University of Technology, 2016, 39(4): 523-528. DOI:10.3969/j.issn.1003-5060.2016.04.019 |
| [4] |
Lan J, Jia J, Liu A, et al. Pollution levels of banned and non-banned pesticides in surface sediments from the East China Sea[J]. Marine Pollution Bulletin, 2019, 139: 332-338. DOI:10.1016/j.marpolbul.2019.01.006 |
| [5] |
Wu Y, Zhang S, Ren C, et al. Residues of organophosphorus insecticides in sediment around a highly eutrophic lake, eastern China[J]. Journal of Soils and Sediments, 2014, 15(2): 1-9. |
| [6] |
Akoto O, Azuure A A, Adotey K D. Pesticide residues in water, sediment and fish from Tono Reservoir and their health risk implications[J]. SpringerPlus, 2016, 5(1): 1849. DOI:10.1186/s40064-016-3544-z |
| [7] |
Satnami M L, Korram J, Nagwanshi R, et al. Gold nanoprobe for inhibition and reactivation of acetylcholinesterase:An application to detection of organophosphorus pesticides[J]. Sensors & Actuators B Chemical, 2018, 267: 155-164. |
| [8] |
Jokanović M. Neurotoxic effects of organophosphorus pesticides and possible association with neurodegenerative diseases in man:A review[J]. Toxicology, 2018, 410: 125-131. DOI:10.1016/j.tox.2018.09.009 |
| [9] |
刘新培.热脱附技术在有机磷农药污染土壤修复过程中的应用研究[D].天津: 天津大学, 2015: 48-49. LIU Xin-pei. Application of thermal desorption technology in remediation of organophosphorus-pesticides contaminated soils[D]. Tianjin: Tianjin University, 2015: 48-49. http://www.cnki.com.cn/Article/CJFDTotal-TJHG201701026.htm |
| [10] |
郭子武.笋用竹林地有机农药污染土壤微生物修复机理研究[D].北京: 中国林业科学研究院, 2008: 11-15. GUO Zi-wu. Study on bioremediation of organ-pesticides polluted soil of bamboo forest for shoot[D]. Beijing: China Academy of Forestry Sciences, 2008: 11-15. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=D602710 |
| [11] |
Zhu C, Zhu F, Wang F, et al. Comparison of persulfate activation and fenton reaction in remediating an organophosphorus pesticides-polluted soil[J]. Pedosphere, 2017, 27(3): 465-474. DOI:10.1016/S1002-0160(17)60342-4 |
| [12] |
Amaya C, Martinez T, Lopez M, et al. Methyl parathion toxicity to and removal efficiency by Typha latifolia in water and artificial sediments[J]. Chemosphere, 2006, 7(63): 1124-1129. |
| [13] |
钱嫦萍, 王东启, 陈振楼, 等. 生物修复技术在黑臭河道治理中的应用[J]. 水处理技术, 2009, 35(4): 13-17. QIAN Chang-ping, WANG Dong-qi, CHEN Zhen-lou, et al. Progress of bioremediation for controlling blackening and stink of rivers[J]. Technology of Water Treatment, 2009, 35(4): 13-17. |
| [14] |
程炜. 基于微生物修复技术的黑臭水体底泥治理研究[J]. 环境与可持续发展, 2019, 44(1): 151-153. CHEN Wei. Study on sediment treatment of black odor water based on microbial rehabilitation technology[J]. Environment and Sustainable Development, 2019, 44(1): 151-153. |
| [15] |
孙明明, 滕应, 骆永明. 厌氧微生物降解多环芳烃研究进展[J]. 微生物学报, 2012, 52(8): 931-939. SUN Ming-ming, TENG Ying, LUO Yong-ming. Progresses in anaerobic biodegradation of polycyclic aromatic hydrocarbons:A review[J]. Acta Microbiologica Sinica, 2012, 52(8): 931-939. |
| [16] |
郑政伟, 李开明, 朱芳, 等. 底泥中多环芳烃的微生物降解与原位修复技术[J]. 环境科学与技术, 2010, 33(6): 49-53. ZHENG Zheng-wei, LI Kai-ming, ZHU Fang, et al. Overviews of biodegradation of PAHs and in situ remediation of PAHs-contaminated sediment[J]. Environmental Science & Technology, 2010, 33(6): 49-53. |
| [17] |
徐熊, 谢翼飞, 陈政阳, 等. 曝气强化微生物功能菌修复黑臭水体[J]. 环境工程学报, 2017, 11(8): 4559-4565. XU Xiong, XIE Yi-fei, CHEN Zheng-yang, et al. Remediation of urban black-odorous river by aeration enhancing functional strains[J]. Chinese Journal of Environmental Engineering, 2017, 11(8): 4559-4565. |
| [18] |
刘雅楠.喹硫磷棉田降解因子及典型土壤微生物降解特性研究[D].杭州: 浙江大学, 2016: 93-95. LIU Ya-nan. Degradation factors of quinalphos in cotton field and degradation characteristics of typical soil microbes[D]. Hangzhou: Zhejiang University, 2016: 93-95. http://cdmd.cnki.com.cn/Article/CDMD-10335-1016124855.htm |
| [19] |
王堃.乐果降解菌的分离、鉴定及其降解特性研究[D].南京: 南京农业大学, 2008: 8-10. WANG Kun. Isolation identification and degradation characters of dimethoate-degrading strain L3[D]. Nanjing: Nanjing Agricultural University, 2008: 8-10. http://cdmd.cnki.com.cn/Article/CDMD-10307-2009077226.htm |
| [20] |
Mageong Y C, Joseph F P. Sererospecific enzymetic hydrolysis of phosphorus-sulfur bond in chiral organophosphate triesters[J]. Bioorganic & Med Chem Let, 1994, 4(2): 1473-1478. |
| [21] |
Cao Y, Jia L, Xu L, et al. Analysis of different PCBs degradation abilities of biphenyl dioxygenase derived from Enterobacter sp. LY402 by molecular simulation[J]. New Biotechnology, 2012, 29(1): 90-98. |
| [22] |
段海明, 王开运, 王冕, 等. 蜡状芽孢杆菌HY-1降解甲基对硫磷和毒死蜱的影响因素研究[J]. 农业环境科学学报, 2010, 29(3): 437-443. DUAN Hai-ming, WANG Kai-yun, WANG Mian, et al. Degradative characteristics of bacillus cereus HY-1 to methyl-parathion and chlorpyrifos[J]. Journal of Agro-Environment Science, 2010, 29(3): 437-443. |
| [23] |
Shardeendu K, Garima K, Mohd A, et al. Microbial degradation of organophosphate pesticides:A review[J]. Pedosphere, 2018, 28(2): 26-44. |
| [24] |
Zhang Y H, Xu D, Liu J Q, et al. Enhanced degradation of five organophosphorus pesticides in skimmed milk by lactic acid bacteria and its potential relationship with phosphatase production[J]. Food Chemistry, 2014, 164: 173-178. DOI:10.1016/j.foodchem.2014.05.059 |
| [25] |
Ungordu A, Tezer N. The solvent(water)and metal effects on HOMO-LUMO gaps of guanine base pair:A computational study[J]. Journal of Molecular Graphics & Modelling, 2017, 74: 265-272. |
 2020, Vol. 39
2020, Vol. 39