目前,重金属对农业生态系统的污染已引起全球的广泛关注。当植物受到重金属毒害时,植物细胞通过自身防御功能使重金属选择性分布,避免重金属对植物重要的组织、细胞及细胞器的损害[1]。Mwamba等[2]发现,在甘蓝型油菜中,Cd的大部分积累在可溶性部分,相比之下,在细胞壁和液泡中则有较多的Cu被隔离。Zhang等[3]、司江英等[4]和沈奕昕等[5]研究表明,Cd、Pb和Cu主要分布在玉米的细胞壁区域,其次为细胞溶质部分,细胞器中分布很少,且植物根部的金属含量明显高于茎叶部分。Hou等[6]研究发现,芥菜和小白菜的根部V的73.4%~78.6%、茎中的74.9%~79.8%、叶片中的86.6%~93.2%积累在细胞壁和可溶性部分,这表明在植物V积累和解毒过程中,细胞壁和液泡共同起作用。细胞壁是重金属进入细胞的第一道屏障,它阻止了重金属离子进入细胞质,这种抑制能力直接反映了植物对重金属的耐受性。研究植物亚细胞中重金属的分布,对于揭示金属对植物的毒理和植物耐受性具有重要意义。非蛋白巯基(NPT)是防止植物受到重金属毒害的植物体内重要组成部分。非蛋白巯基化合物主要包括谷胱甘肽(GSH)、植物螯合素(PCs)和半胱氨酸(Cys)等,是植物去除重金属的主要成分,重金属与巯基类物质的络合是植物对重金属胁迫的响应[7]。PCs是富含半胱氨酸的多肽物质,其主要生理功能是PCs通过与细胞内-SH基团反应形成毒性更低的金属络合物,并将其存储在细胞液泡中,避免游离的重金属离子迁移至细胞质中,从而降低毒性作用。Aborode等[8]研究表明GSH和PCs在拟南芥的亚硒酸盐和砷酸盐解毒中起着重要作用。李冬琴等[9]研究表明,NPT可与水稻中的Cd螯合从而降低Cd的毒性。可见,不同植物在不同的重金属胁迫下产生不同的巯基蛋白质,这些巯基化合物对于植物自身的解毒机制起重要作用。
V被认为是植物生长非必需的微量元素。低浓度V会促进植物生长发育,但高浓度V对植物产生毒性作用[10-11]。研究表明,V对植物更具有流动性和毒性[12]。近年来,V污染对土壤和生物的影响引起了人们的关注。Imtiaz等[13]研究表明,V显著增加了所有基因型鹰嘴豆的酶活性,降低了蛋白质含量、植物的生物量以及根和茎的长度,植物根部积累了大量的V。Saco等[14]和Yang等[15]研究表明,从营养生长到生殖生长,菜豆和大豆均受到了V的影响。V主要积累在植物的根中,只有低于20%转运至地上部分。随着土壤中V浓度的增加,细胞壁中V浓度与根中总V浓度的比值也随之增加,植物可能产生自我防御系统以承受V毒性。Tian等[16]研究表明,大白菜中的V从根到叶部的转运极低,但土壤中活动性最高的V通常为五价态,而叶片中的V(Ⅳ)占优势(占总V的60%~80%),表明大白菜中V具有生物还原性。中国的V产量占全球V产量的57%,在中国西南部有26.49%的土壤被V污染[17],广西岩溶地区的独特环境条件使土壤中全V和可溶态V含量较高,其耕层土壤中V含量平均值达106.28 mg·kg-1,个别地区石灰岩土壤背景高达565.7 mg·kg-1 [18],这有可能使V在作物中积累,进而影响人体健康。近年来人们关注到V对蔬菜类植物生长的影响,而粮食作物的研究较少,尤其是作物本身对V的解毒机理罕见报道。甜玉米是华南地区广泛种植的农作物,保证甜玉米的优质高产是这个新兴农业优势产业可持续发展的基础。因此,本文以甜玉米为研究对象,在以往的水培研究成果[19]基础上,通过在土壤中施加外源V,研究了盆栽试验培养模式下,V在玉米植物体内的生物积累、V的亚细胞分布和非蛋白巯基化合物对V的响应差异,旨在从细胞分子水平探讨V在植物中的生物学效应,阐明植物的耐性机制,为环境中V污染的风险评估和预防提供科学依据。
1 材料与方法 1.1 材料以桂林理工大学雁山校区附近农田土壤作为盆栽试验用土壤,土壤部分理化性质的测定参考刘光崧等[20]文献,结果见表 1。
|
|
表 1 土壤部分理化性质 Table 1 Physical and chemical properties of the soil |
土壤经风干,除去石块和垃圾,每盆(上直径×下直径×高:27 cm×17 cm×23 cm)称取过筛(3.2 mm)后的土壤7 kg,每千克土壤施用N[CO(NH2)2] 0.2 g、P2O5(KH2PO4)0.2 g、K2O(K2SO4)0.1 g作为底肥,这些分析纯试剂均以粉末形式与土壤混匀。
供试玉米(Zea mays L.)种子为正甜68超甜玉米种子(广东金作农业科技有限公司)。
1.2 试验处理盆栽试验共设计5个不同的V处理(0、100、200、300、500 mg V·kg-1土壤),分别以NH4VO3(AR)固体粉末的形式加入,每个处理6个重复,每盆土壤充分混匀后陈化平衡7 d,备用。
挑选籽粒饱满的甜玉米种子,用0.3% H2O2消毒30 min,洗净,用纯水浸泡6 h后于30 ℃烘箱中催芽,将已萌发小芽的玉米种子播种于盆栽土壤中,所有盆都随机排列并偶尔改变位置。待幼苗长至3片叶,每盆定为5株,按大田栽培管理要求,按期浇水以保持土壤湿度。当甜玉米幼苗生长至5片叶时(约38 d),收获每个处理的4盆玉米植株,另外2盆在玉米含苞结籽后再收获(约93 d)。第一次收获的植物分成根和茎叶(幼苗期)用水洗净(根部用0.1 mol·L-1EDTA溶液浸泡15 min,以除去表面吸附的金属离子,再用水洗净),再用纯水洗涤2次。将样品分成两部分,一部分样品(2盆10株)用吸水纸吸干植物表面水分后,剪碎混合,分别准确称取每份1.000 g的植物鲜样,置于-20 ℃冰箱中保存,用于V的亚细胞分布和非蛋白巯基含量的分析测定。第二次收获的植株分为根、茎、叶和子实(成熟期),如上述方法洗净后,将样品(包括第一次收获的另2盆样品)放入烘箱100 ℃杀青10 min,置于60 ℃烘箱3 d。用分析天平记录植物干质量后,将样品制成粉末状,放入干燥器以备测定V含量。
试验所用试剂均为分析纯,水为重蒸馏水。
1.3 测定内容与方法 1.3.1 V的亚细胞分级取出上述预处理好的新鲜(或冰冻)植物样,将根、茎叶分别剪碎,将样品与提取液[0.25 mol·L-1蔗糖+50 mmol·L-1 Tris-HCl缓冲液(pH7.5)+1 mmol·L-1二硫苏糖醇(C4H10O2S2)]按1:10(g:mL)的比例混合,在冰浴中用玛瑙研钵将样品研磨成匀浆,按下列步骤进行细胞组分逐级离心分离:匀浆液在1500 r·min-1下离心20 min,沉淀为细胞壁及未破碎残渣(F1);上清液在2500 r·min-1下离心10 min,沉淀为细胞核(F2);上清液在10 000 r·min-1下离心30 min,沉淀为线粒体和叶绿体(F3);上清液为核蛋白和可溶性组分(F4)。全部操作在4 ℃下进行。
1.3.2 非蛋白巯基(NPT)、谷胱甘肽(GSH)和植物螯合态(PCs)含量的测定在研钵中放入1 g鲜样组织,加液氮研磨,加入预冷的50 g·L-1磺基水杨酸(SSA,含6.3 mmol·L-1 DTPA,pH < 1)3 mL和少量石英砂,冰浴研磨至匀浆。在4 ℃ 11 000 r·min-1下离心15 min,收集上清液定容至5 mL,4 ℃冷藏,按Keltjens等[21]的5,5′-二硫代双(2-硝基苯甲酸)(DTNB)比色法测定NPT含量。在研钵内放入1 g鲜样组织,加入预冷的50 g·L-1三氯乙酸(TCA)3 mL和少量石英砂,冰浴研磨至匀浆,按上述方法离心并收集上层清液,测定GSH含量。试验结果均为3次重复试验的平均值。植物螯合肽(PCs)含量的测定:
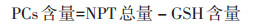
|
(1) |
准确称取一定量的植物样品粉末和已蒸干浓缩的不同亚细胞组分,分别用HNO3和H2O2(V:V=2:1)在电热板上消解直至溶液澄清,纯水定容后用石墨炉原子吸收光谱法测定样品中V含量(GFAAS,nov AA 400P,Analytik Jena AG)。试验结果为3次重复试验的平均值,采用生物组分分析标准参考物质菠菜(GBW10015,GSB-6)和柑橘叶(GBW10020,GSB-11)进行样品中V的质量控制。
1.4 数据分析转运系数(Translocation factor,TF)和富集系数(Bioconcentration factor,BF)计算公式分别为:

|
(2) |
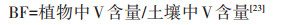
|
(3) |
使用DPS数据处理系统和Microsoft Excel 2010进行统计分析,并用Duncan多重性方法比较分析同一品种不同处理间的差异显著性。所得结果表示为平均值±标准偏差(平均值±SD,n=3)。
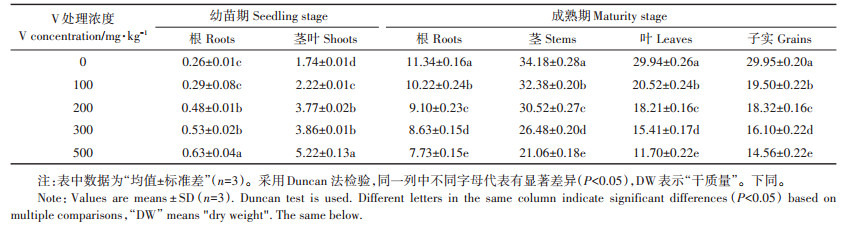
2 结果与分析 2.1 玉米植株的生物量如表 2所示,玉米植株的叶片占植株生物量的11.7%~88.5%,茎占21.0%~34.2%,子实占14.6%~29.9%,根占10.8%~14.1%。不同生长期玉米植株各器官生物量随V的胁迫浓度增大变化趋势不同。V处理浓度增大,幼苗期玉米植株各器官生物量逐渐增加,成熟期生物量则呈下降趋势。当V浓度在100~500 mg×kg-1,与对照相比较,幼苗期植物根和茎叶分别增加8.5%~138.0%和27.2%~126.6%,而成熟期的植物根、茎、叶和子实分别下降9.9%~31.8%、5.2%~38.4%、31.5%~60.9%和34.7%~51.4%。
|
|
表 2 不同V处理对玉米植株生物量分配的影响(g,干质量) Table 2 Dry biomass of different parts of maize(Zea mays L.)seedlings under V stress (g, DW) |
由表 3结果可见,在不同V浓度胁迫下,幼苗期甜玉米各部分V积累量依次为:根 > 茎叶,成熟期则为:根 > 叶 > 茎 > > 子实。多数V积累在根部,且根部V含量远高于地上部。如图 1所示,根部V含量约占总量的74.8%~95.6%,茎叶部V含量约占总量的4.4%~24.6%,子实中V含量约占0.1%~0.6%,表明玉米植株将V从地下部向地上部运输的能力较弱。随着V浓度增大,植株各部分V含量均呈现上升趋势,但根部增幅明显大于茎叶。土壤经过500 mg·kg-1 V处理后,与对照相比较,幼苗的根和茎叶中V含量显著增加1 635.7%和118.8%,成熟期的根、茎、叶和子实V含量增加3 342.6%、1 681.5%、753.3%和403.3%。同一生长期土壤经过不同浓度V处理,植物根部V含量具有显著性差异(P < 0.05)。此外,土壤中V浓度较低(V≤100 mg·kg-1)并不明显影响幼苗期茎叶、成熟期叶和子实中V含量。
|
|
表 3 不同生长时期玉米根、茎和叶中V含量(mg·kg-1 DW) Table 3 V content in stems, leaves and roots of maize(Zea mays L.)plant in different growth periods(mg·kg-1 DW) |

|
图 1 玉米植株器官中V含量所占比例 Figure 1 Proportion of V content in organs of mazie(Zea mays L.)crops |
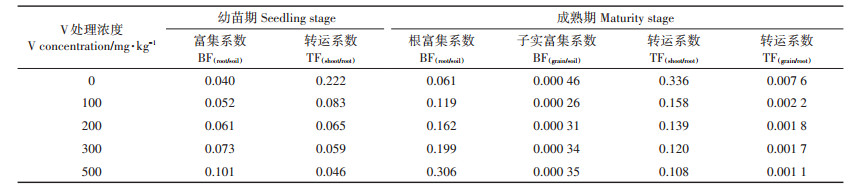
如表 4所示,随着土壤中V浓度增加,各生长期玉米植株V的富集系数(BF)逐渐增大,但转运系数(TF)呈下降趋势。成熟期的BF(root/soil)明显高于幼苗期,表明根系在生长过程中积累了更多V。当土壤中的V浓度为0 mg·kg-1,BF(grain/soil)的最大值仅有0.000 46,随着土壤V浓度增加,BF(grain/soil)值先下降后上升,但始终低于对照,可见子实对V富集能力很小。在玉米生长期,不同V浓度胁迫时根到茎的TF(shoot/root)和根到子实的TF(grain/root)差异较大。对于V处理过的土壤,幼苗期和成熟期的根到茎叶的TF值[TF(shoot/root)]以及成熟期的根到子实的TF值[TF(grain/root)],均明显小于对照的TF值,随着V处理浓度的增加,玉米茎叶和子实的TF显著下降。土壤V浓度从100 mg·kg-1到500 mg·kg-1,与对照组相比,玉米幼苗期的TF(shoot/root)值下降了62.4%和79.2%,成熟期的TF(shoot/root)下降53.1%和68.1%,并且TF(grain/root)值较小(均小于0.01),表明V从玉米根到子实的转运极少。可见,随着V胁迫浓度增大,玉米植株积累V的能力增强,由于植物根部固持V的能力增强,减少了V从根部向地上部分的运输,转运能力逐渐降低。
|
|
表 4 玉米不同生长期V的生物富集系数和转运系数 Table 4 Bioconcentration factor (BF)and translocation factor (TF)of V in different growth periods of maize(Zea mays L.)plant |
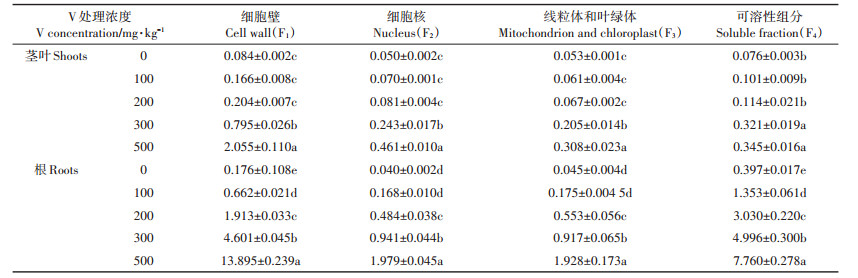
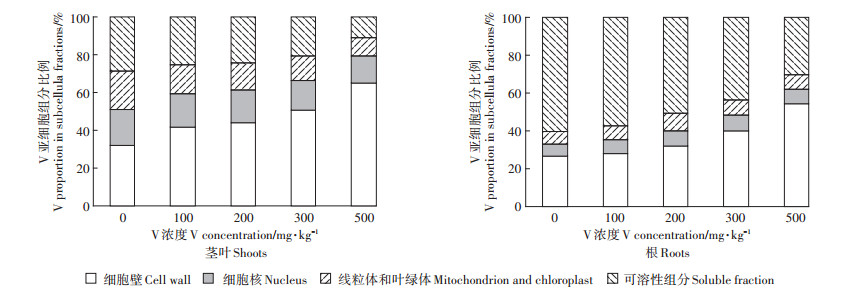
V在玉米幼苗的亚细胞分布结果如表 5、图 2所示。玉米植株茎叶中V主要分布在细胞壁(F1)和可溶性组分(F4),分别占总量的31.94%~64.86%和10.89%~28.82%,在细胞核(F2)和叶绿体、线粒体组分(F3)中分配较少,仅占14.54%~19.07%和9.71%~20.17%。随着V胁迫浓度增大,玉米茎叶中V在F1的含量明显增加,而在F4中的含量显著降低,F2和F3的含量变化较小。
|
|
表 5 玉米幼苗茎叶和根亚细胞组分中的V含量(mg·kg−1鲜质量) Table 5 V content in the subcellular fractions in shoots and roots of maize(Zea mays L.)seedlings under V stress (mg·kg−1 FW) |
|
图 2 玉米幼苗中V的亚细胞组分分配比例 Figure 2 Percentages of subcellular fractions of V in maize(Zea mays L.)seedlings |
植物根部V的亚细胞组分分配与地上部明显不同,升高的V浓度被可溶性组分(F4)吸收,其次是细胞壁(F1),F1和F4之和占总量的82.66%~87.02%。随着V胁迫浓度增加,根中V在F1和F4中的分配变化与茎叶相同,当V浓度从100 mg·kg-1增加到500 mg· kg-1,F1的比例从28.06%增加到54.36%,而F4的比例从57.37%降到30.36%,F2和F3的比例变化不大,二者之和占总量的12.98%~17.34%。
2.4 V胁迫对玉米中NPT、GSH和PCs含量的影响玉米幼苗中非蛋白巯基(NPT)含量对比如图 3(A)所示,可以看出,随着V浓度增大,茎叶和根中NPT含量均为先上升后下降,且茎叶中NPT含量增加明显,根部变化平缓。茎叶和根中NPT在V浓度为300 mg·kg-1时达最大值,分别为2.47 μmol·g-1和1.61 μmol·g-1,相比于对照增加了32.88%和20.24%,当V浓度大于300 mg·kg-1,NPT含量下降,仍然高于对照,茎叶比对照增加了5.76%,而根系与对照比较没有显著性差异(P < 0.05)。

|
图 3 V对玉米幼苗茎叶和根中NPT、GSH和PCs含量的影响 Figure 3 Effect of V on the concentrations of the NPT, GSH and PCs in shoots and roots of maize(Zea mays L.)seedlings |
从图 3(B)中可以看出,随着V胁迫浓度增大,玉米幼苗茎叶和根中谷胱甘肽(GSH)含量逐渐降低,在V浓度为100 mg·kg-1和500 mg·kg-1,与对照相比较,茎叶中GSH含量下降了16.7%和82.6%,根中GSH含量下降了13.1%和38.3%,茎和根的平均降幅分别为45.9%和23.6%。不同V浓度处理下,玉米幼苗各部分GSH含量差异达显著性水平(P < 0.05)。与NPT不同,根部GSH含量高于地上部。
同NPT相似,随着V胁迫浓度增加,植物螯合肽(PCs)含量呈先增加后降低的变化趋势(图 3C),V胁迫使得PCs主要积累在玉米的茎叶部。在V浓度为300 mg·kg-1,茎叶和根中PCs含量达最大值1.88 μmol·g-1和0.54 μmol·g-1,相比于对照增加207.9%和600.2%,可见,根系PCs含量的增幅远大于茎叶(P < 0.05)。当V浓度大于300 mg·kg-1,PCs含量下降,但仍远高于对照。茎叶中PCs含量远高于根中PCs含量,各V处理下玉米茎叶和根中PCs含量存在显著性差异(P < 0.05)。
3 讨论植物生物量一定程度上反映植物的生长活力,常作为敏感植物对逆境的响应参数并用于测量植物对金属胁迫的耐性。和Tian等[16]研究的V对大白菜生长的影响结果相似,在玉米幼苗期,植物生命力旺盛,适量外源V激发了自身的防御系统,并刺激了新陈代谢机能,促进了作物生长,所以,在一定范围内随着V胁迫浓度增大,玉米植株各器官生物量增加。这种影响也可能是土壤施加外源V时,由于加入的钒酸铵的量增加,土壤中有效氮含量升高,而苗期土壤钒的生物有效性较低,因此随着土壤V浓度增加,玉米植株各器官生物量增加。当玉米植株发育到了成熟期,子实迅速生成,成为光合产物的运输和转移中心,干质量不再增加(表 3)。此时,植物积累V含量超过自身的防御能力,会伤害植物细胞结构,破坏其生理代谢功能,所以,V胁迫明显抑制植株生长发育,植物叶片出现卷缩和发黄,生物量显著下降,这与先前Imtiaz等[13]研究V使鹰嘴豆生物量明显下降相同。表明在逆境下,重金属胁迫激活了植物代谢系统,加速了自身对重金属的吸收,反过来又抑制了植物的代谢活动,对植物产生毒害作用[24]。
玉米植物中V的分布(表 3、图 1)表明,玉米不同器官对V的积累能力不同。随着V胁迫浓度增加,植物根系对V的吸收显著增加,使得V在植物体内的分布规律表现为,在新陈代谢旺盛的器官(如根部)蓄积量较大,而在营养储存器官(如茎部、叶片)蓄积量则较少,这与Yang等[15]和Qian等[25]研究结果一致。玉米根中V含量较高,可能与V进入玉米作物根皮层细胞后,与细胞中的蛋白质、多糖类和核酸等结合形成稳定的大分子螯合物或不稳定性有机大分子而沉积有关,根已被证明是一个屏障,限制了金属从根运输到茎叶,从而减少了V对玉米茎叶的伤害[14]。随着V胁迫浓度升高,富集系数BF值增加,转运系数TF(shoot/root)和TF(grain/root)值明显下降,BF和TF值均小于0.5,可见玉米植株对V的富集能力较低,且有较强的阻止V从根系向地上部转运的能力,缓解了V对植物的毒害。玉米将V从根部转运到子实中的能力极低[TF(grain/root) < 0.01],说明玉米根系对V的固持可以降低V通过食物链对人体造成的危害。事实证明,根中V含量高于其他组织中的V含量是玉米的重要耐受机制。与非耐性植物相比,耐金属植物的根中总是积累较高浓度的有毒金属,而茎叶中则较低[26],所以玉米是V的耐性植物。
金属在植物组织中的选择性分布,对于植物是否受到有毒金属损伤具有重要的意义。玉米幼苗茎叶和根中V大多数积累在细胞壁,其次是可溶性组分,两者占总V的65%(茎叶)和85%(根)以上,表明细胞壁(F1)和可溶性组分(F4)是主要的V积累位点,它们对玉米作物的耐受性起重要作用。这与关于Cd在生菜和萝卜中亚细胞分布报道一致[27-28]。在亚细胞水平上,细胞壁沉积和液泡区域化被认为是最重要的两种重金属解毒机制[26, 29],V在根和茎叶的细胞壁组分中比例较高(图 2,F1比例高达50%以上),表明细胞壁是储存V的重要部位,能束缚V并限制跨膜转运,以维持植物细胞中正常生理活动。当细胞壁中结合位点达饱和后,V将进入植物细胞和液泡中[30]。液泡中含有多种蛋白质、有机酸和有机碱。它们可以与V结合形成螯合物将V限制在液泡中[31-32],从而降低过量V对植物的影响。试验还发现,在高浓度V胁迫下,植物细胞壁中V比例显著增加,可溶性组分比例减少,两组分比例之和保持稳定(图 2),这进一步说明,大部分V可能与细胞壁结合或积聚在空泡中,使得细胞质的区隔化作用增强,可以有效抵御高浓度V进入细胞器组分。这既有利于满足植物体细胞对微量元素V的需求,又减轻了过量V对细胞器的伤害,从而保证维持植物细胞的正常生理代谢功能[6]。前述可知,V在玉米幼苗根中积累的比例很高(图 1,占V总量的74.8%~95.6%),而根细胞中,以细胞壁(F1)和可溶性组分(F4)为主要组分的亚细胞分布保留了大部分V(图 2,占根中V总量的82.66%~87.02%),这就抵抗了V从根向茎叶的转运,有助于减少V对植物的伤害。所以,V在玉米植物中的亚细胞分布规律体现了玉米幼苗对V的耐性反应。
巯基化合物在植物的金属耐受机制中起重要作用[26]。NPT的合成是由细胞中的各种金属和准金属诱导的,主要通过螯合金属离子来实现防御金属毒性[33],玉米幼苗内不同部位NPT含量反映植物对V的耐受能力。Mahdavian等[34]发现,Pb暴露能诱导骆驼蓬的NPT显著增加。随着V胁迫浓度增加,玉米幼苗根和茎叶中NPT含量增加,而茎叶中NPT增加得更多,茎叶部NPT含量显著高于根部,可见,V显著促进玉米茎叶部非蛋白巯基化合物的合成,以修复和保护蛋白质的-SH基团免受金属毒性而不被氧化,减轻重金属对植物的毒害。
GSH作为植物中最重要的非蛋白巯基化合物和最丰富低分子量多肽,总是直接或间接地(作为酶和PCs的底物)参与植物抗逆性,它是细胞中关键非酶抗氧化剂,能清除几种潜在的有毒ROS(例如O2-·或·OH),并帮助细胞应对由氧化所引起的氧化应激[35]。在金属毒性情况下,有毒金属离子具有高度活性并且与生物分子-SH基团具有高亲和力,细胞通过合成植物螯合素PCs,减少细胞质中游离金属离子浓度来保护基本生物分子(如蛋白质)的- SH基团[26, 36-37]。本研究中,在V暴露下玉米幼苗中GSH降低,而PCs含量显著增加,植物消耗大量的GSH来合成PCs用于解毒,显然,GSH在预防V损伤中起重要作用。尽管由于GSH合成的减少而更多形成了可与V螯合的PCs,但随着V胁迫浓度增加(> 500 mg· kg-1),会使GSH减少到足以对其他细胞过程产生有害影响,这将对植物存在潜在危害,最终表现为抑制生长。由于茎叶有比根更高的NPT浓度以消耗GSH浓度,因此在玉米内部对V具有更高耐受性可归因于PCs对V的螯合能力增强。可见,在玉米植物的解毒机制中,在V胁迫下PCs似乎比GSH发挥更强的作用。
4 结论(1)玉米植株根部积累V含量显著高于茎叶部,大大降低了V由根部向茎叶和子实的转运,避免了过量V对植物的损伤。
(2)在外源V的胁迫下,玉米体内V在细胞壁沉积和液泡区室化作用,以及NPT、GSH和PCs对V的螯合,是重要的解毒机制。
(3)玉米植株能将吸收的V隔离在植物根部,未表现出明显的中毒症状,玉米是V的耐性植物。
| [1] |
李江遐, 张军, 马友华, 等. 硅对镉胁迫条件下两个水稻品种镉亚细胞分布、非蛋白巯基物质含量的影响[J]. 农业环境科学学报, 2018, 37(6): 1066-1071. LI Jiang-xia, ZHANG Jun, MA You-hua, et al. Effects of silicon on cadmium subcellular distribution and non-protein thiol matrix content of two rice varieties under cadmium stress[J]. Journal of Agro-Environment Science, 2018, 37(6): 1066-1071. |
| [2] |
Mwamba T M, Li L, Gill R A, et al. Differential subcellular distribution and chemical forms of cadmium and copper in Brassica napus[J]. Ecotox Environ Safe, 2016, 134: 239-249. DOI:10.1016/j.ecoenv.2016.08.021 |
| [3] |
Zhang X F, Hu Z H, Yan T X, et al. Arbuscular mycorrhizal fungi alleviate Cd phytotoxicity by altering Cd subcellular distribution and chemical forms in Zea mays[J]. Ecotoxicology and Environmental Safety, 2019, 171: 352-360. DOI:10.1016/j.ecoenv.2018.12.097 |
| [4] |
司江英, 赵海涛, 汪晓丽, 等. 不同铜水平下玉米细胞内铜的分布和化学形态的研究[J]. 农业环境科学学报, 2008, 27(2): 452-456. SI Jiang-ying, ZHAO Hai-tao, WANG Xiao-li, et al. Effects of different copper levels on subcellular distribution and chemical forms of copper in maize cells[J]. Journal of Agro-Environment Science, 2008, 27(2): 452-456. DOI:10.3321/j.issn:1672-2043.2008.02.009 |
| [5] |
沈奕昕, 李元, 祖艳群, 等. 不同玉米(Zea mays L.)品种根细胞壁多糖对Pb胁迫的响应[J]. 生态环境学报, 2018, 27(5): 950-956. SHEN Yi-xin, LI Yuan, ZU Yan-qun, et al. Responses of polysaccharide in root cell wall of maize(Zea mays L.)cultivars to Pb stress[J]. Ecology and Environmental Sciences, 2018, 27(5): 950-956. |
| [6] |
Hou M, Hu C, Xiong L, et al. Tissue accumulation and subcellular distribution of vanadium in Brassica juncea and Brassica chinensis[J]. Microchemical Journal, 2013, 110: 575-578. DOI:10.1016/j.microc.2013.07.005 |
| [7] |
Song W Y, Mendoza-Cózatl D G, Lee Y, et al. Phytochelatin-metal (loid)transport into vacuoles shows different substrate preferences in barley and Arabidopsis[J]. Plant, Cell & Environment, 2014, 37(5): 1192-1201. |
| [8] |
Aborode F A, Raab A, Voigt M, et al. The importance of glutathione and phytochelatins on the selenite and arsenate detoxification in Arabidopsis thaliana[J]. Journal of Environmental Sciences, 2016, 49: 150-161. DOI:10.1016/j.jes.2016.08.009 |
| [9] |
李冬琴, 王丽丽, 李智鸣, 等. 镉胁迫对高低积累型水稻幼苗非蛋白巯基含量的影响[J]. 农业环境科学学报, 2019, 38(12): 2697-2704. LI Dong-qin, WANG Li-li, LI Zhi-ming, et al. Effects of cadmium stress on non-protein sulfhydryl content of high and low accumulation rice seedlings[J]. Journal of Agro-Environment Science, 2019, 38(12): 2697-2704. DOI:10.11654/jaes.2019-1086 |
| [10] |
Sánchez T, Martín S, Saco D. Some responses of two Nicotiana tabacum L. cultivars exposed to vanadium[J]. Journal of Plant Nutrition, 2014, 37(5): 777-784. DOI:10.1080/01904167.2013.873456 |
| [11] |
Hou M, Li M, Yang X, et al. Responses of nonprotein thiols to stress of vanadium and mercury in maize(Zea mays L.)seedlings[J]. Bulletin of Environmental Contamination and Toxicology, 2019, 102(3): 425-431. DOI:10.1007/s00128-019-02553-w |
| [12] |
Larsson M A, Baken S, Gustafsson J P, et al. Vanadium bioavailability and toxicity to soil microorganisms and plants[J]. Environmental Toxicology and Chemistry, 2013, 32(10): 2266-2273. DOI:10.1002/etc.2322 |
| [13] |
Imtiaz M, Tu S, Xie Z, et al. Growth, V uptake, and antioxidant enzymes responses of chickpea(Cicer arietinum L.)genotypes under vanadium stress[J]. Plant and Soil, 2015, 390(1/2): 17-27. |
| [14] |
Saco D, Martín S, San Jose P. Vanadium distribution in roots and leaves of Phaseolus vulgaris:Morphological and ultrastructural effects[J]. Biologia Plantarum, 2013, 57(1): 128-132. DOI:10.1007/s10535-012-0133-z |
| [15] |
Yang J, Wang M, Jia Y, et al. Toxicity of vanadium in soil on soybean at different growth stages[J]. Environmental Pollution, 2017, 231: 48-58. DOI:10.1016/j.envpol.2017.07.075 |
| [16] |
Tian L, Yang J, Alewell C, et al. Speciation of vanadium in Chinese cabbage(Brassica rapa L.)and soils in response to different levels of vanadium in soils and cabbage growth[J]. Chemosphere, 2014, 111: 89-95. DOI:10.1016/j.chemosphere.2014.03.051 |
| [17] |
Yang J, Teng Y, Wu J, et al. Current status and associated human health risk of vanadium in soil in China[J]. Chemosphere, 2017, 171: 635-643. DOI:10.1016/j.chemosphere.2016.12.058 |
| [18] |
中国环境监测总站. 中国土壤元素背景值[M]. 北京: 环境科学出版社, 1990. China National Environmental Monitoring Station. Background value of soil elements in China[M]. Beijing: Environmental Science Press, 1990. |
| [19] |
侯明, 杨心瀚, 霍岩, 等. 钒在不同品种玉米幼苗中的亚细胞分布和动态变化[J]. 生态环境学报, 2019, 28(11): 2299-2306. HOU Ming, YANG Xin-han, HUO Yan, et al. Subcellular distribution and dynamic changes of vanadium in different maize varieties seedlings[J]. Ecology and Environmental Sciences, 2019, 28(11): 2299-2306. |
| [20] |
刘光崧, 蒋能慧, 张连第, 等. 土壤理化分析与剖面描述[M]. 北京: 中国标准出版社, 1996. LIU Guang-song, JIANG Neng-hui, ZHANG Lian-di, et al. Soil physical and chemical analysis[M]. Beijing: China Standard Press, 1996. |
| [21] |
Keltjens W G, Van Beusichem M L. Phytochelatins as biomarkers for heavy metal stress in maize(Zea mays L.)and wheat(Triticum aestivum L.):Combined effects of copper and cadmium[J]. Plant and Soil, 1998, 203(1): 119-126. DOI:10.1023/A:1004373700581 |
| [22] |
Tanhan P, Kruatrachue M, Pokethitiyook P, et al. Uptake and accumulation of cadmium, lead and zinc by Siam weed[Chromolaena odorata (L.)King & Robinson][J]. Chemosphere, 2007, 68(2): 323-329. DOI:10.1016/j.chemosphere.2006.12.064 |
| [23] |
Tiwari K K, Singh N K, Patel M P, et al. Metal contamination of soil and translocation in vegetables growing under industrial wastewater irrigated agricultural field of Vadodara, Gujarat, India[J]. Ecotoxicology and Environmental Safety, 2011, 74(6): 1670-1677. DOI:10.1016/j.ecoenv.2011.04.029 |
| [24] |
Patra M, Bhowmik N, Bandopadhyay B, et al. Comparison of mercury, lead and arsenic with respect to genotoxic effects on plant systems and the development of genetic tolerance[J]. Environmental and Experimental Botany, 2004, 52(3): 199-223. DOI:10.1016/j.envexpbot.2004.02.009 |
| [25] |
Qian Y, Gallagher F J, Feng H, et al. Vanadium uptake and translocation in dominant plant species on an urban coastal brownfield site[J]. Science of the Total Environment, 2014, 476: 696-704. |
| [26] |
Weng B, Xie X, Weiss D J, et al. Kandelia obovata(S. L.)Yong tolerance mechanisms to cadmium:Subcellular distribution, chemical forms and thiol pools[J]. Marine Pollution Bulletin, 2012, 64(11): 2453-2460. DOI:10.1016/j.marpolbul.2012.07.047 |
| [27] |
贾月慧, 韩莹琰, 刘杰, 等. 生菜对镉胁迫的生理响应及体内镉的累积分布[J]. 农业环境科学学报, 2018, 37(8): 1610-1618. JIA Yue-hui, HAN Ying-yan, LIU Jie, et al. The physiological response of lettuce to cadmium stress and the accumulation and distribution of cadmium in the body[J]. Journal of Agro-Environment Science, 2018, 37(8): 1610-1618. |
| [28] |
Xin J, Zhao X H, Tan Q L, et al. Comparison of cadmium absorption, translocation, subcellular distribution and chemical forms between two radish cultivars(Raphanus sativus L.)[J]. Ecotoxicology and Environmental Safety, 2017, 145: 258-265. DOI:10.1016/j.ecoenv.2017.07.042 |
| [29] |
Zhang H Z, Guo Q J, Yang J X, et al. Subcellular cadmium distribution and antioxidant enzymatic activities in the leaves of two castor (Ricinus communis L.)cultivars exhibit differences in Cd accumulation[J]. Ecotoxicology and Environmental Safety, 2015, 120: 184-192. DOI:10.1016/j.ecoenv.2015.06.003 |
| [30] |
Rodríguez-Rosales M P, Jiang X, Gálvez F J, et al. Overexpression of the tomato K+/H+ antiporter LeNHX2 confers salt tolerance by improving potassium compartmentalization[J]. New Phytologist, 2008, 179(2): 366-377. DOI:10.1111/j.1469-8137.2008.02461.x |
| [31] |
Zhao Y, Wu J, Shang D, et al. Subcellular distribution and chemical forms of cadmium in the edible seaweed, Porphyra yezoensis[J]. Food Chemistry, 2015, 168: 48-54. DOI:10.1016/j.foodchem.2014.07.054 |
| [32] |
Fu Q, Lai J, Tao Z, et al. Characterizations of bio-accumulations, subcellular distribution and chemical forms of cesium in Brassica juncea, and Vicia faba[J]. Journal of Environmental Radioactivity, 2016, 154: 52-59. DOI:10.1016/j.jenvrad.2016.01.016 |
| [33] |
Wei Z, Wong J W, Chen D. Speciation of heavy metal binding nonprotein thiols in Agropyron elongatum by size-exclusion HPLC-ICPMS[J]. Microchemical Journal, 2003, 74(3): 207-213. DOI:10.1016/S0026-265X(03)00002-X |
| [34] |
Mahdavian K, Ghaderian S M, Schat H. Pb accumulation, Pb tolerance, antioxidants, thiols, and organic acids in metallicolous and nonmetallicolous Peganum harmala L. under Pb exposure[J]. Environmental and Experimental Botany, 2016, 126: 21-31. DOI:10.1016/j.envexpbot.2016.01.010 |
| [35] |
Bhoomika K, Pyngrope S, Dubey R S. Effect of aluminum on protein oxidation, non-protein thiols and protease activity in seedlings of rice cultivars differing in aluminum tolerance[J]. Journal of Plant Physiology, 2014, 171(7): 497-508. DOI:10.1016/j.jplph.2013.12.009 |
| [36] |
Sun Q, Wang X R, Ding S M, et al. Effects of interactions between cadmium and zinc on phytochelatin and glutathione production in wheat(Triticum aestivum L.)[J]. Environmental Toxicology:An International Journal, 2005, 20(2): 195-201. DOI:10.1002/tox.20095 |
| [37] |
Vázquez S, Goldsbrough P, Carpena R O. Comparative analysis of the contribution of phytochelatins to cadmium and arsenic tolerance in soybean and white lupin[J]. Plant Physiology and Biochemistry, 2009, 47(1): 63-67. DOI:10.1016/j.plaphy.2008.09.010 |
 2020, Vol. 39
2020, Vol. 39