2. 南开大学环境科学与工程学院, 环境污染过程与基准教育部重点实验室, 天津市城市生态环境修复与污染防治重点实验室, 天津 300071
2. Key Laboratory of Pollution Processes and Environmental Criteria(Ministry of Education), Tianjin Key Laboratory of Environmental Remediation and Pollution Control, College of Environmental Science and Engineering, Nankai University, Tianjin, 300071, China
近年来,含砷灌溉水的使用导致砷污染农田大面积出现,农田中的砷进一步通过食物链传递对人体健康造成危害[1-2]。砷的生物毒性不仅取决于生物体中砷的含量,而且与砷的形态密切相关,砷可分为无机砷、有机砷和单质砷,其中单质砷溶解度较低,不易被人体吸收[3],而无机砷的毒性大于有机砷[1]。在土壤与水环境中,可溶性砷形态主要为砷酸盐As(Ⅴ)和亚砷酸盐As(Ⅲ),在有氧条件下,As(Ⅴ)占主导地位[4],因此本研究选取砷酸盐作为主要研究对象。生菜具有重要的食用价值和药用价值,现已成为设施农业和植物工厂的主要种植对象之一[5]。本研究选取生菜作为研究对象,采用可以排除复杂土壤环境影响的水培方式[6],从砷酸盐的生菜积累以及对其安全品质影响方面开展研究。
腐植酸(Humic acid,HA)是一种天然存在的高络合和聚合有机物,其丰富的含氧官能团(例如羧酸、酚羟基和醌官能团[7])可以络合许多金属[8]。本研究所采用的腐植酸中的黄腐酸(富里酸)含量≥90%,其分子结构中存在含氧活性基团,如羧基和酚羟基,同时还含有杂氮环,所以有离子交换性和与金属离子形成螯合物的能力,另外含有的醌基和半醌基具有一定的氧化还原能力[9]。黄腐酸能使作物根系发达,次生根数量增多,提高作物吸水力,并能降低叶面蒸腾作用,提高叶绿素含量,促进光合作用[10]。此外,腐植酸还可以提高植物肥力,改善植物生长[11-12]。因此,本研究进一步选取腐植酸对砷的植物毒性进行调节,旨在从生菜中砷的安全限量的角度,探究蔬菜中砷的累积规律以及砷和腐植酸对蔬菜的毒性调节作用,为蔬菜质量安全及品质改善提供数据,对修订相关标准以及蔬菜的安全生产具有指导意义。
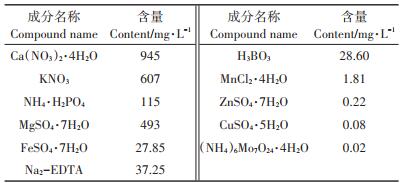
1 材料与方法 1.1 生菜的培养及染毒本研究选取玻璃生菜Lettuce(Iceberg L.)作为研究对象,采用蛭石将生菜种子培育至四叶一心后,移入水培盆中,每个水培盆种植生菜12株。各水培盆中均装有5 L的Hoagland营养液,成分组成见表 1。用NaOH调节pH为6.0,并及时补充蒸馏水至5 L水位线,定期用充氧泵进行曝气处理,定期测定培养液中砷含量的变化。
|
|
表 1 Hoagland营养液的成分表 Table 1 Formula of Hoagland nutrient solution |
为考察不同砷酸盐As(Ⅴ)初始添加浓度对生菜生长的影响,分别设置0.5、1、5、10、30 mg·L-1的砷酸盐浓度(分别表示为V-0.5、V-1、V-5、V-10、V-30,V代表五价砷,由于V-30处理组在生菜生长至第10 d全部死亡,因此不再作分析),同时设置空白对照组(CK),以及不添加植物空白对照组(NP)。
为研究腐植酸对生菜砷胁迫的影响,选取V-10处理组,分别添加1、5、10 mg·L-1的腐植酸(分别表示为V10HA1、V10HA5、V10HA10,HA代表腐植酸),同时设置腐植酸的空白添加实验,在不添加砷的营养液中分别添加腐植酸5、10 mg·L-1(分别表示为CKHA5、CKHA10)。其中腐植酸分子式为C9H9NO6,CAS:1415-93-6,黄腐酸(富里酸)含量≥90%。为考察不同生长期生菜生长表现,分别在生菜生长早期(生长至第10 d,Day10)、中期(生长至第20 d,快速生长期,Day20)、收获期(生长至第30 d,生长趋于稳定,Day30)时,随机选取生菜样品3株,采用便携式叶绿素仪(SPAD-502,Minolta Camera,Osaka,Japan)对应测定叶片的SPAD(Soil and plant analyzer develotrnent)值,每个处理组测定30次取平均值。采集生菜样品,分别进行植物鲜质量、株高、根长的测定。
1.2 pH、砷总量及砷形态的测定方法染毒前,统一调节各实验组中培养液pH为6.0。在生菜3个对应生长期,进行pH测定,并进一步采集10 mL培养液,进行适当稀释后,测定培养液中的砷总量及形态。
在生菜不同生长期,从每个处理组中随机采集生菜样品3株,使用陶瓷剪刀将其剪碎并混匀。同时各植株分别称取根、茎、叶样品2 g,每个样品制备两份,其中一份用于生菜中砷形态的测定[13],将样品研磨后加入10 mL提取剂(磷酸缓冲盐:2 mmol·L-1磷酸氢二铵和0.2 mmol· L-1 EDTA),250 r·min-1振荡20 min,8 000 r·min-1离心5 min,上清液经0.45 μm水系滤膜过滤后,上机测定。另外一份置于消解管中,加入10 mL浓硝酸过夜,置于电热消解仪上进行消解,升温至120 ℃加热0.5 h,后升温至150 ℃继续加热3 h,再调至170 ℃赶酸至0.5 mL,待消煮管内液体冷却后定容至10 mL,上机测定。
溶液及生菜中砷形态的测定采用HPLC-ICP-MS (HPLC:Agilent1100;ICP-MS:Agilent Technologies 7700 Series),流动相为20 mmol·L-1柠檬酸+5 mmol· L-1己烷磺酸钠,采用NaOH调节pH为4.3,进样量为20 μL,流速为1 mL·min-1,测定过程中,通过添加质控、监控点以及复测方式进行质量控制。
1.3 生菜品质指标测定方法为研究不同处理组在生菜快速生长期营养品质变化,采用维生素C、可溶性糖、硝酸盐、总酚测定试剂盒进行生菜品质指标的测定,试剂盒均由南京建成生物有限公司提供。氨基酸的测定采用Sykam S433D型氨基酸自动分析仪进行,氨基酸的提取采用王丽[14]的方法。
1.4 数据统计分析除另有说明外,每个实验设置3个平行。采用SPSS 22.0对数据进行单因素方差分析,通过T检验,当P < 0.05时,认为具有显著差异。同时采用SIMCA 14.1软件对氨基酸差异分布进行PLS-DA分析。
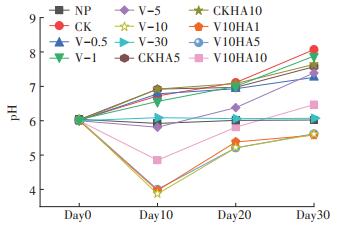
2 结果与讨论 2.1 不同处理组培养液pH的变化如图 1所示,NP组pH在各时期基本维持稳定。当移入生菜后,CK中培养液的pH呈上升趋势,当生长至第30 d时,溶液中的pH达到8.07,增加了34.1%。有研究指出,当施用硝态氮肥时,植物根系吸收的氮素以硝态氮为主,植物根际会释放OH-、HCO3-,导致根际环境pH升高[15]。当外源As(Ⅴ)浓度在1 mg·L-1以上时,溶液的pH在不同生长时期均表现出明显的下降,说明在As(Ⅴ)的胁迫下,生菜体内产酸代谢能力增强,而当溶液中As(Ⅴ)浓度达到10 mg· L-1时,溶液中pH在生菜的各生长期均下降至最低,在生菜生长至第10 d时达到3.87,然后随着生菜的生长和适应能力的增强,pH在生菜生长中、后期开始回升至5.60。有研究指出,在外界环境胁迫条件下,大部分植物会分泌有机酸,这被认为是对不利条件的适应[16]。当As浓度达到30 mg·L-1时,生菜在染毒至第10 d出现了干枯死亡现象,溶液中pH与NP组一致,没有明显变化。
|
图 1 生菜培养液的pH变化 Figure 1 The change of pH of culture solution of lettuce |
同时,在生菜的空白溶液中添加腐植酸后,溶液的pH变化与不添加腐植酸的CK处理中pH变化趋势基本相同,说明单纯添加腐植酸并未引起溶液的pH发生显著变化,而pH的升高是由生菜自身代谢作用引起的。由图 1可看出,在As(Ⅴ)浓度为10 mg·L-1的培养液中添加腐植酸,对生菜的砷毒性具有一定的缓解作用,但是在腐植酸添加量为1、5 mg·L-1时,作用并不明显。当腐植酸的添加量为10 mg·L-1时,生菜的产酸代谢得到缓解,溶液中的pH与单纯添加10 mg·L-1的As(Ⅴ)相比,在生菜各个生长期均有明显的升高,第10 d时pH回升最明显,达到4.85。
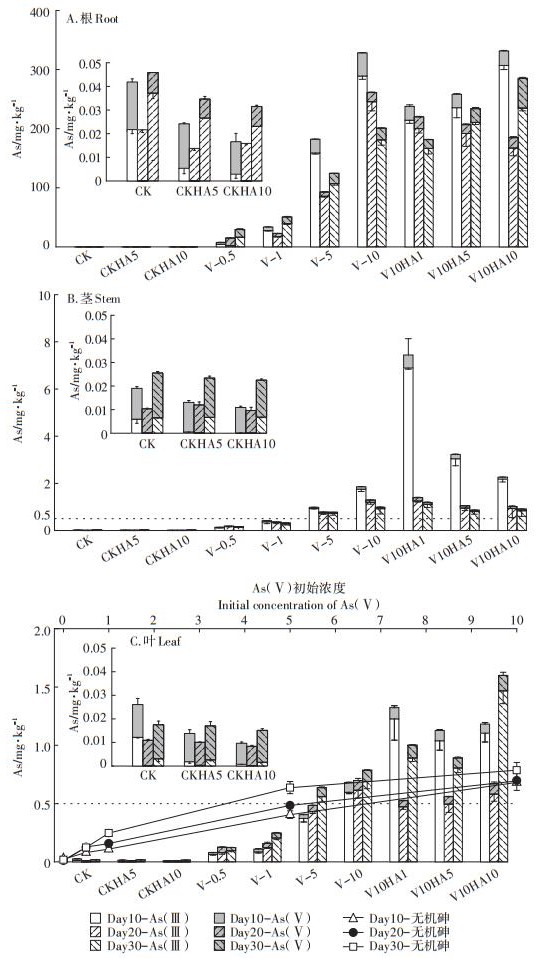
2.2 不同处理组生菜叶中砷的累积变化规律研究初始在培养液中添加不同浓度的As(Ⅴ),并在第10、第20、第30 d时对不同处理组的培养液进行测定,发现各处理组培养液中的砷主要以As(Ⅴ)存在,未检测到有机砷和As(Ⅲ)。如图 2所示,砷的积累主要集中在生菜的根部[17],其次为茎部,叶中含量最少。在As(Ⅴ)添加浓度为10 mg·L-1时,根中无机砷最高累积浓度达到328.07 mg·kg-1,不同砷酸盐处理组,生菜各组织中无机砷的含量均随着处理浓度的增加而在各生长时期呈现出不同的增加趋势。砷酸盐处理组,生菜体内砷主要是以As(Ⅲ)形态存在。有研究指出,砷酸盐As(Ⅴ)被植物根吸收后,会与富含硫醇的肽络合,从而在植物体内很容易还原成As(Ⅲ),As(Ⅲ)与含硫酰基(-SH)的化合物如植物螯合素(PC)配位,As-PC复合物被认为会储存在液泡中[18],从而减少了砷对细胞质基质及细胞器中各种生理代谢活动的影响,达到植物解毒的作用。在CK及CKHA处理组中砷主要是以As(Ⅴ)形态存在于植物中。腐植酸富含含氧官能团,可与As(Ⅴ)络合增加其植物吸收能力。从植物根、茎、叶中砷含量的结果看,腐植酸的添加降低了根中砷的积累,促进了砷向生菜茎和叶中的转运。Park等[19]研究表明,添加腐植酸增加了植物叶中Pb、Cu、Cd、Ni的积累;Xu等[20]的研究指出,腐植酸是通过增加植物细胞壁的延展性而刺激Pb2+的转运和积累。这是因为腐植酸与植物根部分泌的有机酸以及根际微生物活动的相互作用会将腐植酸的超分子结构分解为易被植物吸收的小分子单元,从而促进植物对腐植酸-重金属络合物的吸收,增加了植物对重金属的转运[21]。
|
图 2 生菜各组织中砷形态的变化 Figure 2 The changes of arsenic species in the lettuce tissues |
如图 2A所示,在0.5 mg·L-1的As(Ⅴ)添加浓度条件下,生菜根部生长早、中期主要以As(Ⅴ)吸附积累为主,到生长后期,随着植物体内砷的积累,逐渐被转化为As(Ⅲ)。生菜根部无机砷含量随着砷酸盐添加浓度的升高逐渐增加,当As(Ⅴ)浓度达到10 mg· L-1时,生菜生长早期根部无机砷含量最高可达328.07 mg·kg-1,As(Ⅴ)浓度从0.5 mg·L-1增长到10 mg·L-1时,生菜根中砷的含量由随时间增加逐渐变为随时间而减少。有研究指出当植物受砷胁迫较严重时,根部的膜转运蛋白将砷排出到外部介质中,增强植物根际As(Ⅲ)的外排能力[22]。在添加腐植酸处理组中,当腐植酸的浓度为1、5 mg·L-1时,相比V-10处理组,无机砷的含量在生菜各生长期整体呈下降趋势,但是进一步提高腐植酸的添加浓度(10 mg·L-1),对根部无机砷的积累不但没有降低作用,反而有明显的回升趋势,所以,适量的腐植酸添加可以降低根部无机砷的积累。
如图 2B所示,生菜茎部无机砷含量随着砷酸盐添加浓度的升高逐渐增加,但对于相同砷酸盐处理组,无机砷的积累均随着生菜生长呈现逐渐降低的趋势。在添加腐植酸处理组中,随着腐植酸添加浓度的增加,茎部无机砷含量在生菜各生长期均逐渐下降,在生菜生长早期,无机砷含量明显高于未添加腐植酸组,由此推断腐植酸的添加促进了茎部早期无机砷的积累,并呈现浓度依赖性,而随着生菜生长至中、后期,腐植酸的作用逐渐消失,各腐植酸处理组与未添加组无机砷含量基本保持一致。
如图 2C所示,生菜叶部无机砷含量随着砷酸盐添加浓度的升高逐渐增加,当As(Ⅴ)浓度达到10 mg·L-1时,生菜生长早期叶部无机砷积累浓度最高可达0.68 mg·kg-1。与茎部变化趋势相反,对于相同砷酸盐处理组,无机砷的积累均随着生菜生长呈现递增趋势,推断主要与茎部的无机砷向叶部转移有关。根据《食品安全国家标准食品中污染物限量》 (GB 2762—2017)[23],由图 2C可知,当As(Ⅴ)添加浓度为3.5 mg·L-1时,生菜生长晚期叶部的无机砷含量已超过国家限量标准。与茎部一致,腐植酸的添加,在生长早期均不同程度地促进了无机砷的叶部积累,最高积累量也是在腐植酸添加浓度为1 mg·L-1时,达到1.32 mg·kg-1,是未添加腐植酸组的1.94倍,而在生菜生长中期,腐植酸的添加均不同程度地降低了无机砷的积累。当腐植酸添加浓度为5 mg·L-1时,生菜叶部无机砷积累量最低为0.49 mg·kg-1,相比未添加腐植酸组降低了33.78%。但生菜生长后期,腐植酸降低叶部无机砷含量的作用消失,无机砷的积累相比生长中期随着腐植酸添加浓度的增加产生明显的增加趋势,最高达到1.60 mg·kg-1。由此推断,低于5 mg· L-1的适量腐植酸添加在生菜生长中期具有明显降低生菜叶部无机砷积累的作用,均能使生菜早期叶部无机砷含量降至限量标准附近,但是随着生菜的生长,腐植酸的作用消失,并随着腐植酸的过量添加,呈现明显的无机砷吸收积累增加趋势,腐植酸的无机砷去除作用具有时间和浓度依赖性。
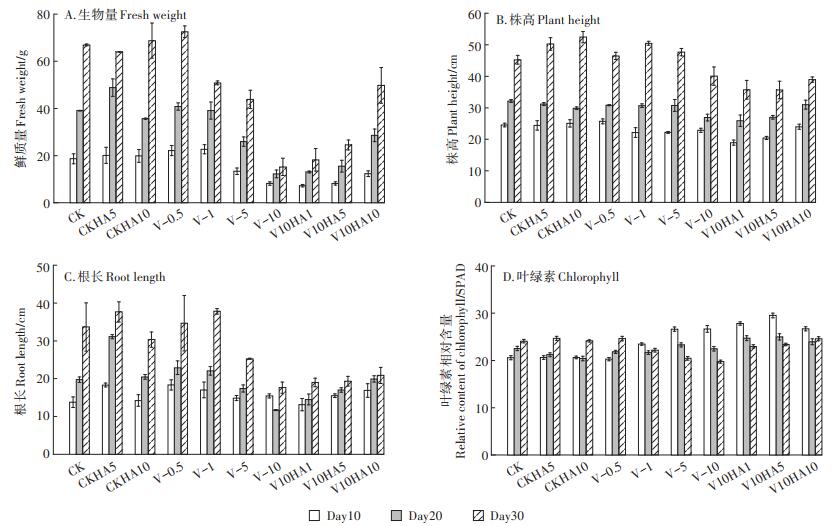
2.3 不同处理组生菜生长表现如图 3A所示,各处理组生菜鲜质量随生菜生长逐渐升高,不同处理组生菜的鲜质量随As(Ⅴ)添加浓度的升高而呈先升高后降低的趋势,当As(Ⅴ)浓度达到10 mg·L-1时,生菜生长至第10、20、30 d时的生物量较CK组分别下降了56.22%、68.66%、77.30%。CKHA与CK组的生物量并无显著差异,而在10 mg· L-1As(Ⅴ)处理组,生菜生物量随着腐植酸浓度的升高而升高,当腐植酸添加浓度为10 mg·L-1时,生菜生物量达到最大49.77 g,相比V-10增加了227.43%。说明腐植酸具有明显促进生菜生物量增加的作用,这与之前的研究报道一致[11-12]。
|
图 3 不同处理组生菜的生物量、株高、根长和叶绿素的变化 Figure 3 The fresh weight, plant height, root length and chlorophyll change of lettuce in different treatment groups |
如图 3B和图 3C所示,生菜株高、根长的变化与生物量变化趋势基本一致,相同处理组生菜株高与根长均随生菜生长逐渐增加,不同处理组生菜株高、根长与As(Ⅴ)浓度呈负相关,V-10处理组生菜的株高、根长均达到最低,生菜生长至第30 d时,株高较CK组下降了11.50%,根长较CK组下降了47.62%。CKHA与CK组的株高并无显著差异,在10 mg·L-1As(Ⅴ)处理组,腐植酸的添加对生菜株高并无显著作用,而对生菜根的生长具有不同程度的轻微促进作用。
如图 3D所示,相比CK,各处理组生菜生长早期随着As(Ⅴ)浓度的增加叶绿素呈递增趋势,而在生长后期叶绿素含量呈递减趋势,造成不同程度的叶绿体损伤。当As(Ⅴ)浓度提高到10 mg·L-1时,在第30 d时,叶绿素含量降至最低为19.75,相比CK下降了17.98%。相比CK,单纯的腐植酸添加并未显著引起生菜叶绿素变化。对于砷酸盐处理组,适当浓度的腐植酸添加在生菜各生长期均不同程度地增加了生菜的叶绿素含量,当腐植酸浓度为5 mg·L-1时,生菜生长至第10、20、30 d时,叶绿素含量分别提高了10.71%、11.18%、18.41%。而进一步提高腐植酸浓度到10 mg·L-1时,叶绿素含量较腐植酸浓度为5 mg·L-1时整体呈现不同程度的下降,说明适当浓度的腐植酸对降低砷酸盐的叶绿体损伤具有缓解作用。姜佰文等[24]研究指出,适量的腐植酸添加会促进叶绿素合成,与本文结论一致。
综上,当As(Ⅴ)添加浓度为0.5 mg·L-1时,生物量、株高、根长以及叶绿素的相对含量均高于CK组,说明低浓度的砷酸盐可促进生菜生长,具有低剂量兴奋作用[25-26],高浓度砷酸盐均不同程度地对生菜生长产生抑制作用[17],其中地上部的生长会比根的生长受到更大的影响[27]。已有报道腐植酸对植物生长以及根系发育具有积极作用[28],从本文研究结果可看出,腐植酸对高浓度砷酸盐的生菜毒性作用有所缓解。
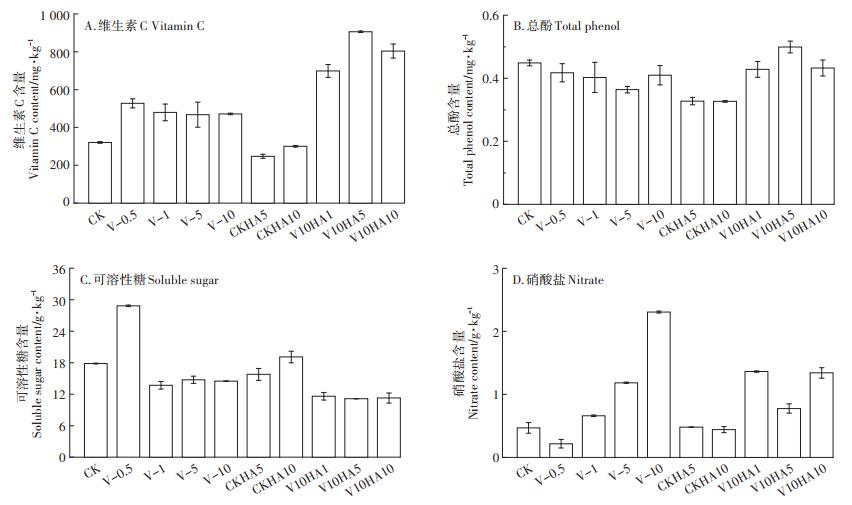
2.4 不同处理组生菜品质指标的变化 2.4.1 基本营养指标的变化由图 4A可知,当添加不同浓度的As(Ⅴ)时,生菜叶中维生素C的含量均高于CK组,其中As(Ⅴ)添加浓度为0.5 mg·kg-1时,生菜叶中维生素C的含量较CK提高了65.38%。在CK处理中添加腐植酸,生菜维生素C的含量无明显变化,而在砷酸盐处理组添加腐植酸可显著提高生菜中维生素C的含量。当腐植酸添加浓度为5 mg·L-1时,维生素C含量达到最大,较V-10处理增加了92.27%。有研究报道,维生素C与植物抗逆能力呈正相关,不超标情况下,添加适量砷可提高生菜中维生素C含量,腐植酸促进维生素的积累可能与光合作用水平提高有关,并且过量的腐植酸添加会引起叶绿体损伤[29],这与本文研究结果一致。
|
图 4 不同处理组生菜的维生素C、总酚、可溶性糖、硝酸盐含量的变化 Figure 4 The changes in the content of vitamin C, total phenol, soluble sugar, and nitrate of lettuce in different treatment groups |
如图 4B所示,不同浓度砷酸盐处理组,生菜的总酚含量无显著差异。而在10 mg·L-1 As(Ⅴ)的培养液中添加腐植酸时,生菜中总酚的含量随着腐植酸添加浓度的升高呈先升高后降低,当腐植酸浓度为5 mg· L-1时,相比V-10处理组总酚含量增加了21.83%,与前述营养指标类似,进一步提高腐植酸浓度到10 mg· kg-1时,总酚的含量下降。
如图 4C所示,生菜中可溶性糖含量随着砷酸盐浓度的升高呈现先升高后降低的趋势,在添加0.5 mg·L-1As(Ⅴ)后,生菜的可溶性糖含量显著升高,相较CK组升高了61.62%,而As(Ⅴ)浓度高于0.5 mg· L-1时,生菜的可溶性糖含量相较CK处理组下降,当As(Ⅴ)浓度为10 mg·L-1时,生菜可溶性糖下降了18.67%。在砷酸盐处理组添加腐植酸会使生菜中可溶性糖含量下降,在加入10 mg·L-1的腐植酸后,与V-10处理组相比,可溶性糖含量下降了22.30%。刘华琳[30]的研究指出,砷毒害使植物还原糖、非还原糖、可溶性总糖含量增加,α-淀粉酶、β-淀粉酶、蔗糖磷酸化酶活性下降,蔗糖合成酶、酸性转化酶、淀粉磷酸化酶活性升高,进而导致水稻幼苗碳代谢紊乱。
如图 4D所示,随着外源砷酸盐添加浓度的升高,生菜所含硝酸盐的含量呈先降低后升高的趋势,当As(Ⅴ)添加浓度为0.5 mg·L-1时,生菜中硝酸盐含量最低为216.89 mg · kg-1,相比CK处理组下降了53.73%,随着砷酸盐浓度进一步提高,生菜中硝酸盐的含量显著升高,在10 mg·L-1处理组,生菜中的硝酸盐含量较CK组升高了391.83%。Mao等[31]研究发现,硝酸盐转运蛋白在植物响应重金属胁迫中具有重要作用,植物吸收NO-3可提高对重金属的耐受性。所以重金属胁迫会促进植物对硝酸盐的吸收。从添加腐植酸的结果看,相比CK,添加腐植酸对生菜中硝酸盐的含量没有显著影响,在含As(Ⅴ)的培养液中添加腐植酸时,生菜中硝酸盐随着腐植酸添加浓度的增加呈显著下降趋势,当腐植酸的添加浓度为5 mg·L-1时,生菜中的硝酸盐含量最低为775.42 mg·kg-1,较V-10处理组降低了66.37%,进一步提高腐植酸添加量,生菜中硝酸盐的含量具有回升趋势,说明适量的腐植酸添加,可以显著降低生菜中硝酸盐的含量。
维生素C是一种还原剂,可使SOD酶活性增强,从而提高机体免疫力,对人类防癌和抗衰老有重要作用[32]。可溶性糖可以维持植物细胞的结构,调节细胞的渗透压,而摄入硝酸盐含量较高的蔬菜会增加人体患肠胃癌等疾病的几率[33]。从本文的结果看,V-0.5处理组的维生素C和可溶性糖含量最高,硝酸盐含量最低。可见,在生菜叶内砷含量不超标的条件下,外源砷浓度为0.5 mg·L-1会提高生菜的品质。腐植酸可促进根系生长,提高根系活力,同时促进植物的光合作用,以此增强作物抗逆性,提高作物品质和产量。在高浓度砷处理组中,V10HA5处理组的维生素C含量最高,硝酸盐含量最低,说明添加适量腐植酸可以提高生菜的品质,过量的腐植酸不仅造成资源浪费,对蔬菜品质的改善效果也会降低。
2.4.2 游离氨基酸的变化图 5A为根据砷处理组与CK组生菜氨基酸含量做PLS-DA分析得到的VIP图。由图可看出,应对砷酸盐胁迫的主要差异表达氨基酸类型为谷氨酸(GLU)和精氨酸(ARG),其中不同砷处理组生菜ARG表达水平均有不同程度的下调,V-10处理组相比CK组,GLU表达水平下降了19.69%,ARG表达水平下降了90.31%。
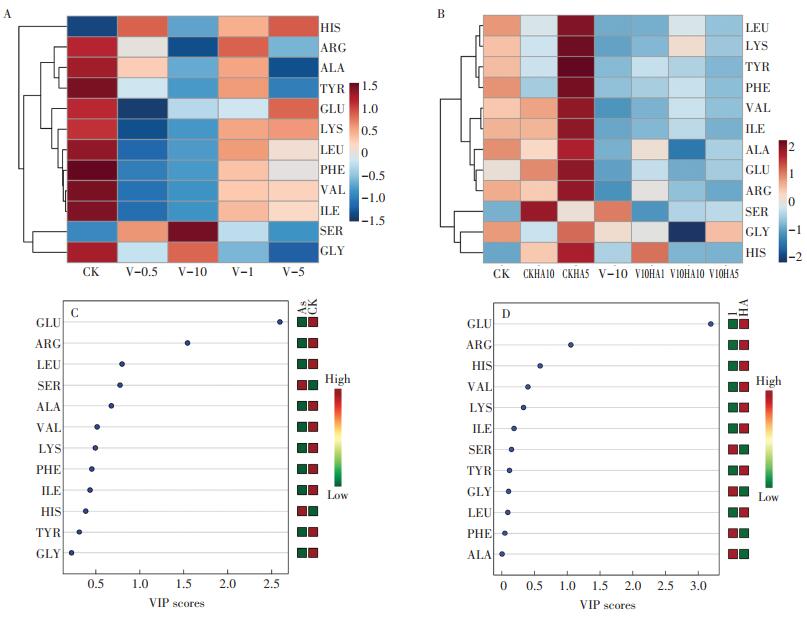
|
ALA为丙氨酸,ARG为精氨酸,GLY为甘氨酸,GLU为谷氨酸,HIS为组氨酸,ILE为异亮氨酸,LEU为亮氨酸,LYS为赖氨酸,PHE为苯丙氨酸,SER为丝氨酸,TYR为酪氨酸,VAL为缬氨酸 ALA is alanine, ARG is arginine, GLY is glycine, GLU is glutamic acid, HIS is histidine, ILE is isoleucine, LEU is leucine, LYS is lysine, PHE is Phenylalanine, SER is serine, TYR is tyrosine, and VAL is valine 图 5 砷处理组与腐植酸处理组生菜氨基酸含量水平(A、B)和VIP图(C、D) Figure 5 The relative level (A and B)and the VIP diagram analysis(C and D)of amino acid content in lettuce after arsenate stress and humic acid is added to the medium |
图 5B主要表示腐植酸对生菜中氨基酸表达水平的影响,结合PLS-DA分析及VIP得分可知,GLU和ARG同时也是腐植酸添加后所引起的主要差异表达氨基酸类型。其中腐植酸上调了GLU的表达水平,与CK组相比,CKHA5处理组GLU的表达水平提高了34.71%,与V-10处理组相比,V10HA1处理组GLU的表达水平提高了44.55%;同时腐植酸的添加也引起了ARG表达水平的提高,与CK组相比,CKHA5的ARG表达水平升高了62.84%,与V-10处理组相比,V10HA1的ARG表达水平升高了801.26%。
在细胞质和叶绿体中,GLU在△1-吡咯琳-5羧酸合成酶(P5CS)和△ 1 -吡咯琳- 5羧酸还原酶(P5CR)的作用下合成脯氨酸,脯氨酸在植物细胞中起着重要作用,可以作为渗透剂、羟自由基清除剂,还可以作保护酶的相溶性溶质[34]。植物体内的P5CS通常有两个同源的P5CS基因编码,这两个同源的P5CS在不同胁迫条件下的表达水平存在差异[35]。砷胁迫下,植物中脯氨酸的含量通常会增加[36],则作为底物的GLU降低,这与本文结果相符。而在腐植酸处理组中,腐植酸的添加增加了植物中GLU的含量,表明腐植酸在一定程度上降低了植物的胁迫。从本研究也可看出,ARG在砷胁迫下受到显著影响。ARG是抗氧化性氨基酸,具有良好的清除自由基能力[37],是生成多胺、一氧化氮和GLU等的前体物质,而多胺、一氧化氮是植物体内重要的信使分子,参与生长发育、抗逆等几乎所有的生理生化过程[38]。Capone等[39]的研究表明,ARG代谢有利于植物对逆境的感知和识别。砷胁迫下,ARG含量不同程度降低,表明ARG可能生成了许多作为信使分子的多胺和一氧化氮。而腐植酸的添加在一定程度增加了ARG的含量,降低了植物的砷胁迫。
3 结论(1) 随着砷酸盐添加浓度的增加,生菜产酸代谢增强,添加腐植酸能够明显缓解生菜的产酸胁迫作用。
(2) 当砷酸盐添加浓度低于3.5 mg·L-1时,在生菜各生长时期,可食部分叶中的砷含量均不超国家限量标准。腐植酸在生菜生长初期会促进砷在茎和叶中的积累,中期会显著降低叶中砷的含量,后期会增加叶中砷的积累。
(3) 当砷酸盐添加浓度为0.5 mg·L-1时,可促进生菜的生长,同时会增加生菜叶中的叶绿素含量。而添加腐植酸可以显著改善由于高浓度砷胁迫导致的生菜生长抑制作用。
(4) 腐植酸可上调由于砷胁迫而降低的与抗逆相关的GLU和ARG含量,适量的腐植酸添加可显著改善生菜的营养品质,在砷酸盐处理组,5 mg·L-1的腐植酸添加对改善生菜营养品质具有较好的效果。
| [1] |
Jia Y, Huang H, Chen Z, et al. Arsenic uptake by rice is influenced by microbe-mediated arsenic redox changes in the rhizosphere[J]. Environmental Science & Technology, 2014, 48(2): 1001-1007. |
| [2] |
Stroud J L, Norton G J, Islam M R, et al. The dynamics of arsenic in four paddy fields in the Bengal delta[J]. Environmental Pollution, 2011, 159(4): 947-953. DOI:10.1016/j.envpol.2010.12.016 |
| [3] |
Jain C K, Ali I. Arsenic:Occurrence, toxicity and speciation techniques[J]. Water Research, 2000, 34(17): 4304-4312. DOI:10.1016/S0043-1354(00)00182-2 |
| [4] |
Requejo R, Tena M. Proteome analysis of maize roots reveals that oxidative stress is a main contributing factor to plant arsenic toxicity[J]. Phytochemistry, 2005, 66(13): 1519-1528. DOI:10.1016/j.phytochem.2005.05.003 |
| [5] |
Chen R S, Liu H C, Song S W, et al. Effects of light quality on growth and quality of lettuces in hydroponic[C]. New York: Ieee, 2015.
|
| [6] |
Gibeaut D M, Hulett J, Cramer G R, et al. Maximal biomass of Arabidopsis thaliana using a simple, low-maintenance hydroponic method and favorable environmental conditions[J]. Plant Physiology, 1997, 115(2): 317-319. |
| [7] |
Yi X Y, Yang Y P, Yuan H Y, et al. Coupling metabolisms of arsenic and iron with humic substances through microorganisms in paddy soil[J]. J Hazard Mater, 2019, 373: 591-599. DOI:10.1016/j.jhazmat.2019.03.113 |
| [8] |
Yang T, Hodson M E. Investigating the use of synthetic humic-like acid as a soil washing treatment for metal contaminated soil[J]. Sci Total Environ, 2019, 647: 290-300. DOI:10.1016/j.scitotenv.2018.07.457 |
| [9] |
上海化工学院煤化工专业腐植酸小组. 腐植酸制品在环境保护中的应用[J]. 环境科学, 1976(1): 57-63. Humic acid group coal chemical engineering Shanghai university of chemical technology. Application of humic acid products in environmental protection[J]. Environmental Science, 1976(1): 57-63. |
| [10] |
Le T T, Yoon H, Son M H, et al. Treatability of hexabromocyclododecane using Pd/Fe nanoparticles in the soil-plant system:Effects of humic acids[J]. Sci Total Environ, 2019, 689: 444-450. DOI:10.1016/j.scitotenv.2019.06.290 |
| [11] |
Yu Y, Wan Y N, Camara A Y, et al. Effects of the addition and aging of humic acid-based amendments on the solubility of Cd in soil solution and its accumulation in rice[J]. Chemosphere, 2018, 196: 303-310. DOI:10.1016/j.chemosphere.2018.01.002 |
| [12] |
Xiang Y L, Kang F R, Xiang Y X, et al. Effects of humic acid-modified magnetic Fe3O4/MgAl-layered double hydroxide on the plant growth, soil enzyme activity, and metal availability[J]. Ecotox Environ Safe, 2019, 182: 189. |
| [13] |
刘伟鹏.砷在土壤-作物体系中的形态测定及累积规律研究[D].沈阳: 沈阳农业大学, 2017. LIU Wei-peng. Study on the speciation and accumulation of arsenic in soil-crop system[D]. Shenyang: Shenyang Agricultural University, 2017. |
| [14] |
王丽.华北棉区棉蚜寄主专化型及其形成机制初步研究[D].北京: 中国农业科学院, 2015. WANG Li. Preliminary studies on the host biotypes and formation mechanism of cotton aphid in cotton areas of north China[D]. Beijing: Chinese Academy of Agricultural Sciences, 2015. |
| [15] |
刘芷宇. 土壤-根系微区养分环境的研究概况[J]. 土壤学进展, 1980(3): 1-11. LIU Zhi-yu. A survey of soil-root micro-region nutrient environments[J]. Turangxue Jinzhan, 1980(3): 1-11. |
| [16] |
Xu W H, Liu H, Ma Q F, et al. Root exudates, rhizosphere Zn fractions, and Zn accumulation of ryegrass at different soil Zn levels[J]. Pedosphere, 2007, 17(3): 389-396. DOI:10.1016/S1002-0160(07)60047-2 |
| [17] |
任红艳.宝山矿区农田土壤-水稻系统重金属污染的遥感监测[D].南京: 南京农业大学, 2008. REN Hong-yan. Use of hyper/multiple-spectral data on monitoring heavy metal pollution in soil-rice system nearby Baoshan Mines[D]. Nanjing: Nanjing Agricultural University, 2008. |
| [18] |
Finnegan P M, Chen W. Arsenic toxicity:The effects on plant metabolism[J]. Front Physiol, 2012, 3: 182. |
| [19] |
Park S Y, Kim K S, Kang D. Effects of humic acid on heavy metal uptake by herbaceous plants in soils simultaneously contaminated by petroleum hydrocarbons[J]. Environmental Earth Sciences, 2013, 68(8): 2375-2384. DOI:10.1007/s12665-012-1920-8 |
| [20] |
Xu Q, Duan D C, Cai Q Y, et al. Influence of humic acid on Pb uptake and accumulation in tea plants[J]. J Agric Food Chem, 2018, 66(46): 12327-12334. DOI:10.1021/acs.jafc.8b03556 |
| [21] |
García A C, de Souza L G, Pereira M G, et al. Structure-propertyfunction relationship in humic substances to explain the biological activity in plants[J]. Scientific Reports, 2016, 6(1): 20798. DOI:10.1038/srep20798 |
| [22] |
Logoteta B, Xu X Y, Macnair M R, et al. Arsenite efflux is not enhanced in the arsenate-tolerant phenotype of Holcus lanatus[J]. New Phytologist, 2009, 183(2): 340-348. DOI:10.1111/j.1469-8137.2009.02841.x |
| [23] |
中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局.食品安全国家标准食品中污染物限量GB 2762-2017[S].北京: 中国标准出版社, 2017. National Health and Family Planning Commission of the People's Republic of China, State Food and Drug Administration. National food safety standards limits of contaminants in food GB 2762-2017[S]. Beijing: China Standard Press, 2017. |
| [24] |
姜佰文, 谢晓伟, 王春宏, 等. 应用腐植酸减肥对玉米产量及氮效率的影响[J]. 东北农业大学学报, 2018, 49(3): 21-29. JIANG Bai-wen, XIE Xiao-wei, WANG Chun-hong, et al. Effects of applying humic acid on reducing chemical fertilizer on maize yield and nitrogen efficiency[J]. Journal of Northeast Agricultural University, 2018, 49(3): 21-29. |
| [25] |
Khan I, Ahmad A, Iqbal M. Modulation of antioxidant defence system for arsenic detoxification in Indian mustard[J]. Ecotox Environ Safe, 2009, 72(2): 626-634. DOI:10.1016/j.ecoenv.2007.11.016 |
| [26] |
Shri M, Kumar S, Chakrabarty D, et al. Effect of arsenic on growth, oxidative stress, and antioxidant system in rice seedlings[J]. Ecotox Environ Safe, 2009, 72(4): 1102-1110. DOI:10.1016/j.ecoenv.2008.09.022 |
| [27] |
Paivoke A E A, Simola L K. Arsenate toxicity to Pisum sativum:Mineral nutrients, chlorophyll content, and phytase activity[J]. Ecotoxicology & Environmental Safety, 2001, 49(2): 111-121. |
| [28] |
Khan R, Khan M Z, Akhtar M E, et al. Chemical composition of lignitic humic acid and evaluating its positive impacts on nutrient uptake, growth and yield of maize[J]. Pakistan Journal of Chemistry, 2014, 4(1): 19-25. DOI:10.15228/2014.v04.i01.p04 |
| [29] |
Ciarkowska K, Solek-Podwika K, Filipek-Mazur B, et al. Comparative effects of lignite-derived humic acids and FYM on soil properties and vegetable yield[J]. Geoderma, 2017, 303: 85-92. DOI:10.1016/j.geoderma.2017.05.022 |
| [30] |
刘华琳.玉米对砷污染的生理生态响应[D].泰安: 山东农业大学, 2008. LIU Hua-lin. Physiological and ecological responses of maize to arsenic pollution[D]. Tai'an: Shandong Agricultural University, 2008. |
| [31] |
Mao Q Q, Guan M Y, Lu K X, et al. Inhibition of nitrate transporter 1.1-controlled nitrate uptake reduces cadmium uptake in Arabidopsis[J]. Plant Physiology, 2014, 166(2): 934-944. |
| [32] |
徐卫红, 王正银, 权月梅, 等. 沼液对莴笋和生菜硝酸盐含量及营养品质的影响[J]. 生态与农村环境学报, 2003, 19(2): 34-37. XU Wei-hong, WANG Zheng-yin, QUAN Yue-mei, et al. Effect of application of biogas slurry on nitrate content and nutrition quality of lettuce and romaine lettuce[J]. Journal of Ecology and Rural Environment, 2003, 19(2): 34-37. DOI:10.3969/j.issn.1673-4831.2003.02.008 |
| [33] |
Zhang S N, Zhang Z C, Zhang H L, et al. Growth, physiological and biochemical characteristics of non-heading Chinese cabbage under low temperature stress[J]. Acta Botanica Boreali-Occidentalia Sinica, 2008, 28(1): 109-112. |
| [34] |
Yang S L, Lan S S, Deng F F, et al. Effects of calcium and calmodulin antagonists on chilling stress-induced proline accumulation in Jatropha curcas L[J]. Journal of Plant Growth Regulation, 2016, 35(3): 815-826. DOI:10.1007/s00344-016-9584-3 |
| [35] |
Szekely G, Abraham E, Cselo A, et al. Duplicated P5CS genes of Arabidopsis play distinct roles in stress regulation and developmental control of proline biosynthesis[J]. Plant Journal, 2010, 53(1): 11-28. |
| [36] |
Pavlik M, Pavlikova D, Staszkova L, et al. The effect of arsenic contamination on amino acids metabolism in Spinacia oleracea L[J]. Ecotoxicology & Environmental Safety, 2010, 73(6): 1309-1313. |
| [37] |
Kalac P, Krausova P. A review of dietary polyamines:Formation, implications for growth and health and occurrence in foods[J]. Food Chem, 2005, 90(1/2): 219-230. |
| [38] |
Crawford N M. Mechanisms for nitric oxide synthesis in plants[J]. Journal of Experimental Botany, 2006, 57(3): 471-478. DOI:10.1093/jxb/erj050 |
| [39] |
Capone R, Tiwari B S, Levine A. Rapid transmission of oxidative and nitrosative stress signals from roots to shoots in Arabidopsis[J]. Plant Physiology & Biochemistry, 2004, 42(5): 425-428. |
 2020, Vol. 39
2020, Vol. 39