2. 江苏省农业科学院农业资源与环境研究所, 农业农村部长江下游平原农业环境重点实验室, 南京 210014;
3. 江苏省农业科学院农业信息研究所, 南京 210014;
4. 江苏大学环境与安全工程学院, 江苏镇江 212001
2. Key Laboratory of AgroEnvironment in Downstream of Yangtze Plain, Ministry of Agriculture and Rural Affairs, Institute of Agricultural Resources and Environment, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China;
3. Institute of Agricultural Information, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China;
4. School of Environmental and Safety Engineering, Jiangsu University, Zhenjiang 212001, China
镉(Cd)作为一种有毒重金属,其源于电池、陶瓷、油漆、电镀、矿山、磷肥等行业废水排放[1],过量摄入会导致血液、肌肉、骨骼、泌尿和心血管疾病。近几年我国的Cd污染事件频发,对人类经济、身体健康和环境造成了严重的危害[2]。因此寻求安全有效的Cd污染治理方法迫在眉睫[3-4]。目前针对Cd污染废水的处理技术包括共沉淀、离子交换、膜分离、过滤/超滤、反渗透、透析/电渗析和吸附法等[5]。其中,吸附法因具有成本低、潜在风险小、能够处理低浓度废水等优点而受到广泛关注[6]。吸附法的关键是选择合适的吸附剂。生物炭具有比表面积大、吸附效率高、成本低等优点,是被广泛应用的高效的吸附剂[7]。并且生物炭能够吸附土壤中的污染物质如有机污染物、重金属、农药,是一种低成本、环境友好型的土壤修复剂[8-10]。生物炭的表面特性与重金属的钝化和污水的净化有直接关联[11-12],Yu等[13]发现玉米秆生物炭实现了对污水中Cd2+ 88.1%的去除率。
生物炭根据制备方法的不同,常见的分为两类:限氧炭化法制备的常规裂解炭(Pyrochar,PBC)和水热炭化法制备的水热炭(Hydrochar,HBC) [14]。其中,水热炭化技术作为一种新型生物炭制备技术,由于具有能量密度较高、转化效率高、无需预干燥、制备温度相对较低的优点,在吸附净化、催化剂载体、多孔炭制备、清洁能源等领域展现出了良好的应用前景[15-16]。但同时水热炭的芳烃结构、耐热性和比表面积较低,孔隙度差,阻碍了其在环境和储能方面应用的有效开发[17],因此需要对其进行改性。关于PBC及其改良技术已有较多报道,但是对于HBC改良的报道尚不多见。
目前,生物炭改良技术一般分为三类:物理改良、化学改良、生物改良[18]。其中,物理改良法主要是利用热处理技术清除生物炭孔隙中的有机物等杂物,从而使其孔隙结构发生改变,比表面积增加[19]。Lam等[20]采用单步微波蒸汽活化(STMSA)生产的微波活化生物炭(MAB)表现出较好的吸附性能。化学改良法是目前最常见的方法,如酸碱改性(HNO3、H2SO4、KOH等)、氧化和还原改性(铁盐、锌盐、钙盐、氨水)等[21]。史月月等[22]以ZnCl2为改性剂,浸渍比为2:1时制备的生物炭对甲基橙的去除效果最好。生物改性法主要是利用微生物在生物炭表面所产生的反应,通过微生物的生长代谢过程,实现对生物炭表面的影响,从而对其实现改良的方法[23]。如通过共堆肥技术,实现炭的陈化和表面官能团的改变[24]。Han等[25]用动物肥料制备的水热炭和热解炭去除水溶液中的Sb离子,发现水热炭对Sb离子具有更高的吸附能力。相对于物理和化学改良措施,生物改良方法具有成本低且环境友好的优势。然而,目前使用生物方法对水热炭进行改良的研究几乎未见报道。
为此,本研究拟通过微生物陈化过程对水热炭的表面特性进行改良,以提升其吸附性能;即通过厌氧发酵技术,使厌氧发酵菌与水热炭发生一系列过程,溶出并在一定程度上降解水热炭源可溶性有机质中普遍存在的有机酸和有机酚,以及炭化不彻底的其他易分解有机成分[26]。本研究考察了不同微生物陈化处理时间对水热炭表面特性的影响,并比较了其对溶液中重金属Cd的吸附去除效果,研究结果将为水热炭的生物改良提供新的思路,为水热炭化技术的应用提供参考。
1 材料与方法 1.1 水热炭及其改良水热炭的制备在密封的水热高压釜中,以农林废弃物麦秆为原料,以水为溶剂和反应介质,温度设置为220 ℃,物料比1:6,压力4 MPa,制备得到麦秆水热炭(WHC)。微生物陈化麦秆水热炭则是通过厌氧发酵技术对WHC进行微生物陈化所得:将反应得到的水热炭在烘箱中干燥,再将其放在发酵罐中进行微生物陈化处理,陈化过程中参与的微生物主要是厌氧发酵菌,包括甲烷细菌、纤维素分解菌和蛋白质水解菌。微生物陈化过程中,首先在150 L的厌氧发酵桶里加入100 L沼液和11 kg麦秆作为炭源,再加入适量养分以促进微生物发酵,最后加入3780 g WHC,WHC用尼龙网袋装入,分别经过20、40、60 d的陈化后取出,冲洗后烘干,即可得到微生物陈化水热炭。其中,发酵体系初始pH为7.34。将得到的水热炭研磨过筛(0.3 mm),密封保存于干燥器中备用。初始水热炭与微生物陈化改良后的水热炭按照陈化天数不同(20、40、60 d)分别标记为WHC、WHC-M20、WHC-M40、WHC-M60。
1.2 表征分析水热炭的产率为制备前后的质量比,分别称取陈化后水热炭样品的干质量和陈化前水热炭的干质量,并计算二者的比值。灰分由灼烧法测定。pH用pH计测定,炭水比为1:10(m/V)。元素组成采用元素分析仪测定(Vario EL cube,德国Elementar);比表面积采用全自动比表面与孔径分析仪测定(ASIQMO002- 2,美国Quantachrome);原材料及水热炭表面官能团的变化通过傅立叶红外光谱(FTIR)仪(VERTEX 70,德国Bruker,扫描波数500~4000 cm-1)和X-射线光电子能谱(XPS)(Escalab 250Xi,美国Thermo Fisher Scientific)测定并进行定性分析,吸附后溶液的Cd2+浓度通过电感耦和等离子体质谱仪进行测定(ICP-OES,美国PerkinElmer)。
1.3 吸附过程与模型等温吸附实验:配制1000 mg∙L-1的Cd2+母液,分别将其稀释成10、20、30、40、50 mg∙L-1;将稀释液分装到50 mL的离心管中,再分别称取0.05 g水热炭样品于离心管中,放至恒温振荡器(转速160 r∙min-1)中振荡24 h;采集上清液,过滤后上机分析测试。
吸附动力学实验:称取0.05 g水热炭于50 mg∙L-1的Cd2+溶液中,溶液初始pH为7,振荡24 h,分别在不同时间点定时采样并测定其Cd2+浓度。
生物水热炭吸附重金属离子的过程,用Lagergren拟一级速率方程和拟二级速率方程来表征[27]。同时使用Langmuir模型、Freundlich模型和Temkin方程对吸附等温数据进行拟合。其中,Langmuir模型假设单层吸附在均匀表面上,没有相互作用吸附分子;Freundlich模型是一个经验模型方程,常用于描述非均质表面的化学吸附。Temkin方程考虑的是当水热炭吸附溶液中的水热炭时,其与被吸附的溶质发生相互作用,影响吸附行为和吸附过程,具体能量关系为吸附热随吸附量线性降低。
1.4 环境条件对水热炭吸附Cd2+的影响在pH为2~11范围内,设置pH为2、5、8、11,考察了不同pH对水热炭吸附Cd2+的影响。将生物炭以1 g∙L-1的剂量添加到初始Cd2+浓度为30 mg∙L-1的溶液中,使用1 mol∙L-1的NaOH和1 mol∙L-1的HCl调节溶液的pH,在25 ℃恒温振荡器中振荡24 h(160 r ∙ min-1),取样测定Cd2+浓度。
同时考察了温度对水热炭吸附Cd2+的影响。配制Cd2+浓度为30 mg∙L-1的溶液,且吸附反应温度分别设置为278.15 K、298.15 K、318.15 K,待吸附平衡后进行采样测试。
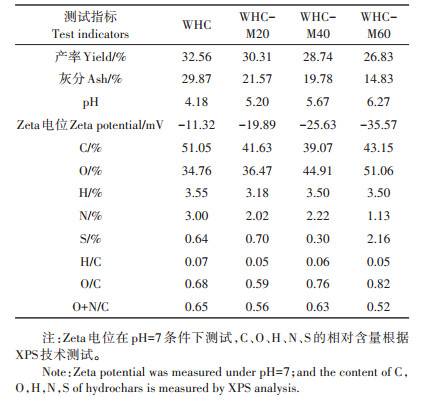
2 结果与分析 2.1 微生物陈化处理对麦秆水热炭理化性质的影响微生物陈化处理对麦秆水热炭的理化性质产生明显影响。由表 1可知,随着陈化时间的增加,4种生物炭产率逐渐下降(32.56%~26.83%),灰分含量由29.87%逐渐减少到14.83%,pH由4.18逐渐增大到6.27。值得注意的是,生物炭的表面均带负电荷,且电荷量随陈化时间的增加而增加(-11.32~-35.57 mV),这可能将有利于带正电荷的重金属离子如Cd2+通过静电作用吸附于其表面。
|
|
表 1 微生物陈化水热炭的基本理化性质 Table 1 Basic physical and chemical properties of microbial aging hydrochars |
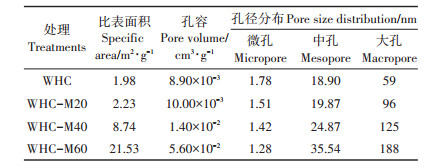
微生物陈化过程对水热炭的孔隙发育产生显著影响,而比表面积和孔隙发育会直接影响到水热炭与Cd2+的吸附作用。如表 2所示,随着陈化时间的增加,水热炭的比表面积由1.98 m2∙g-1增加到21.53 m2∙g-1,增加了9.87倍。
|
|
表 2 微生物陈化水热炭的比表面积及孔径分布 Table 2 The surface area and pore size distribution of different microbial aged hydrochars |
水热炭表面灰分的减少(表 1),表明其无机成分减少,这从侧面印证水热炭的孔隙可能被打开,这将显著影响水热炭对重金属物质的吸附效果,进而提高水热炭的吸附性能。一般大孔(>50 nm)主要分布在炭的表面,对重金属的吸附影响较小;中孔(2~50 nm)是水中重金属的主要吸附场所,即进入微孔的通道,对吸附作用的影响较大。如表 2所示,随着陈化时间的增加,孔容从8.90×10-3 cm3·g-1增加到5.60×10-2 cm3·g-1,增加了5.29倍。孔径分布也发生了改变,陈化60 d的水热炭大孔孔径明显增加,由59 nm增加到188 nm,增加了2.19倍,同时中孔的孔径经陈化60 d处理后也呈增加的趋势。
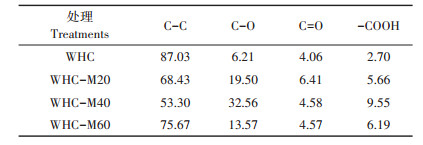
2.3 微生物陈化处理对麦秆水热炭光谱特性的影响 2.3.1 XPS分析X-射线光电子能谱(XPS)拥有比较高的表面灵敏度,通过比较WHC与微生物改性WHC-M20、WHC-M40和WHC-M60处理表面元素结合能的变化来进一步研究水热炭对Cd2+的吸附机理。通过分峰处理,C=C键的位置在284.5 eV、C-O键的位置在285.7 eV、C=O键的位置在287.0 eV处,而-COOH的位置在288.9 eV处。微生物陈化过程显著影响了水热炭表面的官能团。如图 1所示,经过微生物陈化处理后的水热炭,在288.9 eV结合能位置上的峰随着陈化时间的增加更加明显,而该位置代表-COOH。这说明陈化后的水热炭氧化程度增加,含氧官能团如C=O和-COOH得到强化。表 3列出了各官能团的具体变化。其中,C=C键丰度呈减少的趋势,WHC-M40减少了38.75%;而含氧官能团的丰度呈增加趋势,WHC-M40的C-O键丰度增加了424.31%,-COOH丰度增加253.70%,WHC-M20的C=O含量增加57.88%。与WHC相比,经微生物陈化之后的水热炭的C=C键所对应的峰面积相对减少,而C-O和C=O官能团对应的峰面积随着陈化时间增加而出现增加的趋势。同时从表 3可以得出,WHC-M60所对应的C=C键的丰度比WHC-M20和WHC-M40处理有所增加,说明陈化60 d的含碳有机物转化为含氧官能团的物质减少。
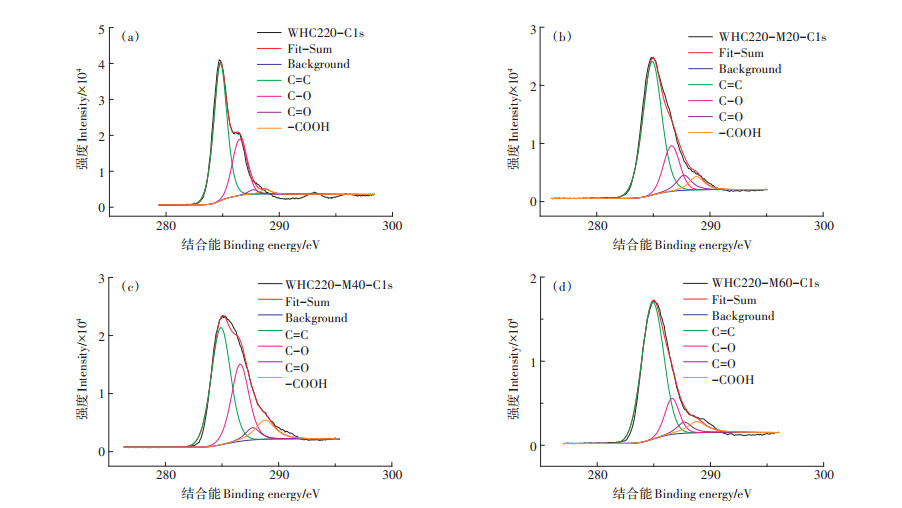
|
图 1 不同微生物陈化水热炭的X-射线光电子能谱C1s谱图 Figure 1 X-ray photoelectron spectroscopy C1s spectra of hydrochars aged by different microorganisms |
|
|
表 3 XPS分析相关官能团的相对丰度(%) Table 3 The intensity of related functional group was analyzed by XPS (%) |
红外光谱可用于分析材料表面官能团特性,辅助对反应机理进行分析。本文通过观察水热炭微生物陈化前后的红外光谱特征,研究官能团对水热炭吸附Cd2+的影响过程。图 2a为不同微生物陈化时间对水热炭表面官能团的影响。通过FTIR分析,可以发现,WHC表面含有丰富的官能团,在3338、2925、1700、1600、1496、1276、1205、1031、877、811、642 cm-1处有较明显的吸收峰。其中3340 cm-1附近宽吸收峰来自羟基-OH的伸缩振动,2920 cm-1处为脂肪性C-H的伸缩振动峰,1700 cm-1附近吸收峰主要为脂类、羧酸的C=O伸缩振动吸收,1600 cm-1和1510 cm-1之间为C=C的伸缩振动峰,1220 cm-1和1120 cm-1之间为C-O的伸缩振动,780 cm-1处为芳香性C-H的伸缩振动。陈化后的水热炭分别与WHC对比,其-OH吸收峰的位置由3340 cm-1偏移至3354 cm-1,且伸缩振动程度明显增加;2920 cm-1处的脂肪性C-H的伸缩振动峰经微生物陈化后的振动程度明显减弱,说明脂肪性C-H化合物成分减少;同时1700 cm-1处的-COOH和1220 cm-1处的C-O含氧官能团伸缩振动峰经陈化改良后得到加强。
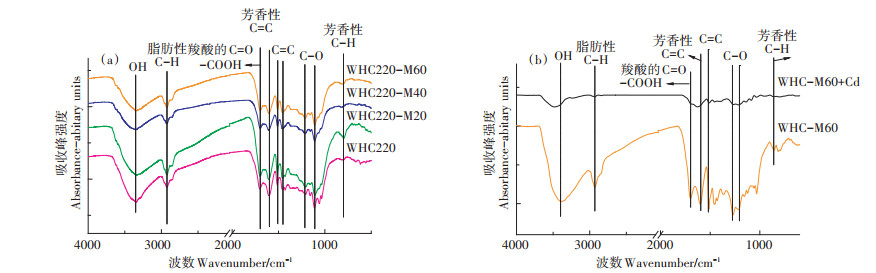
|
图 2 麦秆水热炭与不同微生物陈化时间水热炭的FTIR对比分析谱图和微生物陈化60 d的水热炭吸附Cd2+前后的FTIR图谱 Figure 2 FTIR analysis of WHC and different microbial aged WHC and FTIR analysis of WHC-M60 before and after Cd2+ adsorption |
通过对比水热炭吸附Cd2+前后的红外光谱图,可以发现官能团的一些变化(图 2b)。WHC-M60在吸附Cd2+前后在672 cm-1处的芳香性C-H吸收峰发生了明显的变化,表明更多的芳香官能团通过提供π电子与Cd2+相结合;同时在2934 cm-1处的脂肪性C-H吸收峰几乎全部消失,说明脂肪性C-H官能团可能参与了Cd2+在水热炭表面的吸附。在1512 cm-1处的C=C、1255 cm-1处的C-O、1542 cm-1处的-COOH等吸收峰的伸缩振动程度也在吸附Cd2+后减弱,说明C=C、C-O、-COOH等官能团参与了Cd2+的吸附过程。综上所述,微生物陈化改良水热炭表面丰富的官能团在Cd2+的吸附过程中起到重要作用。结合XPS和FTIR的分析可得到C-C官能团的含量减少,含氧官能团C-O、C=O、-COOH的含量增加,同时通过水热炭吸附Cd2+前后的变化可以得出芳香官能团可以通过提供π电子与Cd2+发生反应,含氧官能团C-O、-COOH可与Cd2+发生络合反应。
2.4 关键环境条件对不同水热炭吸附Cd2+的影响吸附体系的pH在重金属吸附过程中起到关键作用。由图 3可知,当pH由2升至8时,不同水热炭对Cd2+的吸附量呈上升的趋势,WHC、WHC-M20、WHC-M40、WHC-M60的吸附量分别增加7.36、2.18、2.71、4.66倍。从pH2到pH5,吸附量增长缓慢,pH5到pH8,吸附量增长迅速,pH8到pH11,吸附量缓慢增长。在同样的pH范围内(2~11),WHC-M60对Cd2+吸附能力的变化幅度大于其他3种水热炭材料。
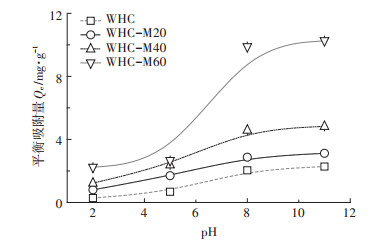
|
图 3 pH对不同水热炭吸附Cd2+的影响 Figure 3 The effect of pH value on Cd2+ adsorption capacity by different hydrochars |
温度也直接影响了水热炭吸附Cd2+的能力。如图 4所示,随着温度升高,4种水热炭的吸附能力均逐渐增加。其中,WHC的吸附量增加了3.75倍,WHCM20的吸附量增加了0.97倍,WHC-M40的吸附量增加了1.97倍,WHC-M60的吸附量增加0.29倍。在同一温度下,随着陈化时间的增加水热炭的吸附量也在增加,其中WHC的吸附量增加幅度较明显。这表明,通过提升体系温度可以实现水热炭对Cd2+更高的吸附去除效率。
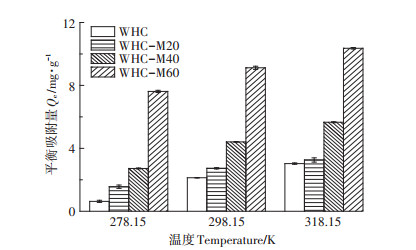
|
图 4 温度对不同水热炭吸附Cd2+的影响 Figure 4 The effect of temperature on Cd2+ adsorption capacity by different hydrochars |
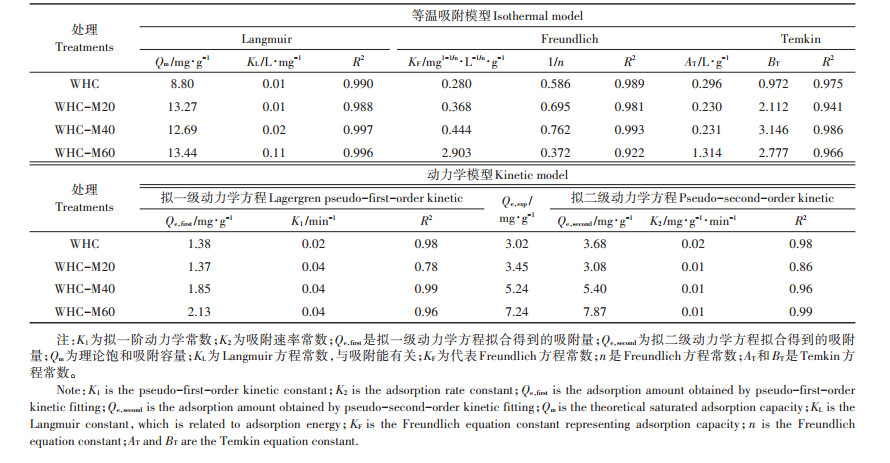
通过等温吸附和吸附动力学可以定量化地理解不同水热炭吸附Cd2+的过程,并从宏观上理解相关吸附机制。由图 5和表 4可知,Langmuir方程和Freundlich方程、Temkin方程对等温吸附数据的拟合系数都较高,其中,Langmuir模型(R2>0.988)对4种材料的拟合优于Freundlich模型和Temkin模型。这表明4种水热炭对Cd2+的吸附过程为单层均相吸附,水热炭介质较均匀。对比4种水热炭处理可以发现,WHC、WHC-M20、WHC-M40、WHC-M60的最大吸附量Qm分别是8.80、13.27、12.69、13.44 mg∙g-1,随着陈化时间的增加逐渐增加。参数KL为Langmuir吸附平衡常数,它是吸附速率和解吸速率之比,反映了固体表面吸附能力的强弱,其值越大,水热炭和吸附质结合得越稳定。随着微生物陈化时间的增加,KL值也呈增加的趋势,说明水热炭和吸附质的结合更稳定。同时最大吸附量的拟合结果和动力学拟合结果一致,经陈化处理后的水热炭的吸附量增加。对于拟一级动力学拟合结果,拟合出来的Qe,first与实验得到的Qe,exp之间的误差为32%~57%,对于拟二级动力学拟合结果,拟合出来的Qe,second与实验得到的Qe,exp之间的误差为9%~17%。总的来说,4种原料都较好地符合拟一级动力学模型和拟二级动力学模型,其中拟二级动力学方程拟合系数更优(R2>0.86),且得到的Qe,second更接近实测值。
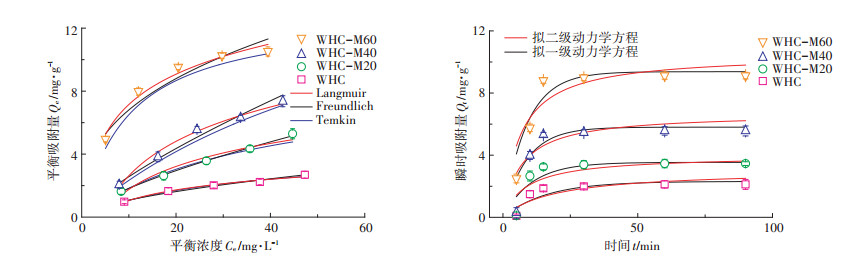
|
图 5 不同水热炭的吸附模型图 Figure 5 isothermal adsorption diagrams of different hydrochars and adsorption kinetics diagrams of different hydrochars |
|
|
表 4 不同水热炭的等温吸附模型参数和动力学模型参数 Table 4 Adsorption isotherm model and kinetic model fitting parameters of different hydrochars |
首先,微生物陈化过程使得生物炭产率减少,这是由于微生物的消化作用要消耗一定量的含碳有机物,在厌氧条件下将含碳有机物转化为甲烷和二氧化碳;同时,灰分含量也呈减少的趋势,这是因为经微生物陈化后溶出了一些矿质成分[27]。此外,经微生物陈化后pH逐渐上升,主要是因为水热炭的厌氧消化过程维持在pH7.34,同时陈化过程是一个厌氧发酵过程,有机酸被产甲烷菌等微生物转化为甲烷和二氧化碳,从而造成了pH的上升[28]。而水热炭表面的负电荷呈现增加的趋势,这主要是由于陈化后的pH增加,说明其表面的OH-增加,且其表面的-OH、-COOH官能团也呈增加的趋势,这就使得负电荷量逐渐增加。H/C的数值变化表明水热炭经过60 d的陈化后芳香化程度降低,极性官能团聚合度变低[29]。O/C的数据变化说明了其中含有极性官能团如羰基、酚羟基较多[30]。这些均表明,经过微生物陈化,水热炭可以通过表面带负电荷的基团与溶液中带正电荷的重金属离子之间产生静电作用,从而更好地吸附Cd2+[31]。
经微生物陈化处理后水热炭的比表面积增加,原因是由于灰分的减少,灰分主要存在于炭表面孔径隧道中,灰分的减少会导致其表面的较大孔径隧道坍塌,形成更多较小孔径,增加其表面的孔容及中孔数量。微孔(< 2 nm)是生物炭吸附重金属的主要区域,此外,水热炭表面富含的可溶性有机成分[32]随着微生物陈化时间的增加而逐渐溶出,进而被厌氧发酵体系中存在的大量微生物作为营养源加以利用或降解[33],使得炭骨架凸显出来,孔容更多,从而显著增加了生物炭的比表面积,提高了炭对不同分子大小物质的吸附性能。已知经微生物陈化后中孔数量呈增加的趋势,而中孔数量的增加扩大了水热炭对重金属的吸附位点,有利于提高水热炭的吸附性能[34]。
XPS的结果表明,与WHC相比,经微生物陈化之后水热炭的C-C键所对应的峰面积相对减少,而C-O和C=O官能团对应的峰面积随着陈化时间增加而出现增加的趋势。推测主要原因是微生物的作用将水热炭表面的烷烃类有机物转化为了酸类或醇类物质[35]。含氧官能团相对含量增加,特别是C=O和-COOH官能团增加明显,这对于水热炭吸附阳离子物质(如Cd2+)具有积极作用。因为这些含氧官能团与Cd2+会形成络合物(如R-OH、R-OOH等) [36],附着到炭材料表面,实现水体中Cd2+的有效去除。同时经FTIR分析也可得到随着陈化时间的增加含氧官能团的含量增加,C-C键的含量减少,说明官能团参与水热炭对Cd2+的吸附过程。
3.2 微生物陈化麦秆水热炭吸附Cd2+的过程与机制分析微生物陈化处理的水热炭对Cd2+的吸附过程是吸热过程,并且在pH 2~11范围内,随着pH的增加,吸附量呈增加的趋势,当pH在8附近时,有利于实现Cd2+的最大吸附。等温吸附过程符合Langmuir方程,说明水热炭表面对Cd2+的吸附亲和力在表面官能团和键能上是均匀的,表面含有有限个相同的吸附位点[37]。吸附动力学结果较符合拟二级动力学方程,说明化学吸附在整个吸附过程中起主导作用[38]。研究结果表明,WHC、WHC-M20、WHC-M40、WHC-M60对Cd2+的吸附以化学吸附为主。
随着pH的增加,4种水热炭对Cd2+的吸附量逐渐增大,主要是因为在较低pH条件下,溶液中质子化作用使材料表面带正电荷,影响了水热炭对Cd2+的吸附能力[39]。当pH逐渐增加到6时,酸度迅速降低,减弱了H+与Cd2+的竞争吸附作用,从而提供了更多的吸附位点,最终吸附容量迅速上升;当吸附体系呈碱性时,水热炭表面OH-增加,水热炭可通过静电作用和络合反应等方式吸附Cd2+。当pH≥8时,4种水热炭的吸附量并未显著提升,说明并没有形成明显沉淀,这与水热炭表面呈酸性有关。当水热炭表面活性点位被完全占据时,吸附达到饱和状态,吸附容量达到最大值[40]。总体而言,对于4种水热炭,当pH在8附近时,有利于实现Cd2+的最大吸附。水热炭对Cd2+的吸附过程属于吸热过程,其原因可能是温度的适当升高可以使水热炭表面的颗粒膨胀,水热炭的比表面积增大,物理吸附作用加强[41]。
微生物陈化处理的麦秆水热炭对Cd2+的吸附机制可能包括以下几个方面:第一,Cd2+与微生物陈化水热炭表面丰富的含氧官能团的络合作用,可能是其被吸附去除的重要机制之一。本实验通过XPS表征分析表明,-COOH、C=O官能团相对丰度增加,说明陈化后的水热炭氧化程度增加,含氧官能团得到强化。通过比较微生物陈化水热炭吸附Cd2+前后的FTIR图谱,-OH与Cd2+形成化学键,分子内-OH中的氢键作用力减少,因此可以猜测-OH官能团参与了与Cd2+的络合[42];同时,C=O、-COOH等官能团吸收峰的伸缩振动程度也在吸附Cd2+之后减弱,说明C=O、-COOH等官能团也参与了Cd2+的吸附过程。第二,水热炭含有的π键与Cd2+的配位作用,也是其被吸附去除的机制之一。已有研究表明,Cd2+与π键的配位结合(如与C=C、C=N)是吸附重金属离子的重要机制[43]。本研究中C=O官能团的含量增加,说明极有可能会与π键发生配位结合从而提高对Cd2+的吸附能力。第三,微生物陈化水热炭较大的表面负电荷量对于Cd2+的吸附起到重要作用。本研究表明,水热炭的表面负电荷量随着微生物陈化时间的增加而增多,这将有利于水热炭通过表面负电荷与溶液中带正电荷的Cd2+之间产生静电作用[44],提升其吸附性能。此外,水热炭中与表面官能团结合的无机盐离子脱离炭表面之后,可利于Cd2+通过离子交换作用实现高效吸附去除[45],本实验通过对水热炭水浸出液中的Al3+、Ca2+、Mg2+金属离子含量进行测试,发现随着微生物陈化时间的增加,浸出液中金属离子的含量呈增加趋势(数据未展示);这与微生物陈化水热炭对Cd2+的吸附能力提升趋势一致。这从侧面验证了离子交换在微生物陈化水热炭吸附去除Cd2+的过程中起到重要作用。另外,有报道表明,常规裂解生物炭表面含有的无机矿物离子(如PO43-、CO32-和SiO32-等)与重金属离子络合,会形成碳酸盐、磷酸盐或硅酸盐的沉淀[46]。然而,水热炭表面呈现酸性,则沉淀作用可能不是去除Cd2+的主要机制。
4 结论(1) 使用微生物陈化处理对水热炭进行改良后,水热炭中H/C减少,O/C增加;芳香官能团含量减少,含氧官能团如羧基的丰度增加,表面氧化性增加;比表面积显著提高,孔隙发育更加充分。
(2) 微生物陈化过程提升了水热炭对Cd2+的吸附性能,且等温吸附符合Langmuir模型;动力学吸附均符合准二级动力学模型。表明该吸附过程以化学吸附为主导,且为单分子层均相吸附。微生物陈化水热炭对Cd2+的吸附机制主要为官能团络合、表面静电作用、离子交换、π键配位作用。
(3) 利用厌氧发酵技术对水热炭进行生物改良,不需重复投资;相对于物理和化学改良技术具有成本低和环境友好的优势,且可以明显提高对Cd2+的吸附性能,是一种具有应用潜力的农林废弃物水热炭化改良方法。
| [1] |
Fosso-Kankeu E, Mittal H, Waanders F, et al. Thermodynamic properties and adsorption behaviour of hydrogel nanocomposites for cadmium removal from mine effluents[J]. Journal of Industrial & Engineering Chemistry, 2017, 48: 151-161. |
| [2] |
Duan Q, Lee J, Liu Y, et al. Distribution of heavy metal pollution in surface soil samples in China:A graphical review[J]. Bulletin of Environmental Contamination & Toxicology, 2016, 97(3): 303-309. |
| [3] |
Huang Y, Wang L, Wang W, et al. Current status of agricultural soil pollution by heavy metals in China:A meta-analysis[J]. Science of the Total Environment, 2019, 651: 3034-3042. DOI:10.1016/j.scitotenv.2018.10.185 |
| [4] |
Wang Z, Wang H, Li Q, et al. Heavy metal pollution and potential health risks of commercially available Chinese herbal medicines[J]. Science of the Total Environment, 2019, 653: 748-757. DOI:10.1016/j.scitotenv.2018.10.388 |
| [5] |
Fu F, Wang Q. Removal of heavy metal ions from wastewaters:A review[J]. Journal of Environmental Management, 2011, 92(3): 407-418. DOI:10.1016/j.jenvman.2010.11.011 |
| [6] |
Liu L, Huang Y, Zhang S, et al. Adsorption characteristics and mechanism of Pb(Ⅱ)by agricultural waste-derived biochars produced from a pilot-scale pyrolysis system[J]. Waste Management, 2019, 100: 287-295. DOI:10.1016/j.wasman.2019.08.021 |
| [7] |
Park J H, Choppala G K, Bolan N S, et al. Biochar reduces the bioavailability and phytotoxicity of heavy metals[J]. Plant & Soil, 2011, 348(1/2): 439-451. |
| [8] |
阴文敏, 关卓, 刘琛, 等. 生物炭施用及老化对紫色土中抗生素吸附特征的影响[J]. 环境科学, 2019, 40(6): 2920-2929. YIN Wen-min, GUAN Zhuo, LIU Chen, et al. Effects of biochar application and ageing on the adsorption of antibiotics in purple soil[J]. Environmental Sciences, 2019, 40(6): 2920-2929. |
| [9] |
邵翼飞, 张鹏, 刘爱菊, 等. 生物炭对噻虫胺在土壤中吸附和降解的影响[J]. 农业环境科学学报, 2019, 38(11): 2520-2527. SHAO Yi-fei, ZHANG Peng, LIU Ai-ju, et al. Effects of biochar on the adsorption and degradation of clothianidin in soil[J]. Journal of Agro-Environmental Science, 2019, 38(11): 2520-2527. DOI:10.11654/jaes.2019-0460 |
| [10] |
蒋少军, 刘峻光, 刘玲玲, 等. 生物炭对矿区农田土壤及大豆安全种植的影响研究[J]. 农业环境科学学报, 2019, 38(1): 124-131. JIANG Shao-jun, LIU Jun-guang, LIU Ling-ling, et al. Effect of biochar on farmland soil and planting security of soybean in mining area[J]. Journal of Agro-Environmental Science, 2019, 38(1): 124-131. |
| [11] |
Son E B, Poo K M, Chang J S, et al. Heavy metal removal from aqueous solutions using engineered magnetic biochars derived from waste marine macro-algal biomass[J]. Science of the Total Environment, 2018, 615: 161-168. DOI:10.1016/j.scitotenv.2017.09.171 |
| [12] |
Zhou H, Meng H, Zhao L, et al. Effect of biochar and humic acid on the copper, lead, and cadmium passivation during composting[J]. Bioresource Technology, 2018, 258: 279-286. DOI:10.1016/j.biortech.2018.02.086 |
| [13] |
Yu W C, Lian F, Cui G N, et al. N-doping effectively enhances the adsorption capacity of biochar for heavy metal ions from aqueous solution[J]. Chemosphere, 2018, 193: 8-16. DOI:10.1016/j.chemosphere.2017.10.134 |
| [14] |
Takaya C A, Fletcher L A, Singh S, et al. Phosphate and ammonium sorption capacity of biochar and hydrochar from different wastes[J]. Chemosphere, 2016, 145: 518-527. DOI:10.1016/j.chemosphere.2015.11.052 |
| [15] |
Cao Y, Shen G, Zhang Y, et al. Impacts of carbonization temperature on the Pb(Ⅱ)adsorption by wheat straw-derived biochar and related mechanism[J]. Science of the Total Environment, 2019, 692: 479-489. DOI:10.1016/j.scitotenv.2019.07.102 |
| [16] |
Gai C, Chen M, Liu T, et al. Gasification characteristics of hydrochar and pyrochar derived from sewage sludge[J]. Energy, 2016, 113: 957-965. DOI:10.1016/j.energy.2016.07.129 |
| [17] |
Feng Y, Sun H, Han L, et al. Fabrication of hydrochar based on food waste(FWHTC) and its application in aqueous solution rare earth ions adsorptive removal:Process, mechanisms and disposal methodology[J]. Journal of Cleaner Production, 2019, 212: 1423-1433. DOI:10.1016/j.jclepro.2018.12.094 |
| [18] |
Tao Q, Chen Y, Zhao J B, et al. Enhanced Cd removal from aqueous solution by biologically modified biochar derived from digestion residue of corn straw silage[J]. Science of the Total Environment, 2019, 674: 213-222. DOI:10.1016/j.scitotenv.2019.03.438 |
| [19] |
Zong Y, Wang Y, Sheng Y, et al. Ameliorating soil acidity and physical properties of two contrasting texture Ultisols with wastewater sludge biochar[J]. Environmental Science & Pollution Research, 2018, 25(26): 25726-25733. |
| [20] |
Lam S S, Yek P N Y, Ok Y S, et al. Engineering pyrolysis biochar via single-step microwave steam activation for hazardous landfill leachate treatment[J]. Journal of Hazardous Materials, 2019, 390: 121649. |
| [21] |
Jiang B, Lin Y, Mbog J C, et al. Biochar derived from swine manure digestate and applied on the removals of heavy metals and antibiotics[J]. Bioresource Technology, 2018, 270: 603-611. DOI:10.1016/j.biortech.2018.08.022 |
| [22] |
史月月, 单锐, 袁浩然, 等. 改性稻壳生物炭对水溶液中甲基橙的吸附效果与机制[J]. 环境科学, 2019, 40(6): 2783-2792. SHI Yue-yue, SHAN Rui, YUAN Hao-ran, et al. Effects and mechanisms of methyl orange removal from aqueous solutions by modified rice shell biochar[J]. Environmental Sciences, 2019, 40(6): 2783-2792. |
| [23] |
Dias B O, Silva C A, Higashikawa F S, et al. Use of biochar as bulking agent for the composting of poultry manure:Effect on organic matter degradation and humification[J]. Bioresource Technology, 2010, 101(4): 1239-1246. DOI:10.1016/j.biortech.2009.09.024 |
| [24] |
Bass A M, Bird M I, Kay G, et al. Soil properties, greenhouse gas emissions and crop yield under compost, biochar and co-composted biochar in two tropical agronomic systems[J]. Science of the Total Environment, 2016, 550: 459-470. DOI:10.1016/j.scitotenv.2016.01.143 |
| [25] |
Han L F, Sun H R, Ro K S, et al. Removal of antimony(Ⅲ)and cadmium(Ⅱ)from aqueous solution using animal manure-derived hydrochars and pyrochars[J]. Bioresource Technology, 2017, 234: 77-85. DOI:10.1016/j.biortech.2017.02.130 |
| [26] |
Bolan N S, Kunhikrishnan A, Choppala G K, et al. Stabilization of carbon in composts and biochars in relation to carbon sequestration and soil fertility[J]. Science of the Total Environment, 2012, 424: 264-270. DOI:10.1016/j.scitotenv.2012.02.061 |
| [27] |
Basu M, Guha A K, Ray L. Adsorption behavior of cadmium on husk of lentil[J]. Process Safety And Environmental Protection, 2017, 106: 11-22. DOI:10.1016/j.psep.2016.11.025 |
| [28] |
Cuong D V, Liu N L, Nguyen V A, et al. Meso/micropore-controlled hierarchical porous carbon derived from activated biochar as a highperformance adsorbent for copper removal[J]. Science of the Total Environment, 2019, 692: 844-853. DOI:10.1016/j.scitotenv.2019.07.125 |
| [29] |
Baek J, Lee H M, An K H, et al. Preparation and characterization of highly mesoporous activated short carbon fibers from kenaf precursors[J]. Carbon Letters, 2019, 29(4): 393-399. DOI:10.1007/s42823-019-00042-y |
| [30] |
Estrade-Szwarckopf H. XPS photoemission in carbonaceous materials:A "defect" peak beside the graphitic asymmetric peak[J]. Carbon, 2004, 42(8/9): 1713-1721. |
| [31] |
Yu S, Feng Y, Xue L, et al. Biowaste to treasure:Application of microbial-aged hydrochar in rice paddy could improve nitrogen use efficiency and rice grain free amino acids[J]. Journal of Cleaner Production, 2019, 240: 118180. DOI:10.1016/j.jclepro.2019.118180 |
| [32] |
Peng H, Xie W, Li D, et al. Copper-resistant mechanism of Ochrobactrum MT180101 and its application in membrane bioreactor for treating electroplating wastewater[J]. Ecotoxicology & Environmental Safety, 2019, 168: 17-26. |
| [33] |
Fan Q, Sun J, Chu L, et al. Effects of chemical oxidation on surface oxygen-containing functional groups and adsorption behavior of biochar[J]. Chemosphere, 2018, 207: 33-40. DOI:10.1016/j.chemosphere.2018.05.044 |
| [34] |
Li B, Guo J, Lv K, et al. Adsorption of methylene blue and Cd(Ⅱ)onto maleylated modified hydrochar from water[J]. Environmental Pollution, 2019, 254(12): 113014. |
| [35] |
Naeimi A, Amini M. Biosorption of cadmium using a novel, renewable and recoverable modified natural cellulose bearing chelating Schiff base ligand based on 2-hydroxy-5-methyl benzaldehyde[J]. Iranian Polymer Journal, 2018, 27(7): 461-468. DOI:10.1007/s13726-018-0623-8 |
| [36] |
Zhang H, Yue X, Li F, et al. Preparation of rice straw-derived biochar for efficient cadmium removal by modification of oxygen-containing functional groups[J]. Science of the Total Environment, 2018, 631/632: 795-802. DOI:10.1016/j.scitotenv.2018.03.071 |
| [37] |
Chen Z L, Zhang J Q, Huang L, et al. Removal of Cd and Pb with biochar made from dairy manure at low temperature[J]. Journal of Integrative Agriculture, 2019, 18(1): 201-210. |
| [38] |
Cimon C, Kadota P, Eskicioglu C, et al. Effect of biochar and wood ash amendment on biochemical methane production of wastewater sludge from a temperature phase anaerobic digestion process[J]. Bioresource Technology, 2019, 297: 122440. |
| [39] |
Yang X, Baeg G H, Wang C H, et al. Characterization and ecotoxicological investigation of biochar produced via slow pyrolysis:Effect of feedstock composition and pyrolysis conditions[J]. Journal of Hazardous Materials, 2019, 365: 178-185. DOI:10.1016/j.jhazmat.2018.10.047 |
| [40] |
Chen T, Luo L, Deng S, et al. Sorption of tetracycline on H3PO4 modified biochar derived from rice straw and swine manure[J]. Bioresource Technology, 2018, 267: 431-437. DOI:10.1016/j.biortech.2018.07.074 |
| [41] |
Donar Y O, Çağlar E, Sınağ A, et al. Preparation and characterization of agricultural waste biomass based hydrochars[J]. Fuel, 2016, 183: 366-372. DOI:10.1016/j.fuel.2016.06.108 |
| [42] |
Si B, Yang L, Zhou X, et al. Anaerobic conversion of the hydrothermal liquefaction aqueous phase:Fate of organics and intensification with granule activated carbon/ozone pretreatment[J]. Green Chemistry, 2019, 21(6): 1305-1318. DOI:10.1039/C8GC02907E |
| [43] |
杜文慧, 朱维琴, 潘晓慧, 等. 牛粪源蚓粪及其生物炭对Pb(Ⅱ)、Cd (Ⅱ)的吸附特性[J]. 环境科学, 2017, 38(5): 2172-2181. DU Wen-hui, ZHU Wei-qin, PAN Xiao-hui, et al. Adsorption of Pb2+ and Cd2+ from aqueous solution using vermicompost derived from cow manure and its biochar[J]. Environmental Science, 2017, 38(5): 2172-2181. |
| [44] |
Wu B, Liu C, Fu C, et al. Selective separation of Cr(Ⅵ)and V(Ⅴ) from solution by simple pH controlled two-step adsorption/desorption process with ZrO2[J]. Chemical Engineering Journal, 2019, 373: 1030-1041. DOI:10.1016/j.cej.2019.05.131 |
| [45] |
Rechberger M V, Kloss S, Wang S L, et al. Enhanced Cu and Cd sorption after soil aging of woodchip-derived biochar:What were the driving factors?[J]. Chemosphere, 2019, 216: 463-471. DOI:10.1016/j.chemosphere.2018.10.094 |
| [46] |
邓金环, 郜礼阳, 周皖婉, 等. 不同温度制备香根草生物炭对Cd (Ⅱ)的吸附特性与机制[J]. 农业环境科学学报, 2018, 37(2): 340-349. DENG Jin-huan, GAO Li-yang, ZHOU Wan-wan, et al. Adsorption characteristics and mechanisms of Cd2+ in biochar derived from vetiver grass under different pyrolysis temperatures[J]. Journal of AgroEnvironment Science, 2018, 37(2): 340-349. |
 2020, Vol. 39
2020, Vol. 39