2. 湖南省凤凰县农业特色产业中心, 湖南 凤凰 416200;
3. 中国科学院大学, 北京 100049
2. Special Agricultural Industry Center in Fenghuang county of Hunan Province, Fenghuang 416200, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China
水体氮污染已成为世界上最为严峻的环境问题,而生物脱氮是水污染处理中最为经济、有效的处置方法[1]。传统生物脱氮主要包括硝化与反硝化作用。生物硝化与反硝化过程相互依赖,但是由于硝化和反硝化微生物在生理生化上存在巨大差异,所以对溶氧(Dissolved oxygen,DO)、温度、pH、生长速度、化学需氧量(Chemical oxygen demand, COD)以及硝酸盐和亚硝酸盐有着不同的耐受和表现。这使得传统硝化与反硝化过程很难平衡和协调,导致脱氮过程十分复杂,且效率低下[2]。
最近,一类能在好氧条件下进行同步硝化反硝化的新型微生物——异养硝化-好氧反硝化(Heterotrophic nitrification - aerobic denitrification,HN-AD)菌,受到广泛关注,如Pseudomonas An-1[3]、Klebsiella sp. KSND[4]、Paracoccus denitrificans FJAT - 14899[5]等。HN-AD菌有着比传统硝化微生物更高的细胞生长速率,并且可以利用有机基质作为碳源,同时能够将不同的形态氮污染物,如氨氮(NH4+-N)、硝态氮(NO3-- N)和亚硝态氮(NO3--N)转化为含氮气体[4]。而且,HN-AD菌在硝化和反硝化过程中的酸碱补偿还可以减少pH调节成本[6]。一些特殊HN-AD菌甚至还具备耐受低温、高NH4+-N、低C/N、高有机物和高盐度的特性[4]。这些优势使得HN-AD菌成为水处理领域的热点。然而,目前对HN-AD菌生理生化和脱氮性能的研究多通过人工合成废水和摇瓶培养试验,而在实际废水和生物反应器中的脱氮潜力还鲜有报道,因此很难评价HN-AD菌在自然环境条件下的实际脱氮性能[6]。此外,DO已经被证明是影响HN-AD菌同步硝化反硝化能力的重要因素,对其氮代谢过程有着重要影响[7],但是以前研究多集中于某一DO条件对HNAD菌脱氮性能的影响[8-9],而很少研究DO对HN-AD菌硝化和反硝化活性发挥的影响阈值和具体应用,因此研究DO控制对生物反应器中HN-AD菌脱氮效力的影响十分必要。
本研究以长期处理养殖废水的湿地系统分离的一株高效HN-AD菌(Alcaligenes faecalis WT14)为研究对象,通过氮平衡分析了该菌株的同步硝化反硝化特性,以Boltzmann模型确定了不同DO浓度对菌株WT14 NH4+-N和NO3--N去除能力的影响及其DO抑制阈值,并考察了DO控制对固定化床反应器中的菌株WT14脱氮性能的影响。本研究为HN-AD菌处理高NH4+-N废水提供了新的视角。
1 材料和方法 1.1 微生物菌株、培养基和养殖废水Alcaligenes faecalis WT14(GenBank No. MN578054)由本实验室从长期处理养殖废水的绿狐尾藻湿地底泥基质中分离,前期已鉴定为一株高效HN-AD菌株。Luria-Bertani(LB)富集培养基:酵母粉5.00 g·L-1;酶蛋白胨10.0 g·L-1;NaCl 10.0 g·L-1。氨氮培养基:(NH4)2SO4 0.38 g·L-1、柠檬酸钠4.08 g·L-1、MgSO4·7H2O 0.05 g·L-1、K2HPO4 0.2 g·L-1、NaCl 0.12 g·L-1、MnSO4·4H2O 0.01 g·L-1、FeSO4 0.01 g·L-1、去离子水1 L,pH=7。硝氮培养基:KNO3 0.72 g·L-1、柠檬酸钠4.08 g·L-1、MgSO4·7H2O 0.05 g·L-1、K2HPO4 0.20 g·L-1、NaCl 0.12 g·L-1、MnSO4·4H2O 0.01 g·L-1、FeSO4 0.01 g·L-1、去离子水1 L,pH=7。氨-硝培养基:(NH4)2SO4 0.19 g·L-1、KNO3 0.36 g·L-1、柠檬酸钠4.08 g·L-1、MgSO4·7H2O 0.05 g·L-1、K2HPO4 0.20 g·L-1、NaCl 0.12 g·L-1、MnSO4·4H2O 0.01 g·L-1、FeSO4 0.01 g·L-1、去离子水1 L,pH=7。养殖废水:取自中国科学院长沙环境监测站长期处理养猪废水的绿狐尾藻人工湿地中处理组调节池,进水NH4+-N浓度253~295 mg·L-1,TN浓度261~311 mg·L-1,COD浓度1 088~1 447 mg·L-1。
1.2 氮平衡将菌株WT14接种于在100 mL LB培养基中,在30 ℃、120 r·min-1(DO 5.50 mg·L-1)条件下培养24 h,随后离心(5 000 r·min-1、10 min),用0.9%无菌NaCl溶液悬浮,重复3次(OD600nm=1)备用。
为了分析菌株WT14的氮转化,将1 mL菌悬液分别接种于包含50 mg·L-1 NH4+-N的100 mL氨氮培养基和包含25 mg·L-1 NH4+-N、25 mg·L-1 NO3--N的氨-硝培养基中,120 r·min-1(DO 5.50 mg·L-1)、30 ℃培养24 h。培养结束收集培养液,HX-IID超声波细胞破碎仪(沪析,上海)进行超声处理,并用于测定最终的总氮(Total nitrogen,TN)浓度(包括细胞内氮)。接着将培养液8 000 r·min-1离心10 min,上清液过0.22 μm滤膜,滤液用于测定可溶性TN、NH4+-N、NO3--N和NO2--N[10]。
1.3 DO对菌株WT14脱氨脱硝性能的影响为了解DO对菌株WT14脱氨脱硝能力的影响。将100 mL氨氮培养基和硝氮培养基分别置于250 mL锥形瓶中,NH4+-N和NO3--N浓度均设置为100 mg·L-1,菌悬液接种量1%(V/V),30 ℃恒温培养24 h,不同DO培养条件设置如下:0(0.05 mg·L-1)、20(0.85 mg·L-1)、40(1.81 mg·L-1)、60(2.84 mg·L-1)、80(3.85 mg·L-1)、100(4.75 mg·L-1)、120(5.50 mg·L-1)、140(6.08 mg·L-1)、160 r·min-1(6.51 mg·L-1)和180 r·min-1(6.81 mg·L-1),不同转速DO浓度通过DO测定仪测定,培养结束取样测定NH4+-N和NO3--N浓度变化,并计算NH4+-N去除率和NO3--N去除率。
采用Boltzmann模型对不同DO浓度下菌株WT14的NH4+-N去除率和NO3--N去除率进行分析,模型公式如下:

|
式中:yN和yD分别为菌株WT14在DO浓度为x时的NH4+-N去除率和NO3--N去除率,%;A1和A2为最低和最高NH4+-N或NO3--N去除率,%;x为DO浓度,mg·L-1;xN和xD分别为一半最大NH4+-N去除率和一半最大NO3--N去除率时的DO浓度,mg·L-1;dx为时间常数(Time const)。
1.4 养殖废水处理可行性分析为评价菌株WT14处理实际养殖废水的可行性。将1 mL菌悬液接种于装有100 mL养殖废水的250 mL三角瓶中,在30 ℃、120 r·min-1(DO 5.50 mg·L-1)条件下培养24 h。每8 h取10 mL水样测定NH4+-N、NO3--N、NO2--N、TN和COD浓度变化。
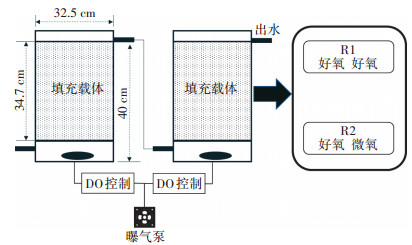
1.5 菌株WT14在养殖废水处理的应用为进一步评价Alcaligenes faecalis WT14在实际应用中的可行性,采用直径32.5 cm、高40.0 cm的透明有机玻璃柱作为固定床反应器,内部填充多孔陶粒作为固定化载体,有效填充高度为34.7 cm(图 1)。固定床反应器在30 ℃下运行,通过LZB玻璃转子空气流量计进行两级DO控制,使用电子气体流量计(MF5706,MEMS,美国)和DO测定仪实时监测气体通量和DO溶度,好氧溶氧浓度(4.00±0.30)mg·L-1,微氧溶氧浓度(0.50±0.10)mg·L-1,水力停留时间为12 h。装填完成后系统先运行7 d进行稳定,再进行30 d定期采样监测,每日采样一次,每次采水样50 mL,测定水样NH4+-N、NO3--N、NO2--N、TN和COD浓度变化。
|
图 1 固定床反应器示意图 Figure 1 Schematic diagram of fixed bed reactor |
使用全自动流动分析系统(AA3,海豹公司,德国)测定NH4+-N、NO3--N和TN的浓度,NO3--N和NO2--N用连续流分析仪测定,TN通过碱性过硫酸钾光度法测定,COD使用重铬酸钾氧化法测定[11],DO浓度采用多参数DO测定仪测定(SG68,梅特勒,瑞士)。
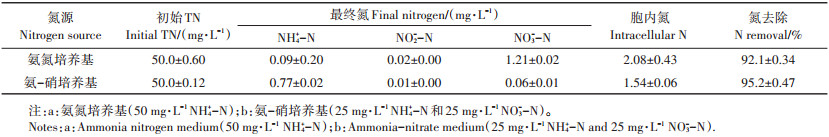
2 结果与讨论 2.1 异养硝化-好氧反硝化性能与氮平衡如表 1所示,在氨氮培养基中,约92%的氮以气态形式去除,仅有少量NO3--N的积累(1.21 mg·L-1),其余大部分为胞内氮(2.08 mg·L-1)。而在氨-硝培养基中,WT14的氮去除率更高,约95%的氮转化为气态氮,且胞内氮浓度更低(0.06 mg·L-1)。这表明菌株WT14与好氧反硝化菌Hanseniaspora uvarum KPL108相似,具有NH4+-N同化能力[12]。与氨氮培养基相比(1.21 mg·L-1),菌株WT14在氨-硝培养基中有着更低的NO3--N积累量(0.06 mg·L-1)。在菌株Pseudomonas stutzeri T13中也发现了同样的现象,在NO3--N和NH4+-N同时存在时,NH4+-N会促进好氧反硝化菌对NO3--N的还原,从而有着更低的NO3--N积累[13]。
|
|
表 1 菌株WT14在好氧条件下的氮平衡 Table 1 Nitrogen balance of the strain WT14 under aerobic conditions |
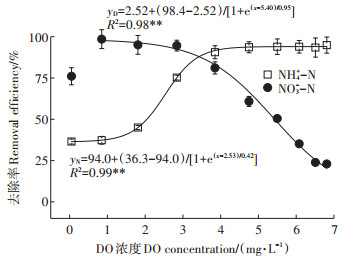
图 2展示了不同DO浓度对菌株WT14脱氨脱硝能力的影响。菌株WT14的NH4+-N去除能力与DO浓度有着很好的正相关性,通过Boltzmann模型进行拟合得到相关性函数公式:yN=94.0+(36.3-94.0)/[1+e (x-2.53)/0.42](图 2),相关系数R2=0.99(P<0.01),这表示Boltzmann模型能够很好地解释DO浓度与菌株WT14 NH4+-N去除率的关系。根据该模型,在DO浓度为2.53 mg·L-1时,WT14的NH4+-N去除率为最大NH4+-N去除率94.0%的一半(半数抑制浓度)。此外在DO浓度为3.85 mg·L-1时,菌株WT14能够达到90%的NH4+-N去除率,高于同等条件下的好氧反硝化菌Ochrobactrum anthropic LJ81[14]和P. chengduensis ZPQ2[15]。菌株WT14的硝化活性虽然受DO限制,但是其最低NH4+-N去除率依然能达到36.3%(图 2),这表明菌株WT14具有较强的低氧耐受性,在厌氧条件下也有着较好的硝化活性。
|
图 2 不同DO浓度对NH4+-N和NO3--N去除的影响 Figure 2 Effect of different DO concentrations on NH4+-N and NO3--N removal efficiency |
菌株WT14的NO3--N去除能力同样与DO浓度密切相关,相关性函数公式为yD=2.52+(98.4-2.52)/[1+ e (x-5.40)/0.95],相关系数R2=0.98(P<0.01),表明该模型同样能很好地解释DO浓度与WT14 NO3--N去除能力的关系(图 2)。根据模型,菌株WT14的NO3--N去除能力在DO浓度为5.40 mg·L-1时会被抑制一半,其最大NO3--N去除率为98.4%,这表明菌株WT14对DO有着较高的耐受度。但是高DO对WT14还有较强的抑制作用,当DO浓度超过6.51 mg·L-1时,NO3--N去除率仅为23.0%,模型预测极限的高DO条件,菌株WT14的最低反硝化率为2.52%。这表明相比于硝化活性,反硝化活性对DO变化更加敏感。
菌株WT14的NH4+-N去除能力与DO浓度呈正相关,而NO3--N去除能力与DO浓度呈负相关(图 2),这表明异养硝化-好氧反硝化菌具备同步硝化和反硝化能力还是有着其矛盾的地方。Jin等[4]发现,在好氧条件下HN-AD菌硝化关键功能基因HAO的表达量是其厌氧条件下表达量的2.72倍,而反硝化关键功能基因NAR的表达量比厌氧条件下增加了大约3倍,这说明DO浓度的变化是通过抑制硝化反硝化相关基因的表达影响HN-AD菌异养硝化-好氧反硝化功能的发挥,本次试验也间接验证了这一点。此外,在DO浓度为0.05 mg·L-1(0 r·min-1)时,该DO浓度的NO3--N去除率与模型离散,表现出较低的NO3--N去除率(76.0%),该结果与Sun等[7]的结果相似,菌株P. stutzeri T13在转速为50 r·min-1时,有着近100%的硝化率,而在0 r·min-1时,NO3--N去除率降低了约21.0%,这是由于在低DO条件菌株WT14有着较低的细胞生长率,从而影响了NO3--N的去除[7]。
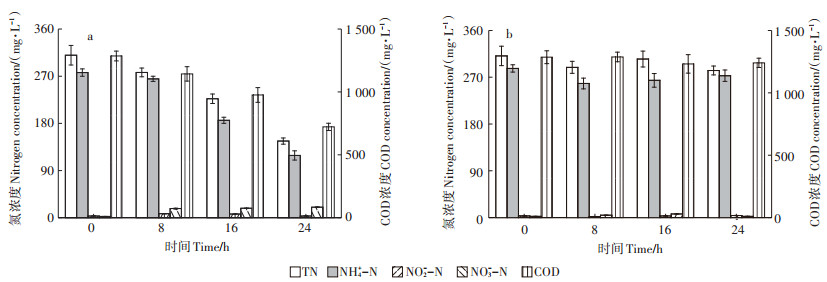
2.3 菌株WT14处理养殖废水的可行性分析如图 3所示,经24 h处理,养殖废水TN、NH4+-N和COD浓度分别从初始310、276 mg·L-1和1 285 mg·L-1下降到146、119 mg·L-1和772 mg·L-1,去除率分别为52.9%、56.9%和39.9%。由于所取养殖废水氮组成以NH4+-N为主,因此TN和NH4+-N有着相近的去除率,24 h平均NH4+-N去除速率为6.60 mg·L-1,高于菌株Pseudomonas fluorescens wsw-1001[16]和Pseudomonas stutzeri YZN-001[17]。养殖废水中NO2--N和NO3--N初期浓度都较低,自8 h时开始有了积累(NO2--N 7.00~7.70 mg·L-1,NO3--N 17.4~20.1 mg·L-1)。前期试验已表明菌株WT14具备同步硝化-反硝化能力,因此NO2--N和NO3--N波动是菌株WT14的氮代谢所引起,而且120 r·min-1(DO 5.50 mg·L-1)的DO条件也抑制了WT14约一半的NO3--N还原活性,这也导致了NO2--N和NO3--N的积累。此外,对照组(图 3b)各污染物浓度随时间变化均较小,这表明养殖废水中污染物的去除是由于菌株WT14的存在,因此继续进行装置试验,探究其实际应用潜能。
|
(a)添加1% WT14菌悬液的养殖废水,(b)未添加1% WT14菌悬液的养殖废水 (a)1% WT14 bacteria suspension was added, (b)1% WT14 bacteria suspension was not added 图 3 菌株WT14对养殖废水中氮和COD的去除 Figure 3 Removal of nitrogen and COD in breeding wastewater by strain WT14 |
前期DO影响试验证明菌株WT14在高DO条件有着较高的NH4+-N去除率和较低的NO3--N去除率,且反硝化活性更易受到DO的抑制,而养殖废水氮去除可行性试验进一步证明WT14在高DO条件下处理高NH4+-N浓度养殖废水时其反硝化活性受到抑制,易积累NO3--N和NO2--N,从而影响TN的去除。为维持较高的NH4+-N去除率,同时促进NO3--N和NO2--N的还原,基于DO模型预测WT14在DO浓度为4.0 mg·L-1时,有约90%的NH4+-N去除率,在DO浓度为0.50 mg·L-1时,有约97.7%的NO3--N去除率,因此建立了两个污水处理系统R1(好氧+好氧)和R2(好氧+微氧)(图 1)来明确好氧-微氧控制对TN去除的促进作用。如图 4a所示,养殖废水进水TN、NH4+-N和COD浓度分别为261~311、253~295 mg·L-1和1 088~1 447 mg·L-1,而NO3--N和NO2--N浓度较低,分别为0.60~ 6.60 mg·L-1和0.50~4.90 mg·L-1。R1和R2反应器出水NH4+-N和COD浓度相近,分别为0.9~3.0(R1)、0.7~2.1mg·L-1(R2)和27.0~36.4(R1)、18.2~30.5 mg·L-1(R2)和27.0~36.4(R1)、18.2~30.5 mg·L),但是两个反应器出水TN浓度相差较大,分别为27.2~30.9 mg·L-1(R1)和4.8~9.2 mg·L-1(R2)(图 4b和图 4c)。这主要是由于R1反应器中NO3--N(17.5~ 22.4 mg·L-1)和NO2--N(2.80~5.70 mg·L-1)的积累,导致其TN去除率(90.5%)低于R2(97.6%)(图 4d)。前期研究结果已经证明高DO条件(DO 4.00 mg·L-1)有利于菌株WT14对NH4+-N的去除,硝化活性比反硝化活性更不易受到抑制,因此R1和R2有着相似的NH4+-N去除率(99.3%和99.3%),但是高DO会抑制WT14反硝化功能的发挥,从而导致了R1反应器中NO3--N和NO2--N的积累(图 4d)。而R2后续的微氧条件重新激活了WT14的反硝化活性,从而促进了NO3--N和NO2--N的还原,因此R2中有着较低的NO3--N和NO2--N积累量。此外,R1和R2反应器的COD去除率相差不大,分别为97.4%和98.2%,这说明菌株WT14对COD的去除并不受DO浓度变化的影响,这与Yan等[18]的结果一致。

|
(a)进水,(b)R1出水,(c)R2出水,(d)TN、NH4+-N、COD去除率和NO3--N、NO2--N积累浓度 (a)Influent, (b)Effluent from R1 reactor, (c)Effluent from R2 reactor, (d)TN, NH4+-N, COD removal efficiency, and NO3--N, NO2--N accumulation concentration 图 4 固定床反应器对养殖废水中氮和COD的去除 Figure 4 Removal of nitrogen and COD in breeding wastewater from a fixed-bed reactor |
异养硝化-好氧反硝化菌有着同步硝化反硝化的天然优势,但是以前研究都过度着重于对NH4+-N的去除,而忽视了TN的去除[19],如接种Bacillus methylotrophicus L7的膜生物反应器中NH4+-N的去除率能达到77.5%,但是TN去除率仅有52.0%[20];Alcaligenes faecalis NR的NH4+-N去除率为72.4%,而TN去除率为64.2%[21];Acinetobacter calcoaceticus N7的NH4+-N去除率为99.2%,而TN去除率为67.1%[22]。这主要是由于HN-AD菌的异养硝化和好氧反硝化相关酶对DO的敏感性不同,这就导致HN-AD菌在高DO条件下处理高NH4+-N废水时虽然有着较高的NH4+-N去除率,但是却有着NO3--N或NO2--N的积累,从而影响TN的去除[7]。本次试验通过好氧-微氧两级DO控制显著改善了这一点,保证NH4+-N去除率的同时,促进了WT14的反硝化活性,显著提高了TN去除率,这对HN-AD菌用于处理高NH4+-N废水具有重要意义。
3 结论(1)菌株WT14在以NH4+-N作为底物时,约92.1%的NH4+-N以气态形式去除,其余大部分同化为胞内氮,同时NH4+-N的存在会促进NO3--N的还原。
(2)菌株WT14的NH4+-N去除能力和NO3--N去除能力与DO浓度显著相关,符合Boltzmann模型,分别在DO浓度为2.53 mg·L-1和5.40 mg·L-1时有着一半的最大NH4+-N去除率和NO3--N去除率,最大NH4+-N去除率和NO3--N去除率分别为94.0%和98.4%。
(3)好氧-微氧两级DO控制能够显著提高WT14的TN去除率,在进水TN、NH4+-N和COD浓度分别为261~311、253~295 mg·L-1和1 088~1 447 mg·L-1的养殖废水中,平均去除率达到97.6%、99.3%和98.2%,且几乎没有NO3--N或NO2--N的积累,这为HN-AD菌株处理高污染负荷废水提供了参考和借鉴。
| [1] |
林燕, 张焕杰, 刘曦, 等. 固定反硝化菌强化人工湿地处理低污染水研究[J]. 农业环境科学学报, 2016, 35(11): 2154-2162. LIN Yan, ZHANG Huan-jie, LIU Xi, et al. Performance of immobilized denitrifying bacteria in constructed wetland for slightly-polluted water treatment[J]. Journal of Agro-Environment Science, 2016, 35(11): 2154-2162. DOI:10.11654/jaes.2016-0540 |
| [2] |
Zhou Y, Oehmen A, Lim M, et al. The role of nitrite and free nitrous acid(FNA)in wastewater treatment plants[J]. Water Res, 2011, 45(15): 4672-4682. DOI:10.1016/j.watres.2011.06.025 |
| [3] |
Ren H, Su Y, Wang C, et al. Application of response surface methodology to optimize nitrate removal at low temperature by aerobic denitrificator Pseudomonas strain An-1[J]. Water Environ J, 2018, 32(2): 235-241. |
| [4] |
Jin P, Chen Y, Xu T, et al. Efficient nitrogen removal by simultaneous heterotrophic nitrifying-aerobic denitrifying bacterium in a purification tank bioreactor amended with two-stage dissolved oxygen control[J]. Bioresource Technol, 2019, 281: 392-400. DOI:10.1016/j.biortech.2019.02.119 |
| [5] |
王洁, 蓝江林, 刘波. 一株异养硝化细菌的分离鉴定和脱氮特性研究[J]. 农业环境科学学报, 2013, 32(4): 805-810. WANG Jie, LAN Jiang-lin, LIU Bo. Isolation and denitrification characteristics of a heterotrophic nitrification bacterium[J]. Journal of AgroEnvironment Science, 2013, 32(4): 805-810. |
| [6] |
Zhang Q, Liu Y, Ai G, et al. The characteristics of a novel heterotrophic nitrification-aerobic denitrification bacterium, Bacillus methylotrophicus strain L7[J]. Bioresource Technol, 2012, 108: 35-44. DOI:10.1016/j.biortech.2011.12.139 |
| [7] |
Sun Y, Li A, Zhang X, et al. Regulation of dissolved oxygen from accumulated nitrite during the heterotrophic nitrification and aerobic denitrification of Pseudomonas stutzeri T13[J]. Appl Microbiol Biot, 2015, 99(7): 3243-3248. DOI:10.1007/s00253-014-6221-6 |
| [8] |
王莹, 周巧红, 梁威, 等. 人工湿地高效好氧反硝化菌的分离鉴定及反硝化特性研究[J]. 农业环境科学学报, 2010, 29(6): 1193-1198. WANG Ying, ZHOU Qiao-hong, LIANG Wei, et al. Isolation and identification of a high-efficiency aerobic denitrifier and its denitrifying characteristic in constructed wetland[J]. Journal of Agro-Environment Science, 2010, 29(6): 1193-1198. |
| [9] |
Zhao B, An Q, He Y L, et al. N2O and N2 production during heterotrophic nitrification by Alcaligenes faecalis strain NR[J]. Bioresource Technol, 2012, 116: 379-385. DOI:10.1016/j.biortech.2012.03.113 |
| [10] |
Huang T, Guo L, Zhang H, et al. Nitrogen-removal efficiency of a novel aerobic denitrifying bacterium, Pseudomonas stutzeri strain ZF31, isolated from a drinking-water reservoir[J]. Bioresource Technol, 2015, 196: 209-216. DOI:10.1016/j.biortech.2015.07.059 |
| [11] |
Luo P, Liu F, Zhang S, et al. Nitrogen removal and recovery from lagoon-pretreated swine wastewater by constructed wetlands under sustainable plant harvesting management[J]. Bioresource Technol, 2018, 258: 247-254. DOI:10.1016/j.biortech.2018.03.017 |
| [12] |
Zhang H, Zhao Z, Kang P, et al. Biological nitrogen removal and metabolic characteristics of a novel aerobic denitrifying fungus Hanseniaspora uvarum strain KPL108[J]. Bioresource Technol, 2018, 267: 569-577. DOI:10.1016/j.biortech.2018.07.073 |
| [13] |
Sun Y, Feng L, Li A, et al. Ammonium assimilation:An important accessory during aerobic denitrification of Pseudomonas stutzeri T13[J]. Bioresource Technol, 2017, 234: 264-272. DOI:10.1016/j.biortech.2017.03.053 |
| [14] |
Lei X, Jia Y, Chen Y, et al. Simultaneous nitrification and denitrification without nitrite accumulation by a novel isolated Ochrobactrum anthropic LJ81[J]. Bioresource Technol, 2019, 272: 442-450. DOI:10.1016/j.biortech.2018.10.060 |
| [15] |
潘玉瑾, 刘芳, 孟爽, 等. 好氧反硝化菌P. chengduensis ZPQ2的筛选及其反硝化条件优化[J]. 环境工程, 2016, 34(1): 41-46. PAN Yu-jin, LIU Fang, MENG Shuang, et al. Isolation and characterization of an aerobic denitrifying-heterotrophic bacterium[J]. Environmental Engineering, 2016, 34(1): 41-46. |
| [16] |
Zhang S, Sha C, Jiang W, et al. Ammonium removal at low temperature by a newly isolated heterotrophic nitrifying and aerobic denitrifying bacterium Pseudomonas fluorescens wsw-1001[J]. Environ Technol, 2015, 36(19): 2488-2494. DOI:10.1080/09593330.2015.1035759 |
| [17] |
Zhang J, Wu P, Hao B, et al. Heterotrophic nitrification and aerobic denitrification by the bacterium Pseudomonas stutzeri YZN-001[J]. Bioresource Technol, 2011, 102(21): 9866-9869. DOI:10.1016/j.biortech.2011.07.118 |
| [18] |
Yan L, Liu S, Liu Q, et al. Improved performance of simultaneous nitrification and denitrification via nitrite in an oxygen-limited SBR by alternating the DO[J]. Bioresource Technol, 2019, 275: 153-162. DOI:10.1016/j.biortech.2018.12.054 |
| [19] |
颜薇芝, 张汉强, 余从田, 等. 1株异养硝化好氧反硝化不动杆菌的分离及脱氮性能[J]. 环境工程学报, 2017, 11(7): 4419-4428. YAN Wei-zhi, ZHANG Han-qiang, YU Cong-tian, et al. Isolation of Acinetobacter sp. YN3 and its heterotrophic nitrification-aerobic denitrification characters[J]. Chinese Journal of Environmental Engineering, 2017, 11(7): 4419-4428. |
| [20] |
Yao Y, Zhang Q, Liu Y, et al. Simultaneous removal of organic matter and nitrogen by a heterotrophic nitrifying-aerobic denitrifying bacterial strain in a membrane bioreactor[J]. Bioresource Technol, 2013, 143: 83-87. DOI:10.1016/j.biortech.2013.05.120 |
| [21] |
Zhao B, Tian M, An Q, et al. Characteristics of a heterotrophic nitrogen removal bacterium and its potential application on treatment of ammonium-rich wastewater[J]. Bioresource Technol, 2017, 226: 46-54. DOI:10.1016/j.biortech.2016.11.120 |
| [22] |
田雪雪, 程玉立, 张圆圆, 等. 一株异养硝化-好氧反硝化功能菌的分离鉴定及其脱氮特性[J]. 环境工程学报, 2017, 11(2): 1269-1275. TIAN Xue-xue, CHENG Yu-li, ZHANG Yuan-yuan, et al. Isolation identification and nitrogen removal characteristics of a heterotrophic nitrification-aerobic denitrification bacterium[J]. Chinese Journal of Environmental Engineering, 2017, 11(2): 1269-1275. |
 2020, Vol. 39
2020, Vol. 39