2. 江西农业大学生物科学与工程学院, 南昌 330045;
3. 东华理工大学化学生命与材料学院, 南昌 330013;
4. 江西五圆科农实业有限公司, 江西 黎川 344600
2. College of Bioscience and Bioengineering, Jiangxi Agricultural University, Nanchang 330045, China;
3. College of Chemical Life and Materials, East China University of Technology, Nanchang 330013, China;
4. Jiangxi Wuyuan Kenong Industry Co., Ltd, Lichuan 344600, China
镉(Cd)被认为是对农业生产危害最大的重金属之一[1]。近年来,随着矿产开采、加工等人类活动的活跃,Cd在自然环境中的含量不断上升[2],不仅对植物产生严重的毒害作用,影响植物的生长发育,同时还可以在植物可食用部分富集,并随着食物链的传递到达人体,导致人体Cd元素含量超标[3],进而引发多种人类的慢性病以及癌症等[4]。
目前Cd的治理策略主要有两种,第一是直接去除土壤中超量的Cd,第二是通过理化方法改变Cd在土壤中的形态,进而降低Cd在环境中的迁移性和有效性[5]。现有研究表明,使用物理、化学和生态修复等手段直接去除环境中的Cd污染虽然取得了一定的成效,但这些方法存在成本高、易造成二次污染、周期长等缺点[6],严重制约了其大规模应用。而近年来,脯氨酸、甜菜碱、硅肥等外源性化学物质均被证实可用于缓解过量Cd胁迫对植物的毒害作用,大幅度提高了烟草、玉米等对Cd的抗逆性[7]。
多糖作为一种新型的生物源大分子物质,近年来其在农业生产中的应用潜力正日益引起人们的关注。有研究表明,多糖不仅可以提高动植物的抗氧化能力[8]、调节动植物生长,同时多糖大分子可以通过金属的微沉淀、质子交换等方式强力络合重金属[9],降低重金属的迁移性和毒害性。相较于动植物多糖,微生物多糖具有培养周期短、成本低、产量大、过程可控、易于分离等优点[10],具有较好的应用前景。本课题组前期研究发现,乳酸菌胞外多糖可作为一种良好的植物生长调节剂促进植物生长,同时具有促进盐、酸与铜离子胁迫条件下水稻生长的特性[11-14]。在上述研究的基础上,本研究以自行分离的屎肠球菌所产胞外多糖为对象,研究其对Cd胁迫下水稻种子萌发和幼苗生长发育的影响,并通过形态学指标测定、生理代谢分析、抗氧化体系活力测定等手段,初步阐明屎肠球菌胞外多糖诱导水稻缓解Cd毒害的效果与作用机理,为利用天然生物活性物质缓解重金属对植物生长的毒害作用提供理论与实践依据。
1 材料与方法 1.1 试验材料屎肠球菌(Enterococcus faecalis)CX 2-6由江西农业大学应用微生物研究所提供。
供试水稻品种为五优308,由广东省金稻种业有限公司提供。选取粒大饱满的水稻籽粒,用5%NaClO浸泡消毒10 min,然后用蒸馏水冲洗5~7次,于28 ℃蒸馏水中浸泡24 h,沥干水备用。
MRS培养基:牛肉膏10 g·L-1,蛋白胨10 g·L-1,酵母浸粉5.0 g·L-1,葡萄糖20 g·L-1,无水乙酸钠5.0 g· L-1,柠檬酸氢二铵2 g·L-1,结晶硫酸镁0.58 g·L-1,硫酸锰0.25 g·L-1,吐温80 1 mL·L-1。pH 6.5,121 ℃高压灭菌15 min。
1.2 试验方法 1.2.1 屎肠球菌胞外多糖的制备将活化的屎肠球菌接种于MRS培养基中,37 ℃静置培养24 h,10 000 r·min-1离心10 min除去菌体。上清液减压浓缩至原体积的1/3,加入80%(m/V)的三氯乙酸至终体积7%(m/V)除蛋白,4 ℃静置12 h,10 000 r·min-1离心10 min收集上清,加入3倍体积95%乙醇于4 ℃静置过夜,4 ℃ 10 000 r·min-1离心10 min收集沉淀,用蒸馏水将沉淀溶解,装入透析袋中(截留分子量8~14 kDa)透析72 h,冷冻干燥制得粗多糖。
1.2.2 水稻种子萌发将消毒好的水稻种子平铺在垫有2层滤纸的培养皿中,每皿30粒,用不同浓度的Cd与胞外多糖溶液浸泡进行复合培养。设置Cd(CdCl2·2.5H2O)浓度为0、20、40 mg·L-1,胞外多糖浓度为0、500、1 000 mg· L-1,共9个处理,每个处理3次重复,每皿每次添加10 mL上述混合溶液,每2 d更换一次培养液,培养至第8 d洗净备用。
1.2.3 水稻幼苗的培养将消毒好的水稻种子均匀撒在放置有湿润纱布的白瓷盘中,28 ℃恒温暗光催芽48 h,保持纱布湿润。将长势一致的水稻幼苗转移至含有500 mL 1/4浓度Hoagland培养液的黑色快餐盒中室温培养,每3 d更换一次培养液。培养至第10 d时,用全浓度的Hoagland培养液继续培养,每次更换培养液时,向培养液中同时添加不同浓度的Cd与屎肠球菌胞外多糖,Cd与胞外多糖浓度如1.2.2所述,设置9个处理,每个处理4次重复,每3 d更换一次培养液。水稻生长至第15 d与第25 d时取样进行数据测定。
1.2.4 水稻形态指标的测定在第3 d测定水稻种子发芽势,第8 d测定种子发芽率,同时在第8 d时记录水稻种子根长和芽长。水稻幼苗在播种后第15 d与第25 d时随机取样,测定其株高、叶长、根长。
1.2.5 水稻Cd含量的测定参照1.2.3,水稻培养至第10 d时,向营养液中添加Cd与屎肠球菌胞外多糖,Cd浓度恒定为20 mg· L-1,胞外多糖浓度为0、50、100 mg·L-1,每个处理4次重复,培养至第15 d。取新鲜水稻组织,用含有硫酸钙的去离子水洗涤,于80 ℃下烘干3 d,样品置于3 mL HNO3中消化,先于75 ℃消化10 min,再于105 ℃加热15 min,随后冷却10 min,向三角瓶中添加1 mL H2O2,随后再于109 ℃加热15 min。使用原子吸收分光光度计(AAS)测定样品中Cd浓度,从1 000 mg·L-1的原液中制备Cd的标准溶液,进行梯度稀释(0.1~4.0 mg·L-1),以覆盖标准校准曲线的最佳吸光度范围。
1.2.6 水稻可溶性糖和可溶性蛋白含量的测定参考陈顺钰等[15]的方法,采用硫酸-蒽酮法测定可溶性糖,采用考马斯亮蓝法测定可溶性蛋白。
1.2.7 抗氧化酶活及丙二醛含量的测定丙二醛(Malondialdehyde,MDA)含量采用硫代巴比妥酸(TBA)[16]法测定。抗氧化酶活性的测定参考Zhang等[17]的方法,采用氮蓝四唑(NBT)比色法测定超氧化物歧化酶(Superoxide dismutase,SOD)活性、双氧水法测定过氧化氢酶(Catalase,CAT)活性、愈创木酚法测定过氧化物酶(Peroxidase,POD)活性。
1.2.8 光合色素的测定参考Shyam等[18]的方法,采用乙醇丙酮法测定光合色素的含量。
1.2.9 类黄酮和花色素苷的测定取新鲜叶片0.5 g,用适量含1%盐酸的乙醇溶液研磨,于30 ℃摇床(100 r·min-1)浸提2 h,过滤,定容至10 mL备用。
类黄酮的测定参考张路等[19]的方法,采用亚硝酸钠-硝酸铝比色法测定。以芦丁为标准品,以芦丁浓度(mg·mL-1)为纵坐标,吸光度为横坐标的拟合标准曲线:y=0.340 3x-0.004 6,相关系数r=0.998 7。
花色素苷的测定参考黄莹莹[20]的方法,采用分光光度计法测定提取液在535 nm处的OD值。花色素苷含量(μg·g-1)=OD×10/m,m为水稻叶片质量(g)。
1.2.10 傅里叶红外变换光谱分析(FTIR)参照余顺慧等[21]的方法,取新鲜水稻叶片于105 ℃杀青30 min,再于75 ℃烘箱中干燥48 h,粉碎后过75 μm筛子,测定时将样品与KBr混合,设置光谱范围4 000~400 cm-1,分辨率4 cm-1。红外光谱图中的特征吸收峰与官能团鉴定参考文献[22]。
1.2.11 统计分析所有数据采用DPS 7.05软件进行统计分析和方差分析,采用Origin 2018软件进行作图。图、表中数值为平均值±标准差。
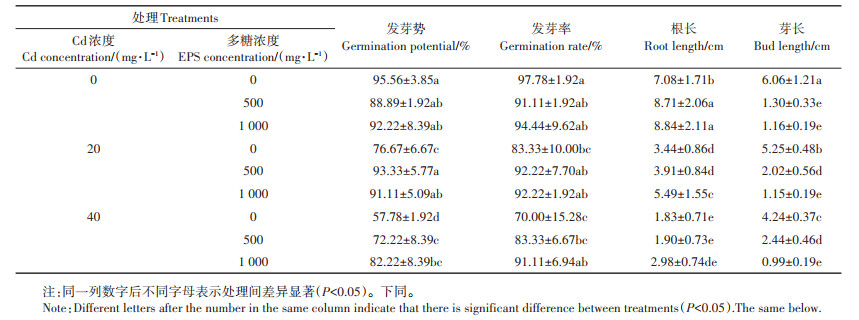
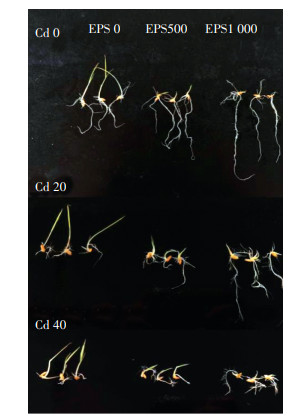
2 结果与分析 2.1 胞外多糖对Cd胁迫下水稻种子萌发的影响 2.1.1 对水稻种子萌发态指标的影响由表 1及图 1可以看出,Cd胁迫严重抑制了水稻种子的萌发,且随着Cd浓度升高抑制作用增强。在Cd胁迫下添加胞外多糖促进了水稻种子萌发的发芽势和发芽率。在20 mg·L-1Cd胁迫下,相较于不添加胞外多糖组,添加500 mg·L-1和1 000 mg·L-1胞外多糖水稻种子的发芽势分别提高了21.73%和18.83%,发芽率均提高了10.67%。
|
|
表 1 不同浓度屎肠球菌胞外多糖对Cd胁迫下水稻种子发芽率、发芽势、根长和芽长的影响 Table 1 Effects of different concentrations of exopolysaccharides from Enterococcus faecalis on germination rate, germination potential, root length and bud length of rice seeds under cadmium stress |
|
图 1 屎肠球菌胞外多糖对Cd胁迫下水稻种子萌发的影响 Figure 1 Effect of exopolysaccharides from Enterococcus faecalis on rice seed germination under cadmium stress |
Cd胁迫条件下,胞外多糖的添加促进了根的生长。在40 mg·L-1Cd胁迫下,与不添加胞外多糖组相比,添加500 mg·L-1和1 000 mg·L-1胞外多糖使水稻根长分别增加了3.83%和62.84%。但值得注意的是,水稻种子的芽长受到胞外多糖的强烈抑制,在40 mg· L-1Cd胁迫下,添加500 mg·L-1和1 000 mg·L-1胞外多糖较不添加胞外多糖组使水稻芽长分别降低了42.45%和76.65%。
2.1.2 对水稻种子可溶性糖和可溶性蛋白含量的影响由图 2可知,Cd胁迫显著提高了水稻种子蛋白质的含量,添加胞外多糖提高了水稻种子萌发过程中可溶性蛋白的含量,抑制了可溶性糖的含量,且随着胞外多糖浓度升高,可溶性蛋白含量也升高。与相应对照组相比,在20 mg·L-1Cd胁迫下,添加500 mg·L-1和1 000 mg·L-1胞外多糖水稻种子可溶性蛋白含量分别提高了10.15%和6.79%,在40 mg·L-1Cd胁迫下,可溶性蛋白含量分别提高了16.70%和29.25%。
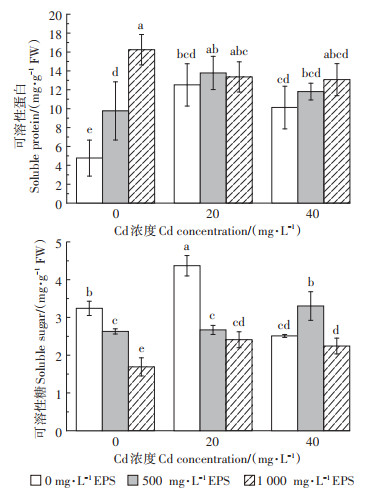
|
不同字母表示处理间差异显著(P < 0.05)。下同 Different letters indicate that there is significant difference between treatments(P < 0.05). The same below 图 2 屎肠球菌胞外多糖对Cd胁迫下水稻种子可溶性蛋白及可溶性糖含量的影响 Figure 2 Effect of exopolysaccharides from Enterococcus faecalis on the content of soluble protein and sugar in rice seeds under cadmium stress |
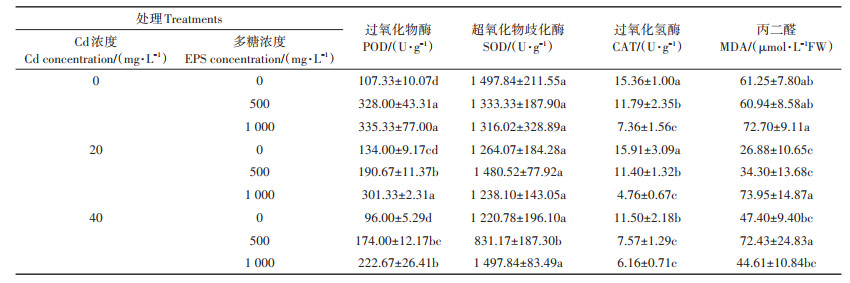
由表 2可知,Cd的存在显著抑制了水稻体内多种抗氧化酶的活性,而添加胞外多糖显著提升了水稻种子过氧化物酶的活性,且其上升趋势与胞外多糖浓度有明显的关联性。相较于相应对照组,在20 mg· L-1Cd胁迫下,添加500 mg·L-1和1 000 mg·L-1胞外多糖后,水稻种子POD酶活分别提高了42.29%和124.87%,而在40 mg·L-1Cd胁迫下,POD酶活分别提高了81.25%和131.95%。同时,在Cd胁迫条件下添加胞外多糖降低了水稻CAT酶活,提高了水稻种子MDA的含量,但对SOD酶活性无明显影响。
|
|
表 2 屎肠球菌胞外多糖对Cd胁迫下水稻种子抗氧化酶活及MDA含量的影响 Table 2 Effects of exopolysaccharides from Enterococcus faecalis on antioxidant enzyme activity and MDA content of rice seeds under cadmium stress |
不同浓度Cd胁迫条件下,添加胞外多糖对水稻形态的影响效果如表 3所示。Cd胁迫明显抑制了水稻幼苗的生长,而添加胞外多糖可提高Cd胁迫下水稻幼苗的株高、根长和叶长。当水稻生长至第15 d时,相较于相应对照组,在20 mg·L-1Cd胁迫下,添加500 mg·L-1胞外多糖处理组水稻幼苗株高和叶长分别提高了7.42%和6.26%,而在40 mg·L-1Cd胁迫时,株高和叶长分别提高了15.08%和12.33%。当水稻生长至第25 d时,也得到了相似的结果。
|
|
表 3 屎肠球菌胞外多糖对Cd胁迫下水稻幼苗形态指标的影响 Table 3 Effect of exopolysaccharides from Enterococcus faecalis on the morphological indexes of rice seedlings under cadmium stress |
胞外多糖的添加对水稻幼苗地上及地下部分Cd含量有较为显著的影响。由图 3可知,Cd的添加显著提高了水稻幼苗体内Cd的含量,相对于不添加胞外多糖组,胞外多糖的添加促进了水稻根部Cd含量的升高,但显著降低了水稻叶片Cd的含量。在添加50 mg·L-1胞外多糖时,水稻根部的Cd含量相较对照提高了5.32%,水稻叶片Cd含量降低了14%。
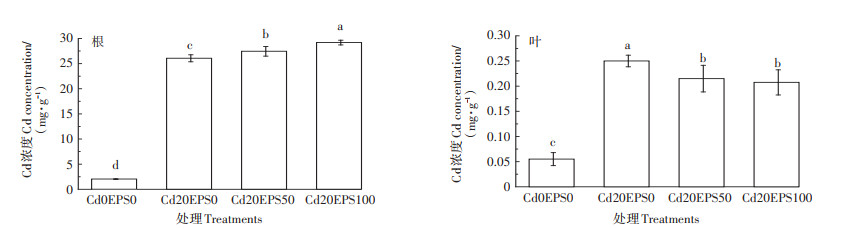
|
图 3 屎肠球菌胞外多糖对Cd胁迫下水稻幼苗Cd含量的影响 Figure 3 Effect of exopolysaccharides from Enterococcus faecalis on cadmium content in rice seedlings under cadmium stress |
Cd的存在显著抑制了水稻幼苗CAT与POD的活性,且提高了水稻体内MDA的含量,而添加胞外多糖对Cd胁迫下水稻幼苗抗氧化酶的活力有一定的促进作用,在水稻生长至第25 d时显著降低了水稻幼苗MDA含量。从图 4可以看出,当水稻生长至第15 d时,胞外多糖对水稻幼苗POD与SOD的活力存在一定促进作用,500 mg·L-1胞外多糖处理组,在20 mg· L-1Cd胁迫下,水稻幼苗POD活力相比于对照组提高了71.43%,在40 mg·L-1Cd胁迫下SOD活力相比于对照组提高了31.20%,但胞外多糖明显抑制了水稻幼苗CAT的活力,且提高了水稻体内MDA的含量。当水稻生长至25 d时,胞外多糖对水稻幼苗体内POD、SOD与CAT有一定促进作用,但在不同浓度Cd胁迫下存在差异,20 mg·L-1 Cd胁迫下胞外多糖促进了水稻体内POD和SOD的活力,40 mg·L-1 Cd胁迫下胞外多糖促进了水稻体内SOD和CAT的活力,且添加胞外多糖显著降低了水稻体内MDA的含量。
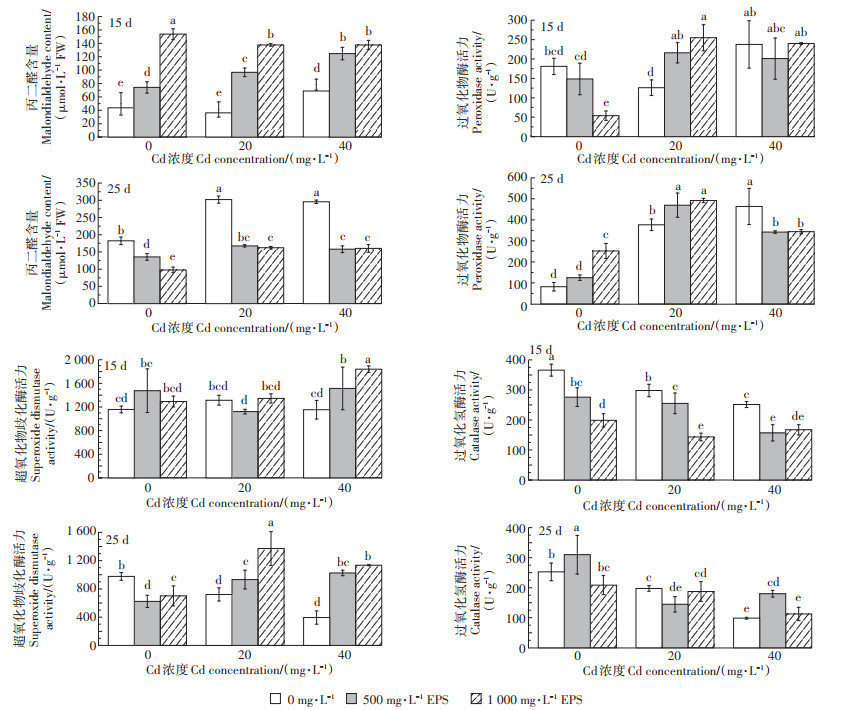
|
图 4 屎肠球菌胞外多糖对Cd胁迫下水稻幼苗抗氧化酶及MDA含量的影响 Figure 4 Effect of exopolysaccharides from Enterococcus faecalis on the activities of antioxidant enzymes and malondialdehyde contents in rice seedlings under cadmium stress |
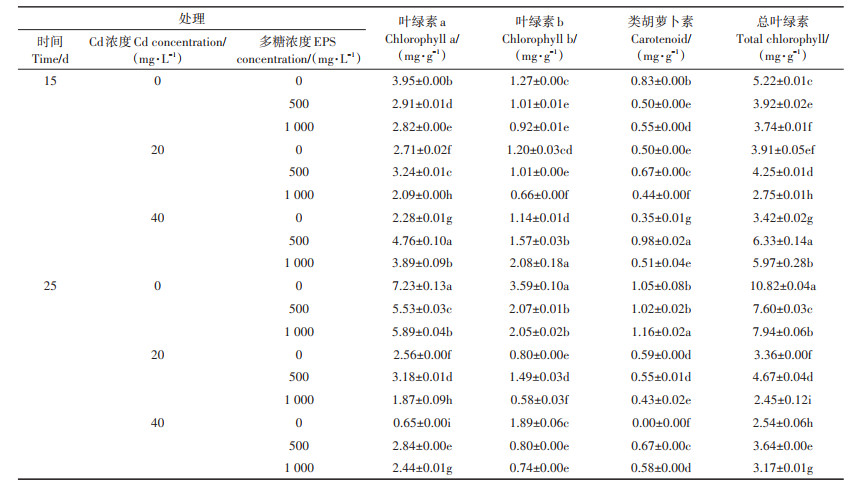
由表 4可知,Cd的存在显著抑制了水稻叶片光合色素的含量,胞外多糖对水稻幼苗光合色素含量有明显促进作用。当水稻生长至第15 d时,在20 mg·L-1 Cd胁迫下,500 mg·L-1胞外多糖处理组相较于未处理组叶绿素a、类胡萝卜素、总叶绿素含量分别上升19.55%、34.00%和8.60%,叶绿素b含量下降了15.84%。在40 mg·L-1 Cd胁迫下,不同浓度胞外多糖均可提高水稻幼苗光合色素含量,其中500 mg·L-1胞外多糖效果最显著,相较于未处理组,叶绿素a、叶绿素b、类胡萝卜素和总叶绿素含量分别提高了108.77%、37.71%、180.00%、85.08%。当水稻生长至第25 d时,在20 mg·L-1 Cd胁迫下,500 mg·L-1胞外多糖处理组效果最佳,相较于对照组,叶绿素a、叶绿素b、总叶绿素含量分别提高了24.22%、86.25%和38.99%。
|
|
表 4 屎肠球菌胞外多糖对Cd胁迫下水稻幼苗光合色素含量的影响 Table 4 Effect of exopolysaccharides from Enterococcus faecalis on the morphological index of rice seedlings under cadmium stress |
由图 5可知,Cd胁迫显著抑制了水稻叶片内类黄酮与花色素苷的含量,添加胞外多糖有效提高水稻幼苗类黄酮和花色素苷含量,且500 mg·L-1胞外多糖效果最佳。当水稻生长至第15 d时,添加胞外多糖促进了水稻幼苗类黄酮与花色素苷的含量,添加500 mg· L-1胞外多糖使得在20 mg·L-1 Cd胁迫下水稻叶片类黄酮与花色素苷含量相较于对照组分别提高了208.74%和27.13%,在40 mg·L-1 Cd胁迫下分别提高了165.02%和28.57%。当水稻生长至第25 d时,添加胞外多糖同样促进了水稻幼苗类黄酮与花色素苷的含量,添加500 mg·L-1胞外多糖使得在20 mg·L-1 Cd胁迫下水稻类黄酮与花色素苷含量分别提高了106.23%和40.70%,在40 mg·L-1 Cd胁迫下分别提高了186.39%和118.75%。

|
图 5 胞外多糖对Cd胁迫下水稻幼苗类黄酮及花色素苷含量的影响 Figure 5 Effects of exopolysaccharides from Enterococcus faecalis on the contents of flavonoids and anthocyanins in rice seedlings under cadmium stress |
植物体内的有机大分子存在特异的官能团与转动方式,可以通过FTIR进行快速识别,且特征吸收峰吸光度值的变化能侧面反映此特征峰所代表官能团物质含量的变化。在不同浓度的Cd胁迫和胞外多糖添加量下,应用FTIR对不同处理条件下水稻幼苗叶片进行测定,结果如图 6所示。由图可知,不同处理未使得各特征峰出现位移且无新特征峰出现,只是各特征峰峰强发生了变化,Cd胁迫使得水稻叶片的红外特征吸收峰型变窄变小,胞外多糖的添加使得水稻叶片恢复了原来的吸收峰型,同时,胞外多糖的添加提高了水稻叶片各特征吸收峰的峰值。在40 mg·L-1 Cd胁迫下添加胞外多糖使得水稻叶片在3 325~3 425、2 916~2 930、1 638~1 660、1 383~1 406 cm-1和1 036~1 065 cm-1处的红外吸收峰值上升,且随着多糖浓度升高而提高。由此可知胞外多糖提高了Cd胁迫下水稻叶片中碳水化合物、蛋白质、脂类和羧酸盐的含量。

|
图中Cd和EPS的浓度单位为mg·L-1 In figures, the unit of Cd and EPS concentration is mg·L-1 图 6 添加胞外多糖时镉胁迫下水稻幼苗叶片红外吸收图谱 Figure 6 Infrared absorption spectrum of rice seedling leaves under Cd stress with exopolysaccharides from Enterococcus faecalis |
Cd作为一种非氧化还原性重金属,对植物有较强的毒害作用。Cd被植物吸收后,会诱导植物产生自由基,进而引起植物组织的氧化应激反应[23]。同时,Cd会与植物体内酶的活性中心或蛋白巯基结合,取代蛋白反应中心的Ca2+、Mg2+、Mn2+等金属离子,抑制植物体内酶活性,继而抑制植物生长[24]。此外,Cd还具有导致植物黄化、加速植物衰老等多种效应[25],是一种对植物生长影响极大的重金属。因此长期以来,如何降低Cd胁迫条件下农作物的生长特性,缓解Cd元素带来的毒害效应,一直是农业生产领域研究的热点问题。
糖是一种类似于植物激素的信号分子,可以调节植物的营养传输、下胚轴伸长、子叶绿化和芽的发育[26],在植物的生长发育和逆境响应中有着重要的作用[27]。León等[28]认为葡萄糖的添加会影响拟南芥的生长发育,而这种影响与植物应激激素乙烯与脱落酸合成之间存在紧密的联系;潘丽芹等[29]报道低浓度的壳聚糖对盐胁迫白三叶种子的萌发与生长有一定的促进作用,但当壳聚糖浓度高于100 mg·L-1时,壳聚糖对白三叶种子的根与芽的发育均有明显的抑制作用;向达兵等[30]研究了内生真菌(Bionectria pityrodes)多糖浸种对苦荞种子萌发的影响,结果表明当所用内生真菌多糖浓度为100 mg·kg-1时,对苦荞株高有明显的促进效果,但当多糖浓度继续升高时,其促进效果显著下降,而当浓度上升到800 mg·kg-1时,真菌多糖浸种处理有明显的抑制效果。本课题组前期对这一问题也进行了类似的研究,张文平等[11]研究发现乳酸菌胞外多糖(20~2 000 mg·L-1)对水稻种子根的生长有促进作用,且随着胞外多糖浓度的升高而增强,但对水稻种子芽的生长无显著影响;赵泽文等[14]研究发现外源添加茶树菇菌糠多糖(1~2 000 mg·L-1)可以缓解铜离子胁迫对水稻种子萌发的毒害作用,且外源添加茶树菇菌糠多糖促进了水稻种子根的生长,但对水稻种子芽的生长无显著影响。综合上述研究结果,多糖对植物发育的影响是一个非常复杂的过程,并没有体现出明显的规律性,但在一定浓度范围内,多糖类物质对植物的根部发育均具有显著的促进作用,而对芽的发育影响则有不同的效应,这种差异是否与植物或多糖种类的不同有关尚有待进一步研究。本研究中,在500~1 000 mg·L-1浓度范围内,胞外多糖的添加对水稻种子的发芽势与发芽率存在一定的促进作用,同时对根的生长发育促进尤为显著,种子内可溶性蛋白的含量也随着多糖的加入而显著上升。但是,多糖的添加对水稻种子芽的生长发育存在显著的抑制效应,水稻种子中可溶性糖的含量也显著下降。我们推测在水稻种子的萌发阶段,屎肠球菌胞外多糖可以调节水稻体内的蛋白与糖代谢通路以应对外界的Cd胁迫,而芽的生长抑制可能也与多糖调节了作物体内的代谢流分布有关,即多糖的存在使得更多的物质与能量流向植物的地下部分,从而使得地上部分的发育受到一定的抑制,但这一假设需要更进一步的研究来证实。但在幼苗生长阶段,我们没有观察到胞外多糖对叶长与株高等地上部形态指标的抑制,同时屎肠球菌胞外多糖对水稻幼苗根系生长依旧存在一定促进作用。这可能是种子萌发时期相对于其他时期更容易受到外界因素影响所导致的。
胁迫条件下,植物会通过对抗氧化系统的调节来应对外界的伤害。类黄酮[31]、花色苷素[32]、可溶性蛋白等代谢物质及过氧化物酶系等物质的大量合成,可以帮助植物抵御外界损伤,清除植物体内自由基,缓解重金属的毒害作用[33]。其中,可溶性蛋白是植物体重要的营养物质和渗透调节物质,在外界胁迫下植物体会合成更多的可溶性蛋白,这些蛋白一方面是抗氧化酶系的重要组成部分,通过催化氧化应激反应来抵御Cd的毒害;同时部分蛋白还可以直接通过螯合Cd来降低Cd的危害[34]。本试验表明环境中Cd浓度的升高会提高水稻幼苗体内POD的活力与MDA的含量,但同时抑制了SOD和CAT的活力,而屎肠球菌胞外多糖的添加对水稻幼苗体内抗氧化酶活力影响不一,其中对POD与SOD的促进效果较为显著。添加屎肠球菌胞外多糖明显提高Cd胁迫下水稻幼苗体内类黄酮与花色素苷的含量,可溶性蛋白的含量也显著上升,MDA的含量显著下降,这说明在Cd胁迫条件下,屎肠球菌胞外多糖可以促进水稻体内抗逆性物质的合成,降低有害物质累积,从而有助于保护水稻免受Cd的毒害。
叶片是植物的主要器官之一,植物体90%左右的干物质来源于叶片的光合作用[35]。同时,叶片在维持植物整体水分平衡时也起到了关键作用[36]。研究表明,Cd对植物地上部的毒害作用主要体现在对植物光合作用系统的破坏上[37]。本试验表明,Cd胁迫显著抑制了水稻叶片内光合色素含量,胞外多糖的添加提高了水稻叶片叶绿素a、叶绿素b与类胡萝卜素的含量,屎肠球菌胞外多糖通过将Cd固定在根部,减少了Cd向地上部的运输,从而保护水稻体内光合色素免受Cd的破坏,维持植物光合作用的正常运行,继而缓解Cd胁迫对水稻叶片的毒害作用。张运红等[38]发现外源添加海藻酸钠寡糖显著提高了Cd胁迫下水稻幼苗光合色素的含量,这与本研究结果相似。
傅里叶红外光谱(FTIR)是一种基于化合物极性振动键与官能团的结构分析技术,其可以表征糖类、蛋白质等大分子的结构特性[39]。目前国内学者已经开始应用FTIR技术研究植物对重金属的抗性机制[40]。余顺慧等[21]利用FTIR研究了香根草对Cd胁迫的生理响应,发现Cd胁迫抑制了香根草叶片中蛋白质与碳水化合物的合成,降低了水稻叶片中羧酸盐类物质的积累,继而抑制了香根草的生长。本研究发现,Cd胁迫使得水稻叶片的红外特征吸收峰峰型变小变窄,这表明Cd胁迫降低了水稻叶片内各种基础物质的含量,破坏了水稻叶片细胞的正常生理功能,添加屎肠球菌胞外多糖使得Cd胁迫下水稻叶片在3 325~3 425、2 916~2 930 cm-1处的峰值上升,这说明胞外多糖促进了Cd胁迫下水稻叶片纤维素、半纤维素等碳水化合物的分泌与合成;水稻叶片1 638~1 660 cm-1处的峰值提升,表明胞外多糖促进了Cd胁迫下水稻叶片多肽、蛋白质的合成;水稻叶片1 383~1 406 cm-1处峰值的提升,表明胞外多糖的添加提高了水稻叶片脂类物质的含量,保护了水稻叶片细胞膜的完整性,这与MDA的测定结果相符;而水稻叶片1 036~1 065 cm-1处峰值的升高,表明胞外多糖促进了水稻叶片羧酸盐类物质的含量,羧酸盐类物质可以通过与Cd的螯合来降低Cd的毒性,这说明胞外多糖可能通过促进水稻叶片羧酸盐的累积从而缓解Cd对水稻的毒害。综上所述,添加胞外多糖促进了水稻幼苗叶片碳水化合物、蛋白质和多肽类物质的合成,以及羧酸盐的累积。结合他人的研究结果推测胞外多糖可以通过加强渗透作用来提高水稻叶片对Cd的耐受性,从而缓解Cd胁迫对水稻幼苗的毒害作用。
4 结论(1)添加屎肠球菌胞外多糖可以缓解Cd胁迫对水稻种子萌发的毒害作用,提高水稻种子萌发的发芽势、发芽率以及根的发育,但水稻幼芽的生长会随着多糖的加入而受到一定程度的抑制,这种抑制效应在水稻幼苗生长后期消失。
(2)屎肠球菌胞外多糖促进了Cd胁迫下水稻幼苗的生长,降低了水稻体内膜脂过氧化程度,提高了水稻叶片内光合色素、类黄酮和羧酸盐类物质的含量,说明胞外多糖的添加可以通过促进抗逆物质的合成来保护水稻免受Cd的毒害。
(3)Cd可以通过破坏水稻叶片内物质的合成与运输来抑制水稻的生长,屎肠球菌胞外多糖可以将更多的Cd固定在水稻根部,降低Cd向地上部的运输,继而缓解与保护水稻免受Cd的毒害。此外,FTIR分析表明,屎肠球菌胞外多糖可以促进水稻叶片内碳水化合物、蛋白质和多肽类物质的合成以及羧酸盐的积累,并加强渗透作用提高水稻对Cd的耐受性。
| [1] |
李婧, 周艳文, 陈森, 等. 我国土壤镉污染现状、危害及其治理方法综述[J]. 安徽农学通报, 2015, 21(24): 104-107. LI Jing, ZHOU Yan-wen, CHEN Sen, et al. Actualities, damage and management of soil cadmium pollution in China[J]. Anhui Agricultural Science Bulletin, 2015, 21(24): 104-107. |
| [2] |
Parsamanesh S, Sadeghi H. The phytoremediation effect of Medicago scutellata(L.)Mill. on soils under Cd-water stress:A good choice for contaminated dry lands[J]. Environmental Science and Pollution Research, 2019, 26(28): 29065-29073. DOI:10.1007/s11356-019-05989-z |
| [3] |
Faraz A, Faizan M, Sami F, et al. Supplementation of salicylic acid and citric acid for alleviation of cadmium toxicity to Brassica juncea[J]. Journal of Plant Growth Regulation, 2019, 1: 1-15. |
| [4] |
Xie P, Deng J, Zhang H, et al. Effects of cadmium on bioaccumulation and biochemical stress response in rice(Oryza sativa L.)[J]. Ecotoxicology and Environmental Safety, 2015, 122: 392-398. DOI:10.1016/j.ecoenv.2015.09.007 |
| [5] |
李彩.硅对不同品种水稻吸收镉的影响与机制研究[D].沈阳: 沈阳农业大学, 2017. LI Cai. Effect and mechanisms of silicon application on cadmium uptake in different rice varieties[D]. Shenyang: Shenyang Agricultural University, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10157-1017124412.htm |
| [6] |
Dermont G, Bergeron M, Mercier G, et al. Soil washing for metal removal:A review of physical/chemical technologies and field applications[J]. Journal of Hazardous Materials, 2008, 152(1): 1-31. |
| [7] |
宋敏, 徐文竞, 彭向永, 等. 外源脯氨酸对镉胁迫下小麦幼苗生长的影响[J]. 应用生态学报, 2013, 24(1): 129-134. SONG Min, XU Wen-jing, PENG Xiang-yong, et al. Effects of exogenous proline on the growth of wheat seedlings under cadmium stress[J]. Chinese Journal of Applied Ecology, 2013, 24(1): 129-134. |
| [8] |
Li S, Huang R, Shah N P, et al. Antioxidant and antibacterial activities of exopolysaccharides from Bifidobacterium bifidum WBIN03 and Lactobacillus plantarum R315[J]. Journal of Dairy Science, 2014, 97(12): 7334-7343. DOI:10.3168/jds.2014-7912 |
| [9] |
Ozturk S, Aslim B, Suludere Z, et al. Metal removal of cyanobacterial exopolysaccharides by uronic acid content and monosaccharide composition[J]. Carbohydrate Polymers, 2014, 101(2): 265-271. |
| [10] |
Guo H, Yi W J, Wang P. Current understanding on biosynthesis of microbial polysaccharides[J]. Current Topics in Medicinal Chemistry, 2008, 8(2): 141-151. |
| [11] |
张文平, 杨臻, 吴佩佳, 等. 乳酸菌胞外多糖对逆境胁迫下水稻种子萌发及幼苗生长的影响[J]. 核农学报, 2019, 33(1): 138-147. ZHANG Wen-ping, YANG Zhen, WU Pei-jia, et al. Effect of exopolysaccharides of lactic acid bacteria on seed germination and seedling growth of rice under different stress[J]. Journal of Nuclear Agricultural Sciences, 2019, 33(1): 138-147. |
| [12] |
张文平, 王清, 黄诗宸, 等. 乳酸菌胞外多糖对水稻生长及土壤理化性质的影响[J]. 浙江农业学报, 2019, 31(1): 130-138. ZHANG Wen-ping, WANG Qing, HUANG Shi-chen, et al. Effects of exopolysaccharides of lactic acid bacteria on rice growth and soil physicochemical proper[J]. Acta Agriculturae Zhejiangensis, 2019, 31(1): 130-138. |
| [13] |
黄诗宸, 王清, 张文平, 等. 乳酸菌多糖对水稻种子萌发及幼苗生长的影响[J]. 江西农业学报, 2018, 30(4): 59-62. HUANG Shi-chen, WANG Qing, ZHANG Wen-ping, et al. Effects of lactic acid bacterial exopolysaccharides on seed germination and seedling growth of rice[J]. Acta Agriculturae Jiangxi, 2018, 30(4): 59-62. |
| [14] |
赵泽文, 杨政宁, 万琳, 等. 菌糠多糖对铜离子胁迫下水稻种子萌发的影响[J]. 农业环境科学学报, 2020, 39(3): 473-481. ZHAO Ze-wen, YANG Zheng-ning, WAN Lin, et al. Effects of spent mushroom substrate polysaccharide on rice seed germination under copper stress[J]. Journal of Agro-Environment Science, 2020, 39(3): 473-481. |
| [15] |
陈顺钰, 赵雅曼, 李宗勋, 等. Pb、Cd和酸胁迫下枫香萌发种子的生理生化变化及其亚细胞结构[J]. 农业环境科学学报, 2019, 38(3): 510-520. CHEN Shun-yu, ZHAO Ya-man, LI Zong-xun, et al. Biochemical changes and subcellular structure in germinating seeds of Liquidambar formosana under Pb, Cd, and acid stress[J]. Journal of Agro-Environment Science, 2019, 38(3): 510-520. |
| [16] |
王学奎. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2003. WANG Xue-kui. Principles and techniques of physiological and biochemical experiments on plants[M]. Beijing: Higher Education Press, 2003. |
| [17] |
Zhang H J, Zhang N A, Yang R C, et al. Melatonin promotes seed germination under high salinity by regulating antioxidant systems, ABA and GA interaction in cucumber(Cucumis sativus L.)[J]. Journal of Pineal Research, 2015, 57(3): 269-279. |
| [18] |
Shyam R, Aery N C. Effect of cerium on growth, dry matter production, biochemical constituents and enzymatic activities of cowpea plants[Vigna unguiculata(L.) Walp.][J]. Journal of Soil Science & Plant Nutrition, 2012, 12(1): 1-14. |
| [19] |
张路, 于慧敏, 杜凤沛, 等. 金花葵中总黄酮的分离提取及含量测定[J]. 吉林师范大学学报(自然科学版), 2015, 36(4): 104-108. ZHANG Lu, YU Hui-min, DU Feng-pei, et al. The preparative isolation and content determination of total flowones of Hibiscus Manihot L.[J]. Journal of Jilin Normal University(Natural Science Edition), 2015, 36(4): 104-108. |
| [20] |
黄莹莹.水稻籽粒花色苷、矿质元素含量及相关性状的QTL定位[D].哈尔滨: 东北农业大学, 2013. HUANG Ying-ying. QTL identification underlying anthocyanin and mineral elements content related traits in rice[D]. Harbin: Northeast Agricultural University, 2013. http://d.wanfangdata.com.cn/Thesis_Y2295518.aspx |
| [21] |
余顺慧, 张静, 陈华华, 等. 香根草对镉毒害的生理响应——采用傅里叶变换红外光谱法(FTIR)[J]. 生态学报, 2019, 39(19): 7267-7273. YU Shun-hui, ZHANG Jing, CHEN Hua-hua, et al. Physiological responses of Vetiveria zizanioides to cadmium stress by fourier transform infrared spectroscopy[J]. Acta Ecologica Sinica, 2019, 39(19): 7267-7273. |
| [22] |
Matsumura W M K, Balzaretti N M, Iannuzzi R. Fourier transform infrared characterization of the middle devonian non-vascular plant Spongiophyton[J]. Palaeontology, 2016, 59(3): 365-386. DOI:10.1111/pala.12230 |
| [23] |
Calero Muñoz N, Exposito M, Collado A, et al. Cadmium induces ROS-dependent pexophagy in Arabidopsis leaves[J]. Plant, Cell & Environment, 2019(42): 1528-1532. |
| [24] |
Yue J, Zhang X, Liu N. Retraction note to:Cadmium permeates through calcium channels and activates transcriptomic complexity in wheat roots in response to cadmium stress[J]. Genes & Genomics, 2018, 40(6): 685. |
| [25] |
沈潇, 黄瑞敏, 过子倩, 等. 镉胁迫对薄壳山核桃幼苗生长的影响[J]. 核农学报, 2018, 32(8): 1627-1638. SHEN Xiao, HUANG Rui-min, GUO Zi-qian, et al. Effects of cadmium stress on seedling growth of Carya illinoinensis[J]. Journal of Nuclear Agricultural Sciences, 2018, 32(8): 1627-1638. |
| [26] |
Shahri W, Ahmad S S, Tahir I. Sugar signaling in plant growth and development[M]. Plant signaling: Understanding the molecular crosstalk, New Delhi:Springer India, 2014: 93-116.
|
| [27] |
赵莹, 杨克军, 李佐同, 等. 外源糖浸种缓解盐胁迫下玉米种子萌发[J]. 应用生态学报, 2015, 26(9): 2735-2742. ZHAO Ying, YANG Ke-jun, LI Zuo-tong, et al. Alleviation of salt stress during maize seed germination by presoaking with exogenous sugar[J]. Chinese Journal of Applied Ecology, 2015, 26(9): 2735-2742. |
| [28] |
León P, Sheen J. Sugar and hormone connections[J]. Trends in Plant Science, 2003, 8(3): 110-116. DOI:10.1016/S1360-1385(03)00011-6 |
| [29] |
潘丽芹, 韦海忠, 张浩, 等. 壳聚糖对盐胁迫下白三叶种子萌发及幼苗生长的缓解作用[J]. 分子植物育种, 2018, 16(11): 3740-3744. PAN Li-qin, WEI Hai-zhong, ZHANG Hao, et al. Effects of chitosan on seed germination and seedling growth of Trifolium Repens under salt stress[J]. Molecular Plant Breeding, 2018, 16(11): 3740-3744. |
| [30] |
向达兵, 赵江林, 马成瑞, 等. 内生真菌多糖浸种对苦荞出苗及幼苗素质的影响[J]. 广东农业科学, 2018, 45(11): 1-6. XIANG Da-bing, ZHAO Jiang-lin, MA Cheng-rui, et al. Effects of seed soaked by polysaccharide obtained from endophytic fungus on the sprout and seedling quality of tartary buckwheat[J]. Guangdong Agricultural Sciences, 2018, 45(11): 1-6. |
| [31] |
Juan C, Xue M M, Yan P S. Determination of seven flavonoids in Ixeridium gracile(dc.)shih by high-performance liquid chromatography[J]. Journal of Aoac International, 2019, 92(3): 773-778. |
| [32] |
Abdelgawad M A M, Abdelaziz M A M, Elsayed M E M, et al. In vitro antioxidant, total phenolic and flavonoid contents of six allium species growing in egypt[J]. Journal of Microbiology Biotechnology & Food Sciences, 2018, 4: 343-346. |
| [33] |
Jaakola L, Hohtola A. Effect of latitude on flavonoid biosynthesis in plants[J]. Plant Cell and Environment, 2010, 33(8): 1239-1247. |
| [34] |
Wingler A. Transitioning to the next phase:The role of sugar signaling throughout the plant life cycle[J]. Plant Physiology, 2018, 176(2): 1075. |
| [35] |
Somavat P, Kumar D, Singh V. Techno-economic feasibility analysis of blue and purple corn processing for anthocyanin extraction and ethanol production using modified dry grind process[J]. Industrial Crops & Products, 2018, 115: 78-87. |
| [36] |
王帆, 何奇瑾, 周广胜. 夏玉米三叶期持续干旱下不同叶位叶片含水量变化及其与光合作用的关系[J]. 生态学报, 2019, 39(1): 254-264. WANG Fan, HE Qi-jin, ZHOU Guang-sheng. Leaf water content at different positions and its relationship with photosynthesis when consecutive drought treatments are applied to summer maize from the 3-leaf stage[J]. Acta Ecologica Sinica, 2019, 39(1): 254-264. |
| [37] |
Toppi L S D, Gabbrielli R. Response to cadmium in higher plants[J]. Environmental & Experimental Botany, 1999, 41(2): 105-130. |
| [38] |
张运红, 孙克刚, 杜君, 等. 海藻酸钠寡糖提高水稻幼苗对镉胁迫的抗性[J]. 中国土壤与肥料, 2017(4): 143-149. ZHANG Yun-hong, SUN Ke-gang, DU Jun, et al. Alginate oligosaccharides enhanced the resistance of Oryza sativa L. to cadmium stress[J]. Soil and Fertilizer Sciences in China, 2017(4): 143-149. |
| [39] |
闫磊, 姜存仓, Muhammad Riaz, 等. 不同形态硼对油菜幼苗铝毒的缓解效应及其FTIR特征分析[J]. 作物学报, 2017, 43(12): 1817-1826. YAN Lei, JIANG Cun-cang, Muhammad Riaz, et al. Mitigative effect of different forms of boron on aluminum toxicity of rape seedlings and its FTIR characteristics[J]. Acta Agronomica Sinica, 2017, 43(12): 1817-1826. |
| [40] |
Szymanska-Chargot M, Zdunek A. Use of FT-IR spectra and PCA to the bulk characterization of cell wall residues of fruits and vegetables along a fraction process[J]. Food Biophysics, 2013, 8(1): 29-42. |
 2020, Vol. 39
2020, Vol. 39