2. 西北农林科技大学理学院, 陕西 杨凌 712100;
3. 西北农林科技大学创新实验学院, 陕西 杨凌 712100
2. College of Science, Northwest A&F University, Yangling 712100, China;
3. College of Innovation and Experiment, Northwest A&F University, Yangling 712100, China
塑料产品由于成本低廉、不易腐烂和适用范围广泛等,在人类生活中被大量使用,但同时,自然环境中的塑料污染问题也愈发严重。特别在农业中,塑料地膜的使用在提高农业产量的同时也使农田中白色污染问题愈加严重[1-4]。现阶段,农用地膜大部分为聚乙烯材料,其化学结构稳定并难以降解[5-6],残留在农田中的地膜会影响土壤结构与功能,甚至影响植物生长[7-8]。目前对废弃塑料地膜的处置方式大多为填埋、焚烧、二次加工等,这些处理方式对环境的污染较大,且处理成本高[9]。因此,地膜残留问题现已成为全球环境污染的热点问题。
近年来,生物降解地膜的出现在一定程度上减轻了农田中聚乙烯地膜的污染问题。聚己二酸/对苯二甲酸丁二酯(Polyadipate/butylene terephthalate,PBAT)是一种可生物降解的聚合物,其具有良好的耐热性和延伸性,在土壤微生物作用下可降解为无毒小分子,对生态环境友好。目前全球PBAT产量占生物塑料总产量的7.2%,PBAT地膜已成为生物降解地膜中常见的一种,已经逐渐商业化[10-12]。2011年,国家发改委出台的《产业结构调整指导目录(2011年本)》中指出,要鼓励使用生物降解材料,推动农用薄膜无污染降解技术的开发和利用。2017年,全生物降解材料被列入《“十三五”材料领域科技创新专项规划》。自此,PBAT地膜的年生产量从2011年的1.19万t增长至2018年的3.38万t。据综合农膜发展趋势以及塑料污染防控政策预测分析,PBAT地膜的产量将增至每年34万t[13]。
虽然PBAT属于可降解材料,但有研究表明其在特定条件下才能达到较好的降解效果,实际应用过程中其降解情况并不理想,邬强等[14]研究发现,在棉花种植过程中铺施PBAT地膜,180 d后,PBAT地膜表面仅出现细小裂纹,降解程度不明显。目前关于PBAT地膜的降解菌种资源还较少,且现有菌种在温和条件下对PBAT的降解效果不理想[15-16]。因此,深入寻找对PBAT塑料地膜的高效降解菌株非常必要。
本试验从垃圾场下层土壤中筛选对PBAT有潜在降解作用的菌种,通过降解性能测定,拟筛选可以高效降解PBAT地膜的菌株,旨在丰富PBAT降解菌种资源库,为PBAT地膜降解提供理论支持和参考,有利于生物降解地膜的推广。
1 材料与方法 1.1 塑料样品与塑料降解菌来源本试验使用的塑料地膜样品类型为PBAT生物可降解地膜,由山东农业大学徐静教授提供。本试验菌株分离自长期存在PBAT塑料地膜污染的陕西省杨凌示范区曹新庄生活垃圾填埋场的下层土壤。
1.2 试验仪器与培养基所需仪器有高压蒸汽灭菌锅(GI54TW),超声波清洗器(KQ-250B),恒温培养摇床(ZWY-2102C),恒温培养箱(DNP-9272),PCR仪(SimpliAmp),酶标仪(Epoch),电泳仪(Powerpac Basic),凝胶成像仪(Biorad Gel Imager),扫描电子显微镜(S-4800;Hitachi,Japan),原子力显微镜(Multimode-8;Bruker,USA),傅里叶变换红外光谱仪(Vetex70;Bruker,Germany)和水接触角仪(JC2000D1;Powereach,China)等。
所需培养基有微量碳源培养基、无机盐培养基、LB营养培养基、脲酶产生试验培养基、碳源利用试验培养基、脂肪酶产生试验培养基、H2S产生培养基、淀粉降解试验培养基、漆酶产生试验培养基以及过氧化氢酶产生试验培养基等[17-19]。
1.3 PBAT地膜降解菌的筛选膜片表面灭菌处理:将PBAT地膜剪成大小为2 cm×1.5 cm的膜片,然后依次浸泡于2% SDS、75%乙醇、95%乙醇中4 h,再用无菌水冲洗干净,置于紫外灭菌灯下灭菌15 min[20]。
将1.0 g土壤加入9.0 mL微量碳源液体培养基中,并加入1片预处理过的PBAT膜片,28 ℃、180 r·min-1振荡培养10 d;再将膜片转接入10.0 mL新的微量碳源液体培养基中继续培养10 d。使用PBS溶液(0.1 mol·L-1)振荡清洗膜片,将菌悬液转接入30 mL含有0.1 g左右PBAT地膜的无机盐培养基中,180 r·min-1、28 ℃条件下振荡培养30 d。使用稀释平板涂布法,吸取培养30 d后的培养悬液涂布于LB固体培养基,挑选优势菌落进行多次分离纯化,得到对PBAT有潜在降解能力的菌株。
1.4 PBAT地膜降解菌的鉴定使用碱裂解法提取细菌总DNA[21],以其为模板,以27F/1492R(27F:5′ -AGAGTTTGATCC TGGCTCAG- 3′;1492R:5′-TACGGCTACCTTGTTACGACTT-3′)和P1 / P6(P1:5′ - CGGGATCCAGAGTTTGATCCTGGCT⁃ CAGAACGAACG CT-3′;P6:5′ -CGGGATCCTACG⁃ GCTACCTTGTTACGACTTCACCCC- 3′)为引物进行PCR扩增。PCR扩增反应条件:95 ℃预变性5 min;95 ℃变性1 min,58 ℃退火1 min,72 ℃延伸2 min,循环30次;最后72 ℃延伸10 min,4 ℃保存。对扩增产物进行电泳检测,委托生工生物工程(上海)股份有限公司测序。将测序结果与Ezbiocloud数据库中已有序列进行序列比对分析,并选取同源性相近的菌株,采用MEGA 7.0软件构建系统发育树,构建方法为Neighbor-joining,检验方法为Bootstrp method,比对次数为1 000。
1.5 PBAT地膜降解率的测定将分离、纯化得到的潜在PBAT降解菌株于LB培养基中培养至对数生长期,4 ℃、8 000 r·min-1离心10 min,去掉上清液,沉淀菌体用0.01 mol·L-1磷酸盐缓冲溶液冲洗。将菌体接种于含有30 mL无机盐培养基的锥形瓶中,调整并保持菌液的OD600值为0.8~ 1.0。加入0.1 g表面灭菌的PBAT塑料地膜膜片(灭菌方法同1.3),28 ℃、180 r·min-1振荡培养8周。将不接种菌悬液的含有PBAT膜片的液体无机盐培养基在相同条件下培养,作为空白对照(CK)。8周后,将膜片表面冲洗干净并干燥至恒质量,计算膜片失重率[2, 22]。
膜片的失重率=(膜片初始质量-膜片被降解后质量)/膜片初始质量×100%
1.6 扫描电子显微镜(SEM)以及原子力显微镜(AFM)观察将被降解8周的膜片清洗干净后自然干燥。固定喷金后在扫描电子显微镜(S-4800;Hitachi,Japan)下观察其表面是否出现褶皱及孔洞等破损情况[2]。利用原子力显微镜(Multimode-8;Bruker,USA)扫描塑料地膜的表面特征,通过NanoScope Analysis软件分析图像,观察膜片表面的粗糙程度,扫描尺寸为5 mm×5 mm[2, 23]。
1.7 傅立叶变换红外光谱仪(FTIR)测定将被降解8周的膜片清洗干净后自然干燥。使用傅里叶红外光谱仪(Vetex70;Bruker,Germany)测定膜片表面的官能团,扫描波长范围为600~4 000 cm-1,观察降解后膜片表面是否有新的极性官能团[5, 24]。
1.8 水接触角(WCA)测定将降解8周的塑料地膜清洗干净后自然干燥,使用水接触角计(JC2000D1;Powereach,China)进行膜片静水接触角的测定,进而分析膜片表面疏水性的变化[24-25]。
1.9 数据处理本研究数据运用IBM SPSS Statistics 23进行统计学分析,采用单因素方差分析T检验对不同处理进行分析(n=3),利用OriginPro 2016绘图。
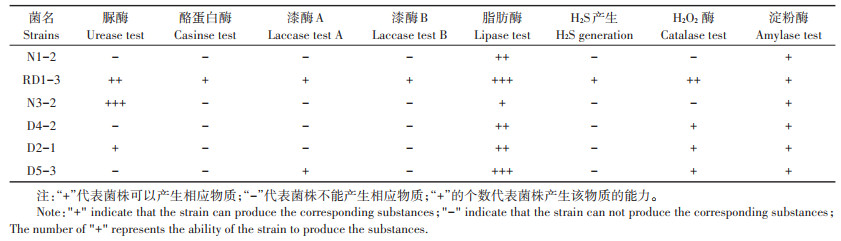
2 结果与分析 2.1 PBAT地膜降解菌株鉴定结果从以PBAT地膜为唯一碳源的培养基中共筛选出56株细菌。通过潜在降解菌生长的优势程度,挑选出6株优势菌作为潜在的高效PBAT塑料降解菌进行后续降解性能分析。该6株优势菌的系统进化树如图 1所示,菌株N1-2、RD1-3以及D4-2均属于假单胞菌属(Pseudomonas),菌株D2-1、N3-2和D5-3分别属于黄杆菌属(Chryseobacterium)、克雷伯氏菌属(Klebsiella)和寡养单胞菌属(Stenotrophomonas)。
|
图 1 基于16S rRNA基因的潜在PBAT地膜降解菌的系统发育树 Figure 1 Phylogenetic tree of potential PBAT mulch-degrading bacteria based on 16S rDNA |
6株潜在降解菌株的各项生理生化实验鉴定结果如表 1所示。菌株RD1-3可以分泌的酶的种类最多且可产生H2S。其他5株潜在高效塑料降解菌均能分泌脂肪酶和淀粉酶,菌株N3-2分泌脲酶的能力较高。
|
|
表 1 潜在降解菌的生理生化试验结果 Table 1 Physiological and biochemical test results of potentially degrading bacteria |
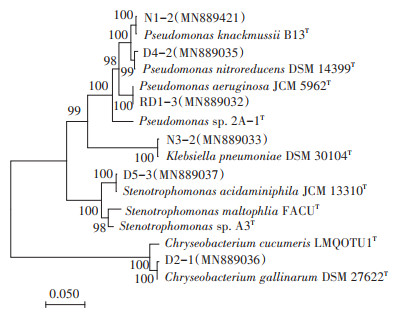
由图 2可知,以PBAT为唯一碳源时,菌株RD1-3对PBAT膜片的降解率最高,8周降解率可达6.88%± 0.06%。其次为菌株N1-2以及N3-2,对膜片的降解率分别可达6.49%±0.01%和6.54%±0.09%。其余菌株对PBAT的降解率均在5%左右。由此可以初步推测,菌株RD1-3、N1-2以及N3-2对PBAT具有较高的降解作用。
|
不同小写字母表示处理间差异显著(P < 0.05)。下同 The different lowercase letters indicate significant differences among treatments(P < 0.05). The same below 图 2 不同菌株处理的PBAT塑料地膜的失重率 Figure 2 Weight loss of PBAT plastic film by different strains |
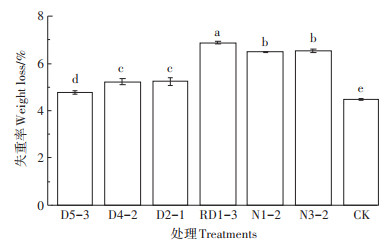
扫描电镜结果显示,未经处理的原膜(ORI)以及CK处理表面光滑平整,6株潜在的PBAT降解菌均可使膜片表面产生破损。菌株N1-2、RD1-3以及D4-2处理组中,膜片表面均出现明显的褶皱以及沟壑。在菌株N3-2、D2-1以及D5-3处理组中,膜片表面也出现细小沟壑以及微孔,但均不明显(图 3)。

|
图 3 不同菌株处理PBAT塑料地膜降解前后的扫描电镜图(×3 000倍) Figure 3 Scanning electron microscope observations results of PBAT plastic film before and after degradation by different strains(×3 000 times) |
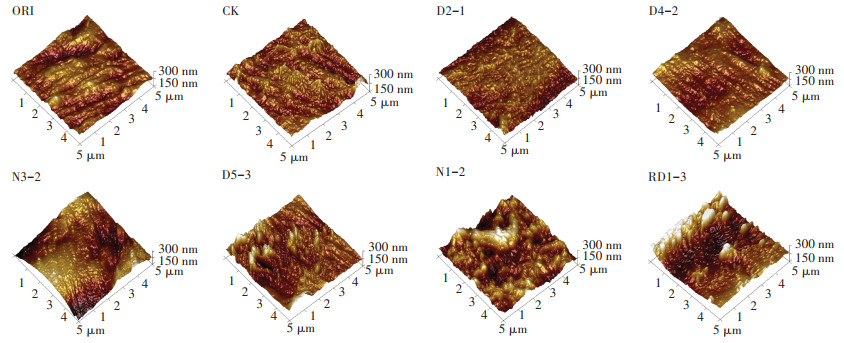
图 4为原子力显微镜下观察到的降解8周后PBAT地膜表面特征。ORI和CK组中膜片表面粗糙程度很轻,较为平整。在菌株N1-2、RD1-3以及D5-3降解8周后,PBAT膜片表面出现明显凸起及凹陷,粗糙程度加深。其余处理组的膜片表面粗糙度与CK组差别均不明显。本结果与扫描电镜结果相似,可以看出,菌株N1-2以及RD1-3对PBAT膜片表面形态影响较大。
|
图 4 不同菌株处理PBAT塑料地膜降解前后的原子力显微镜观察结果 Figure 4 Atomic force microscopy observation results of PBAT plastic film before and after degradation by different strains |
PBAT为芳香族和脂肪族的聚合物。由图 5可知,红外光谱图中1 450 cm-1附近的苯环特征峰(—C6H4—)、1 716 cm-1附近的羰基特征峰(—C=O)以及2 966 cm-1附近的—CH2—不对称伸缩振动峰均为PBAT的特征峰。降解8周后,6株潜在PBAT降解菌均向PBAT结构中引入了新的极性官能团,如碳氮三键(2 350 cm-1附近)、碳碳双键(3 099 cm-1附近)以及羟基(3 400~3 330 cm-1)等,极性官能团的引入可以降低塑料膜片的稳定性,从而使其更易被降解。菌株RD1-3及N1-2在2 350 cm-1附近的特征峰较其他菌株强,说明该两株菌能增强膜片的不稳定性,从而更易对PBAT薄膜进行降解。
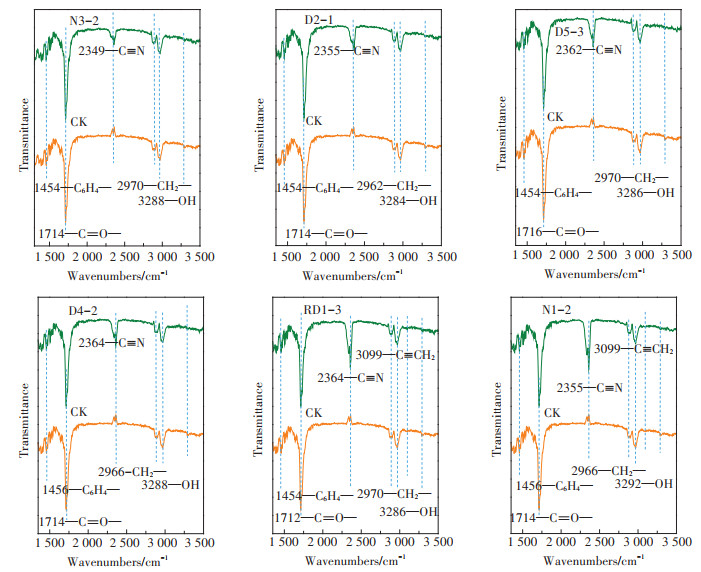
|
图 5 不同菌株处理PBAT塑料地膜降解前后的傅里叶变换红外光谱图 Figure 5 Fourier transform infrared spectroscopy analysis of PBAT plastic film by different strains before and after degradation |
水接触角能反映膜片表面疏水性大小,膜片表面疏水性降低是塑料被降解的重要表征[26]。如图 6所示,降解8周后,6种菌株均可显著降低PBAT膜片表面水接触角大小(P < 0.05),菌株D4-2以及N1-2降低膜片水接触角的程度最大,分别降低至73.6°±1.3°和73.1°±1.4°。此外,菌株RD1-3降低水接触角的程度也较高(77.9°±0.7°)。由此可知,此3株菌均能较大程度地降低膜片表面疏水性,从而证明3株菌对PBAT塑料膜片具有较好的降解作用。

|
图 6 不同菌株处理PBAT塑料地膜降解前后的水接触角大小 Figure 6 Decreased water contact angles(WCA)of PBAT plastic film before and after degradation by different strains |
塑料在降解过程中会发生很多物理、化学表征变化,最典型的降解特征为质量发生损失,但质量的降低程度不能完全反映塑料的降解程度[27],因此本文除膜片降解率外,还对膜片表面微观特征、表面疏水性、表面官能团等进行测定。综合上述各指标的结果,最终从6株潜在PBAT降解菌中选择出RD1-3和N1-2两株菌,推测其为潜在高效PBAT降解菌。大多数塑料降解菌都会通过分泌降解酶从而对塑料产生降解作用,如脲酶、漆酶、过氧化物酶以及脂肪酶等[28-29]。本试验中菌株RD1-3具有合成并分泌多种胞外降解酶的能力。
菌株RD1-3和N1-2对PBAT的降解率均在6%以上,与其他在常温下进行的研究相比降解率较高。如霍向东等[12]从南疆农田中分离得到的鞘脂单胞菌XJSL2,其60 d的PBAT降解率仅不到1%;Wang等[27]研究发现PBAT地膜在常规农田土壤中3个月的降解率仅为2.3%;Tan等[30]在土壤中筛选出19种细菌,其在30 ℃条件下对PBAT的绝对降解量均很低,且只有两株菌对PBAT造成可见的降解。另有研究表明,真菌对塑料地膜的降解率远高于细菌,如7 d内,菊异茎点霉(Paraphoma Chrysanthemicola B47-9)对该类地膜的降解面积高达99.2%,但在现有研究中未发现细菌对PBAT有如此高的降解率[31]。提高降解体系的温度或改变pH值,以及在降解体系中加入氧助化剂等均能提高微生物对塑料膜片的降解率,如在温度为58 ℃的堆肥条件下,PBAT膜片48 d的降解率可达64.3%[19, 32-34]。但在自然环境中控制农田温度和酸度或添加助化剂实施较困难。本试验在常温条件下进行,目的是筛选出在常温且温和条件下即可以对PBAT有高效降解作用的菌株。除降解率外,本研究中扫描电镜、原子力显微镜、红外光谱以及水接触角结果,均能很好地展现菌株RD1-3和N1-2对PBAT良好的降解性。
菌株RD1-3和N1-2均属于假单胞菌属。关于假单胞菌属细菌对塑料有降解作用的报道也较多。绿脓假单胞菌、恶臭假单胞菌和施氏假单胞菌等具有高效降解低密度聚乙烯的能力[35-38]。此外,该属细菌对聚丙烯、聚氯乙烯、聚苯乙烯、聚氨酯、氯代芳烃等也有降解作用[38-39]。假单胞菌对烃类化合物产生降解能力的原因之一为其携带编码烷烃羟化酶的基因,可以利用氧分子从而在塑料稳定的化学结构中引入不稳定的含氧官能团[40]。
推测两株高效降解菌RD1-3和N1-2可通过产生多种酶对烃链进行降解。此外,PBAT塑料膜片疏水性降低、粗糙度增加、产生破损以及新的极性官能团的引入,均有利于微生物在膜表面的附着和薄膜的分解,从而进一步加快了菌株的降解作用[26, 41]。
4 结论(1)本试验从垃圾场土壤中分离得到6种潜在的PBAT塑料降解菌,通过对6株菌对PBAT降解性能结果的综合分析,最终得到两株高效降解PBAT的假单胞菌,分别为Pseudomonas sp. RD1-3和Pseudomonas sp. N1-2。
(2)28 ℃条件下,经8周培养,两株菌对PBAT地膜的降解率分别为6.88%±0.06%和6.49%±0.01%。
(3)两株菌作用8周后,PBAT地膜表面均出现明显的褶皱与沟壑,粗糙程度增加,且薄膜表面结构中出现新的极性官能团,薄膜表面亲水性增加。
| [1] |
Accinelli C, Abbas H K, Shier W T, et al. Degradation of microplastic seed film-coating fragments in soil[J]. Chemosphere, 2019, 226: 645-650. DOI:10.1016/j.chemosphere.2019.03.161 |
| [2] |
Harshvardhan K, Jha B. Biodegradation of low-density polyethylene by marine bacteria from pelagic waters, Arabian Sea, India[J]. Marine Pollution Bulletin, 2013, 77(1/2): 100-106. |
| [3] |
Koitabashi M, Sameshima-Yamashita Y, Koike H, et al. Biodegradable plastic-degrading activity of various species of paraphoma[J]. Journal of Oleo Science, 2016, 65(7): 621-627. DOI:10.5650/jos.ess16067 |
| [4] |
Rillig M C. Microplastic in terrestrial ecosystems and the soil?[J]. Environmental Science & Technology, 2012, 46(12): 6453-6454. |
| [5] |
Mehmood C T, Qazi I A, Hashmi I, et al. Biodegradation of low density polyethylene(LDPE)modified with dye sensitized titania and starch blend using Stenotrophomonas pavanii[J]. International Biodeterioration & Biodegradation, 2016, 113: 276-286. |
| [6] |
丁茜, 余佳, 蒋馨漫, 等. 生物降解地膜材料的研究进展[J]. 工程塑料应用, 2019, 47(12): 150-153. DING Qian, YU Jia, JIANG Xinman, et al. Research progress on biodegradable mulching film materials[J]. Engineering Plastics Application, 2019, 47(12): 150-153. DOI:10.3969/j.issn.1001-3539.2019.12.028 |
| [7] |
Pignattelli S, Broccoli A, Renzi M. Physiological responses of garden cress(L. Sativum)to different types of microplastics[J]. Science of the Total Environment, 2020, 727: 138609. DOI:10.1016/j.scitotenv.2020.138609 |
| [8] |
Qi Y, Yang X, Mejia Pelaez A, et al. Macro-and micro-plastics in soil-plant system:Effects of plastic mulch film residues on wheat(Triticum aestivum)growth[J]. Science of the Total Environment, 2018, 645: 1048-1056. DOI:10.1016/j.scitotenv.2018.07.229 |
| [9] |
严昌荣, 刘恩科, 舒帆, 等. 我国地膜覆盖和残留污染特点与防控技术[J]. 农业资源与环境学报, 2014, 31(2): 95-102. YAN Changrong, LIU En-ke, SHU Fan, et al. Review of agricultural plastic mulching and its residual pollution and prevention measures in China[J]. Journal of Agricultural Resources and Environment, 2014, 31(2): 95-102. |
| [10] |
Souza P M S, Sommaggio L R D, Marin-Morales M A, et al. PBAT biodegradable mulch films:Study of ecotoxicological impacts using Allium cepa, Lactuca sativa and HepG2/C3A cell culture[J]. Chemosphere, 2020, 256: 126985. DOI:10.1016/j.chemosphere.2020.126985 |
| [11] |
冯欢, 何文清, 张凤华, 等. 生物降解地膜性能及对棉花产量的影响评价研究[J]. 生态环境学报, 2019, 28(3): 580-586. FENG Huan, HE Wen-qing, ZHANG Feng-hua, et al. Study on the performance of biodegradable film and its influence on cotton yield[J]. Ecology and Environmental Sciences, 2019, 28(3): 580-586. |
| [12] |
霍向东, 高雁, 林青, 等. 聚对苯二甲酸-己二酸丁二酯(PBAT)降解菌的分离鉴定和降解能力测定[J]. 新疆农业科学, 2017, 54(11): 2086-2091. HUO Xiang-dong, GAO Yan, LIN Qing, et al. Isolation and identification of poly(butylene adipate-co-terephthalate)-degrading Bacteria[J]. Xinjiang Agricultural Sciences, 2017, 54(11): 2086-2091. DOI:10.6048/j.issn.1001-4330.2017.11.016 |
| [13] |
和晓楠. 降解塑料的发展现状分析[J]. 高科技与产业化, 2020(2): 56-62. HE Xiao-nan. Analysis of the development status of degradable plastics[J]. High-Technology & Commercialization, 2020(2): 56-62. |
| [14] |
邬强, 王振华, 郑旭荣, 等. PBAT生物降解膜覆盖对绿洲滴灌棉花土壤水热及产量的影响[J]. 农业工程学报, 2017, 33(16): 135-143. WU Qiang, WANG Zhen-hua, ZHENG Xu-rong, et al. Effects of biodegradation film mulching on soil temperature, moisture and yield of cotton under drip irrigation in typical oasis area[J]. Transactions of the Chinese Society of Agricultural Engineering, 2017, 33(16): 135-143. DOI:10.11975/j.issn.1002-6819.2017.16.018 |
| [15] |
Muroi F, Tachibana Y, Soulenthone P, et al. Characterization of a poly (butylene adipate-co-terephthalate)hydrolase from the aerobic mesophilic bacterium Bacillus pumilus[J]. Polymer Degradation and Stability, 2017, 137: 11-22. DOI:10.1016/j.polymdegradstab.2017.01.006 |
| [16] |
张敏, 贾昊, 翁云宣, 等. 聚乳酸/聚己二酸-对苯二甲酸丁二酯对土壤细菌群落结构的影响及其降解菌的筛选[J]. 微生物学通报, 2020, 47(2): 420-430. ZHANG Min, JIA Hao, WENG Yun-xuan, et al. Effects of polylactide/polybutylene adipate-co-terephthalate on bacterial community structure of soil and isolation of degrading bacteria[J]. Microbiology China, 2020, 47(2): 420-430. |
| [17] |
Barragan D H, Pelacho A M, Martin-Closas L. Degradation of agricultural biodegradable plastics in the soil under laboratory conditions[J]. Soil Research, 2016, 54(2): 216-224. DOI:10.1071/SR15034 |
| [18] |
Esmaeili A, Pourbabaee A A, Alikhani H A, et al. Biodegradation of low-density polyethylene(LDPE)by mixed culture of Lysinibacillus xylanilyticus and Aspergillus niger in soil[J]. PLoS One, 2013, 8(9): e71720. DOI:10.1371/journal.pone.0071720 |
| [19] |
林娟, 周景文, 康振, 等. 聚乳酸降解菌株筛选鉴定及降解过程优化[J]. 微生物学通报, 2013, 40(9): 1560-1569. LIN Juan, ZHOU Jing-wen, KANG Zhen, et al. Isolation, identification of poly lactic acid degrading microorganisms and optimization of the degradation process[J]. Microbiology China, 2013, 40(9): 1560-1569. |
| [20] |
Sekhar V C, Nampoothiri K M, Mohan A J, et al. Microbial degradation of high impact polystyrene(HIPS), an e-plastic with decabromo-diphenyl oxide and antimony trioxide[J]. Journal of Hazardous Materials, 2016, 318: 347-354. DOI:10.1016/j.jhazmat.2016.07.008 |
| [21] |
迟原龙, 唐垚, 金璐, 等. 采用碱裂解法提取DNA鉴定细菌和酵母菌[J]. 食品研究与开发, 2018, 39(2): 177-180. CHI Yuan-long, TANG Yao, JIN Lu, et al. Identification of bacteria and yeasts by using an alkaline lysis method for DNA extraction[J]. Food Research and Development, 2018, 39(2): 177-180. DOI:10.3969/j.issn.1005-6521.2018.02.032 |
| [22] |
Hou L, Xi J, Chen X, et al. Biodegradability and ecological impacts of polyethylene-based mulching film at agricultural environment[J]. Journal of Hazardous Materials, 2019, 378: 120774. DOI:10.1016/j.jhazmat.2019.120774 |
| [23] |
Yang J, Yang Y, Wu W M, et al. Evidence of polyethylene biodegradation by bacterial strains from the guts of plastic-eating waxworms[J]. Environmental Science & Technology, 2014, 48(23): 13776-13784. |
| [24] |
Yang Y, Yang J, Wu W M, et al. Biodegradation and mineralization of polystyrene by plastic-eating mealworms:Part 2. Role of gut microorganisms[J]. Environmental Science & Technology, 2015, 49(20): 12087-12093. |
| [25] |
祝振鑫. 膜材料的亲水性、膜表面对水的湿润性和水接触角的关系[J]. 膜科学与技术, 2014, 34(2): 1-4. ZHU Zhen-xin. Hydrophilicity, wettability and contact angle[J]. Membrane Science and Technology, 2014, 34(2): 1-4. DOI:10.3969/j.issn.1007-8924.2014.02.001 |
| [26] |
Restrepo-Flórez J-M, Bassi A, Thompson M R. Microbial degradation and deterioration of polyethylene:A review[J]. International Biodeterioration & Biodegradation, 2014, 88: 83-90. |
| [27] |
Wang H, Wei D, Zheng A, et al. Soil burial biodegradation of antimicrobial biodegradable PBAT films[J]. Polymer Degradation and Stability, 2015, 116: 14-22. DOI:10.1016/j.polymdegradstab.2015.03.007 |
| [28] |
Kunlere I O, Fagade O E, Nwadike B I. Biodegradation of low density polyethylene(LDPE)by certain indigenous bacteria and fungi[J]. International Journal of Environmental Studies, 2019, 76(3): 428-440. DOI:10.1080/00207233.2019.1579586 |
| [29] |
Ojha N, Pradhan N, Singh S, et al. Evaluation of hdpe and ldpe degradation by fungus, implemented by statistical optimization[J]. Scientific Reports, 2017, 7(1): 39515-39515. DOI:10.1038/srep39515 |
| [30] |
Tan F T, Cooper D G, Maric M, et al. Biodegradation of a synthetic co-polyester by aerobic mesophilic microorganisms[J]. Polymer Degradation and Stability, 2008, 93(8): 1479-1485. DOI:10.1016/j.polymdegradstab.2008.05.005 |
| [31] |
Koitabashi M, Sameshima-Yamashita Y, Watanabe T, et al. Phylloplane fungal enzyme accelerate decomposition of biodegradable plastic film in agricultural settings[J]. Japan Agricultural Research Quarterly, 2016, 50(3): 229-234. DOI:10.6090/jarq.50.229 |
| [32] |
Kijchavengkul T, Auras R, Rubino M, et al. Biodegradation and hydrolysis rate of aliphatic aromatic polyester[J]. Polymer Degradation and Stability, 2010, 95(12): 2641-2647. DOI:10.1016/j.polymdegradstab.2010.07.018 |
| [33] |
Abrusci C, Pablos J L, Marin I, et al. Photodegradation and biodegradation by bacteria of mulching films based on ethylene-vinyl acetate copolymer:Effect of pro-oxidant additives[J]. Journal of Applied Polymer Science, 2012, 126(5): 1664-1675. DOI:10.1002/app.36989 |
| [34] |
Kawai F, Watanabe M, Shibata M, et al. Comparative study on biodegradability of polyethylene wax by bacteria and fungi[J]. Polymer Degradation and Stability, 2004, 86(1): 105-114. DOI:10.1016/j.polymdegradstab.2004.03.015 |
| [35] |
聂红云.铜绿假单胞菌NY3胞外小分子活性物及其促进烃类降解的作用机制研究[D].西安: 西安建筑科技大学, 2017: 96-98. NIE Hong-yun. Studies on characteristics of the secretion of extracellular small active compounds by P. aeruginosa NY3 and their promotion mechanisms to the efficiency of biodegradation of hydrocarbon[D]. Xi'an: Xi'an University of Architecture and Technology, 2017: 96-98. |
| [36] |
Sangale M K, Shahnawaz M, Ade A B. A review on biodegradation of polythene:The microbial approach[J]. Journal of Bioremediation and Biodegradation, 2012, 3(10): 1-9. |
| [37] |
Sharma A, Sharma A. Degradation assessment of low density polythene(LDP)and polythene(PP)by an indigenous isolate of pseudomonas stutzeri[J]. Journal of Scientific & Industrial Research, 2004, 63(3): 293-296. |
| [38] |
Kyaw B M, Champakalakshmi R, Sakharkar M K, et al. Biodegradation of low density polythene(LDPE) by Pseudomonas species[J]. Indian Journal of Microbiology, 2012, 52(3): 411-419. DOI:10.1007/s12088-012-0250-6 |
| [39] |
Bhattacharya P, Lin S, Turner J P, et al. Physical adsorption of charged plastic nanoparticles affects algal photosynthesis[J]. Journal of Physical Chemistry C, 2010, 114(39): 16556-16561. DOI:10.1021/jp1054759 |
| [40] |
Liu H, Xu J, Liang R, et al. Characterization of the medium-and long-chain n-alkanes degrading Pseudomonas aeruginosa strain SJTD-1 and its alkane hydroxylase genes[J]. PLoS One, 2014, 9(8): e105506. DOI:10.1371/journal.pone.0105506 |
| [41] |
Perz V, Hromic A, Baumschlager A, et al. An esterase from anaerobic Clostridium hathewayi can hydrolyze aliphatic-aromatic polyesters[J]. Environmental Science & Technology, 2016, 50(6): 2899-2907. |
 2021, Vol. 40
2021, Vol. 40