2. 北京农学院, 北京 102206
2. Beijing University of Agriculture, Beijing 102206, China
畜禽粪便是农作物生产中重要的营养物质来源,土地利用则是粪便资源化的主要方式。然而,畜禽粪便只能在耕作期施用于土地,所以在冬季免耕期,大量的畜禽粪便会堆放储存在户外[1]。而在许多寒冷地区,由于冬季昼夜温差大,畜禽粪便在堆放过程中就会经历冻融循环过程。冻融循环是一种十分常见的气候现象,仅在我国,56%的国土面积都会发生冻融循环[2]。此外,我国每年产生约38亿t的粪便,大量粪便在冬季会经历冻融循环过程[3],因此探究冻融循环对畜禽粪便环境行为的影响具有重要意义。然而,目前关于冻融的研究多数以土壤作为对象,对畜禽粪便的关注则相对较少[4-6]。
研究表明,冻融循环可以使土壤颗粒破碎,并影响土壤的物理化学性质、微生物种群及其有机质的种类[7]。因此可以推断,冻融循环也可能会对畜禽粪便的粒径分布及其有机质的组成和结构产生影响,进而影响其在环境中的迁移和污染情况。畜禽粪便中含有大量的有机物质,其中溶解性有机质、腐植酸、木质素和蛋白质是畜禽粪便中有机质的重要组分,也是畜禽粪便环境行为的重要影响因素。溶解性有机质不仅包含大量的生物反应中间体,还充当某些微生物养分的直接来源,对微生物的群落结构和活性以及畜禽粪便中污染物的迁移具有重要影响[8]。腐植酸在施肥后的土壤生态、土壤结构、肥料效率和植物生长中也起着重要作用[9]。此外,蛋白质类物质(例如氧化还原酶和水解酶)也与基本营养素的代谢密切相关[10],对其含量和结构变化的分析有助于反映有机质的分解过程。木质素则会吸附有机污染物,并影响粪便中污染物在环境中的迁移和转化等行为[11]。
因此,本研究通过冻融模拟实验,研究冻融循环对粪便的粒径分布和有机质含量的影响。同时,在冻融前后提取粪便中的有机质组分(包括溶解性有机质、腐植酸、木质素和蛋白质),并通过傅里叶红外光谱和13C核磁共振光谱研究其结构变化,来进一步深入分析冻融对粪便有机质组成的影响,以便更好地了解环境温度下猪粪的冻融过程,为评估冻融循环过程对畜禽粪便的潜在环境影响提供理论依据。
1 材料与方法 1.1 样品采集实验用新鲜猪粪采集于某集约化养猪场。使用木铲将收集的粪便样品装入塑料桶中运输至实验室进行基本理化性质的测定以及后续相关实验。原始粪便的主要理化性质如表 1所示。
|
|
表 1 猪粪的基本理化性质 Table 1 Basic physical and chemical properties of pig manure |
将猪粪样品封装于塑料盒内进行冻融处理。将样品在(-18±2)℃的冷冻室中冻结24 h,然后在(20± 2)℃的恒温培养箱中融解24 h,整个过程即为一个冻融循环周期(48 h),整个冻融实验共经历30个冻融循环。在第5、10、20、30次冻融处理后取出子样本,与0次冻融循环(即未经冻融处理)样品一同进行冷干处理,之后提取其中的溶解性有机物、腐植酸、蛋白质和木质素进行测定和分析。
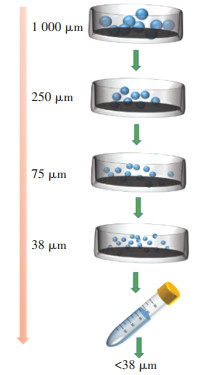
1.3 粒径分布通过湿筛法确定猪粪中的粒径分布。向100 g猪粪样品中加入600 mL超纯水,搅拌均匀后在40 W下超声5 min,按图 1所示过程进行筛分,得到>1 000、250~1 000、75~250 μm和38~75 μm的颗粒,在通过38 μm尼龙筛后的液体几乎澄清时,将混合物在10 000 r·min-1下离心30 min,得到 < 38 μm的颗粒[12]。
|
图 1 猪粪颗粒筛分过程示意图 Figure 1 Schematic diagram of pig manure particle size screening process |
使用马弗炉灼烧法测定总有机质的含量[13]。将粪便样品在105 ℃的烘箱中干燥过夜后置于马弗炉中,在550 ℃下加热5 h,称质量后计算总有机质的含量。
1.4.2 溶解性有机质用去离子水在固液比为1:5(m/V)的条件下提取粪便样品,在20 ℃下振荡16 h,然后于4 ℃下以8 000 r·min-1离心25 min后,将悬浮液通过0.45 μm滤膜过滤。使用总有机碳分析仪(TOC-500,日本岛津)测定滤液中溶解性有机碳(DOC)的浓度,即为溶解性有机质的含量[14]。
1.4.3 腐植酸用0.1 mol·L-1=NaOH和0.1 mol·L-1=Na2P2O7在固液比为1:10(m/V)的条件下对猪粪样品进行萃取,在4 000 r·min-1下离心20 min后分离出含有腐植酸的上清液。重复提取3次后将上清液混合并在室温下静置24 h,再次在4 000 r·min-1下离心20 min,将获得的上清液进行冷冻干燥以获得腐植酸样品[15]。
1.4.4 蛋白质使用硫酸铵沉淀法提取蛋白质样品[16]。向一定量的粪便样品中加入10 mL磷酸盐缓冲液(pH = 7),然后将溶液离心以完全去除悬浮颗粒。随后,向上清液中加入60%的硫酸铵溶液,同时通过1 mol·L-1的KH2PO4调节pH使其稳定在7.0。在4 ℃下放置4 h后,将悬浮液在8 000 r·min-1下离心35 min,得到的沉淀物即为蛋白质样品。
1.4.5 木质素将粪便样品进行风干研磨后,取0.025 g干样至聚四氟乙烯消解罐,加入0.5 g CuO、0.05 g六水合硫酸铁铵和15 mL 2 mol·L-1=NaOH溶液在155 ℃下萃取3 h。冷却至常温后在2 000 r·min-1下离心10 min后,将上清液用6 mol·L-1 HCl酸化至pH=1,并用10 mL乙酸乙酯重复萃取3次,风干后即得到木质素样品[17]。
1.5 样品分析根据方宇潇等[18]的方法测定猪粪pH以及含水率。同时,使用傅里叶红外光谱和固态交叉极化13C核磁共振光谱获得上述提取的有机质组分的官能团以及化学成分的相关信息来进行进一步分析。
1.6 数据处理使用IBM SPSS Statistics 20.0软件进行统计分析,并采用单因素方差分析来评估统计差异,显著性水平选择为0.05。使用Origin 2018对所得数据进行绘图。
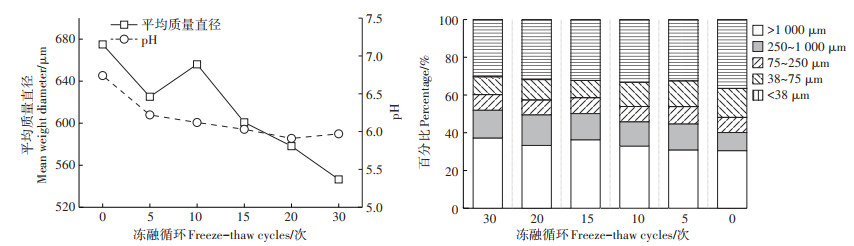
2 结果与讨论 2.1 冻融对猪粪粒径分布的影响统计学分析表明,冻融循环对猪粪的粒径分布存在显著影响(P < 0.05)。如图 2所示,冻融循环处理过后,粪便的平均质量直径明显减小,且随着冻融循环次数的增加,粪便的平均质量直径呈现出降低趋势。从粒径的分布来看,原始粪便主要由>1 000 μm和 < 38 μm的颗粒组成,其共占总粒径的67.6%,而38~250 μm的颗粒含量范围仅为8.33%~14.65%。随着冻融循环次数的增加,>1 000 μm的颗粒含量逐渐降低,而小颗粒的比例逐渐上升。其中,经过30次冻融循环处理的样品与原始样品相比,>1 000 μm的颗粒含量降低了6.73%,而38~75 μm和 < 38 μm的颗粒含量则分别增加了5.94%和6.13%。这说明冻融循环过程使得粪便中的大颗粒发生破碎,主要由>1 000 μm的颗粒破碎成 < 75 μm的颗粒。并且,随着冻融循环次数的增加,破碎的效果也更加明显。这与对土壤粒径大小在冻融环境下变化的研究结果类似[4-5]。出现这一现象的主要原因是冻融循环过程中猪粪颗粒间的水分发生冻结,形成的冰晶对颗粒不断发生剪切作用而使大颗粒破碎成小颗粒[19]。除此之外,相关研究发现,含水率越高,冻融作用对颗粒的破坏性越大[20]。本实验使用的猪粪的含水率高达71%,远高于表层土壤含水率(11.71%~16.46%),因此,高含水率的猪粪结冰后会形成更强的扩张力进而破坏颗粒间的结合,同时颗粒间隙的增加也扩大了冻结的面积,这均会导致大颗粒破碎比例的增加。因此,冻融环境中>1 000 μm的颗粒的破碎主要是物理作用引起的。
|
图 2 冻融循环对猪粪平均质量直径、pH及粒径分布的影响 Figure 2 Effect of freeze-thaw cycle on mean weight diameter, pH and particle size distribution of pig manure |
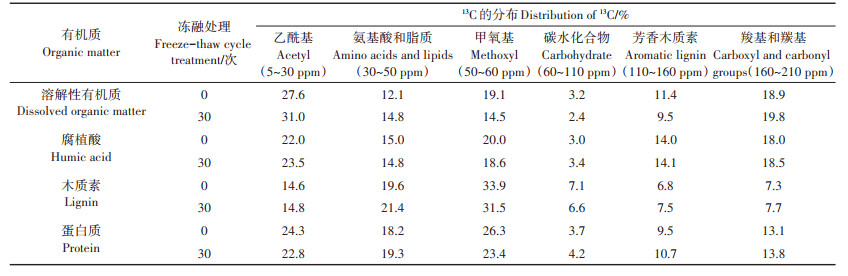
如图 3所示,所有样品的红外光谱都包含相似的峰位置,主要的特征吸收带是:(1)酚、羧酸和醇在3 400 cm-1附近的O—H拉伸振动;(2)脂族结构在2 930 cm-1和2 855 cm-1附近的C—H拉伸振动;(3)硫醇在2 356 cm-1附近的S—H伸缩振动;(4)1 659 cm-1附近芳香环的C=C骨架振动;(5)酰胺在1 570 cm-1附近的N—H变形和C=N拉伸;(6)1 385 cm-1附近酚结构的O—H变形和/或COO—基团的不对称拉伸;(7)仲醇、酚类和芳基醚在1 103 cm-1附近的C—O拉伸[21]。13C核磁共振光谱的化学位移所代表的化学成分如下:乙酰(5~30 ppm),氨基酸和脂质(30~50 ppm),甲氧基(50~60 ppm),碳水化合物(60~110 ppm),芳香木质素(110~160 ppm),羰基/羧基(160~ 210 ppm)[22]。13C光谱强度的相对分布由化学位移面积的积分确定,其积分结果如表 2所示。
|
|
表 2 30次冻融循环处理前后猪粪的溶解性有机质、腐植酸、木质素和蛋白质的13C核磁图谱积分结果 Table 2 Distribution of 13C in dissolved organic matter, humic acid, lignin and protein extracted from pig manure without freeze-thaw cycle and after 30 freeze-thaw cycle treatment |
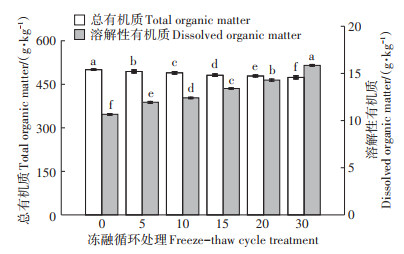
在经历冻融循环之后,猪粪中的总有机质下降,冻融循环次数对总有机质存在显著影响(P < 0.05),其含量随着冻融循环次数的增加而逐渐降低(图 4)。与未进行冻融处理的样本相比,经历30次冻融循环的猪粪的总有机质含量下降了5.34%,此现象可能受许多因素影响。冷冻过程的温度低至-20 ℃,一些热塑性微生物可能由于对温度的耐受性低而死亡,并作为碳源释放。但是,细胞裂解后释放的营养物可以被存活的生物体利用,改变了有机质的状态。研究发现,细菌的存活基本不受冻融环境的影响[17],尤其是反硝化细菌,它可以利用有机物进行厌氧呼吸,发生反硝化反应。因此,冻融循环之后的总有机质下降可能是因为存活细菌分解的有机质大于碳源释放产生的有机质。冻融循环还可能促进了不稳定有机碳和氮的矿化,并产生了二氧化碳和一氧化二氮气体,导致有机质的流失[23]。
|
不同小写字母表示不同处理间差异显著(P < 0.05) The different lowercase letters indicate significant difference between different treatments(P < 0.05) 图 4 冻融循环对猪粪中总有机质和溶解性有机质的影响 Figure 4 Effect of freeze-thaw cycle on total organic matter and dissolvedorganic matter in pig manure |
根据统计分析,冻融循环处理对猪粪中溶解性有机质含量也有显著影响(P < 0.05)。与总有机质的变化相反,随着冻融循环次数的增加,溶解性有机质的含量逐渐增加(图 4)。与原始样品相比,经过30次冻融循环处理的猪粪中的溶解性有机质含量增加了48.7%。这一现象可以归因于3个原因:首先,大颗粒的破碎会产生许多结冰缝隙,使未结冰部分的水不断向冻结冰面迁移。该过程可以携带一部分溶解性有机质,待融化时溶出[24]。其次,一些由于低温死亡的微生物细胞释放出大量可用的碳源(如糖和氨基酸),增加了溶解性有机质的溶出。最后,厌氧环境中的无氧呼吸是厌氧微生物的主要呼吸方式,其会产生大量的厌氧消化产物(例如丙酸、丁酸、异丁酸、戊酸等[1),]其中大多数处于胶体状态或溶解状态,因此,在固液分离的情况下,它们将进入液相[25]。
红外光谱的结果证实了这一假设。如图 3a所示,30次冻融循环处理后,3 400 cm-1处的条带变宽,表明产生了更多的氨基酸;此外,在2 352 cm-1和1 638 cm-1处的峰几乎消失,这表明在冻融过程中硫醇的消耗和碳不饱和度的增加。与未经冻融处理的样品相比,30次冻融循环处理后的样品在1 385 cm-1处的峰具有较高的相对强度,表明溶解性有机质中OH和/或COO—基团的增加[26]。猪粪冻融后pH逐渐降低也证明了这一点(图 2)。此外,对应多糖C—O或硅酸盐Si—O的峰在冻融之后强度降低,表明多糖和硅酸盐的消耗[27]。

|
图 3 未经冻融处理和30次冻融循环处理后的猪粪样品中溶解性有机质、腐植酸、木质素和蛋白质的红外光谱 Figure 3 Fourier transform infrared spectra of dissolved organic matter, humic acid, lignin and protein in pig manure without freeze-thaw cycle and after 30 freeze-thaw cycle treatment |
从猪粪中提取的溶解性有机质的核磁共振光谱如图 5a所示。可以看出,冻融处理后,0~30 ppm区域的乙酰基含量在增加,信号峰增强,尤其是在12、18 ppm和22 ppm处。从表 2可以看出,冻融后氨基酸和脂质含量增加,38 ppm和49 ppm的峰值明显升高,这可能是由于多糖分解使产物被转化成更简单的烷基链[28]。此外,经过冻融处理后,羧基和羰基的含量增加。一般来说,有机物的分解伴随着羧基的生成[29],氧化的木质素会产生更多的羧基、苯酚和羰基[30],这也与上述红外光谱结果中溶解性有机质不饱和度增加的现象一致。
2.2.3 冻融对腐植酸的影响从腐植酸的红外光谱来看(图 3b),在冻融处理后,2 923 cm-1处的峰强度升高,对应脂肪族结构的含量增加,表明有机营养碳源的消耗量低于冻融过程中的生成量。30次冻融处理后,1 643 cm-1和1 565 cm-1处的峰没有明显变化,表明腐植酸的芳香结构在冻融过程中没有变化。此外,与未经冻融处理的样品相比,经过30次冻融处理的样品在1 500 cm-1处的峰具有较高的相对强度,这归因于NH变形和酰胺的C=N拉伸[26],表明氮的含量有所增加,与上述冻融过程中氨基酸增加结果一致。腐植酸的核磁共振光谱也显示出相似的结果(图 5b)。178 ppm处代表羧基的特征峰在冻融处理后的峰值强度增加了80%,说明冻融处理使腐植酸产生了更多的COO—。冻融过程中腐植酸的芳香区(110~160 ppm)基本不变,说明经过冻融处理后腐植酸的芳香性基本没有改变。此外,烷基碳区域(0~50 ppm)的特征峰略有增加,这可能是多糖分解所导致的[29]。
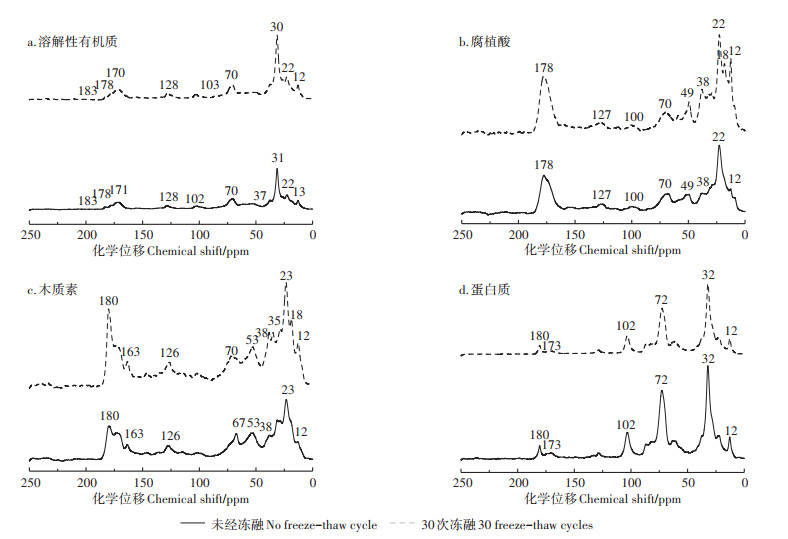
|
图 5 未经冻融和30次冻融处理后的猪粪样品中溶解性有机质、腐植酸、木质素和蛋白质的核磁共振光谱 Figure 5 13C nuclear magnetic resonance spectra of dissolved organic matter, humic acid, lignin and protein in pig manure without freezethaw cycle and after 30 freeze-thaw cycle treatment |
冻融处理后,猪粪中的木质素结构也受到影响(图 3c)。冻融处理后样品的光谱中2 917 cm-1和2 855 cm-1处的峰与未冻融样品相比具有较高的相对强度,表明脂肪族结构富集。与未冻融样品相比,冻融处理后的样品在2 358 cm-1处的峰轻度降低,表明硫醇作为微生物的营养物被消耗。此外,在冻融处理后的样品中1 561 cm-1处的峰强度增加,表明在冻融过程中芳香结构的富集。表 2显示了在冻融过程中木质素的甲氧基和碳水化合物被消耗,生成了氨基酸、脂类和芳香碳。180 ppm处代表羧基的明显特征峰在经过冻融处理后没有发生明显变化(图 5c),这表明木质素的羧基含量在冻融过程中基本不变。
2.2.5 冻融对蛋白质的影响冻融处理也会对猪粪中蛋白质的性质产生影响(图 3d)。3 226 cm-1处的峰代表蛋白质的独有结构——酰胺键,经过冻融处理后其谱带变宽,说明在冻融过程中产生了小分子氨基酸,这与溶解性有机质和腐植酸中的变化一致。此外,经过冻融处理后,1 650 cm-1处的峰值强度增加,表明在冻融过程中芳香结构的富集。以上结果表明,冻融循环可以将猪粪中的蛋白质分解为小氨基酸,增加蛋白质的芳香结构并增加其不饱和度。从核磁光谱看(图 5d),173 ppm时出现的特征峰主要为羧基碳,经过冻融处理后,该峰强度增加了约50%,说明冻融后蛋白质产生了更多的COO—。110~160 ppm区域的含量明显增加,说明冻融处理后蛋白质的芳香性增加,这可能是由于低耐受性微生物在冷冻过程中死亡以及一些不饱和化合物的释放所致[31]。
2.2.6 与堆肥过程的比较在经历冻融循环过程后,猪粪的总有机质含量下降,溶解性有机质含量上升。从红外光谱和核磁共振光谱的结果判断,冻融使猪粪中有机质(溶解性有机质、腐植酸、木质素、蛋白质)的不饱和度增加,产生了更多的氨基酸、—COO—和C=O基团。另外,溶解性有机质的芳香性降低,腐植酸和木质素的芳香性基本不变,而蛋白质的芳香性增加。
畜禽粪便主要通过堆肥的方式回收利用[32]。堆肥是在有机肥生产过程中,通过微生物的高温发酵作用,使畜禽粪便矿化、腐殖质化而达到无害化的过程[33]。研究表明,在堆肥过程中,有机质的芳香性会增加,碳水化合物会分解,—COO—基团会降解,这与冻融循环过程中有机质的变化形成了鲜明的对比。因此,堆肥是粪便中有机物逐渐稳定并达到无害化的过程,而与之相反,冻融过程的变化(例如溶解性有机质的增加以及大分子有机物分解的现象),将会增加粪便在自然环境中的溶解度和流动性,进而导致粪便中的污染物如抗生素和重金属等的迁移性增加,带来更大的环境风险和危害[14]。
3 结论(1)经过冻融处理后,粪便中>1 000 μm的粒径组成减少,而38~75 μm和<38 μm的颗粒增加,说明冻融使粪便中的大颗粒破碎成小颗粒,且冻融次数越多,破碎效果越明显。
(2)冻融循环会影响猪粪中有机质的含量。经过30次冻融循环后,猪粪中的总有机质降低了5.34%,溶解性有机质增加了48.7%。
(3)冻融循环后,猪粪中溶解性有机质、腐植酸、蛋白质和木质素中的不饱和有机物成分均增加,并产生了更多的氨基酸、—COO—和C=O基团。溶解性有机质的芳香性降低而蛋白质的芳香性增加。这可能会导致环境中猪粪有机质的迁移率增加,进而影响粪便中污染物的环境行为,并对人和动物健康构成威胁。因此,需要进一步研究粪便施用,储存和土地利用过程中的污染物迁移情况,同时,常年经历冻融的区域应针对性地采用适当的方法储存畜禽粪便,减少冻融所造成的粪便中污染物迁移而导致的面源污染风险和环境危害。
| [1] |
Popovic O, Jensen L S. Storage temperature affects distribution of carbon, VFA, ammonia, phosphorus, copper and zinc in raw pig slurry and its separated liquid fraction[J]. Water Research, 2012, 46(12): 3849-3858. DOI:10.1016/j.watres.2012.04.020 |
| [2] |
Ran Y, Li X, Cheng G, et al. Distribution of permafrost in China:An overview of existing permafrost maps[J]. Permafrost and Periglacial Processes, 2012, 23(4): 322-333. DOI:10.1002/ppp.1756 |
| [3] |
Zhang M, He L, Liu Y, et al. Variation of antibiotic resistome during commercial livestock manure composting[J]. Environment International, 2020, 136: 105458. DOI:10.1016/j.envint.2020.105458 |
| [4] |
薛爽, 刘红, 程志辉, 等. 土壤冻融对溶解性有机质与菲结合的影响[J]. 环境科学学报, 2018, 38(10): 4165-4175. XUE Shuang, LIU Hong, CHENG Zhi-hui, et al. Effects of soil freezing and thawing on the binding of phenanthrene to dissolvedorganic matter in soils[J]. Acta Scientiae Circumstantiae, 2018, 38(10): 4165-4175. |
| [5] |
高敏, 李艳霞, 张雪莲, 等. 冻融过程对土壤物理化学及生物学性质的影响研究及展望[J]. 农业环境科学学报, 2016, 35(12): 2269-2274. GAO Min, LI Yan-xia, ZHANG Xue-lian, et al. Influence of freeze-thaw process on soil physical, chemical and biological properties:A review[J]. Journal of Agro-Environment Science, 2016, 35(12): 2269-2274. DOI:10.11654/jaes.2016-1087 |
| [6] |
王洋, 刘景双, 王全英. 冻融作用对土壤团聚体及有机碳组分的影响[J]. 生态环境学报, 2013, 22(7): 1269-1274. WANG Yang, LIU Jing-shuang, WANG Quan-ying. The effects of freeze-thaw processes on soil aggregates and organic carbon[J]. Ecology and Environmental Sciences, 2013, 22(7): 1269-1274. DOI:10.3969/j.issn.1674-5906.2013.07.030 |
| [7] |
Kim E, Lee H K, Choi J H. Effects of a controlled freeze-thaw event on dissolved and colloidal soil organic matter[J]. Environmental Science and Pollution Research, 2017, 24(2): 1338-1346. DOI:10.1007/s11356-016-7552-x |
| [8] |
Wang K, Li X, He C, et al. Transformation of dissolved organic matters in swine, cow and chicken manures during composting[J]. Bioresource Technology, 2014, 168: 222-228. DOI:10.1016/j.biortech.2014.03.129 |
| [9] |
Huang G F, Wu Q T, Wong J W C, et al. Transformation of organic matter during co-composting of pig manure with sawdust[J]. Bioresource Technology, 2006, 97(15): 1834-1842. DOI:10.1016/j.biortech.2005.08.024 |
| [10] |
Waglay A, Achouri A, Karboune S, et al. Pilot plant extraction of potato proteins and their structural and functional properties[J]. LWT, 2019, 113: 108275. DOI:10.1016/j.lwt.2019.108275 |
| [11] |
Suteu D, Malutan T, Bilba D. Removal of reactive dye Brilliant Red HE-3B from aqueous solutions by industrial lignin:Equilibrium and kinetics modeling[J]. Desalination, 2010, 255(1/2/3): 84-90. |
| [12] |
窦森, 郝翔翔. 黑土团聚体与颗粒中碳、氮含量及腐殖质组成的比较[J]. 中国农业科学, 2013, 46(5): 970-977. DOU Sen, HAO Xiang-xiang. Comparison of carbon, nitrogen contents and humus compositions in the aggregates and particles of black soil[J]. Scientia Agricultura Sinica, 2013, 46(5): 970-977. DOI:10.3864/j.issn.0578-1752.2013.05.012 |
| [13] |
Morona F, Melquíades F L, Muller M M L. Quantification of organic matter in agricultural soils from the central region of Paraná State, Brazil[J]. Communications in Soil Science and Plant Analysis, 2017, 48(19): 2288-2293. DOI:10.1080/00103624.2017.1411505 |
| [14] |
He X, Xi B, Li X, et al. Fluorescence excitation-emission matrix spectra coupled with parallel factor and regional integration analysis to characterize organic matter humification[J]. Chemosphere, 2013, 93(9): 2208-2215. DOI:10.1016/j.chemosphere.2013.04.039 |
| [15] |
Preston C M, Hempfling R., Schulten H R, et al. Characterization of organic matter in a forest soil of coastal British Columbia by NMR and pyrolysis-field ionization mass spectrometry[J]. Plant and Soil, 1994, 158(1): 68-82. |
| [16] |
van Koningsveld G A, Gruppen H, de Jongh H H J, et al. Effects of pH and heat treatments on the structure and solubility of potato proteins in different preparations[J]. Journal of Agricultural and Food Chemistry, 2001, 49(10): 4889-4897. DOI:10.1021/jf010340j |
| [17] |
Feng X, Nielsen L L, Simpson M J. Responses of soil organic matter and microorganisms to freeze-thaw cycles[J]. Soil Biology and Biochemistry, 2007, 39(8): 2027-2037. DOI:10.1016/j.soilbio.2007.03.003 |
| [18] |
方宇潇, 张维, 崔俊芳, 等. 猪粪源DOM对三峡消落带土壤吸附Cd的影响[J]. 农业环境科学学报, 2020, 39(6): 1240-1248. FANG Yu-xiao, ZHANG Wei, CUI Jun-fang, et al. Effectsofpigmanurederived dissolved organic matter on the adsorption of cadmium to soils in the Three Gorges Reservoir region, China[J]. Journal of AgroEnvironment Science, 2020, 39(6): 1240-1248. |
| [19] |
Mohanty S K, Saiers J E, Ryan J N. Colloid-facilitated mobilization of metals by freeze-thaw cycles[J]. Environmental Science & Technology, 2014, 48(2): 977-984. |
| [20] |
陈兴财, 张丰松, 童心, 等. 畜禽粪便冻融作用后磷形态分布及其释放特征[J]. 环境科学学报, 2019, 39(5): 1617-1625. CHEN Xing-cai, ZHANG Feng-song, TONG Xin, et al. Form distribution of phosphorus and its release after freeze-thaw process of animal manure[J]. Acta Scientiae Circumstantiae, 2019, 39(5): 1617-1625. |
| [21] |
Guo X, He X, Zhang H, et al. Characterization of dissolved organic matter extracted from fermentation effluent of swine manure slurry using spectroscopic techniques and parallel factor analysis(PARAFAC)[J]. Microchemical Journal, 2012, 102: 115-122. DOI:10.1016/j.microc.2011.12.006 |
| [22] |
Castaldi P, Alberti G, Merella R, et al. Study of the organic matter evolution during municipal solid waste composting aimed at identifying suitable parameters for the evaluation of compost maturity[J]. Waste Management, 2005, 25(2): 209-213. DOI:10.1016/j.wasman.2004.12.011 |
| [23] |
刘淑霞, 王宇, 赵兰坡, 等. 冻融作用下黑土有机碳数量变化的研究[J]. 农业环境科学学报, 2008, 27(3): 984-990. LIU Shu-xia, WANG Yu, ZHAO Lan-po, et al. Effect of freezing and thawing on the content of organic carbon of black soil[J]. Journal of Agro-Environment Science, 2008, 27(3): 984-990. DOI:10.3321/j.issn:1672-2043.2008.03.027 |
| [24] |
Slavik I, Müller S, Mokosch R, et al. Impact of shear stress and pH changes on floc size and removal of dissolved organic matter(DOM)[J]. Water Research, 2012, 46(19): 6543-6553. DOI:10.1016/j.watres.2012.09.033 |
| [25] |
Christensen M L, Hjorth M, Keiding K. Characterization of pig slurry with reference to flocculation and separation[J]. Water Research, 2009, 43(3): 773-783. DOI:10.1016/j.watres.2008.11.010 |
| [26] |
Song C, Li M, Xi B, et al. Characterisation of dissolved organic matter extracted from the bio-oxidative phase of co-composting of biogas residues and livestock manure using spectroscopic techniques[J]. International Biodeterioration & Biodegradation, 2015, 103: 38-50. |
| [27] |
Kim E, Lee H K, Choi J H. Effects of a controlled freeze-thaw event on dissolved and colloidal soil organic matter[J]. Environmental Science and Pollution Research, 2017, 24(2): 1338-1346. DOI:10.1007/s11356-016-7552-x |
| [28] |
Caricasole P, Provenzano M R, Hatcher P G, et al. Chemical characteristics of dissolved organic matter during composting of different organic wastes assessed by 13C CPMAS NMR spectroscopy[J]. Bioresource Technology, 2010, 101(21): 8232-8236. DOI:10.1016/j.biortech.2010.05.095 |
| [29] |
Tang J, Maie N, Tada Y, et al. Characterization of the maturing process of cattle manure compost[J]. Process Biochemistry, 2006, 41(2): 380-389. DOI:10.1016/j.procbio.2005.06.022 |
| [30] |
Kögel-Knabner I. The macromolecular organic composition of plant and microbial residues as inputs to soil organic matter:Fourteen years on[J]. Soil Biology and Biochemistry, 2017, 105: A3-A8. DOI:10.1016/j.soilbio.2016.08.011 |
| [31] |
Vinceslas-Akpa M, Loquet M. Organic matter transformations in lignocellulosic waste products composted or vermicomposted(eiseniafetidaandrei):Chemical analysis and 13C CPMAS NMR spectroscopy[J]. Soil Biology and Biochemistry, 1997, 29(3): 751-758. |
| [32] |
Qian Y, Song K, Hu T, et al. Environmental status of livestock and poultry sectors in China under current transformation stage[J]. Science of the Total Environment, 2018, 622/623: 7025-709. |
| [33] |
Bao W, Yang Y, Fu T, et al. Estimation of livestock excrement and its biogas production potential in China[J]. Journal of Cleaner Production, 2019, 229: 1158-1166. DOI:10.1016/j.jclepro.2019.05.059 |
 2021, Vol. 40
2021, Vol. 40