2. 湖南杂交水稻研究中心, 杂交水稻国家重点实验室, 长沙 410125
2. State Key Laboratory of Hybrid Rice, Hunan Hybrid Rice Research Center, Changsha 410125, China
镉是生物毒性最强的重金属之一,据2014年原环境保护部和原国土资源部《全国土壤污染状况调查公报》显示,我国耕地点位超标率为19.4%,主要污染物为镉、镍、砷、铜、汞、滴滴涕和多环芳烃等。其中,镉是我国农田最为主要的重金属污染元素之一,其点位超标率高达7.0%,位于八大超标重金属元素之首[1]。水稻是一种易于富集镉的重要粮食作物,镉米是人类通过饮食摄入镉的主要来源[2]。因此,控制稻米镉积累是保证粮食安全生产的重要研究方向。
目前,针对重金属污染稻田的微生物修复技术主要包括3个方面:微生物原位钝化、微生物-植物联合修复[3-4]以及微生物与土壤调理剂(固定剂)联合修复[5]。其中,微生物原位钝化是指微生物自身以单菌或混合菌剂的方式,通过沉淀、吸附、吸收、转化等方式对土壤中的重金属进行固定或清除,以达到净化环境的目的[6]。
有研究报道,细菌原位钝化技术可以促进水稻的生长、降低重金属在籽粒中的积累,涉及到芽孢杆菌属(Bacillus)[7-8]、新根瘤菌属(Neorhizobium)[8]、戴尔福特菌属(Delftia)[9-10]、假单胞菌属(Pseudomonas)[10]、贪铜菌属(Cupriavidus)[11-12]、寡养单胞菌属(Stenotrophomonas)[10]等属的菌株,以及商业化菌剂EM[7]和微生物菌剂CJY[13]等。例如耐重金属巨大芽孢杆菌(Bacillus megaterium)H3和新根瘤菌(Neorhizobium huautlense)T1-17可以使根际土壤pH升高,并利用细胞壁上的阴离子基团与镉结合,从而降低了根际土壤的可交换性镉含量。施加菌株H3和T1-17可以减少水稻根系、地上组织和精米中的镉含量[8]。台湾贪铜菌(Cupriavidus taiwanensis)KKU2500-3可以促进根毛生长,并定殖在水稻根细胞壁和细胞间隙中,通过将可溶性CdCl2转化为无毒的不溶性CdS,阻断和减少镉向植物地上部转运,降低水稻籽粒镉含量57.74%[11-12]。铜绿假单胞菌(Pseudomonas aeruginosa)、嗜酸寡养单胞菌(Stenotrophomonas acidaminiphila)和鹤羽田戴尔福特菌(Delftia tsuruhatensis)组成的复合菌剂可使水稻籽粒镉含量降低32.6%[10]。以上研究结果表明,在镉胁迫下接种适当的微生物可以减少水稻籽粒中镉的积累,提高水稻品质。
芽孢杆菌广泛存在于土壤环境中,具有较高的环境兼容性和重金属离子吸附性,且可以改善土壤理化性质,因此在重金属污染土壤修复领域的发展前景十分广阔[14]。芽孢杆菌也是常见的植物根际促生菌(PGPR),具有合成铁载体和吲哚乙酸(IAA)的能力,并具有溶磷、固氮等活性,可以促进重金属胁迫下植物的生长[6, 15-16]。目前,利用芽孢杆菌进行重金属的原位钝化研究还十分有限,而且大多采用盆栽试验进行,大田试验较少。本研究以一株对胁迫条件具有很强耐受性的阿氏芽孢杆菌(Bacillus aryabhattai)T61[17-18]为试验材料,分析了其镉抗性、对Cd2+的去除率和植物促生性,观察其在水稻植株上的定殖和对水稻种子萌发的作用,最后通过大田试验,分析施加T61菌剂对于缓解水稻镉胁迫以及降低籽粒镉积累的效应。
1 材料与方法 1.1 材料阿氏芽孢杆菌(Bacillus aryabhattai)T61为本实验室分离保存[17-18]。T61-eGFP为本实验室构建,采用融合PCR的方法将醛酮还原酶AKR5G3基因的启动子区与eGFP荧光报告基因融合,构建完成绿色荧光蛋白(eGFP)标记菌株[19]。
水稻(Oryza sativa L.)种子由湖南杂交水稻研究中心王伟平副研究员提供。其中,日本晴是典型粳稻品种,728B是该中心选育的相对低镉积累的籼稻品种,内香1B是引进的低镉积累籼稻品种,博B和深95B是相对高镉积累的籼稻品种,全发育期100~112 d。
1.2 培养基TGY培养基(1 L):胰蛋白胨5 g,酵母提取物3 g,葡萄糖1 g。King培养基(1 L):蛋白胨20 g,甘油15 mL,MgSO4·7H2O 1.5 g,K2HPO4 1.15 g。MKB培养基(1 L):酪蛋白氨基酸5 g,K2HPO4 2.5 g,MgSO4·7H2O 2.5 g,甘油15 mL。PKO无机磷培养基(1 L):蔗糖10 g,MgSO4·7H2O 0.1 g,(NH4)2SO4 0.1 g,NaCl 0.5 g,Ca3(PO4)2 3.0 g,KCl 0.2 g,MnSO4·H2O 0.03 g,FeSO4 0.03 g,酵母提取物0.5 g。以上固体培养基添加2%琼脂。
1.3 方法 1.3.1 IC50、MIC和MTC的测定半致死浓度(IC50):将菌株在5 mL TGY培养基中30℃培养至对数期(OD600=0.3~0.4)。在各试管中加入10 mmol·L-1的CdCl2,使Cd2+的终浓度为0、5、10、20、40、80、100 μmol·L-1,培养24 h后测定OD600,OD600为空白管(不加CdCl2)一半时所对应的CdCl2浓度为IC50。每个浓度测3个平行样。
最小抑制浓度(MIC):按照Wiegand等[20]的方法进行。将不同浓度的TGY+CdCl2溶液分别加到无菌的96孔板中,第1~9孔加TGY+CdCl2溶液,每孔50 μL,第11孔加100 μL TGY(阴性对照),第12孔加50 μL TGY。将相当于0.5麦氏比浊标准的菌悬液(1×108~2×108 CFU·mL-1),经TGY培养基1∶100稀释后,向第1~10孔和12孔中各加50 μL,使得第1~10孔CdCl2终浓度分别为5、10、20、40、80、160、320、640、1 280、2 560 μmol·L-1,第12孔为菌株生长的阳性对照。30 ℃培养16~20 h后判断结果。选取能观察到菌液浑浊与清亮的相邻两孔,MIC记为没有明显生长的最小CdCl2浓度。每个浓度测3个平行样。
最大耐受浓度(MTC):根据MIC值,逐步增大96孔板中的CdCl2浓度,各孔取100 μL菌液,涂布于不含重金属离子的TGY平板,如果在某个浓度下只能观察到菌株的轻微生长,并且在略高于这个浓度的平板上观察不到菌株的生长,这一浓度即为最大耐受浓度。每个浓度测3个平行样。
1.3.2 T61对Cd2+吸附性的测定参照Zhou等[21]的方法。模拟湖南醴陵基地镉污染程度,配制含2.5、5、10 μmol·L-1的CdCl2 TGY培养液,并按比例加入细菌,使得最终菌体浓度为1.0 g·L-1,以不加菌的TGY培养基为空白对照。在30 ℃、120 r·min-1的恒温培养箱中振荡培养,在2、10、24 h时,分别取菌液于25 ℃,7 000 r·min-1离心10 min,取上清液过0.45 μm滤膜,用电感耦合等离子体质谱仪(ICP-MS)测定溶液中剩余的Cd2+含量。计算细菌对Cd2+的去除能力。
1.3.3 IAA分泌量测定参照Glickmann等[22]的方法,在King培养基中接入对数期菌液,30 ℃、180 r·min-1培养7 d。每组设3次重复,以不加菌的King培养基为空白对照。每24 h取一次培养液,4 ℃、7 000 r·min-1离心10 min。吸取上清液1 mL,运用SaLkowski法,滴加1 mL S2比色液,在避光条件下显色30 min,测定OD530,以5~25 μg·mL-1的IAA制作标准曲线。
1.3.4 铁载体分泌量测定参照Alexander等[23]的方法,在MKB培养基中接入对数期的菌液,30 ℃、180 r·min-1培养8 d。每组设3次重复,以不加菌的MKB培养基为空白对照。每24 h取一次培养液,4 ℃、7 000 r·min-1离心10 min,收集上清液。取上清液与CAS蓝色检测液等体积混合,28 ℃水浴6~12 h,测定OD630。以2~10 µmoL·L-1的甲磺酸去铁胺(DFOM)制作标准曲线。
1.3.5 溶磷量测定参照孙亚凯[24]的方法,在PKO无机磷培养基中接入对数期菌液,30 ℃、180 r·min-1培养9 d,每组设3次重复。每24 h取一次培养液,以4 ℃、7 000 r·min-1离心10 min,吸取上清液5~10 mL于50 mL容量瓶中,用dH2O稀释至约30 mL。加入2~3滴2,6-二硝基苯酚指示剂,并用10% NaOH或5% 稀硫酸调节溶液至刚显微黄色,加入5 mL钼锑抗显色剂,摇匀,加水定容至50 mL。在室温20 ℃以上条件下,放置30 min后测定OD720。根据标准曲线计算出溶磷量。以0.1~0.5 mg·L-1磷酸二氢钾制备的标准磷溶液制作标准曲线。
1.3.6 菌株T61在水稻植株上的定殖试验以粳稻日本晴和籼稻博B为材料,选取饱满的种子用5% NaClO浸泡10 min消毒,用蒸馏水冲洗3~5次,在30 ℃培养箱中暗处催芽24 h。之后将种子转移至铺有两层无菌试纸、直径9 cm的培养皿中,置于光照14 h/黑暗10 h,光强3 000 lx,温度28 ℃/20 ℃,湿度70% 的光照培养箱中培养15 d。将4叶期幼苗用T61-eGFP菌液(108 CFU·mL-1)浸泡根部30 min,随后将幼苗转移至含镉土壤(1 mg·kg-1)中培养,分别在第15 d和30 d取出植株,清洗消毒。将根和茎纵向切成薄片,置于载玻片上,用倒置显微镜在激发蓝光下观察。
1.3.7 耐镉菌株对镉胁迫下水稻种子萌发和幼苗生长的影响将日本晴种子用1.3.6的方法消毒和清洗,在30 ℃培养箱中暗处催芽12 h。菌剂处理组:将催芽12 h的水稻种子转移至阿氏芽孢杆菌T61的饱和菌剂(108 CFU·mL-1)中暗处浸种12 h;空白对照组:将催芽12 h的种子继续在30 ℃培养箱中暗处放置12 h。之后将处理组和对照组的种子转移至铺有两层无菌试纸、直径9 cm的培养皿中,加入10 mL不同浓度的CdCl2溶液,镉浓度为0、10、20、40、80 μmol·L-1,并置于光照培养箱中培养,培养条件同1.3.6。
培养4 d后统计发芽率,以芽长达到种子长度的一半作为发芽标准,发芽率=发芽种子数/供试种子数。生长至14 d时采集全部水稻样品,用卷尺测量茎基部至幼苗顶端叶尖,即为茎叶长,测定根尖到幼苗茎基部的长度,即为根长,记录数据。
1.3.8 耐镉菌株缓解水稻镉胁迫的大田试验2018年4—10月,4个水稻品种728B、内香1B、博B和深95B在湖南杂交水稻研究中心醴陵基地进行栽培。该地区土壤的理化性质为pH 6.5,电导率198.7 μS·cm-1,土壤含水量51.2%,有机质含量3.2%,有机碳含量13.7 g·kg-1,总氮2.8 g·kg-1,速效磷14.2 mg·kg-1,速效钾181.9 mg·kg-1,NH4+-N 220.6 mg·kg-1,NO3--N 0.4 mg·kg-1,重金属镉、铬、锰、铜和铅的含量为0.9、69.0、53.4、28.8 mg·kg-1和52.1 mg·kg-1。根据国家《土壤环境质量农用地土壤污染风险管控标准(试行)》(GB 15618—2018),该地区镉水平超过风险筛选值。
将实验田分成30个区组(200 cm´60 cm),区组之间相隔40 cm,每个区组3列,每列10穴,每穴插2株,穴间距20 cm。当水稻秧苗长至五叶一心时,将水稻根浸泡在饱和T61菌剂(108 CFU·mL-1)中30 min后插秧,对照组不浸泡菌液。每个品种对照组和菌剂处理组各设3个随机区组重复。采用无污染水灌溉,前期按当地习惯进行大田水分管理,抽穗后保持田间浅水,进行干湿灌溉管理。本田施底肥,每公顷施复合肥225 kg,插秧后5 d内进行第一次追肥,每公顷施复合肥225 kg、尿素75 kg。
当水稻在田间生长30 d(营养生长期)和60 d(生殖生长期)时,分别在每个区组收集水稻茎、叶样品各3份,采用苏州科铭生物技术有限公司出品的试剂盒测定样品丙二醛(MDA)和超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)3种抗氧化酶活力。在成熟期收获水稻籽粒,并采用电感耦合等离子体质谱仪(ICP-MS)对去壳籽粒(糙米)镉含量进行测定,每个样品测定3个平行样。
2 结果与分析 2.1 菌株T61对Cd2+的耐受性和吸附性阿氏芽孢杆菌(Bacillus aryabhattai)T61是一株本实验室分离的对多种胁迫条件(紫外辐射、γ-射线、氧化胁迫)具有较强抗性的菌株。本研究对T61进行了Cd2+抗性鉴定,结果表明该菌株对Cd2+的IC50为15 μmol·L-1,MIC为80 μmol·L-1,MTC为500 μmol·L-1。
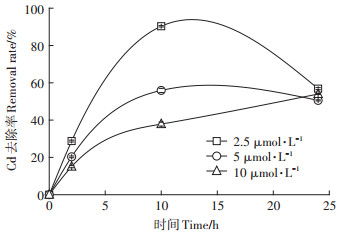
对菌株T61对Cd2+的去除性进行测定,在2.5、5、10 μmol·L-1 CdCl2存在时,菌体T61在2 h时,对Cd2+的去除率分别为28.8%、20.3%和15.0%;在10 h时,对Cd2+的去除率分别为90.3%、55.9% 和37.9%;在24 h时,对Cd2+的去除率分别为56.9%、50.6%和54.0%(图 1)。
|
图 1 菌株T61对Cd2+的去除率 Figure 1 Removal rate of Cd2+ by T61 strain |
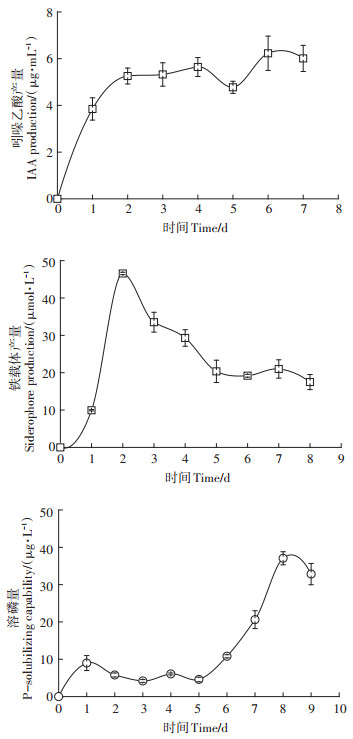
对菌株T61的植物促生性进行测定,结果见图 2。T61在第1 d时产IAA量较少,此后趋于稳定,最高IAA产量为6.2 μg·mL-1;T61在第2 d时合成的铁载体量最高,为46.6 μmol·L-1,此后产量逐渐降低;T61在前5 d溶磷量较低,此后溶磷量上升,在第8 d时达到最大,为37.1 µg·mL-1。
|
图 2 菌株T61的植物促生性测定 Figure 2 Determination of the plant growth promotion traits of T61 strain |
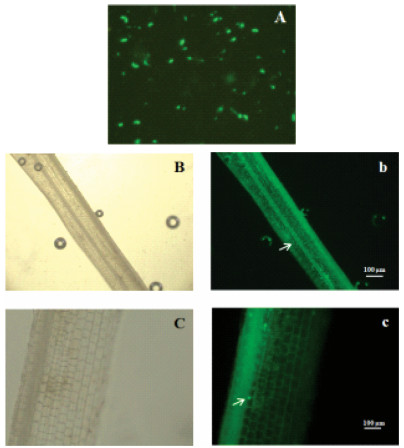
采用绿色荧光蛋白标记的菌株T61(图 3A)侵染水稻根,结果表明T61可在日本晴和博B两个水稻品种的植株内有效定殖。T61菌剂蘸根处理15 d后,标记的菌株T61可以定殖在水稻根部(图 3B和图 3b)。处理30 d后,在水稻幼苗茎部的中央髓部维管束也观察到绿色荧光标记的菌体(图 3C和图 3c)。这一结果表明T61在侵入植物体内后,可通过根部皮层细胞间隙进入维管束,并沿维管束系统纵向移动,由植株地下部分向地上部分迁移或扩散。
|
A:T61-eGFP(放大400倍)B、b:博B根(放大100倍)C、c:日本晴茎部(放大100倍) A: T61-eGFP (400×) B, b: BB root (100×) C, c: RBQ shoot (100×) 图 3 荧光倒置显微镜观察T61-eGFP在水稻植株上的定殖情况 Figure 3 Observation of the colonization of T61-eGFP inside rice by fluorescent inverted microscope |
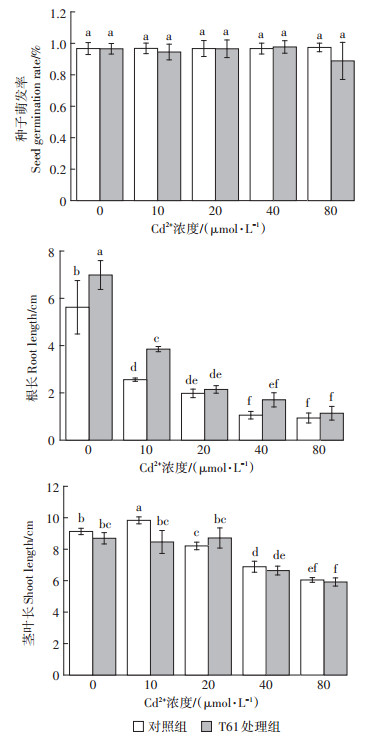
T61对水稻种子萌发的影响如图 4所示。结果表明,当CdCl2浓度在10~80 μmol·L-1时,日本晴种子的萌发率均在90%以上,T61菌剂处理组对萌发率没有产生显著影响。随着Cd2+浓度增大,水稻根的生长受到显著抑制,但在T61菌剂处理组中,根长均大于对照组,说明T61菌剂缓解了镉胁迫对水稻幼苗根生长的抑制作用。施加菌剂对茎叶长没有显著影响。
|
不同小写字母表示处理间差异显著(P < 0.05)。下同 The different lowercase letters indicate significant differences among treatments (P < 0.05). The same below 图 4 镉胁迫下接种T61菌剂对水稻种子萌发的影响 Figure 4 Effect of T61 inoculum on seed germination under Cd stress |
由于镉胁迫可诱导细胞产生活性氧自由基(ROS),引起细胞产生氧化应激反应,为了评估菌剂施加缓解水稻受镉胁迫的作用,对4个水稻品种728B、内香1B、博B和深95B地上茎、叶部分进行氧化应激标志物MDA和抗氧化酶活性测定。
在营养生长期,T61菌剂处理后,MDA水平和抗氧化酶活性整体呈下降趋势(图 5)。相比对照组,茎中的MDA水平下降了12.6%~50.8%、叶中MDA含量下降了4.1%~32.5%;除728B外,其他3个水稻品种茎中的SOD活性下降了24.1%~58.5%,叶中无明显下降趋势;4个水稻品种的茎中POD活性下降25.2%~44.6%,除S95B之外,其他3个品种叶中POD活性下降5.8%~29.5%;4个品种茎中的CAT活性分别下降8.2%~64.5%,叶中无明显下降趋势。在生殖生长期,茎和叶MDA水平和抗氧化酶活性没有明显规律(结果未显示)。
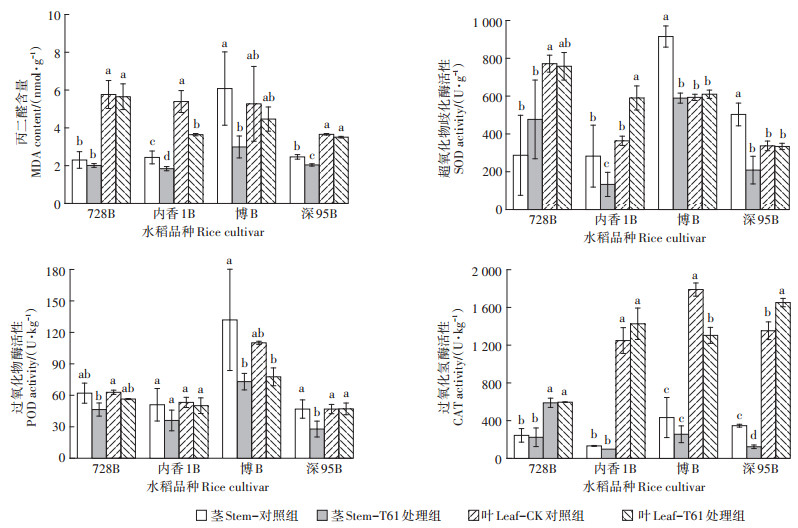
|
图 5 施加T61菌剂对水稻营养生长期丙二醛含量及抗氧化酶活性的影响 Figure 5 Effects of T61 inoculum on MDA content and antioxidant enzyme activity in rice at vegetative stage |
在成熟期收获籽粒,并采用ICP-MS对水稻去壳糙米的镉含量进行测定。T61菌剂施加后,728B和内香1B的镉含量分别比对照组降低13.5%和11.2%,达到国家食品卫生标准(镉<0.2 mg·kg-1),但不能降低博B和深95B糙米的镉含量(图 6),说明T61菌剂对不同水稻品种籽粒镉积累的影响不同。

|
图 6 接种T61对不同品种水稻籽粒镉积累的影响 Figure 6 Effects of T61 inoculum on Cd accumulation in rice grains of different cultivars |
本研究表明阿氏芽孢杆菌T61具有较强的镉耐受性和镉吸附性,具有合成IAA、铁载体和溶磷3种植物促生性。该菌株可以定殖于水稻植株上,促进镉胁迫下水稻幼苗根的生长,缓解水稻营养生长期镉导致的氧化胁迫,并降低某些水稻品种籽粒镉含量,在农田重金属的微生物修复领域具有一定的应用前景。
微生物可以对土壤重金属进行原位钝化修复,主要在于其可以定殖在植物根际和根部,通过胞外沉淀和吸附、胞内吸收和转化对重金属离子加以固定或将其转化为低毒形式,从而减少重金属离子向植物地上部分的转移和积累[6]。芽孢杆菌常用于土壤重金属修复,其细胞壁中的肽聚糖和磷壁酸以及胞外聚合物(EPS)可以结合或吸附重金属离子[14, 25]。有研究报道,阿氏芽孢杆菌MCC3374在含砷培养基中培养24~36 h后可以去除41% 的As(Ⅴ)和26% 的As(Ⅲ)[26]。本研究发现阿氏芽孢杆菌T61在含镉液体培养基中培养24 h后,培养基中的Cd2+下降50%,说明T61菌株可以对Cd2+产生吸附和结合作用。通过荧光蛋白标记,进一步证实菌株T61可以定殖于水稻根部和茎部细胞的细胞间隙,从而可以在胞外对Cd2+进行吸附和固定,减少Cd2+进入植物细胞而产生的毒害。但T61在水稻植株中的分布和迁移规律尚不明确,尚需采用qPCR等技术,定量分析T61在水稻植株各部分的丰度,以探讨菌株定殖和分布与植物细胞重金属含量和胁迫响应的关系。
许多微生物具有植物促生性,可以合成IAA、铁载体、ACC脱氨酶,并具有溶磷和固氮等活性,因此可以通过促进植物生长缓解重金属胁迫[6]。阿氏芽孢杆菌T61可以合成IAA和铁载体,并具有溶磷活性,是一个具有多种植物促生性的菌株。在镉胁迫下,T61菌剂处理组与对照组相比,水稻幼苗根长有显著提高,说明T61可以促进镉胁迫下水稻根的发育,减小镉对根生长的抑制作用。已报道芽孢杆菌DBM[16]、巨大芽孢杆菌[8]、枯草芽孢杆菌[7]和阿氏芽孢杆菌MCC3374[26]具有不同的植物促生性,在胁迫条件下发挥了微生物对植物生长的促进作用。
重金属可以诱导植物体内产生ROS,从而对细胞产生氧化胁迫[27]。一些研究报道了微生物可通过调节植物细胞的抗氧化酶活性以应对重金属胁迫[28]。例如,当Cd2+浓度为2.5 mmol·L-1时,阿氏芽孢杆菌MCC3374可以提高水稻(Oryza sativa L. var. Swarna masuri MTU7029)幼苗的SOD和CAT活性[26]。在另一项研究中,当Cd2+浓度为0.3 mmol·L-1时,芽孢杆菌PbSP6和AsSP9却降低了水稻(Oryza sativa var. Satabdi)幼苗的MDA含量和SOD活性[29]。因此,镉胁迫程度和菌剂种类对不同水稻品种抗氧化酶活性的影响存在差异。本研究通过施加T61菌剂,在湖南醴陵地区轻度镉污染(0.9 mg·kg-1)的条件下,观察到营养生长期4个水稻品种茎叶中的MDA含量和SOD、CAT、POD活性有不同程度的下降,分析其原因可能包括以下几个方面:(1)T61可以定殖在水稻根和茎的细胞间隙,通过在植物细胞外对Cd2+进行吸附和固定,减少Cd2+进入水稻细胞,从而使细胞MDA和抗氧化酶活性均有所降低;(2)菌剂处理后,不同水稻品种MDA和抗氧化酶活性有所差异,这可能与水稻品种以及T61的定殖丰度有关。因此,需要进一步探讨细菌丰度与植物细胞抗氧化酶活性的关系;(3)与营养生长期相比,菌剂处理对生殖生长期MDA和抗氧化酶活性没有明显影响。推测在苗期通过蘸根法进入水稻体内的T61受到来自土壤微生物竞争和宿主自身菌群和代谢的影响,导致营养生长期和生殖生长期植株体内T61的定殖丰度出现变化,削弱了菌剂的作用效果。一些研究表明,许多垂直传播的内生菌在植株内的存活时间受到土壤微生物和宿主代谢活动的影响[30]。因此,尚需深入研究内生菌在植物体内的定殖和分布规律,这对于了解菌剂与水稻的互作关系,探讨耐镉菌剂缓解水稻受镉胁迫的作用具有重要意义。
4 结论(1)阿氏芽孢杆菌T61具有较强的镉抗性和镉吸附性,对Cd2+的最大耐受浓度为500 μmol·L-1;24 h液体培养后对Cd2+的去除率在50%以上。
(2)阿氏芽孢杆菌T61具有较好的植物促生性,可以合成IAA、铁载体,具有溶磷活性。
(3)阿氏芽孢杆菌T61可以定殖在水稻植株内部,在种子萌发期可以促进根的生长,在大田试验中可以缓解水稻营养期镉导致的氧化胁迫,并降低728B和内香1B糙米中的镉含量。
| [1] |
陈卫平, 杨阳, 谢天, 等. 中国农田土壤重金属污染防治挑战与对策[J]. 土壤学报, 2018, 55(2): 261-272. CHEN Wei-ping, YANG Yang, XIE Tian, et al. Challenges and countermeasures for heavy metal pollution control in farmlands of China[J]. Acta Pedologica Sinica, 2018, 55(2): 261-272. |
| [2] |
Hu Y, Cheng H, Tao S. The Challenges and solutions for cadmium-contaminated rice in China: A critical review[J]. Environment International, 2016, 92/93: 515-532. DOI:10.1016/j.envint.2016.04.042 |
| [3] |
Sarwar N, Imran M, Shaheen M R, et al. Phytoremediation strategies for soils contaminated with heavy metals: Modifications and future perspectives[J]. Chemosphere, 2017, 171: 710-721. DOI:10.1016/j.chemosphere.2016.12.116 |
| [4] |
Sobariu D L, Fertu D I T, Diaconu M, et al. Rhizobacteria and plant symbiosis in heavy metal uptake and its implications for soil bioremediation[J]. New Biotechnology, 2017, 39(Pt A): 125-134. |
| [5] |
Liu W, Zuo Q, Zhao C, et al. Effects of Bacillus subtilis and nanohydroxyapatite on the metal accumulation and microbial diversity of rapeseed(Brassica campestris L.)for the remediation of cadmium-contaminated soil[J]. Environmental Science and Pollution Research, 2018, 25(25): 25217-25226. DOI:10.1007/s11356-018-2616-8 |
| [6] |
Etesami H. Bacterial mediated alleviation of heavy metal stress and decreased accumulation of metals in plant tissues: Mechanisms and future prospects[J]. Ecotoxicology and Environmental Safety, 2018, 147: 175-191. DOI:10.1016/j.ecoenv.2017.08.032 |
| [7] |
Treesubsuntorn C, Dhurakit P, Khaksar G, et al. Effect of microorganisms on reducing cadmium uptake and toxicity in rice (Oryza sativa L.)[J]. Environmental Science and Pollution Research, 2018, 25(26): 25690-25701. DOI:10.1007/s11356-017-9058-6 |
| [8] |
Li Y, Pang H D, He L Y, et al. Cd immobilization and reduced tissue Cd accumulation of rice(Oryza sativa wuyun-23)in the presence of heavy metal-resistant bacteria[J]. Ecotoxicology and Environmental Safety, 2017, 138: 56-63. DOI:10.1016/j.ecoenv.2016.12.024 |
| [9] |
Liu Y, Tie B, Li Y, et al. Inoculation of soil with cadmium-resistant bacterium Delftia sp. B9 reduces cadmium accumulation in rice(Oryza sativa L.) grains[J]. Ecotoxicology and Environmental Safety, 2018, 163: 223-229. DOI:10.1016/j.ecoenv.2018.07.081 |
| [10] |
Lin X, Mou R, Cao Z, et al. Characterization of cadmium-resistant bacteria and their potential for reducing accumulation of cadmium in rice grains[J]. Science of the Total Environment, 2016, 569/570: 97-104. DOI:10.1016/j.scitotenv.2016.06.121 |
| [11] |
Punjee P, Siripornadulsil W, Siripornadulsil S. Reduction of cadmium uptake in rice endophytically colonized with the cadmium-tolerant bacterium Cupriavidus taiwanensis KKU2500-3[J]. Canadian Journal of Microbiology, 2018, 64(2): 131-145. DOI:10.1139/cjm-2017-0198 |
| [12] |
Siripornadulsil S, Siripornadulsil W. Cadmium-tolerant bacteria reduce the uptake of cadmium in rice: Potential for microbial bioremediation[J]. Ecotoxicology and Environmental Safety, 2013, 94: 94-103. DOI:10.1016/j.ecoenv.2013.05.002 |
| [13] |
张淼, 叶长城, 喻理, 等. 矿物硅肥与微生物菌剂对水稻吸收积累镉的影响[J]. 农业环境科学学报, 2016, 35(4): 627-633. ZHANG Miao, YE Chang-cheng, YU Li, et al. Effects of mineral silicon fertilizer and microbial agent on uptake and accumulation of cadmium by rice[J]. Journal of Agro-Environment Science, 2016, 35(4): 627-633. |
| [14] |
余劲聪, 何舒雅, 曾润颖, 等. 芽孢杆菌修复土壤重金属镉污染的研究进展[J]. 广东农业科学, 2016, 43(1): 73-78. YU Jin-cong, HE Shu-ya, ZENG Run-ying, et al. Research progress in remediation of cadmium contaminated soil with Bacillus[J]. Guangdong Agricultural Sciences, 2016, 43(1): 73-78. |
| [15] |
Ma Y, Prasad M N, Rajkumar M, et al. Plant growth promoting rhizobacteria and endophytes accelerate phytoremediation of metalliferous soils[J]. Biotechnology Advances, 2011, 29(2): 248-258. DOI:10.1016/j.biotechadv.2010.12.001 |
| [16] |
陈佛保, 柏珺, 林庆祺, 等. 植物根际促生菌(PGPR)对缓解水稻受土壤锌胁迫的作用[J]. 农业环境科学学报, 2012, 31(1): 67-74. CHEN Fo-bao, BO Jun, LIN Qing-qi, et al. Application of plant growth-promoting rhizobacteria(PGPR)for reducing zinc stress on paddy rice[J]. Journal of Agricultural Environmental Science, 2012, 31(1): 67-74. |
| [17] |
冯玮, 张蕾, 宣慧娟, 等. 西藏土壤中耐辐射阿氏芽孢杆菌T61的分离和鉴定[J]. 微生物学通报, 2016, 43(3): 488-494. FENG Wei, ZHANG Lei, XUAN Hui-juan, et al. Isolation and identification of radiation resistant Bacillus aryabhattai T61 from Tibetan soil[J]. Microbiology Bulletin, 2016, 43(3): 488-494. |
| [18] |
Yan Y, Zhang L, Yu M Y, et al. The genome of Bacillus aryabhattai T61 reveals its adaptation to Tibetan Plateau environment[J]. Genes & Genomics, 2016, 38(3): 293-301. |
| [19] |
冯玮. 阿氏芽孢杆菌醛-酮还原酶基因对UV辐射的响应及启动子分析[D]. 北京: 首都师范大学, 2015: 48-49. FENG Wei. UV Response and promoter analysis of an aldo-keto reductase gene from Bacillus aryabhattai[D]. Beijing: Capital Normal University, 2015: 48-49. |
| [20] |
Wiegand I, Hilpert K, Hancock R E. Agar and broth dilution methods to determine the minimal inhibitory concentration(MIC)of antimicrobial substances[J]. Nature Protocols, 2008, 3(2): 163-175. DOI:10.1038/nprot.2007.521 |
| [21] |
Zhou W, Zhang H, Ma Y, et al. Bio-removal of cadmium by growing deep-sea bacterium Pseudoalteromonas sp. SCSE709-6[J]. Extremophiles, 2013, 17(5): 723-731. DOI:10.1007/s00792-013-0554-4 |
| [22] |
Glickmann E, Dessaux Y. A critical examination of the specificity of the Salkowski reagent for indolic compounds produced by phytopathogenic bacteria[J]. Applied and Environmental Microbiology, 1995, 61(2): 793-796. DOI:10.1128/AEM.61.2.793-796.1995 |
| [23] |
Alexander D B, Zuberer D A. Use of chrome azurol S reagents to evaluate siderophore production by rhizosphere bacteria[J]. Biology and Fertility of Soils, 1991, 12(1): 39-45. DOI:10.1007/BF00369386 |
| [24] |
孙亚凯. 功能性微生物菌株的筛选及组合菌群活性研究[D]. 天津: 天津大学, 2006: 6-10. SUN Ya-kai. The screen of the functional microbial strains and the study on activities of microbial combination communities[D]. Tianjing: Tianjing University, 2006: 6-10. |
| [25] |
Wei X, Fang L, Cai P, et al. Influence of extracellular polymeric substances(EPS)on Cd adsorption by bacteria[J]. Environmental Pollution, 2011, 159(5): 1369-1374. DOI:10.1016/j.envpol.2011.01.006 |
| [26] |
Ghosh P K, Maiti T K, Pramanik K, et al. The role of arsenic resistant Bacillus aryabhattai MCC3374 in promotion of rice seedlings growth and alleviation of arsenic phytotoxicity[J]. Chemosphere, 2018, 211: 407-419. DOI:10.1016/j.chemosphere.2018.07.148 |
| [27] |
Shah K, Kumar R G, Verma S, et al. Effect of cadmium on lipid peroxidation, superoxide anion generation and activities of antioxidant enzymes in growing rice seedlings[J]. Plant Science, 2001, 161(6): 1135-1144. DOI:10.1016/S0168-9452(01)00517-9 |
| [28] |
Islam F, Yasmeen T, Ali Q, et al. Influence of Pseudomonas aeruginosa as PGPR on oxidative stress tolerance in wheat under Zn stress[J]. Ecotoxicology and Environmental Safety, 2014, 104: 285-293. DOI:10.1016/j.ecoenv.2014.03.008 |
| [29] |
Pandey S, Ghosh P K, Ghosh S, et al. Role of heavy metal resistant Ochrobactrum sp. and Bacillus spp. strains in bioremediation of a rice cultivar and their PGPR like activities[J]. Journal of Microbiology, 2013, 51(1): 11-17. DOI:10.1007/s12275-013-2330-7 |
| [30] |
Truyens S, Weyens N, Cuypers A, et al. Bacterial seed endophytes: Genera, vertical transmission and interaction with plants[J]. Environmental Microbiology Reports, 2015, 7(1): 40-50. DOI:10.1111/1758-2229.12181 |
 2021, Vol. 40
2021, Vol. 40


