随着工农业的迅猛发展,环境重金属污染给农业生产以及人类健康带来的负面影响日益凸显。据2014年《全国土壤污染状况调查公报》首次对全国土壤污染状况调查显示,全国土壤污染总超标率为16.1%,其中铅(Pb)是我国土壤耕地主要重金属污染和重点监控与防治的六种重金属之一[1-2]。Pb毒害抑制植物根系生长,阻碍植物对土壤养分元素的吸收,并引起植物体内一系列生理代谢紊乱,最终导致作物减产、品质下降[3-5]。土壤重金属污染修复方法包括物理、化学以及生物修复等各种措施,其修复原理主要是通过物理、化学或生物的手段从污染的土壤或水体环境中移除重金属或将重金属固定在环境中降低其移动性和生物有效性从而降低其毒性[6-7]。鉴于污染农田土壤多属于轻度污染以及我国人口多、耕地少的实际情况,选用操作简单、成本低、见效快的原位钝化生态修复技术降低植物对重金属的吸收以及在食用部位的积累而进行边修复边生产具有重要的现实意义[8]。
纳米颗粒(Nanoparticles,NPs)是特征尺寸在纳米数量级(1~100 nm)的极细颗粒,因自身巨大的比表面积、强的催化和吸附等物化特性使其在环境重金属污染修复领域的应用备受关注,在改善环境方面已被美国纳米技术行动列为8个交叉领域之一[9],我国“十三五”规划纲要中也明确提出大力发展纳米功能材料。近年来,国内外一些学者研究表明纳米颗粒还有益于植物的生长并可以缓解重金属[10]、盐[11]等非生物胁迫对植物造成的毒害,如,硅纳米颗粒可以通过减少水稻镉(Cd)、Pb吸收和豌豆铬(Cr)吸收而缓解重金属对植物的伤害[12-13]。然而目前利用纳米材料辅助植物修复方始起步,相关文献报道较少, 而寻求环境友好型的纳米材料高效修复剂对于降低农作物重金属积累、增加粮食安全具有重要的意义。
硫(S)是植物生长必需的大量营养元素,然而其在土壤中生物有效性较低。纳米硫(SNPs)作为一种新兴纳米材料,因其具备的纳米材料属性使其较普通硫肥在农药、医药、纤维工业等方面具有更广泛的应用,也是农业上病虫害防治的重要杀虫剂和杀菌剂[14-15]。然而目前SNPs对植物的效应评价国内外仅见Salem等[16-18]采用叶片喷施SNPs可显著促进番茄和西葫芦生长的相关报道,SNPs对其他植物的影响或在重金属污染修复领域的研究国内外鲜有报道。油菜(Brassica napus L.)为世界第二大油料作物,也是我国播种面积最大、分布最广泛的经济作物。因此,本文以油菜为研究材料,采用培养基培养试验,研究Pb胁迫下SNPs对油菜生长、生物量、Pb含量以及膜脂过氧化产物和抗氧化酶活性的影响,首次评估Pb污染环境下SNPs的生物效应和环境效应,为今后SNPs在农业和农业环境领域的研究与应用提供理论依据。
1 材料与方法 1.1 试验材料SNPs(99.99%,47 nm),购自美国纳米材料研究公司;油菜种子(秦油10号),购于江苏省农业科学院。丙二醛(MDA)含量和抗氧化酶(超氧化物歧化酶SOD、过氧化氢酶CAT、过氧化物酶POD、抗坏血酸过氧化物酶APX)活性检测试剂购于南京寿德试剂公司。
1.2 试验设计 1.2.1 SNPs悬浮液的配制无菌条件下称取0.144 g SNPs置于提前灭菌的装有80 mL去离子水的三角瓶中配制成母液,在超声水浴锅(KQ2200B,100 W,40 kHz,昆山超声仪器公司)内超声分散60 min形成稳定的纳米悬浮液备用。
1.2.2 Pb溶液的配制根据试验所需Pb质量分数,在无菌环境下准确称取Pb(NO3)2倒入提前灭菌的装有1.2 mL去离子水的离心管中混匀备用。
1.2.3 含Pb和SNPs的1/2 MS培养基的配制1/2 MS培养基灭菌后置于超净工作台中冷却,待培养基凝固前迅速将一定体积SNPs悬浮液和Pb溶液加入到培养基中,快速摇匀分装,每培养盒(220 mL)倒入60 mL 1/2 MS培养基。Pb浓度筛选试验保证培养基中Pb浓度为0、0.6、1.2、1.5 mmol·L-1,共4个处理,分别记作Pb0、Pb0.6、Pb1.2、Pb1.5;Pb+SNPs试验共3个处理,分别为CK(Pb 0,SNPs 0)、Pb(Pb 1.2 mmol·L-1)、Pb+SNPs(Pb 1.2 mmol·L-1+SNPs 300 mg· L-1)。以上处理均设置4次重复。
1.2.4 油菜种子的消毒和接种将油菜种子依次用70% 酒精消毒5 min,0.1% HgCl2消毒10 min,30% 的次氯酸钠溶液消毒20 min,灭菌的去离子水(DI H2O)清洗4~5次,每次1 min,然后接种到1/2 MS培养基,每盒接种12粒。
1.2.5 油菜的培养将接种好的培养盒移至人工气候箱中,在昼夜温度24 ℃/21 ℃,光暗时间14 h/10 h,光强42 000 lx的条件下培养,生长10 d后收获分析测定各指标。
1.2.6 不同形态S对油菜幼苗鲜质量和Pb积累的影响为比较Pb胁迫下大颗粒硫(SBPs)和硫酸盐与SNPs对油菜幼苗生长和Pb积累的影响差异,设置Pb+不同S试验,共5组处理,分别为CK、Pb(Pb 1.2 mmol·L-1)、Pb+SNPs(Pb 1.2 mmol·L-1+SNPs 300 mg· L-1)、Pb+SBPs(Pb 1.2 mmol·L-1+SBPs 300 mg·L-1)、Pb+硫酸盐(Pb 1.2 mmol·L-1+MgSO4·7H2O 300 mg· L-1),每处理4次重复。种子处理、SNPs和SBPs的超声悬浮、培养基配制、接种、培养均同上,10 d后收获分析测定植株鲜质量和Pb含量。
1.3 测定方法 1.3.1 生长指标测定幼苗从培养基中取出后,仔细清洗掉根部培养基,并分别用自来水和去离子水冲洗4~5次,株高、根长使用直尺直接测量,然后将根系和地上部分开,一部分用液氮冷冻研成粉末后置于-80 ℃超低温冰箱用于酶活测定,一部分置于烘箱内70 ℃连续干燥72 h烘至恒质量,测定干质量和Pb含量。
1.3.2 Pb含量测定分别称取约0.1 g根系和地上部干样粉末,添加5 mL硝酸采用两步微波消解法消煮(Milestone ETHOS A,Italy):1 000 W升温至180 ℃约10 min,1 000 W保持20 min,然后冷却至50 ℃以下后取出消煮模块,用去离子水定容至40 mL,用ICP-OES(PerkinElmer Optima 8000)测定Pb含量。
1.3.3 MDA和酶活测定MDA含量参照Tang等[19]的硫代巴比妥酸(TBA)法测定;SOD活性参照Beyer等[20]的氮蓝四唑(NBT)光化还原法测定;POD活性参照Jing等[21]的愈创木酚法测定;CAT活性参照Aebi[22]的紫外吸收法测定;APX活性参照Nakano等[23]的分光光度计法测定。
1.4 数据分析采用Office 2007和SPSS 11.5软件进行数据分析及差异显著性检验,数据间的显著性检验用单因素方差分析中的Duncan方法,P < 0.05表示差异显著。所有数据均采用平均值±标准偏差来表示,采用Sigma-Plot 13.0进行数据绘图。
2 结果与分析 2.1 Pb对油菜种子发芽和幼苗生长的影响不同浓度Pb对油菜种子萌发和幼苗生长的影响见图 1。从图 1A可以看出,0~1.2 mmol·L-1 Pb对种子萌发没有影响,种子萌发率均为100%,但是1.5 mmol·L-1高浓度Pb胁迫下种子萌发率仅为67.3%。另外,高浓度Pb对幼苗生长也产生了严重的抑制作用(图 1B),对不同Pb浓度下油菜鲜质量的分析表明,0.6~1.5 mmol·L-1 Pb均显著降低了油菜的鲜质量(P < 0.05),其中,1.2 mmol·L-1 Pb浓度下幼苗整株鲜质量较CK显著降低38.9%。
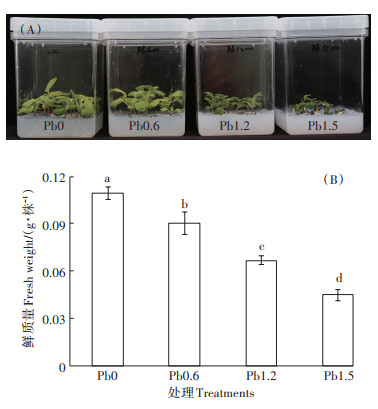
|
不同小写字母表示处理间差异显著(P < 0.05)。下同 Different lowercase letters mean significant differences between treatments (P < 0.05). The same below 图 1 Pb对油菜种子发芽和幼苗生长的影响 Figure 1 Effects of Pb on seed germination and seedlings growth of B. napus |
Pb胁迫及Pb胁迫下SNPs对油菜生长的影响见图 2。由图 2A和图 2B可以看出,1.2 mmol·L-1 Pb显著抑制了根系和地上部的生长,尤其根系的伸长生长严重受抑(P < 0.05),株高和根长分别较CK下降50.4%和90.2%,地上部和根系干质量分别下降40.7% 和31.7%。添加SNPs后Pb对油菜幼苗的毒性被极大缓解,株高、根长几乎接近CK水平,地上部和根系干质量分别较Pb单一处理增加70.7%和26.1%,根系较CK仅下降13.9%(P>0.05),地上部略高于CK(图 2C和图 2D)。

|
图 2 Pb胁迫下SNPs对油菜幼苗生长的影响 Figure 2 Effects of SNPs on seedlings growth of B. napus under Pb stress |
SNPs对油菜根系和地上部Pb含量和Pb积累量的影响如图 3所示。相较于Pb单一处理,1.2 mmol·L-1 Pb胁迫下添加300 mg·L-1 SNPs可显著降低油菜根系和地上部的Pb含量和Pb积累量。Pb+SNPs共处理下油菜地上部和根系Pb含量分别仅为Pb单一处理下相应部位Pb含量的5.7% 和29.5%;单株Pb积累量分别仅为Pb单一处理下相应部位Pb积累量的9.7%和36.4%。
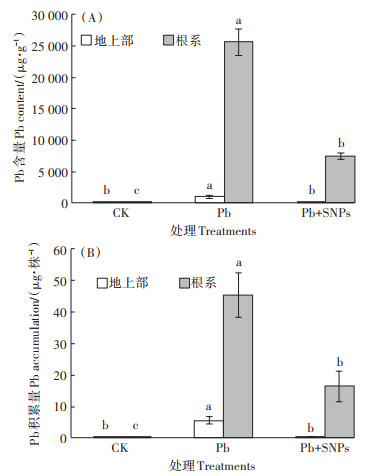
|
图 3 SNPs对油菜地上部和根系Pb含量的影响 Figure 3 Effects of SNPs on Pb contents in shoots and roots of B. napus |
Pb胁迫下SNPs对油菜不同部位膜脂过氧化产物MDA含量的影响见图 4。由图 4可知,1.2 mmol·L-1 Pb对油菜幼苗的胁迫效应非常显著,胁迫造成严重的膜脂过氧化,其产物MDA含量显著增加,地上部和根系MDA含量分别为CK的3.7倍和2.5倍(P < 0.05)。而添加外源SNPs可显著缓解Pb对油菜幼苗造成的胁迫,Pb+SNPs共处理下油菜地上部和根系MDA含量分别为CK的1.8倍和1.6倍,较单一Pb处理显著下降,仅为单一Pb处理下的51.2%和65.8%(P < 0.05),SNPs有效缓解了Pb对油菜细胞膜脂造成的氧化胁迫伤害。
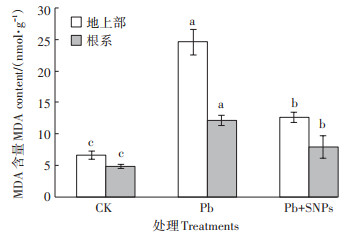
|
图 4 Pb胁迫下SNPs对油菜MDA含量的影响 Figure 4 Effects of SNPs on MDA contents in shoots and roots of B. napus under Pb stress |
Pb胁迫下SNPs对油菜抗氧化酶SOD、POD、CAT和APX活性的影响如图 5所示。由图 5可以看出,1.2 mmol·L-1 Pb单一胁迫诱导油菜根系和地上部SOD、POD、CAT和APX活性均不同程度增加,其中地上部SOD、POD、CAT和APX活性显著高于CK 59.2%、305.3%、69.2% 和86.9%(P < 0.05),根系POD、APX活性较CK也显著增加55.8% 和51.2%,SOD和CAT活性增加不显著。与Pb单一处理不同,Pb胁迫下添加SNPs后根系和地上部SOD、POD、CAT和APX活性均低于Pb单一处理下相应酶活,地上部SOD、POD、CAT和APX活性分别较Pb单一处理分别显著(POD除外)降低30.4%、31.5%、30.6% 和31.0%,根系中4种酶活下降1.2%~13.5%,下降程度不显著。
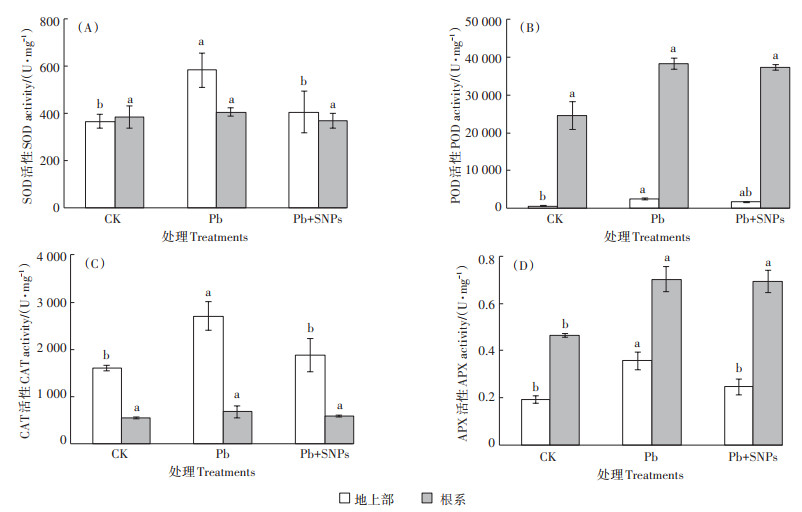
|
图 5 Pb胁迫下SNPs对油菜抗氧化酶活性的影响 Figure 5 Effects of SNPs on antioxidant enzymes activities in B. napus under Pb stress |
Pb胁迫下SNPs、SBPs以及硫酸盐对油菜生长和Pb积累的影响见图 6。由图 6A和图 6B可知,与单一Pb胁迫相比,Pb胁迫下添加不同形态S均显著促进了油菜的生长。但与SNPs相比,Pb胁迫下添加同浓度的SBPs和硫酸盐对油菜生长的促进作用相对较弱,植株鲜质量分别较单一Pb胁迫增加65.5% 和94.6%,而添加SNPs植株鲜质量较单一Pb胁迫增加145.5%,分别是同浓度SBPs和硫酸盐处理下幼苗鲜质量的1.48倍和1.26倍。对Pb胁迫下添加SBPs以及硫酸盐处理后幼苗地上部和根系Pb含量的分析表明,与单一Pb胁迫相比,Pb胁迫下添加不同形态S均显著降低了油菜对Pb的吸收,Pb胁迫下添加同浓度的SBPs和硫酸盐使油菜幼苗地上部Pb含量分别下降28.6% 和44.1%,根系Pb含量分别下降73.5% 和53.5%,但不同组织Pb含量水平显著高于添加同浓度SNPs处理下相应组织Pb含量(图 6C)。

|
图 6 Pb胁迫下不同形态S对油菜鲜质量及Pb含量的影响 Figure 6 Effects of different sulfur on fresh weight and Pb contents in B. napus under Pb stress |
已有大量研究表明,环境中过量的重金属会对植物水分代谢、矿质营养平衡、光合作用、形态建成等造成不可逆的生理毒害[24-26]。本研究也表明,培养基中高浓度Pb显著抑制了油菜种子萌发以及根系和地上部的生长,其中根系生长受抑制程度较地上部更为明显,1.2 mmol·L-1 Pb胁迫下根长较CK下降约90%,根系伸长生长几乎完全受抑。根系作为植物与环境直接接触的界面,是感受逆境信号最直接的器官,进入细胞内的Pb可与酶活性中心或蛋白质中的巯基结合,取代金属蛋白中的必需金属离子,从而导致蛋白质大分子构象改变、酶活性丧失、干扰细胞的正常生理代谢[27]。本研究中1.2 mmol·L-1 Pb胁迫下油菜地上部和根系Pb含量分别达1 006、25 628 µg·g-1,远超过报道中普通植物承受Pb浓度的阈值,因此,油菜体内高Pb累积是造成其生长受阻的直接原因。
MDA是植物细胞膜脂过氧化的重要产物,也是评价细胞损伤程度的重要指标。如秦建桥等[28]报道,随着Pb处理浓度的增加,五节芒叶片中MDA含量大幅度升高;Khan等[29]也报道100~500 μmol·L-1 Pb处理导致蓖麻体内MDA含量显著升高。本研究也表明1.2 mmol·L-1 Pb胁迫10 d导致油菜地上部和根系MDA含量增加,为CK的3.7倍和2.5倍,这可能是由于Pb胁迫下油菜体内Pb的大量积累导致植物体内产生的自由基未能及时清除而造成细胞膜脂严重氧化和细胞受损。植物防御重金属毒害由不同的机制和过程组成,其中抗氧化酶类在植物抵御氧化胁迫、限制活性氧自由基产生中发挥着重要作用。本研究中,Pb单一胁迫诱导油菜根系和地上部SOD、POD、CAT和APX抗氧化酶活性均不同程度增加,其中地上部SOD、POD、CAT和APX活性均显著高于CK。Singh等[30]对印度次藻(Najas indica)的研究表明,Pb胁迫导致MDA含量的增加,伴随着氧化损伤的增强,同时植物自身抗氧化防御机制抗氧化酶活明显提高,与本研究报道结果一致。
纳米材料因特殊的理化性质被应用于重金属污染废水处理的研究已见诸多报道。但目前利用纳米材料辅助植物修复重金属污染土壤的研究甚少。S是植物生长必需的大量元素,目前国内外尚无利用S纳米颗粒辅助植物修复的相关研究报道。本研究表明,Pb胁迫下添加SNPs后油菜地上部和根系Pb含量仅为Pb单一处理下相应部位Pb含量的5.7% 和29.5%;单株Pb积累量仅为Pb单一处理下相应部位Pb积累量的9.7% 和36.4%,SNPs可大幅降低油菜对Pb的吸收和向地上部的转运。同时,SNPs在降低Pb积累的同时使地上部和根系生物量大幅提高,株高、根长几乎接近于CK水平。Ali等[31]对小麦的研究表明,Cd胁迫下小麦幼苗叶片喷施Si纳米颗粒使地上部、根系、籽粒Cd含量分别较对照下降16%~58%、19%~64% 和20%~82%,同时干质量分别增加24%~ 69%、14%~59% 和31%~96%。Li等[32]研究表明不同浓度α-MnO2纳米颗粒处理可有效降低水稻对生物有效态As的吸收和向地上部的转运。Huang等[33]和Hussain等[34]学者最近也报道了纳米Fe3O4和纳米Fe有效降低植物吸收重金属并促进植物生长的相关研究结果。
SNPs极大地缓解了Pb对油菜的毒害,就目前研究结果其解毒机制主要与植物体内重金属积累量和膜脂过氧化程度密切相关。本研究中,Pb+SNPs共处理下地上部和根系Pb含量大幅下降,尤其地上部Pb含量和积累量不足单一Pb胁迫的10%。另外,Pb+ SNPs共处理下油菜地上部和根系膜脂过氧化产物MDA含量仅为单一Pb处理下的51.2% 和65.8%。Castiglionea等[35]对蚕豆(Vicia faba)的研究表明,与对照相比,TiO2显著增加了H2O2积累,而TiO2NPs处理下H2O2积累水平明显下降,H2O2含量比对照降低44.3%,同时抗氧化酶POD和CAT活性也低于对照,尤其CAT活性低于对照47.5%,且粒径越小,膜脂过氧化程度越低,可能由于纳米颗粒TiO2粒径越小,比表面积越大,清除自由基的能力越强。本研究中,Pb胁迫下添加SNPs后根系和地上部SOD、POD、CAT和APX活性也均低于Pb单一处理诱导的相应酶活,这可能是由于Pb+SNPs共处理下油菜对Pb的吸收积累以及Pb积累造成的细胞氧化损伤远低于Pb单一处理,与有关学者对水稻[36]、龙葵[37]、蚕豆[38]等不同作物的研究结果相似。
另外,通过研究比较不同形态S对油菜Pb积累的影响表明,3种不同形态S均显著降低了油菜对Pb的吸收和Pb对植物的毒害。关于S降低植物吸收重金属和促进植物生长已有大量文献报道,如刘家豪等[39]对水稻Cd吸收的研究表明,水稻叶面喷施Na2S可以将水稻产量提高6%~30%,水稻籽粒中Cd含量降低28%~50%。Yang等[40]在S对水稻Pb吸收的影响研究中也表明,30 mg·kg-1 S(Na2SO4)显著降低了水稻地上部茎秆和籽粒中的Pb含量,其机理可能是充足的S供应增加了水稻根系铁膜的形成,从而降低了土壤中Pb的生物有效性,进而减少了Pb在植物体内的积累。但也有文献报道外源施加S可增加重金属的生物活性从而提高植物修复效率,如Wang等[41]研究表明土壤中施加S可显著提高土壤中可溶性铜(Cu) 和锌(Zn)的比例,增加Cu超积累植物海州香薷根系和地上部Cu的积累。本研究中,不同形态S均具有降低油菜Pb吸收的作用,但SNPs效果最显著,其机制一方面可能是SNPs可与Pb离子形成PbS而降低Pb的生物活性,另一方面SNPs大的比表面积和强的吸附能力较普通大颗粒硫和硫酸盐更容易吸附固定介质中的Pb离子,从而降低根系对自由态Pb离子的吸收。
4 结论(1)单一Pb胁迫下油菜幼苗株高、根长、生物量均大幅降低,膜脂过氧化产物MDA含量急剧增加,抗氧化酶SOD、POD、CAT和APX活性不同程度增加,Pb胁迫对油菜生理代谢和生长均造成了较大的负面影响。
(2) Pb胁迫下添加SNPs大幅降低了油菜根系对Pb的吸收以及向地上部的转移,并极大地缓解了Pb对油菜幼苗的毒害。与单一Pb胁迫相比,MDA含量显著下降,株高、根长和生物量等生长参数均显著增加。较普通大颗粒硫和硫酸盐相比,SNPs具有更强的Pb阻控效果。
| [1] |
环境保护部和国土资源部. 全国土壤污染状况调查公报[R]. 北京: 环境保护部和国土资源部, 2014. Ministry of Environmental Protection and Ministry of Land and Resources. The soil pollution condition investigation communique[R]. Beijing: Ministry of Environmental Protection and Ministry of Land and Resources, 2014. |
| [2] |
Li Z, Ma Z, van der Kuijp T J, et al. A review of soil heavy metal pollution from mines in China: Pollution and health risk assessment[J]. Science of the Total Environment, 2014, 468/469: 843-853. DOI:10.1016/j.scitotenv.2013.08.090 |
| [3] |
Gopal R, Rizvi A H. Excess lead alters growth, metabolism and translocation of certain nutrients in radish[J]. Chemosphere, 2008, 70: 1539-1544. DOI:10.1016/j.chemosphere.2007.08.043 |
| [4] |
Yuan H Y, Zhang Y X, Huang S Z, et al. Effects of exogenous glutathione and cysteine on growth, lead accumulation, and tolerance of Iris lactea var. chinensis[J]. Environmental Science and Pollution Research, 2015, 22(4): 2808-2816. DOI:10.1007/s11356-014-3535-y |
| [5] |
Zheng L J, Peer T, Seybold V, et al. Pb-induced ultrastructural alterations and subcellular localization of Pb in two species of Lespedeza by TEM-coupled electron energy loss spectroscopy[J]. Environmental and Experimental Botany, 2012, 77: 196-206. DOI:10.1016/j.envexpbot.2011.11.018 |
| [6] |
Ali H, Khan E, Sajad M A. Phytoremediation of heavy metals: Concepts and applications[J]. Chemosphere, 2013, 91(7): 869-881. DOI:10.1016/j.chemosphere.2013.01.075 |
| [7] |
Gong Y Y, Zhao D Y, Wang Q L. An overview of field-scale studies on remediation of soil contaminated with heavy metals and metalloids: Technical progress over the last decade[J]. Water Research, 2018, 147: 440-460. DOI:10.1016/j.watres.2018.10.024 |
| [8] |
李剑睿, 徐应明, 林大松, 等. 农田重金属污染原位钝化修复研究进展[J]. 生态环境学报, 2014, 23(4): 721-728. LI Jian-rui, XU Yingming, LIN Da-song, et al. In situ immobilization remediation of heavy metals in contaminated soils: A review[J]. Ecology and Environmental Sciences, 2014, 23(4): 721-728. DOI:10.3969/j.issn.1674-5906.2014.04.029 |
| [9] |
Tratnyek P G, Johnson R L. Nanotechnologies for environmental cleanup[J]. Nano Today, 2006, 1: 44-48. |
| [10] |
Tripathi D K, Singh V P, Prasad S M, et al. Silicon nanoparticles (SiNp) alleviate chromium(Ⅵ) phytotoxicity in Pisum sativum L. seedlings[J]. Plant Physiology and Biochemistry, 2015, 96: 189-198. DOI:10.1016/j.plaphy.2015.07.026 |
| [11] |
Rossi L, Zhang W L, Ma X M. Cerium oxide nanoparticles alter the salt stress tolerance of Brassica napus L. by modifying the formation of root apoplastic barriers[J]. Environmental Pollution, 2017, 229: 132-138. DOI:10.1016/j.envpol.2017.05.083 |
| [12] |
Liu J, Cai H, Mei C, et al. Effects of nano-silicon and common silicon on lead uptake and translocation in two rice cultivars[J]. Frontiers of Environmental Science & Engineering, 2015, 9: 905-911. |
| [13] |
Cui J H, Liu T X, Li F B, et al. Silica nanoparticles alleviate cadmium toxicity in rice cells: Mechanisms and size effects[J]. Environmental Pollution, 2017, 228: 363-369. DOI:10.1016/j.envpol.2017.05.014 |
| [14] |
Singh R, Parihar P, Prasad S M. Simultaneous exposure of sulphur and calcium hinder As toxicity: Up-regulation of growth, mineral nutrients uptake and antioxidants system[J]. Ecotoxicology and Environmental Safety, 2018, 161: 318-331. DOI:10.1016/j.ecoenv.2018.05.060 |
| [15] |
Suleiman M, Ali A A, Hussein A, et al. Sulfur nanoparticles: Synthesis, characterizations and their applications[J]. Journal of Materials and Environmental Science, 2013, 4: 1029-1033. |
| [16] |
Salem N M, Albanna L S, Abdeen A O, et al. Green synthesis of nanosized sulfur and its effect on plant growth[J]. Journal of Agricultural Science, 2015, 8(1): 188-194. DOI:10.5539/jas.v8n1p188 |
| [17] |
Salem N M, Albanna L S, Abdeen A O, et al. Sulfur nanoparticles improves root and shoot growth of tomato[J]. Journal of Agricultural Science, 2016, 8(4): 179-185. DOI:10.5539/jas.v8n4p179 |
| [18] |
Salem N M, Albanna L S, Awwad A M. Green synthesis of sulfur nanoparticles using Punica granatum peels and the effects on the growth of tomato by foliar spray applications[J]. Environmental Nanotechnology, Monitoring & Management, 2016, 6: 83-87. |
| [19] |
Tang L L, Cai H, Ji W, et al. Overexpression of GsZFP1 enhances salt and drought tolerance in transgenic alfalfa(Medicago sativa L.)[J]. Plant Physiology and Biochemistry, 2013, 71: 22-30. DOI:10.1016/j.plaphy.2013.06.024 |
| [20] |
Beyer W F, Fridovich I. Assaying for superoxide dismutase activity: Some large consequences of minor changes in conditions[J]. Analytical Biochemistry, 1987, 161(2): 559-566. DOI:10.1016/0003-2697(87)90489-1 |
| [21] |
Jing G X, Huang H, Yang B, et al. Effect of pyrogallol on the physiology and biochemistry of litchi fruit during storage[J]. Chemistry Central Journal, 2013, 7(1): 19-29. DOI:10.1186/1752-153X-7-19 |
| [22] |
Aebi H. Catalase in vitro[M]//Methods in Enzymology, Orlando, Florida: Academic Press, 1984: 121-126.
|
| [23] |
Nakano Y, Asada K. Hydrogen-peroxide is scavenged by ascorbatespecific peroxidase in spinach-chloroplasts[J]. Plant and Cell Physiology, 1981, 22(5): 867-880. |
| [24] |
Singh R P, T ripathi R D, Sinha S K, et al. Response of higher plants to lead contaminated environment[J]. Chemosphere, 1997, 34(11): 2467-2493. DOI:10.1016/S0045-6535(97)00087-8 |
| [25] |
Verma S, Dubey R S. Lead toxicity induces lipid peroxidation and alters the activities of antioxidant enzymes in growing rice plants[J]. Plant Science, 2003, 164(4): 645-655. DOI:10.1016/S0168-9452(03)00022-0 |
| [26] |
黄化刚, 李廷轩, 杨肖娥, 等. 植物对铅胁迫的耐性及其解毒机制研究进展[J]. 应用生态学报, 2009, 20(3): 696-704. HUANG Hua-gang, LI Ting-xuan, YANG Xiao-e, et al. Research advances in plant lead tolerance and detoxification mechanism[J]. Chinese Journal of Applied Ecology, 2009, 20(3): 696-704. |
| [27] |
Stohs S J, Bagchi D. Oxidative mechanism in the toxicity of metal ions[J]. Free Radical Biology and Medicine, 1995, 18(2): 321-326. DOI:10.1016/0891-5849(94)00159-H |
| [28] |
秦建桥, 赵华荣, 胡萌, 等. 铅胁迫下不同生态型五节芒(Miscanthus floridulus) 的抗氧化系统的差异研究[J]. 生态环境学报, 2011, 20(3): 525-531. QIN Jian-qiao, ZHAO Hua-rong, HU Meng, et al. Physiological metabolism and protective enzyme activity of different ecotypes of Miscanthus floridulus under Pb stress[J]. Ecology and Environmental Sciences, 2011, 20(3): 525-531. DOI:10.3969/j.issn.1674-5906.2011.03.024 |
| [29] |
Khan M M, Islam E, Irem S, et al. Pb-induced phytotoxicity in para grass(Brachiaria mutica) and Castorbean(Ricinus communis L.): Antioxidant and ultrastructural studies[J]. Chemosphere, 2018, 200: 257-265. DOI:10.1016/j.chemosphere.2018.02.101 |
| [30] |
Singh R, Tripathi R D, Dwivedi S, et al. Lead bioaccumulation potential of an aquatic macrophyte Najas indica are related to antioxidant system[J]. Bioresource Technology, 2010, 101: 3025-3032. DOI:10.1016/j.biortech.2009.12.031 |
| [31] |
Ali S, Rizwan M, Hussain A, et al. Silicon nanoparticles enhanced the growth and reduced the cadmium accumulation in grains of wheat (Triticum aestivum L.)[J]. Plant Physiology and Biochemistry, 2019, 140: 1-8. DOI:10.1016/j.plaphy.2019.04.041 |
| [32] |
Li B Y, Zhou S, Wei D N, et al. Mitigating arsenic accumulation in rice(Oryza sativa L.) from typical arsenic contaminated paddy soil of southern China using nanostructured α-MnO2: Pot experiment and field application[J]. Science of the Total Environment, 2019, 650: 546-556. DOI:10.1016/j.scitotenv.2018.08.436 |
| [33] |
Huang Q, Liu Q, Lin L N, et al. Reduction of arsenic toxicity in two rice cultivar seedlings by different nanoparticles[J]. Ecotoxicology and Environmental Safety, 2018, 159: 261-271. DOI:10.1016/j.ecoenv.2018.05.008 |
| [34] |
Hussain A, Ali S, Rizwan M, et al. Responses of wheat(Triticum aestivum) plants grown in a Cd contaminated soil to the application of iron oxide nanoparticles[J]. Ecotoxicology and Environmental Safety, 2019, 173: 156-164. DOI:10.1016/j.ecoenv.2019.01.118 |
| [35] |
Castiglionea M R, Giorgettib L, Bellanib L, et al. Root responses to different types of TiO2 nanoparticles and bulk counterpart in plant model system Vicia faba L.[J]. Environmental and Experimental Botany, 2016, 130: 11-21. DOI:10.1016/j.envexpbot.2016.05.002 |
| [36] |
Wang S H, Wang F Y, Gao S C. Foliar application with nano-silicon alleviates Cd toxicity in rice seedlings[J]. Environmental Science and Pollution Research, 2015, 22(4): 2837-2845. DOI:10.1007/s11356-014-3525-0 |
| [37] |
Liu J G, Zhang H M, Zhang Y X, et al. Silicon attenuates cadmium toxicity in Solanum nigrum L. by reducing cadmium uptake and oxidative stress[J]. Plant Physiology and Biochemistry, 2013, 68: 1-7. DOI:10.1016/j.plaphy.2013.03.018 |
| [38] |
Shahid M, Pinelli E, Pourrut B, et al. Effect of organic ligands on lead-induced oxidative damage and enhanced antioxidant defense in the leaves of Vicia faba plants[J]. Journal of Geochemical Exploration, 2014, 144: 282-289. DOI:10.1016/j.gexplo.2014.01.008 |
| [39] |
刘家豪, 赵龙, 孙在金, 等. 叶面喷施硫对镉污染土壤中水稻累积镉的机制研究[J]. 环境科学研究, 2019, 32(12): 2132-2138. LIU Jia-hao, ZHAO Long, SUN Zai-jin, et al. Protective effect of foliar application of sulfur on rice under the stress of Cd[J]. Research of Environmental Sciences, 2019, 32(12): 2132-2138. |
| [40] |
Yang J X, Liu Z Y, Wan X M, et al. Use of sulfur nanoparticles as green pesticide on Fusarium solani and Venturia inaequalis phytopathogens nteraction betwen sulfur and lead in toxicity, iron plaque formation and lead accumulation in rice plant[J]. Ecotoxicology and Environmental Safety, 2016, 128: 206-212. DOI:10.1016/j.ecoenv.2016.02.021 |
| [41] |
Wang Y P, Li Q B, Wang H, et al. Effect of sulphur on soil Cu/Zn availability and microbial community composition[J]. Journal of Hazardous Materials, 2008, 159(2): 385-389. |
 2021, Vol. 40
2021, Vol. 40


