2. 中国环境科学研究院, 环境基准与风险评估国家重点实验室, 北京 100012;
3. 陕西科技大学环境科学与工程学院, 西安 710000
2. State Key Laboratory of Environmental Criteria and Risk Assessment, Chinese Research Academy of Environmental Sciences, Beijing 100012, China;
3. School of Environmental Science and Engineering, Shaanxi University of Science and Technology, Xi'an 710000, China
锌(Zn)是较为常见的一种重金属,其在现代工业中被普遍使用在电池制造、电镀等领域。Zn在生物的生命活动中起着极其重要的作用,是许多生物必需的微量元素之一。但过量的Zn对生物有一定危害,长期接触或摄入大量的Zn可引发慢性中毒[1]。随着城市化进程的加快以及采矿冶炼、污泥倾倒、电子废弃物拆解等人类工业化活动的加剧,重金属严重污染环境的状况愈发严峻。Zn已被列为8种重金属污染物之一,其点位超标率为0.9%,是我国常见的工业污染物。
建立重金属毒性阈值预测模型的关键在于探究不同土壤理化性质对重金属毒性阈值的影响。研究发现,有机质含量、土壤酸碱度、土壤粒度和晶质/非晶质铁锰铝等均是影响重金属毒性阈值常见的关键因子[2]。有学者[3-5]对我国不同土壤中Zn对植物(大麦、西红柿和小白菜)、无脊椎动物(Opisthopora蚯蚓)和微生物(基质诱导硝化)毒性阈值进行了研究,发现土壤理化性质是影响Zn毒性阈值的关键因素。一些外国学者开展了关于Zn对土壤跳虫毒性阈值的研究[6-9],发现不同类型土壤中有机质含量差异和矿物类型理化性质的差异对Zn毒性阈值影响很大。
跳虫是土壤中的优势物种。作为一种典型的土壤无脊椎动物,跳虫具有品种极丰富、数量极庞大、分布极广泛等特点,是土壤中分解有机质、促进营养循环的重要一环[10-11]。白符跳(Folsomia candida)作为跳虫的一种,其繁殖快、生长周期短,在污染土壤中的暴露途径可指示土壤环境的质量,是重要的指示性生物之一,已被国际标准化组织(ISO)规定为毒性实验的模式生物[12]。白符跳虫对土壤中的毒害物质敏感性很高,如白符跳对某些化学污染物的敏感度是奇跳的10倍[13]。Buch等[14]研究发现土壤外源添加重金属汞对白符跳繁殖的EC50值为3.32 mg·kg-1,而影响节跳(Proisotoma minuta)繁殖的EC50值为4.43 mg·kg-1。
目前国内有关Zn对跳虫毒性阈值的研究尚未见报道。本研究以ISO标准方法指南[12]为指导,选用我国20种具有一定代表性的土壤作为供试土壤,选取白符跳虫个体水平的死亡率和繁殖数量为试验终点,以外源添加不同浓度Zn作为染毒方式,研究白符跳的毒性阈值,并建立基于土壤理化性质的毒性预测模型。
1 材料与方法 1.1 供试土壤供试土壤为全国范围内20种理化性质各异的土壤(0~20 cm),采集的土壤经室内自然风干、剔除植物根系及石块后,分别过筛,以满足测试理化性质的不同粒径。土壤pH的测定参照NY/T 1377—2007:风干土壤过2 mm筛,采用土水比1∶2.5电位法测定;土壤有机质含量:风干土过100目筛,采用重铬酸钾容量法测定[15];w(CaCO3):风干土过0.25mm筛,采用中和滴定法测定[15];w(Fe总)、w(Mn总)、w(Al总)和w(Zn背景):经湿式消解法(HCl-HNO3-HF-H2O2)前处理后测定;w(Fe非晶质)、w(Mn非晶质)和w(Al非晶质):风干土过0.25 mm筛,采用草酸-草酸铵浸提-氟化钾取代EDTA容量法测定[15];阳离子交换量(CEC):风干土过2 mm筛,采用三氯化六氨合钴浸提-分光光度法测定[16];土壤中w(黏粒):风干土过1 mm筛孔,采用吸管法测定[17]。w(Zn背景)范围为60.21~109.26 mg·kg-1,20种受试土壤均不受Zn的污染;土壤pH变化范围为3.30~8.89,w(OM)为4.31~65.73 g·kg-1,w(Fe非晶质)、w(Mn非晶质)和w(Al非晶质)差异较大。20种受试土壤的基本理化性质见表 1。
|
|
表 1 20种受试土壤的基本理化性质 Table 1 The basic physicochemical properties of tested soils |
白符跳虫需要在进行毒性试验的实验室中持续不断地培养和使用,以保证供试生物状态的稳定。白符跳在特制的80 mm×13 mm透明培养皿中培养,其底部填充厚度为0.3~0.5 cm的培养基(凝固的活性炭与石膏,配比为1∶9)。添加活性炭的作用是吸收废气和部分排泄物,同时便于在黑色的背景下观察浅色的跳虫个体。此外,制作好的培养基的表面用刀划上刻痕,以便于成年跳虫产卵[11]。适量添加干酵母粒(购自安琪公司)作为白符跳的食物。跳虫培养温度为(20±1)℃,故使用人工气候箱(宁波赛福实验仪器- 智能生化培养箱SPX-450)控制,虽然跳虫不具备感受光照的外部器官,但是研究表明在跳虫内部具有光感受器[3],故设置16 h∶8 h光暗循环(光照强度400~ 800 lx)。气候箱湿度控制在75% 左右,每隔3 d为培养基补充适量去离子水保持培养基表面湿润适宜跳虫生存,同时每隔1~2 d补充适量食物。在培养过程中及时清除培养基表面杂质,保持培养基表面处于清洁且湿润的状态。培养期间每隔2个月更换一次培养基,以利于白符跳虫产卵繁殖。
1.3 供试白符跳同龄化培养正式的毒性试验需避免白符跳虫龄差异和个体大小差异对试验的干扰。跳虫的同龄化培养[18]:将适当大小且较活跃的白符跳成虫转移至新的培养皿,加入少量干酵母,培养条件同1.2。经过2~3 d后,观察到白符跳在新制培养基表面产卵并有幼虫孵化出后,添加少量食物,待幼虫数量较多时移走成虫,继续培养7~9 d,得到可用于正式毒理试验的10~12 d的白符跳,这些跳虫即可认定为是同龄化后个体大小差异较小,年龄相同的跳虫个体。
1.4 土壤外源Zn添加土壤中外源Zn以ZnCl2水溶液喷施的方式添加,w(Zn外源)浓度设置为100、200、400、800、1 600、3 200 mg·kg-1,空白对照组只添加去离子水,每个处理用土200 g。土壤与ZnCl2水溶液充分混匀后,将土壤水分调节到最大可持水量的55%~60%,然后将土壤置于半封口状态的自封袋中稳定7 d,期间通过称质量的方法添加去离子水以保持土壤湿度的稳定。
1.5 白符跳毒性试验称取25~30 g外源添加Zn后的湿润土壤,向其中加入10只同龄化培养后的白符跳虫和适量干酵母,旋紧上盖后培养28 d,培养条件同1.2。由于前期跳虫个体较小,摄食量低且密闭恒温环境中容易导致食物发霉,故第1~2周添加的食物量较少,之后每2 d添加1次食物,添加量视Zn浓度增加而递减。并通过称质量的方法补充少量去离子水以维持土壤湿度。经过28 d培养试验后,将有机玻璃杯中所有内容物倾倒于250 mL的烧杯中,并在烧杯中加入150 mL自来水和几滴黑蓝色墨水(白符跳虫体色偏浅色,当土壤溶液颜色较浅时不易区分观察),用玻璃棒由下至上翻搅土壤悬浊液,由于存活的白符跳个体表面会分泌油脂类物质,使其可以漂浮于水面之上,所以搅拌后静置1~2 min,待存活成虫和幼虫浮到水面后拍照保存,并对数码照片编号,利用Image J软件[19]对白符跳存活和繁殖数量进行计数。
1.6 土壤中有效态锌的测定w(ZnCa)表示利用CaCl2溶液提取的有效态Zn含量,分析测定方法参考Bur等[20],称取(2.000±0.005)g过0.25 mm筛的土壤样品于50 mL塑料离心管中,加入20 mL 0.01 mol·L-1的CaCl2溶液,恒温水浴振荡器(豪诚实验仪器SHZ-28A)水浴振荡2 h后(25 ℃,200 r·min-1),使用离心机(湘仪TDZ5-WS)离心10 min(3 000 r·min-1)。将上清液用一次性注射器吸出并通过醋酸纤维滤膜(0.45 μm)过滤后,稀硝酸稀释,采用ICP-MS(安捷伦科技有限公司Agilent 7500cx)测定滤液中w(ZnCa)。
w(Zn总)表示利用消解土壤的方式测定的Zn总量:参考王北洪等[21]的方法,用电子天平准确称取土壤样品0.150 0 g,置于密封高压消解罐中。向其中加入5 mL硝酸、2 mL过氧化氢、2 mL氢氟酸,摇匀。将消解罐安装好,放入烘箱中,在150~160 ℃下密闭消解平衡9 h,样品消解完成之后,待消解罐温度降至室温时开启。将内罐取出,利用电热板赶酸。赶酸完毕后用0.5% 硝酸溶液转移至10 mL刻度试管中,静置待溶液澄清后采用ICP-MS(安捷伦科技有限公司Agilent 7500cx)测定溶液中w(Zn总),采用国家一级标准物质(GBW-07427)作为试验过程中的质控。
1.7 数据处理与分析Zn对白符跳繁殖的EC50的推导公式:
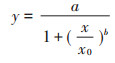
|
式中:y为各个不同处理浓度所对应的繁殖数量,只;x为测得的Zn总量或有效态Zn含量,mg·kg-1;a为对照组中繁殖的白符跳幼虫数量;x0为EC50值,mg·kg-1;b为方程拟合过程中所产生的斜率参数。
Zn对白符跳存活的LC50的推导公式:
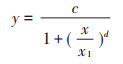
|
式中:y为各个不同处理浓度所对应的成虫存活数量,只;x为测得的Zn总量或有效态Zn含量,mg·kg-1;c为对照组中白符跳虫成虫存活数量;x1为LC50值,mg·kg-1;d为方程拟合过程中所产生的斜率参数。
方程的拟合利用SigmaPlot软件进行,不同土壤理化性质与Zn毒性阈值间的相关关系利用皮尔逊相关性分析确定,相关性分析利用IBM SPSS Statistics 26软件确定。基于土壤理化性质的Zn对白符跳毒性阈值的毒性预测模型利用多元逐步回归分析方法建立,采用OriginPro 2019和Excel 2019软件进行所有的图表制作。
2 结果与分析 2.1 Zn对白符跳毒性效应和阈值的差异对试验后存活成虫数量的统计发现,多数土壤中白符跳成虫存活数量无显著的剂量-效应关系,且未出现随w(Zn总)升高而减少的现象,仅有江西红壤、安徽黄棕壤、江苏水稻土、海南砖红壤等酸性土壤在最高添加浓度附近白符跳成虫的存活与对照组相比受到显著影响。虽然在培养28 d后白符跳成虫的整体存活率超过60%,但是由于数据之间变异性较大,且成虫存活数量无明显变化规律,未呈现出显著的剂量-效应关系,其结果在此不作展示。
不同土壤中Zn对白符跳毒性效应差异见图 1。计算得出基于w(Zn外源)实测值推导的Zn对白符跳繁殖的EC50值的变化为56~711 mg·kg-1,最大值为最小值的12.5倍(表 2)。对比不同土壤中Zn对白符跳毒性效应差异发现:当土壤中w(Zn外源)为0~200 mg·kg-1时,山东潮土、陕西垆土、吉林黑土以及宁夏灰钙土中白符跳的繁殖未受到外源添加Zn的明显影响,但其余土壤中白符跳繁殖数已经开始减少;当土壤中w(Zn外源)为200~800 mg·kg-1时,20种土壤中幼虫繁殖数量出现了不同的下降趋势:新疆灰漠土、山西栗钙土、吉林黑土以及湖北水稻土这4种土壤在不同Zn浓度之间白符跳繁殖数量变化幅度较小;而安徽黄棕壤、江西红壤以及海南砖红壤这3种土壤中白符跳幼虫数量急剧下降,数量变化非常明显。当土壤中w(Zn外源)继续增大至1 600~3 200 mg·kg-1时,几乎所有种类的土壤中白符跳幼虫数量较上一个浓度范围显著减少,在w(Zn外源)达到3 200 mg·kg-1时,所有土壤中白符跳幼虫数量均减少至个位数,且存活的幼虫出现应激性减弱、活性差等生理活动表现。整体而言,经过28 d的毒性试验后,20种土壤中白符跳繁殖的幼虫数量与外源添加Zn的总量之间虽变化趋势不同,但具有明显的剂量-效应关系。初步推测产生的不同变化趋势主要与土壤之间的不同理化性质相关。
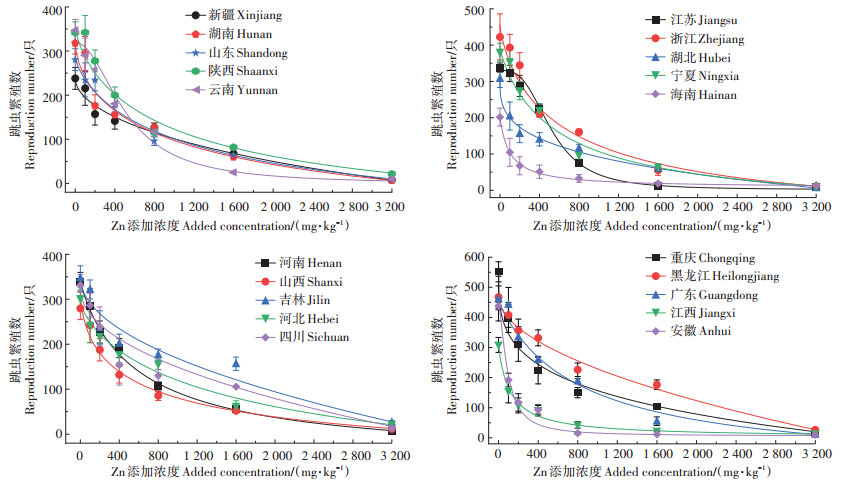
|
图 1 暴露28 d后不同土壤中Zn对白符跳繁殖的毒性效应差异 Figure 1 The reproduction toxicity effects of Zn on Folsomia candida in different soils after 28 days of exposure |
|
|
表 2 基于w(Zn总)和w(ZnCa)实测值推导的Zn对白符跳繁殖的EC50值 Table 2 The EC50 values of Zn for the reproduction of Folsomia candida based on measured total Zn and CaCl2-extracted Zn |
将表 2推导的EC50值与土壤理化性质进行相关性分析发现,Zn对白符跳繁殖的毒性阈值与土壤pH、非晶质铝两种土壤理化性质均呈显著正相关关系,相关系数分别为0.819(P < 0.01)、0.470(P < 0.05)。相关性分析也表明除这两种土壤理化性质外,基于w(Zn总)推导的EC50值与其他理化性质间的相关性均未达到显著水平。基于此,利用回归分析建立毒性预测模型,在单一因子的模型构建过程中土壤pH是影响Zn对白符跳繁殖的EC50的最重要的单一因子,解释了不同土壤之间EC50值65% 的差异。为了提高该模型的预测能力,将w(有机质)加入预测模型,结果表明预测模型的预测能力明显提高,两者可解释Zn对白符跳繁殖的EC50值90.5% 的差异。在构建毒性预测模型的过程中也尝试将非晶质铝这一因子引入,但是在建立回归方程时发现非晶质铝并不能更好地对不同土壤之间EC50值进行解释。基于w(Zn总)推导的EC50值与模型预测的EC50值之间相关性R2达到了0.935(图 2)。
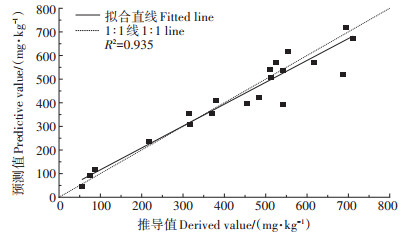
|
所用模型为lg(EC50)=0.673+0.255pH+0.013w(OM) The model used is lg(EC50) =0.673+0.255pH+0.013w (OM) 图 2 基于w(Zn总)实测值推导的Zn对白符跳繁殖的EC50值与利用模型预测的EC50值间的相关关系 Figure 2 The correlation relationship between calculated EC50 values based on total nominal Zn and predicted EC50 for the reproduction of Folsomia candida |
污染物对生态受体的毒性阈值大小与选取的评价终点有关[22]。不同评价终点对毒性阈值的影响十分显著。繁殖和存活是生命体生物周期里最重要的两个环节,故而很多针对白符跳毒理的研究都以存活率和繁殖率作为有效的评价指标[12]。本研究中存活率不能作为评估Zn对白符跳毒性的终点,土壤Zn对白符跳繁殖这一测试终点的影响远比存活更加灵敏。白符跳遭遇到外界毒性胁迫后会优先适应恶劣环境,维持自身的存活,在这种情况下不会进行产卵等生命活动[23]。也可能是由于成虫弹跳性较强,对重金属污染物有本能的趋避效应,在培养期间也观察到有个别成虫爬至玻璃器皿的壁上以躲避毒性胁迫。而繁殖率的高敏感性可能与重金属污染物更容易侵入白符跳产在土壤中的虫卵,使得虫卵的正常繁殖受到金属毒性的影响有关[24]。
研究发现,土壤中Zn的生物有效性受一系列物理化学性质的控制[25],而Zn的生物有效性在通常情况下主要与溶液中可交换态Zn的含量直接相关[26]。因此Zn对白符跳繁殖的EC50值的差异与不同土壤中w(ZnCa)有关。陕西垆土、山东潮土、宁夏灰钙土等偏砂质土壤以及一些中性偏碱性土壤中w(ZnCa)较低,而江西红壤、安徽黄棕壤、海南砖红壤是最具代表性的酸性土壤,且均为粉质偏黏土壤,其w(ZnCa)较高(图 3);白符跳虫是典型的土壤动物,其一系列生命活动均与土壤紧密相关,白符跳的摄食行为处在土壤表层,这不可避免地会通过皮层接触土壤孔隙溶液,此外维持跳虫正常生命活性的水分吸收过程也与土壤溶液紧密相关,两者皆是白符跳非常重要的毒性暴露过程[27]。在20种土壤中,根据w(ZnCa)得出的EC50值较由w(Zn总)得出的EC50值的差异有所减小(表 2),表明有效态Zn能对不同土壤中Zn对白符跳繁殖的毒性阈值有更好的解释能力。这与Lock等[27]和Smit等[28]有关Zn对白符跳毒性阈值的研究结论相似。同样在对其他金属的毒性阈值研究中也发现,提取的有效态重金属能解释部分不同土壤中EC50值的差异:如Lin等[29]发现,水提态As和Ni可以解释部分不同土壤对白符跳繁殖的EC50的差异;李星等[30]发现,利用CaCl2提取Cu的有效态可较好地预测和解释Cu对白符跳繁殖EC50值的差异。
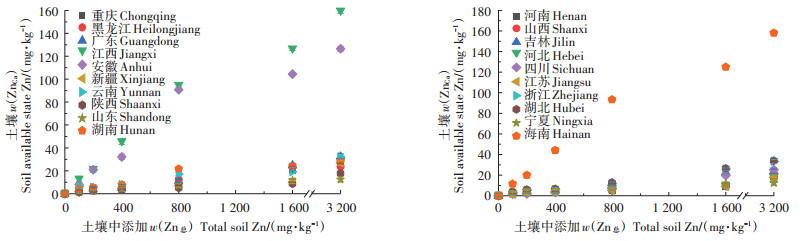
|
图 3 不同土壤w(ZnCa)与添加的w(Zn总)的关系 Figure 3 Relationship between measured CaCl2-extracted Zn and added total nominal Zn concentrations in different soils |
本研究构建的毒性预测模型中,除非晶质铝、pH、w(有机质)外,其他土壤理化性质对土壤Zn毒性的贡献在统计学上均不显著,所建立的模型P值均大于0.05。其中非晶质铝含量通常被认为与土壤吸附能力紧密相关,更高含量的非晶质铝可以为土壤中重金属提供更多吸附点位。研究发现,利用pH和w(有机质)构建的毒性预测模型可较好地预测Zn对微生物(PNR实验)、大麦、西红柿及小白菜生长的毒性差异[3],且pH和w(有机质)也是影响Cu对白符跳毒性阈值的重要理化性质[31]。当pH较低时,有效态Zn浓度较高,而在高土壤pH条件下,金属与其他离子的结合没有H+参与竞争,导致Zn2+可沉淀为氢氧化物或者经过络合作用可形成Zn2+的络离子,从而导致溶解度降低,则Zn的有效性也随之降低。土壤溶液中的Zn2+数量是决定重金属毒性大小的重要条件,而土壤中富含的不溶性Fe和Al含水氧化物可为重金属离子提供可吸附的表面点位[32],这是导致土壤溶液中游离的Zn2+数量减少的一个原因,故更多的不溶性Fe和Al含水氧化物可以显著降低生物毒性。此外土壤有机质包含小分子有机酸、胡敏酸、富里酸等复杂结构的高分子化合物,本身存在大量的含氧活性功能团,可以通过金属螯合作用与金属离子形成络合物沉淀产生固定作用(如胡敏酸与金属离子络合生成难溶性沉淀)[33],土壤对Zn的吸附能力极大增强,土壤溶液中Zn2+的浓度大幅降低,即土壤有机质/碳的增加导致Zn毒性的下降。不同的土壤理化性质影响重金属离子在土壤中的环境行为,土壤复杂的结构为各种络合反应、吸附反应提供了结合位点,有效降低了游离Zn2+的数量,同时也降低了重金属的生物毒性。
4 结论(1)以白符跳的繁殖作为慢性毒性试验的测试终点较为敏感。
(2)土壤CaCl提取态Zn可解释不同受试土壤之间的毒性差异。
(3)根据毒性预测模型显示,影响不同土壤中Zn对白符跳EC50差异的单一因素是土壤pH,在模型中引入w(有机质)因子后预测能力显著提高。
| [1] |
王丕玉, 刘海潮. 锌失衡与人体健康[J]. 中国食物与营养, 2007(7): 50-51. WANG Pi-yu, LIU Hai-chao. Zinc imbalance and human health[J]. Chinese Food and Nutrition, 2007(7): 50-51. DOI:10.3969/j.issn.1006-9577.2007.07.017 |
| [2] |
林祥龙. 不同土壤中锑对白符跳虫的毒性效应及阈值研究[D]. 北京: 中国环境科学研究院, 2017: 5-10. LIN Xiang-long. Study on the toxicity effects and ecological toxicity thresholds of antimony to soil-dwelling folsomia candida in different soils[D]. Beijing: Chinese Research Academy of Environmental Sciences, 2017: 5-10. |
| [3] |
林蕾. 基于不同终点测定土壤中锌的毒性阈值、预测模型及田间验证[D]. 北京: 中国农业科学院, 2013: 12-25. LIN Lei. Study of Zntoxicity thresholds in soils with different bioassay endpoints, its predictive models and field validation[D]. Beijing: Chinese Academy of Agricultural Sciences Dissertation, 2013: 12-25. |
| [4] |
魏威. 土壤外源锌的植物毒害主控因子和预测模型研究[D]. 杨凌: 西北农林科技大学, 2012: 10-21. WEI Wei. Zinc phytotoxicity as affected by soil properties and development of a predictive model[D]. Yangling: Northwest A & F University, 2012: 10-21 |
| [5] |
王振中, 张友梅, 胡觉莲, 等. 土壤重金属污染对蚯蚓(Opisthopora) 影响的研究[J]. 环境科学学报, 1994, 14(2): 236-243. WANG Zhen-zhong, ZHANG You-mei, HU Jue-lian, et al. Effect of heavy metals in soil on earthworms(Opisthopora)[J]. ATCA Scientiae Circumstantiae, 1994, 14(2): 236-243. DOI:10.3321/j.issn:0253-2468.1994.02.001 |
| [6] |
RöMbke J, JäNsch S, Junker T, et al. Improvement of the applicability of ecotoxicological tests with earthworms, springtails, and plants for the assessment of metals in natural soils[J]. Environmental Toxicology & Chemistry, 2010, 25(3): 776-787. |
| [7] |
Waalewijn-K P L, Rupp S, Lofts S, et al. Effect of soil organic matter content and pH on the toxicity of ZnO nanoparticles to Folsomia candida[J]. Ecotoxicology & Environmental Safety, 2014, 108(10): 9-15. |
| [8] |
Waalewijn-K P L, Ortiz M D, Lofts S, et al. The effect of pH on the toxicity of zinc oxide nanoparticles to Folsomia candida in amended field soil[J]. Environmental Toxicology and Chemistry, 2013, 32(10): 2349-2355. DOI:10.1002/etc.2302 |
| [9] |
Kool P L, Ortiz M D, Gestel C A M V. Chronic toxicity of ZnO nanoparticles, non-nano ZnO and ZnCl2 to Folsomia candida(Collembola)in relation to bioavailability in soil[J]. Environmental Pollution, 2011, 159(10): 2713-2719. DOI:10.1016/j.envpol.2011.05.021 |
| [10] |
许杰, 柯欣, 宋静, 等. 弹尾目昆虫在土壤重金属污染生态风险评估中的应用[J]. 土壤学报, 2007, 44(3): 544-549. XU Jie, KE Xin, SONG Jing, et al. Role of collembola in assessment of ecological risk of heavy metal contamination of soils[J]. Acta Pedologica Sinica, 2007, 44(3): 544-549. DOI:10.3321/j.issn:0564-3929.2007.03.023 |
| [11] |
Fountain M T, Hopkin S P. Folsomia candida(Collembola): A "standard" soil arthropod[J]. Annual Review of Entomology, 2005, 50(1): 201-222. DOI:10.1146/annurev.ento.50.071803.130331 |
| [12] |
International Organization for Standardization. ISO 11267, Soil quality-inhibition of reproduction of Collembolan(Folsomia candida)by soil pollutants[S]. Geneva, Switzerland: International Organization for Standardization, 2014.
|
| [13] |
Wiles J A, Frampton G K. A field bioassay approach to assess the toxicity of insecticide residues on soil to Collembola[J]. Pesticide Science, 1996, 47(3): 273-285. DOI:10.1002/(SICI)1096-9063(199607)47:3<273::AID-PS418>3.0.CO;2-8 |
| [14] |
Buch A C, Niemeyer J C, Correia M E F, et al. Ecotoxicity of mercury to Folsomia candida, and Proisotoma minuta, (Collembola: Isotomidae)in tropical soils: Baseline for ecological risk assessment[J]. Ecotoxicology & Environmental Safety, 2016, 127: 22-29. |
| [15] |
鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000. BAO Shi-dan. Soil agrochemical analysis[M]. Beijing: China Agriculture Press, 2000. |
| [16] |
刘蓉, 邓茂, 李莹莹, 等. 不同酸碱度土壤阳离子交换量的测定研究[J]. 中国环境监测, 2020, 36(1): 125-130. LIU Rong, DENG Mao, LI Ying-ying, et al. Optimization for the determination of cation exchange capacity in soils with different acidity and alkalinity[J]. Environmental Monitoring in China, 2020, 36(1): 125-130. |
| [17] |
中国科学院南京土壤研究所. 土壤理化分析[M]. 上海: 上海科学技术出版社, 1978: 481. Nanjing Institute of Soil Science, Chinese Academy of Sciences. Soil physical and chemical analysis[M]. Shanghai: Shanghai Science and Technology Press, 1978: 481. |
| [18] |
刘玉荣, 贺纪正, 郑袁明. 跳虫在土壤污染生态风险评价中的应用[J]. 生态毒理学报, 2008, 3(4): 323-330. LIU Yu-rong, HE Jizheng, ZHENG Yuan-ming. A review of application of springtails in ecological risk assessment of contaminated soils[J]. Asian Journal of Ecotoxicology, 2008, 3(4): 323-330. |
| [19] |
Crouau Y, MoïA C. The relative sensitivity of growth and reproduction in the springtail, Folsomia candida, exposed to xenobiotics in the laboratory: An indicator of soil toxicity[J]. Ecotoxicology and Environmental Safety, 2006, 64(2): 115-121. DOI:10.1016/j.ecoenv.2005.06.002 |
| [20] |
Bur T, Probst A, Bianco A, et al. Determining cadmium critical concentrations in natural soils by assessing Collembola mortality, reproduction and growth[J]. Ecotoxicology and Environmental Safety, 2010, 73: 415-422. DOI:10.1016/j.ecoenv.2009.10.010 |
| [21] |
王北洪, 马智宏, 付伟利. 密封高压消解罐消解-原子吸收光谱法测定土壤重金属[J]. 农业工程学报, 2008, 24(增刊2): 255-259. WANG Bei-hong, MA Zhi-hong, FU Wei-li. Determination of heavy metal in soil by high pressure sealed vessels assisted digestion-atomic absorption spectrometry[J]. Transactions of the CSAE, 2008, 24(Suppl 2): 255-259. |
| [22] |
Lin X L, Sun Z J, Zhao L, et al. The toxicity thresholds of metal(loid) s to soil-dwelling springtail Folsomia candida: A review[J]. Ecotoxicology and Environmental Safety, 2019, 180: 632-645. DOI:10.1016/j.ecoenv.2019.04.068 |
| [23] |
Choi W I, Neher D A, Ryoo I M, et al. Life-history trade-offs of Paronychiurus kimi(Lee)populations exposed to paraquat[J]. Ecotoxicology and Environmental Safety, 2008, 69(2): 227-232. DOI:10.1016/j.ecoenv.2007.01.008 |
| [24] |
Xu J, Wang Y, Luo Y M, et al. Effects of copper, lead and zinc in soil on egg development and hatching of Folsomia candida[J]. Insect Science, 2009, 16(1): 51-55. DOI:10.1111/j.1744-7917.2009.00253.x |
| [25] |
Ana R F, Stephen L, Francisco J, et al. Effects of aging and soil properties on zinc oxide nanoparticle availability and its ecotoxicological effects to the earthworm Eisenia andrei[J]. Environmental Toxicology and Chemistry, 2016, 37(1): 137-146. |
| [26] |
田昕竹, 陈世宝, 王学东, 等. 土壤溶液性质对Zn的形态变化及其微生物毒性的影响[J]. 中国环境科学, 2014, 34(10): 2602-2609. TIAN Xin-zhu, CHEN Shi-bao, WANG Xue-dong, et al. Influence of soil solution properties on the transformation of Zn forms and its toxicity threshold to soil microbes as determined by substracted induced nitrification[J]. China Environmental Science, 2014, 34(10): 2602-2609. |
| [27] |
Lock K, Janssen C R. Toxicity of zinc in spiked artificial soils versus contaminated field soils[J]. Environmental Science and Technology, 2001, 35(21): 4295-4300. DOI:10.1021/es0100219 |
| [28] |
Smit C E, Gestel C A M V. Effects of soil type, prepercolation, and ageing on bioaccumulation and toxicity of zinc for the springtail Folsomia candida[J]. Environmental Toxicology & Chemistry, 2010, 17(6): 1132-1141. |
| [29] |
Lin X, Sun Z, Zhao L, et al. The toxicity of exogenous arsenic to soildwelling springtail Folsomia candida in relation to soil properties and aging time[J]. Ecotoxicology and Environmental Safety, 2019, 171: 530-538. DOI:10.1016/j.ecoenv.2018.12.059 |
| [30] |
李星, 林祥龙, 孙在金. 我国典型土壤中铜对白符跳(Folsomia candida)的毒性阈值及其预测模型[J]. 环境科学研究, 2020, 33(3): 744-750. LI Xing, LIN Xiang-long, SUN Zai-jin. Toxicity thresholds and prediction model of copper to soil-dwelling springtail(Folsomia candida)in Chinese soils[J]. Research of Environmental Sciences, 2020, 33(3): 744-750. |
| [31] |
Criel P, Lock K. Influence of soil properties on copper toxicity for two soils invertebrates[J]. Environmental Toxicology Chemistry, 2008, 8(27): 1748-1755. |
| [32] |
Rassaei F, Hoodaji M, Abtahi S A. Cadmium speciation as influenced by soil water content and zinc and the studies of kinetic modeling in two soils textural classes[J]. International Soil and Water Conservation Research, 2020, 8(3): 286-294. DOI:10.1016/j.iswcr.2020.05.003 |
| [33] |
杜彩艳, 祖艳群, 李元. pH和有机质对土壤中镉和锌生物有效性影响研究[J]. 云南农业大学学报(自然科学), 2005, 20(4): 539-543. DU Cai-yan, ZU Yan-qun, LI Yuan. Effect of pH and organic matter on the bioavailability Cd and Zn in soil[J]. Journal of Yunnan Agricultural University, 2005, 20(4): 539-543. |
 2021, Vol. 40
2021, Vol. 40




