2. 西南林业大学生态与环境学院, 昆明 650224
2. College of Ecology and Environment, Southwest Forestry University, Kunming 650224, China
阿特拉津是世界产量最大的除草剂,其结构稳定、具有生物毒性、易溶于水[1],是地表和地下水体中检出率最高的除草剂之一[2]。水生植物对阿特拉津污染具有较高的敏感性,低浓度的阿特拉津即可对水生植物造成严重的毒性效应[3],引起植物抗氧化系统的改变。研究表明,阿特拉津会对水葱[4]、千屈菜[5]、菖蒲[6-7]、美人蕉[8]、芦苇[9]等挺水植物抗氧化酶系统产生影响,引起超氧化物歧化酶(SOD)、过氧化氢酶(CAT)等酶活性及非酶系统谷胱甘肽(GSH)活性的变化,导致脂质过氧化主要产物丙二醛(MDA)的积累。
人类活动带来的氮、磷等营养盐输入剧增引起的水体富营养化,能够导致水生植物生长及生理生化的改变[10]。磷素不仅是调控水生植物生长发育的关键营养元素,而且是引起水体富营养化的限制性成分[11],水体磷浓度超过0.02 mg·L-1,就会明显促进水体富营养化[12]。适宜浓度磷输入能够提高水生植物叶绿素a含量[13-15]和过氧化氢酶(CAT)活性[14],降低MDA含量[15],但过高的磷输入会导致叶绿素含量减少,引起抗氧化酶保护系统的改变,造成过氧化毒害及叶片中MDA积累量增多[13]。
阿特拉津和磷均能从农业径流进入地表水体,它们的时空共存具有普遍性[16],并存在复杂的交互作用。外源磷的输入能够增加阿特拉津对植物的毒性。Dantin等[17]报道,美洲苦草在高含磷营养盐水体中生长3个月后,再暴露于阿特拉津环境,阿特拉津对苦草毒性增强。向大豆中施加阿特拉津和外源磷,促进了大豆对磷的吸收,提高了其对阿特拉津损伤的敏感性[18]。目前,关于水体中阿特拉津或磷的污染效应,大多数研究侧重于单一污染物对水生植物的影响,但从植物磷吸收及抗氧化酶系统角度探讨阿特拉津和磷复合污染对湿地水生植物生理生化特征影响鲜见报道。本研究选用我国湿地中常见的挺水植物香蒲(Typha angustifolia L.)为对象,通过水培实验,探究在阿特拉津胁迫条件下外源磷对香蒲地上部和地下部磷含量、叶绿素含量、叶片抗氧化酶活性等指标的影响,以期为探索水体中阿特拉津和富营养化复合污染条件下植物修复的生理生化过程与机制提供科学依据。
1 材料与方法 1.1 材料准备实验所用阿特拉津(纯度≥97%)购于上海源叶生物科技有限公司。香蒲为一年生幼苗,购于昆明泛亚花卉公司。实验前先清洗去除幼苗淤泥,再置于晾晒过的自来水中缓苗24 h后,移于5% Hoagland营养液(营养液中不添加阿特拉津及磷)预培养驯化适应14 d。待长出新根后,挑选生长正常、长势一致的香蒲幼苗(平均鲜质量18.0±4.5 g)移于放置在塑料圆桶(直径18 cm,高19 cm)上的定植篮内,植物根部穿过篮底浸入培养液中,篮内填充砾石固定植物,定植篮底部高于桶内水面。桶外用黑色塑料袋包裹避光处理(防止阿特拉津光解),每个水培桶放置3株幼苗。
1.2 实验设计采用交互胁迫设计,研究阿特拉津与外源磷复合污染对香蒲磷吸收与抗氧化酶的影响。依据《地表水环境质量标准》(GB 3838—2002)Ⅴ类水体总磷浓度≤0.4 mg·L-1、文献[4, 19]以及前期室内水培实验,以对植物有一定胁迫效应为宜,分别设置3个磷(NH4H2PO4)浓度梯度(0.5、4、10 mg·L-1)及阿特拉津浓度梯度(0.5、2、5 mg·L-1),并设置空白对照(不添加阿特拉津),共12个处理。先用阿特拉津和丙酮配制1 g·L-1母液,然后移取母液,用5% Hoagland营养液配制的不同磷浓度溶液稀释至相应阿特拉津浓度,对照处理加与配制母液相同体积的丙酮,以消除误差。每个处理3个重复,每桶营养液体积1.6 L,所有处理均置于日光温室培养,培养期间温室内温度为20~ 30 ℃,光强约为自然光强的60%。桶上标记水位线,每日补充蒸馏水至水位线。培养时间10 d。实验结束采集植物样品,一部分用于测定植物叶绿素和抗氧化酶系统指标,另一部分烘干测定植物中磷含量。
1.3 指标测定水培10 d后,将幼苗从培养液中取出,用蒸馏水冲洗后带回实验室,选择香蒲从上往下第3片或第4片新鲜叶片,测量叶绿素含量、抗氧化酶指标。叶绿素a和叶绿素b含量测定采用无水乙醇浸泡提取法[20]。取植物叶片,洗净、晾干,去除中脉后剪碎,称取0.1 g,加入10 mL 95% 乙醇于暗处浸提,并不时摇动,至叶子全白。以95%乙醇为空白对照,利用UV-2400紫外可见分光光度计测定样品提取液在665、649波长下吸光度A值。叶绿素a(Ca,mg·L-1)、叶绿素b(Cb,mg·L-1)浓度计算公式分别为公式(1)和(2):
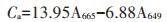
|
(1) |
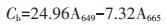
|
(2) |
叶绿素含量(mg·g-1)=叶绿素浓度(mg·L-1)×提取液体积(L)/样品鲜质量(g)。
植物叶内过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、谷胱甘肽(GSH)、丙二醛(MDA)等指标均采用南京建成生物工程研究所开发的试剂盒进行分析测定。称取0.1 g新鲜植物叶片,加入0.9 mL 0.9% 生理盐水,冰浴研磨匀浆后转移至离心管,4 ℃离心10 min(4 000 r·min-1),上清液即为酶提取液。提取液采用南京建成生物工程研究所生产的试剂盒处理,使用UV-2400紫外可见分光光度计测定。
植物采集后分割为地上(茎和叶)和地下部(根),于105 ℃杀青30 min,然后置于75 ℃条件下烘至恒质量,记录干质量。用粉碎机研磨,过40目筛混匀。采用浓硫酸和高氯酸配制而成的混酸消煮,钼锑抗分光光度法测定植物组织中磷含量[21]。
1.4 数据统计分析使用Excel 2007进行数据统计,采用SPSS 23.0进行相关性分析以及阿特拉津和磷浓度处理组间差异的显著性检验,选用Duncan模型,显著性水平设置为P < 0.05,利用Canoco 5进行冗余分析(RDA)。
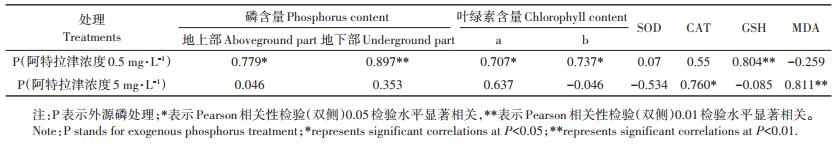
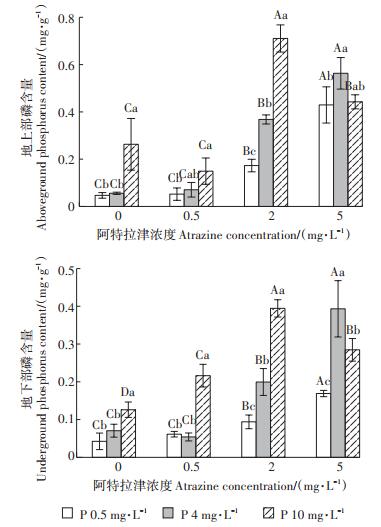
2 结果与分析 2.1 阿特拉津胁迫下外源磷对香蒲磷吸收的影响阿特拉津胁迫下不同外源磷浓度梯度对香蒲地上部、地下部磷含量影响如图 1所示。单外源磷处理条件下,地上部与地下部磷含量随着外源磷增加而提高。0.5 mg·L-1和2 mg·L-1阿特拉津处理下,随着外源磷增加,香蒲地上和地下部磷含量显著升高(P < 0.05),最大值出现在10 mg·L-1外源磷处理,地上部和地下部磷含量分别是对照组的2.7~6.6倍和2.2~3.1倍;5 mg·L-1阿特拉津处理下,地上部与地下部磷含量均高于对照组,但随外源磷增加先升高再降低,地上部和地下部磷含量最大值出现在4 mg·L-1浓度外源磷处理,分别是对照组的10.1倍和5.6倍。因此,阿特拉津胁迫下,外源磷提高了香蒲地上部和地下部对磷的吸收。
|
不同大写字母表示相同外源磷浓度、不同外源阿特拉津浓度处理组间差异显著(P < 0.05),不同小写字母表示相同外源阿特拉津浓度、不同磷浓度处理组间差异显著(P < 0.05)。下同 Different capital letters indicate the significant differences among different atrazine treatments under the same concentrations of exogenous phosphorus(P < 0.05), and different lowercase letters indicate the significant differences among different exogenous phosphorus treatments under the same concentrations of atrazine(P < 0.05). The same below 图 1 阿特拉津胁迫下外源磷对香蒲体内磷含量的影响 Figure 1 Effects of exogenous phosphate on phosphorus contents of cattail under atrazine stress |
阿特拉津胁迫下外源磷对香蒲叶片抗氧化酶系统的影响如图 2所示。单外源磷处理条件下,SOD活性差异不显著(P > 0.05),CAT与GSH活性随着外源磷水平增加而显著上升(P < 0.05);0.5 mg·L-1阿特拉津处理下,外源磷对SOD活性影响不显著(P > 0.05),显著提升了CAT与GSH活性(P < 0.05);2 mg·L-1阿特拉津处理下,外源磷对SOD和CAT活性影响不显著(P > 0.05),低浓度外源磷显著提高了GSH活性(P < 0.05);5 mg·L-1阿特拉津处理下,外源磷显著降低了SOD与CAT活性(P < 0.05),对GSH活性影响不明显(P > 0.05)。结果表明,高浓度阿特拉津胁迫下,外源磷显著降低了香蒲叶片抗氧化酶活性。
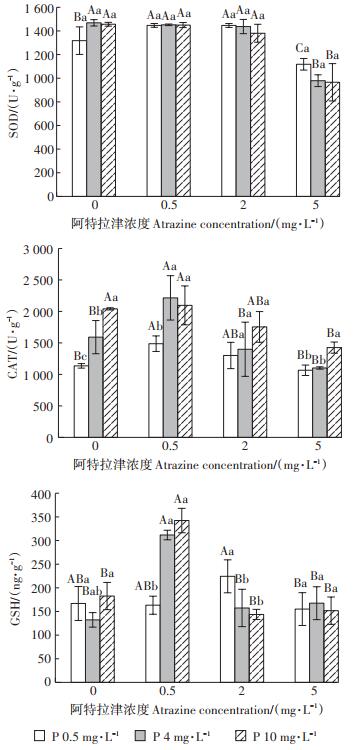
|
图 2 阿特拉津胁迫下外源磷对香蒲抗氧化系统的影响 Figure 2 Effects of exogenous phosphorus on antioxidase system of cattail under atrazine stress |
由图 3可见,单外源磷处理对香蒲叶绿素a和叶绿素b含量无明显影响(P > 0.05)。0.5 mg·L-1阿特拉津处理下,外源磷显著增加了叶绿素b含量(P < 0.05),对叶绿素a含量影响不显著(P > 0.05);2 mg·L-1阿特拉津处理下,高外源磷(10 mg·L-1)显著提高了叶绿素a和叶绿素b含量(P < 0.05);5 mg·L-1阿特拉津处理下,叶绿素a和叶绿素b含量显著低于其他处理组(P > 0.05),外源磷降低了叶绿素a和叶绿素b含量。结果表明,中低浓度阿特拉津处理下,外源磷有助于提高叶绿素a和叶绿素b含量。

|
图 3 阿特拉津胁迫下外源磷对香蒲叶绿素和MDA的影响 Figure 3 Effects of exogenous phosphorus on chlorophyll and MDA contents of cattail under atrazine stress |
单外源磷处理条件下MDA含量无明显差异(P > 0.05)。0.5 mg·L-1阿特拉津处理下,外源磷对MDA含量影响不显著(P > 0.05);2.0 mg·L-1阿特拉津处理下,低外源磷显著增加了MDA含量(P < 0.05),高外源磷显著降低了MDA含量(P < 0.05);5 mg·L-1阿特拉津处理下,随着外源磷水平的提高MDA含量显著增加(P < 0.05)。结果表明,中低浓度阿特拉津处理下,外源磷降低了MDA的积累。
2.4 外源磷、阿特拉津浓度与香蒲生理生化指标间的相互关系低浓度和高浓度阿特拉津胁迫下外源磷与香蒲生理生化指标的相关性分析如表 1所示。在0.5 mg· L-1阿特拉津处理下,外源磷与地下部、地上部磷含量、叶绿素a和叶绿素b含量在0.05检验水平存在显著正相关,与GSH活性在0.01检验水平存在极显著正相关,即在低浓度阿特拉津胁迫下,外源磷的增加有助于香蒲体内磷含量和叶绿素含量的提高,诱导GSH活性升高。在5 mg·L-1阿特拉津处理下,外源磷与MDA含量在0.01检验水平存在显著正相关,即在高浓度阿特拉津胁迫下,外源磷的增加提高了MDA积累,表明高浓度外源磷会加重香蒲细胞的膜脂过氧化程度。
|
|
表 1 不同阿特拉津浓度处理下外源磷与香蒲生理生化指标间的相关系数 Table 1 Correlation coefficients among concentrations of exogenous phosphorus and atrazine and physiological and biochemical indicators of cattail |
利用Canoco 5进行香蒲生理生化指标与外源磷、阿特拉津浓度间的RDA分析,结果如图 4所示。阿特拉津胁迫下外源磷与叶绿素a和叶绿素b含量、地下和地上部磷含量、CAT和GSH活性呈正相关关系,表明外源磷的输入能够促进植物积极地调动其防御系统抵御阿特拉津胁迫。阿特拉津浓度与地上和地下部磷含量、MDA含量在同一区间,箭头方向一致且夹角较小,表现为正相关关系,与GSH、SOD活性箭头方向相反,表现为负相关关系,表明高浓度阿特拉津胁迫能够降低抗氧化酶活性,导致MDA含量升高。

|
图 4 阿特拉津及外源磷浓度与香蒲生理生化指标间的冗余分析 Figure 4 Redundancy analysis(RDA)of exogenous phosphorus and atrazine stress and phosphorus content and biochemical indicators of cattail |
磷作为细胞质和细胞核的主要构成元素,能够通过促进植物细胞分裂、光合作用、酶系统的激活及植物生长,进而提升植物的抗逆性和适应性[22]。水生植物体内磷含量往往随水体中磷营养水平的增高而逐渐增加[23],以提高自身的抵抗能力。本研究发现无论是在何种浓度的阿特拉津胁迫下,随外源磷输入,香蒲地上(0.052~0.711 mg·g-1)和地下部(0.043~0.394 mg·g-1)磷含量均高于对照组,说明阿特拉津胁迫下外源磷刺激了植物对水体中磷的吸收。这可能是由于植物在逆境胁迫条件下,通过增加体内磷含量来提高代谢水平,增强抵抗能力[24]。然而,植物地上部与地下部对磷的吸收量受除草剂与外源磷交互作用的调控[25]。中低阿特拉津浓度(0.5 mg·L-1和2 mg·L-1)处理下,香蒲地上部和地下部磷含量均在高磷浓度(10 mg·L-1)时达到最大值;而高阿特拉津浓度(5 mg· L-1)胁迫下,地上部和地下部磷含量最大值出现在中浓度(4 mg·L-1)外源磷处。植物地上部与地下部对磷的吸收能力具有同步性,地下部含磷量高的,一般地上部含磷量也较高[26]。阿特拉津和外源磷复合胁迫下,香蒲地上部磷含量均高于地下部,这与其他研究报道的香蒲[27]、鸢尾、菖蒲[28]等湿地植物体内磷含量分布规律相一致。这是由于叶是植物进行光合作用合成碳水化合物的重要场所,是积累磷的主要器官[28],叶片的高磷含量提高了植物地上部磷含量。
植物受到环境胁迫,体内会产生大量的活性氧自由基(ROS),ROS会攻击细胞膜,从而引起细胞膜发生脂质过氧化,导致细胞的损伤和破坏[29]。逆境胁迫下,适当的外源磷可以通过提高植物SOD、CAT等抗氧化酶的活性而消除ROS积累,使细胞内自由基的产生和清除维持在一个平衡状态,从而提高水生植物的抗逆性[30]。本研究中低浓度(0.5 mg·L-1)阿特拉津处理下,外源磷显著提高了CAT活性,而SOD活性无明显变化,说明阿特拉津胁迫下,香蒲叶片中的CAT比SOD对外源磷的增加更敏感[14];而在高浓度(5 mg· L-1)处理下,不同浓度外源磷降低了SOD和CAT活性,这与皇竹草在高浓度阿特拉津(40 mg·L-1)胁迫下叶片SOD和CAT活性显著降低研究结果一致[31]。植物体内产生的活性氧自由基超过了SOD、CAT的清除能力,抗氧化系统的动态平衡被破坏。GSH是植物体内一种重要的还原性物质,是胞内代谢过程和植物遭受氧化胁迫时所产生的过氧化物最有效的清除剂之一[32]。董静[33]研究发现随着阿特拉津胁迫的加强,美人蕉体内GSH活性先增后减,当阿特拉津浓度超过1 mg·L-1,GSH由于清除了大量活性氧自由基而导致其活性的降低。本实验在低浓度(0.5 mg·L-1)阿特拉津处理下,高外源磷水平GSH活性显著高于低外源磷,说明在低浓度阿特拉津胁迫下,外源磷的增加能够诱导GSH活性的提高;在中等浓度(2 mg·L-1)阿特拉津处理下GSH活性的升高则出现在低浓度的外源磷处,说明低外源磷水平可以缓解阿特拉津胁迫造成的GSH活性降低;但在高浓度(5 mg·L-1)阿特拉津处理下,外源磷却未能对GSH活性产生显著变化,表示其可能会对香蒲的抗氧化酶系统造成破坏。
MDA是膜质过氧化的产物,其含量的高低反映了植物细胞膜受伤害的程度[6]。而磷则对叶绿素含量及其合成起着重要作用,适宜的外源磷能够提高植物体内叶绿素a和叶绿素b含量、降低MDA含量[13]。本实验在中低浓度(0.5 mg·L-1和2 mg·L-1)阿特拉津处理下,外源磷提高了植物体内磷含量以及叶绿素a和叶绿素b含量,降低了MDA含量,说明外源磷抑制了阿特拉津对香蒲的生理胁迫。这是由于在阿特拉津胁迫下,外源磷的输入促进了植物对磷的吸收,有利于叶绿素a和叶绿素b合成,植物营养状况得到改善,增强了其对逆境的适应能力,并通过提高CAT、SOD和GSH等酶的活性抵御活性氧,降低MDA含量,避免细胞膜受到伤害。但高浓度胁迫下,叶绿体膜的氧化胁迫可对叶绿素的形成产生抑制,合成叶绿素所需酸受到破坏,导致叶绿素的含量降低[34]。研究报道阿特拉津胁迫浓度高于2 mg·L-1时,千屈菜[5]、水葱[4]叶绿素a含量、黄花鸢尾[35]叶绿素a和叶绿素b含量以及芦苇[9]叶绿素b含量显著下降,白菜幼苗[36]叶绿素生成受到抑制、MDA含量增加。本研究结果也表明,高浓度(5 mg·L-1)阿特拉津胁迫处理下,不同外源磷水平引起MDA含量的显著升高,而叶绿素a和叶绿素b含量显著降低。这是由于高浓度阿特拉津胁迫能够造成SOD、CAT和GSH活性降低,产生过量活性氧自由基破坏了植物抗氧化酶的平衡系统,细胞膜质过氧化对植物造成了损伤,这种伤害会随着外源磷水平增加而增强[37]。
目前,富营养化水体磷的削减主要通过水生植物的吸收、富集及定期收割而去除[38]。因此,本研究探讨不同浓度阿特拉津与外源磷交互作用下香蒲磷的吸收、叶绿素a和叶绿素b含量、抗氧化酶活性及膜质过氧化物的变化特征及规律,有助于理解农药污染胁迫条件下植物削减水体外源磷的过程与机制,对于水体富营养化减缓及水体污染消减均具有一定指导意义。
4 结论阿特拉津胁迫下,外源磷提高了香蒲地上和地下部磷含量。中低浓度(0.5 mg·L-1和2 mg·L-1)阿特拉津处理下,外源磷能够促进香蒲叶绿素a和叶绿素b含量增加,激活叶片CAT、GSH活性,缓解膜质过氧化,减少MDA积累。高浓度(5 mg·L-1)处理下外源磷加重了香蒲受到的阿特拉津伤害,表现为叶绿素含量以及SOD、CAT、GST活性显著降低,MDA含量明显提升。
| [1] |
Bazhanov D P, Li C Y, Li H M, et al. Occurrence, diversity and community structure of culturable atrazine degraders in industrial and agricultural soils exposed to the herbicide in Shandong Province, P. R. China[J]. Bmc Microbiology, 2016, 16(1): 265. DOI:10.1186/s12866-016-0868-3 |
| [2] |
Carpenter C, Helbling D E. Widespread micropollutant monitoring in the Hudson River Estuary reveals spatiotemporal micropollutant clusters and their sources[J]. Environmental Science & Technology, 2018, 51(11): 6187-6189. |
| [3] |
于晓宁, 徐冰冰, 李会仙, 等. 淡水水生生物对阿特拉津除草剂的敏感度[J]. 环境科学研究, 2013, 26(4): 418-424. YU Xiao-ning, XU Bing-bing, LI Hui-xian, et al. Species sensitive distribution for aquatic biota exposed to atrazine in freshwater[J]. Research of Environmental Sciences, 2013, 26(4): 418-424. |
| [4] |
王庆海, 张威, 却晓娥, 等. 水体阿特拉津残留对水葱生物量及生理特性的影响[J]. 植物生态学报, 2011, 35(2): 223-231. WANG Qing-hai, ZHANG Wei, QUE Xiao-e, et al. Effects of atrazine residue in water on biomass and physiological characteristics of Scirpus tabernaemontani[J]. Chinese Journal of Plant Ecology, 2011, 35(2): 223-231. |
| [5] |
王庆海, 张威, 李翠, 等. 水体阿特拉津残留对千屈菜的毒性效应[J]. 应用与环境生物学报, 2011, 17(6): 814-818. WANG Qing-hai, ZHANG Wei, LI Cui, et al. Phytotoxicity of atrazine residue in water to Lythrum salicaria[J]. Chinese Journal of Applied and Environmental Biology, 2011, 17(6): 814-818. |
| [6] |
李翠, 温海峰, 郑瑞伦, 等. 阿特拉津胁迫对菖蒲的生理毒性效应[J]. 农业环境科学学报, 2016, 35(10): 1895-1902. LI Cui, WEN Hai-feng, ZHENG Rui-lun, et al. Phytotoxicity of atrazine to Acorus calamus L.[J]. Journal of Agro-Environment Science, 2016, 35(10): 1895-1902. DOI:10.11654/jaes.2016-0301 |
| [7] |
Wang Q H, Zhang W, Li C, et al. Phytoremediation of atrazine by three emergent hydrophytes in a hydroponic system[J]. Water Science and Technology, 2012, 66(6): 1282-1288. DOI:10.2166/wst.2012.320 |
| [8] |
Dong J, Wang L, Ma F, et al. Effects of Funnelliformis mosseae inoculation on alleviating atrazine damage in Canna indica L. var. flava Roxb[J]. International Journal of Phytoremediation, 2017, 19(1): 46-55. DOI:10.1080/15226514.2016.1216079 |
| [9] |
王庆海, 李翠, 陈超, 等. 芦苇对阿特拉津胁迫的生理响应及其与耐受性的关系[J]. 农业环境科学学报, 2017, 36(10): 1968-1977. WANG Qing-hai, LI Cui, CHEN Chao, et al. Physiological responses of Phragmites australis to atrazine exposure and their relevance for tolerance[J]. Journal of Agro-Evnvironment Scinece, 2017, 36(10): 1968-1977. DOI:10.11654/jaes.2017-0461 |
| [10] |
Scheffer M, Hosper S H, Meijer M L, et al. Alternative equilibria in shallow lakes[J]. Trends in Ecology & Evolution, 1993, 8(8): 275-279. |
| [11] |
陈志超, 张志勇, 刘海琴, 等. 4种水生植物除磷效果及系统磷迁移规律研究[J]. 南京农业大学学报, 2015, 38(1): 107-112. CHEN Zhi-chao, ZHANG Zhi-yong, LIU Hai-qin, et al. Research on removal efficiency of phosphorus by four aquatic macrophytes and rule of phosphorus migration in systems[J]. Journal of Nanjing Agricultural University, 2015, 38(1): 107-112. |
| [12] |
韩沙沙, 温琰茂. 富营养化水体沉积物中磷的释放及其影响因素[J]. 生态学杂志, 2004, 23(2): 98-101. HAN Sha-sha, WEN Yan-mao. Phosphorus release and affecting factors in the sediments of eutrophic water[J]. Chinese Journal of Ecology, 2004, 23(2): 98-101. |
| [13] |
宋玉芝, 杨美玖, 秦伯强. 苦草对富营养化水体中氮磷营养盐的生理响应[J]. 环境科学, 2011, 32(9): 2569-2575. SONG Yu-zhi, YANG Mei-jiu, QIN Bo-qiang. Physiological response of Vallisneria natans to nitrogen and phosphorus contents in eutrophic waterbody[J]. Enviromental Science, 2011, 32(9): 2569-2575. |
| [14] |
康彩霞, 戴星照, 刘艳. 高浓度氨氮或磷胁迫对亚洲苦草生理特性的影响[J]. 安全与环境工程, 2018, 25(3): 72-77. KANG Cai-xia, DAI Xing-zhao, LIU Yan. Physiological response of Vallisneria asiatica to the stress of high concentration of ammonia N or P[J]. Safety and Envrionmental Engineering, 2018, 25(3): 72-77. |
| [15] |
黄玉源, 雷泽湘, 何柳静, 等. 不同磷浓度对水生植物苦草的影响研究[J]. 环境科学与技术, 2011, 34(2): 12-16. HUANG Yu-yuan, LEI Ze-xiang, HE Liu-jing, et al. Effects of phosphorus concentration of substrates to growth of Vallisneria natans[J]. Environmental Science and Technology, 2011, 34(2): 12-16. DOI:10.3969/j.issn.1003-6504.2011.02.003 |
| [16] |
Dosskey M G, Vidon P, Gurwick N P, et al. The role of riparian vegetation in protecting and improving chemical water quality in streams[J]. Journal of the American Water Resources Association, 2010, 46(2): 261-277. DOI:10.1111/j.1752-1688.2010.00419.x |
| [17] |
Dantin D D, Boustany R G, Lewis M A, et al. Effects of nutrient preexposure on atrazine toxicity to Vallisneria americana Michx.(Wild Celery)[J]. Archives of Environmental Contamination and Toxicology, 2010, 58(3): 622-630. DOI:10.1007/s00244-009-9399-3 |
| [18] |
Adams R S, Espinoza W G. Effect of phosphorus and atrazine on mineral composition of soybeans[J]. Journal of Agricultural & Food Chemistry, 1969, 17(4): 818-822. |
| [19] |
单丹, 罗安程. 不同水生植物对磷的吸收特性[J]. 浙江农业学报, 2008, 20(2): 135-138. SHAN Dan, LUO An-cheng. Phosphorus uptake characteristics of six aquatic plants[J]. Acta Agriculturae Zhejiangensis, 2008, 20(2): 135-138. DOI:10.3969/j.issn.1004-1524.2008.02.014 |
| [20] |
Lichtenthaler H K. Chlorophylls and carotenoids: Pigment photosynthetic biomembranes[J]. Methods in Enzymology, 1987, 148C(1): 350-382. |
| [21] |
鲍士旦. 土壤农化分析[M]. 第三版. 北京: 中国农业出版社, 2008: 30-109. BAO Shi-dan. Soil agrochemical analysis[M]. 3rd Edition. Beijing: China Agriculture Press, 2008: 30-109. |
| [22] |
李君, 葛跃, 王明新, 等. 镉对蓖麻耐性生理及营养元素吸收转运的影响[J]. 环境科学学报, 2016, 36(8): 3081-3087. LI Jun, GE Yue, WANG Ming-xin, et al. Effect of Cd on tolerance physiology, nutrient uptake and translocation in Ricinus communis LL.[J]. Acta Scientiae Circumstantiae, 2016, 36(8): 3081-3087. |
| [23] |
陈国祥, 刘双, 王娜, 等. 磷对水生植物菱及睡莲叶生理活性的影响[J]. 南京师大学报(自然科学版), 2002, 25(1): 71-77. CHEN Guo-xiang, LIU Shuang, WANG Na, et al. Effect of phosphorus nutrition on physiological activity of Nymphaea tetragona Georgi. and Trapa bispinosa Roxb. leaves[J]. Journal of Nanjing Normal University (Natural Science), 2002, 25(1): 71-77. DOI:10.3969/j.issn.1001-4616.2002.01.016 |
| [24] |
Nuttens A, Chatellier S, Devin S, et al. Does nitrate co-pollution affect biological responses of an aquatic plant to two common herbicides?[J]. Aquatic Toxicology, 2016, 17(7): 355-364. |
| [25] |
Dhillon P S, Byrnes W R, Merritt C. Simazine and phosphorus interactions in red pine seedlings[J]. Weeds, 1967, 15(4): 339-343. DOI:10.2307/4041003 |
| [26] |
陈秋夏, 郑坚, 金川, 等. 水生植物对N、P的富集作用研究[J]. 江西农业大学学报, 2008, 30(3): 437-442. CHEN Qiu-xia, ZHENG Jian, JIN Chuan, et al. Nitrogen and phosphorus uptake of aquatic plant species in Sanyang wetland[J]. Acta Agricuhural Universitatis Jiangxiensis, 2008, 30(3): 437-442. DOI:10.3969/j.issn.1000-2286.2008.03.011 |
| [27] |
Chen C J, Wang F, Hong Y, et al. The biomass accumulation and nutrient storage of five plant species in an in-situ phytoremediation experiment in the Ningxia irrigation area[J]. Scientific Reports, 2019, 9(1): 1-9. |
| [28] |
李琳, 刘娜娜, 达良俊. 鸢尾和菖蒲不同器官对富营养化水体中氮磷的积累效应[J]. 环境污染与防治, 2006, 28(12): 901-903, 907. LI Lin, LIU Na-na, DA Liang-jun. Nitrogen and phosphorus accumulation in Iris tectorum and Acorus calamus in eutrophic water[J]. Environmental Pollution and Control, 2006, 28(12): 901-903, 907. DOI:10.3969/j.issn.1001-3865.2006.12.007 |
| [29] |
Elstner E F. Oxygen activation and oxygen toxicity[J]. Ann Rev Plant Physiol, 1982, 33(1): 73-96. DOI:10.1146/annurev.pp.33.060182.000445 |
| [30] |
侯立刚, 陈温福, 马巍, 等. 低温胁迫下不同磷营养对水稻叶片质膜透性及抗氧化酶活性的影响[J]. 华北农学报, 2012, 27(1): 118-123. HOU Li-gang, CHEN Wen-fu, MA Wei, et al. Effects of different phosphate fertilizer application on permeability of membrane and antioxidative enzymes in rice under low temperature stress[J]. Acta Agriculturae Boreali-Sinica, 2012, 27(1): 118-123. DOI:10.3969/j.issn.1000-7091.2012.01.022 |
| [31] |
张坤, 李元, 祖艳群, 等. 皇竹草活性氧代谢对阿特拉津胁迫的响应特征[J]. 西北植物学报, 2013, 33(12): 2479-2485. ZHANG Kun, LI Yuan, ZU Yan-qun, et al. Response characteristics of reactive oxygen metabolism in Pennisetum hydridum to atrazine stress[J]. Acta Botanica Boreali-Occidentalia Sinica, 2013, 33(12): 2479-2485. DOI:10.7606/j.issn.1000-4025.2013.12.2479 |
| [32] |
李志刚, 许自成, 苏永士, 等. 植物谷胱甘肽研究进展[J]. 江西农业学报, 2010, 22(4): 118-121. LI Zhi-gang, XU Zi-cheng, SU Yong-shi, et al. Research progress in plant glutathione[J]. Acta Agriculturae Jiangxi, 2010, 22(4): 118-121. DOI:10.3969/j.issn.1001-8581.2010.04.038 |
| [33] |
董静. AMF-美人蕉共生系统降解水中阿特拉津特性的研究[D]. 哈尔滨: 哈尔滨工业大学, 2017: 73-74. DONG Jing. Study of degradeation characteristics of atrazine in water by AMF-canna symbiotic system[D]. Harbin: Harbin Institute of Technology, 2017: 73-74. |
| [34] |
冯绪猛, 罗时石, 胡建伟, 等. 农药对水稻叶片丙二醛及叶绿素含量的影响[J]. 核农学报, 2003, 17(6): 481-484. FENG Xu-meng, LUO Shi -shi, HU Jian -wei, et al. Effect of pesticides on MDA and chlorophyll content of rice leaves[J]. Journal of Nuclear Agricultural Sciences, 2003, 17(6): 481-484. DOI:10.3969/j.issn.1000-8551.2003.06.019 |
| [35] |
Wang Q H, Que X, Li C, et al. Phytotoxicity of atrazine to emergent hydrophyte, Iris pseudacorus L.[J]. Bulletin of Environmental Contamination and Toxicology, 2014, 92(3): 300-305. DOI:10.1007/s00128-013-1178-1 |
| [36] |
刘吉敏, 黄其椿, 陈正麟, 等. 莠去津对白菜幼苗生长量及生理效应的影响[J]. 南方农业学报, 2011, 42(7): 752-755. LIU Ji-min, HUANG Qi-chun, CHEN Zheng-lin, et al. Effect of atrazine on growth and physio-biochemical characteristics of cabbage seedling[J]. Journal of Southern Agriculture, 2011, 42(7): 752-755. DOI:10.3969/j.issn.2095-1191.2011.07.016 |
| [37] |
Stolp C F, Penner D. Enhanced phytotoxicity of atrazine-phosphate combinations[J]. Weed Science, 1973, 1(21): 37-40. |
| [38] |
Jeke N N, Zvomuya F, Cicek N, et al. Nitrogen and phosphorus phytoextraction by cattail(Typha spp.) during wetland-based phytoremediation of an end-of-life municipal lagoon[J]. Journal of Environmental Quality, 2019, 48(1): 24-31. DOI:10.2134/jeq2018.05.0184 |
 2021, Vol. 40
2021, Vol. 40