2. 北京师范大学核科学与技术学院射线束技术教育部重点实验室, 北京 100875
2. Key Laboratory of Beam Technology of Ministry of Education, College of Nuclear Science and Technology, Beijing Normal University, Beijing 100875, China
重金属是威胁生态环境安全和人类健康的重要污染物,其污染修复有多种方法,包括物理、化学和生物方法。生物吸附是一种环境友好型的修复技术,尤其是通过固定化微生物和纳米材料吸附溶液中的重金属离子受到越来越多的重视[1]。丝瓜络(Loofah sponge),又名丝瓜网、瓜络、丝瓜瓤,是葫芦科植物丝瓜干燥成熟果实的维管束,主要由纤维素、半纤维素和木质素组成,具有独特的多级孔隙结构和优良的机械强度[2]。丝瓜络作为固定化基质具有价格低廉、生物相容性好和环境友好等特点,目前多用于固定细菌、真菌和藻类制备复合吸附剂,吸附重金属和有机物[3-8]。
氧化锰是环境中重要的吸附剂、催化剂和氧化剂[9]。多种细菌[9-11]和真菌[12]均可以通过直接或间接作用形成生物氧化锰(Biogenic manganese oxides,BMOs)。锰生物氧化速率比化学氧化速率高几个数量级[13],因此推测环境中氧化锰的形成主要是微生物驱动的[14]。微生物主要通过多铜氧化酶[10, 15]、漆酶[16]和动物血红素过氧化物酶[17]等催化锰的氧化,形成无定型态的BMOs纳米微粒。BMOs普遍比化学氧化锰的比表面积大[9],对重金属和放射性核素有良好的吸附[18-22]和氧化作用[23]。在实际应用中,游离氧化锰颗粒吸附重金属离子时存在回收和重复利用困难等问题。有文献报道了将化学氧化锰固定于生物炭[21, 24]和沸石[25]来吸附重金属离子,但将BMOs固定于丝瓜络并用于重金属离子吸附鲜有报道。丝瓜络固定BMOs制备的复合吸附剂(Loofah sponge-immobilized biogenic manganese oxides,LIBMOs)可以提高吸附剂和金属离子的回收利用效率,并有利于改善吸附稳定性。本文制备植物-微生物复合吸附剂LIBMOs,研究该吸附剂的表面性质,并考察其对重金属离子的吸附特点。本研究将为水环境中重金属离子的去除提供理论依据和数据支撑。
1 材料与方法 1.1 BMOs合成本文所用锰氧化细菌是一株蜡样芽孢杆菌Bacillus cereus CP133(CP133),筛选自昌平锰矿旧址[26]。该菌株合成的BMOs为无定形态的纳米微粒[26]。实验所用培养基为不添加pH缓冲液的L2培养基[18],具体成分为:胰蛋白胨2 g·L-1、酵母萃取物0.5 g·L-1、NaCl 0.15 mol·L-1、KCl 0.005 mol·L-1、MgSO4 0.025 mol·L-1、CaCl2 0.005 mol · L-1、CuSO4·5H2O 10 mg · L-1、ZnSO4·7H2O 44 mg · L-1、CoCl2·6H2O 20 mg · L-1、Na2MoO4·2H2O 13 mg · L-1。配制好的培养基高压蒸汽灭菌(121 ℃、30 min)后加入过滤灭菌(0.22 μm滤膜)的MnCl2溶液,终浓度为10 mmol·L-1。BMOs含量用Leucoberbelin Blue(LBB)方法测定[27],所用仪器为MD公司的SpectraMax M3。
1.2 LIBMOs制备本文所用丝瓜络产自北京郊区。将丝瓜络剪成小块,用20%的NaOH和一定量乙醇的混合溶液在室温25 ℃下浸泡48 h;然后在80 ℃恒温水浴中回流3 h;用去离子水洗涤NaOH预处理的丝瓜络若干次,直至洗涤液呈中性,抽滤后70 ℃烘干备用。将2.0 g·L-1的天然丝瓜络(Loofah sponge,LS)或NaOH预处理的丝瓜络(NaOH-treated loofah sponge,NaOH-LS)加入L2液体培养基中高压蒸汽灭菌后接种CP133,并添加MnCl2至10 mmol·L-1,振荡培养(25 ℃、150 r·min-1)14 d。分别在2、4、6、8、10、12、14 d取样检测LS和NaOH-LS体系中被丝瓜络固定的BMOs(Immobilized BMOs)和分散在培养基中的游离BMOs(Free BMOs)含量。14 d后将LIBMOs离心并用磷酸盐缓冲液清洗3次后冷冻干燥,用于表面性质分析和重金属离子吸附实验。
1.3 LIBMOs表面性质分析用扫描电镜(SEM,FEI Quanta 200)观察CP133、BMOs、丝瓜络和LIBMOs的表面形貌,样品用导电胶固定在铜基板上,并做表面喷金处理。采用傅里叶红外光谱仪(Thermo,Nicolet iS 50)对丝瓜络和LIBMOs的表面官能团进行表征,采用KBr压片法制样,扫描范围为4 000~400 cm-1,扫描次数为32次。
1.4 LIBMOs吸附重金属实验LIBMOs分别吸附重金属离子Pb2+、Cd2+、Cu2+和Zn2+,实验在50 mL离心管中进行,反应体系10 mL,pH 6.0,LIBMOs投加量为2.0 g·L-1。实验在25 ℃下进行,往复摇床转速100 r·min-1,设置3个平行。吸附动力学实验中4种重金属离子的初始浓度均为0.1 mmol·L-1,振荡时间4 h。等温吸附实验中4种重金属离子初始浓度均为0~0.8 mmol·L-1,振荡时间2 h。吸附实验结束后,分离LIBMOs并检测残留在溶液中的重金属离子浓度。
LIBMOs从溶液中吸附重金属离子的量q(mmol·g-1)按公式(1)计算[18]:

|
(1) |
式中:[Me]0和[Me]t分别为重金属离子起始浓度和t时刻浓度,mmol·L-1;M为吸附体系中的LIBMOs含量,g·L-1。重金属离子浓度用电感耦合等离子发射光谱法(ICP-AES)(Prodigy,Leeman Labs)测定。
用Langmuir模型(公式2)和Freundlich模型(公式3)拟合LIBMOs吸附重金属离子的等温吸附实验数据[6]:
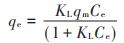
|
(2) |
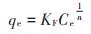
|
(3) |
式中:qm为理论饱和吸附量,mmol·g-1;qe为吸附平衡时重金属离子的吸附量,mmol·g-1;Ce为吸附平衡时重金属离子的浓度,mmol·L-1;KL为Langmuir常数;KF为吸附参数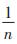
LIBMOs吸附重金属离子的动力学实验数据采用准一级动力学模型(公式4)和准二级动力学模型(公式5)进行拟合[2]。
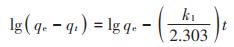
|
(4) |

|
(5) |
式中:qt为t时间重金属离子的吸附量,mmol·g-1;k1为准一级动力学吸附的速率常数,min-1;k2为准二级动力学吸附的速率常数,mmol·g-1·min-1。
采用软件Origin 2018进行数据分析和绘图。
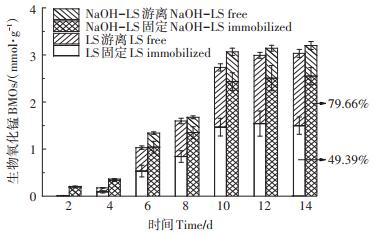
2 结果与讨论 2.1 LIBMOs制备效果评估添加LS和NaOH-LS培养14 d后,CP133合成BMOs的总量差别不大,如图 1所示。推测BMOs固定化的过程为:CP133首先附着在丝瓜络表面并逐渐形成芽孢,芽孢氧化生成的BMOs被固定在丝瓜络表面和分散到溶液中,最终两种状态的BMOs达到平衡。NaOH -LS体系固定BMOs的比例[(固定化BMOs)/(固定化BMOs + 游离BMOs)]和数量均高于LS体系,培养14 d后分别为79.66%(2.43 mmol·g-1)和49.39%(1.46 mmol·g-1)。这可能是因为NaOH预处理在不破坏丝瓜络结构完整性的基础上,有效地去除了表面憎水性组分(胶质和蜡质等),增加了丝瓜络的亲水性,易于CP133芽孢的附着和BMOs的固定[28]。
|
图 1 天然丝瓜络和NaOH预处理丝瓜络固定BMOs总量 Figure 1 Immobilization of biogenic manganese oxides onto natural and NaOH-treated loofah sponge |
锰氧化细菌CP133未添加MnCl2的芽孢形态如图 2A所示,形成的BMOs大量附着在芽孢表面(图 2B)。天然丝瓜络中有大量螺旋状纤维管束结构分布,且纤维表面被丰富的木质素层覆盖,结构粗糙。经过NaOH预处理,部分木质素和半纤维素被去除,横截面密集分布的微小孔洞暴露出来(图 2C),可能使丝瓜络的比表面积增大。经过与CP133共培养,NaOH预处理的丝瓜络表面可见密布的CP133芽孢和BMOs(图 2D),表明该丝瓜络样品对CP133和BMOs的固定化效果良好。

|
图 2 BMOs和丝瓜络的扫描电镜图 Figure 2 SEM micrographs of the loofah sponge and biogenic manganese oxides |
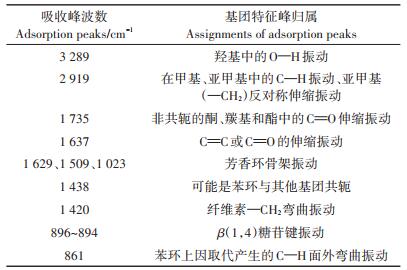
丝瓜络固定BMOs前后的FTIR图谱如图 3所示。参考相关文献[2, 29-30],确定了丝瓜络的红外光谱特征峰及峰的归属,详见表 1。丝瓜络在3 289 cm-1的宽大吸收峰表征羟基(—OH)的伸缩振动,在2 919 cm-1有对应的亚甲基(—CH2)反对称伸缩振动。NaOH预处理后,分子内氢键使—OH吸收峰伸缩振动向低波数方向移动。两种类型丝瓜络接种CP133后,—CH2的吸收峰基本消失,表明纤维素内部部分氢键断裂,其内聚力减小。1 735 cm-1吸收峰表征半纤维素中乙酰基或羧基的C=O伸缩振动,间接表示半纤维素的分布。该峰的强弱一般可以表征木质素与半纤维素连接的强弱。1 629 cm-1和1 509 cm-1的吸收峰表征苯环骨架的伸缩振动和变形振动,表征纤维素的分布。NaOH预处理或接种CP133后,1 735、1 629、1 509 cm-1和1 023 cm-1吸收峰消失或减弱,表明木质素结构受到破坏。推测表面裸露的羟基、胺基、羰基等基团更有利于固定CP133和BMOs颗粒。
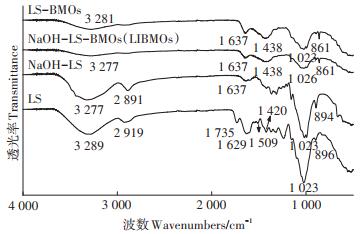
|
图 3 丝瓜络和LIBMOs的红外光谱 Figure 3 FTIR spectra of loofah sponge and LIBMOs |
|
|
表 1 丝瓜络红外光谱的吸收峰及主要归属 Table 1 FTIR absorption peaks of loofah sponge and main assignments |
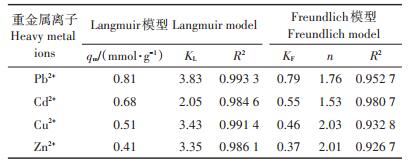
在LIBMOs吸附重金属离子过程中,吸附量受到BMOs和丝瓜络本身的吸附性能以及BMOs在丝瓜络表面分布等因素的影响。用Langmuir和Freundlich模型来拟合LIBMOs吸附重金属离子的实验数据(图 4),拟合参数见表 2。为了比较LIBMOs对不同二价重金属离子的吸附能力,吸附量单位为mmol·g-1。其中Langmuir等温吸附模型较好地拟合了LIBMOs对4种重金属离子的吸附行为,R2均大于0.98。而用Freundlich模型进行拟合时,Pb2+和Cd2+的R2大于0.95,表明这2种重金属离子可能存在多分子层吸附,且吸附强度参数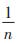
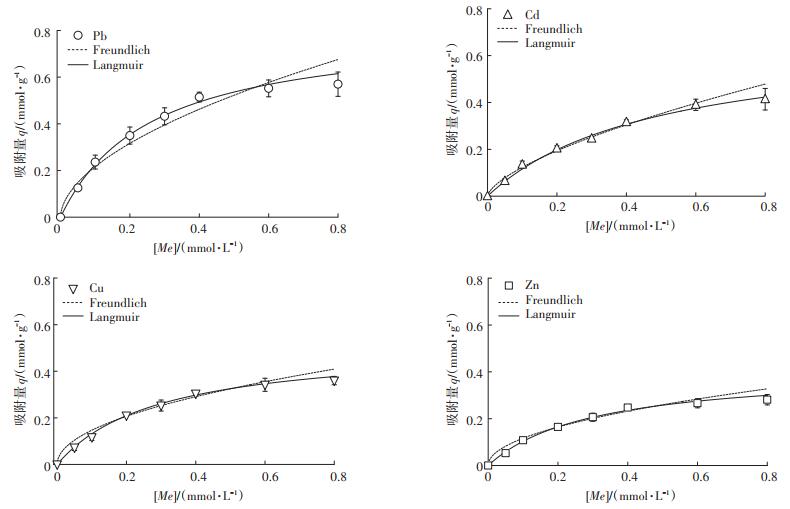
|
图 4 LIBMOs吸附重金属离子的Langmuir和Freundlich模型拟合 Figure 4 Adsorption isotherms of heavy metal ions by LIBMOs fitted by Langmuir and Freundlich models |
|
|
表 2 LIBMOs对重金属离子的吸附等温线拟合参数 Table 2 Adsorption isotherm parameters of heavy metals on LIBMOs |
表 3总结了文献报道的丝瓜络相关吸附剂对不同重金属离子的吸附量,包括天然丝瓜络、改性丝瓜络和丝瓜络固定微生物吸附剂。与文献报道的吸附量相比,本文所用的LIBMOs对几种重金属的吸附量有一定优势,这主要归因于BMOs对重金属离子的高吸附量。文献报道的丝瓜络相关吸附剂对重金属离子的吸附多符合Langmuir模型。在本文中Langmuir和Freundlich模型对LIBMOs吸附Pb2+和Cd2+的数据拟合相关性系数均较高(R2 > 0.95),表明LIBMOs对Pb2+和Cd2+有更大的吸附潜力,可能同时存在外表面吸附、内表面吸附和同晶置换[31-32]。
|
|
表 3 丝瓜络相关生物吸附剂对重金属离子的吸附量 Table 3 Comparison of adsorption capacities of heavy metal ions by loofah sponge-related sorbents |
当吸附时间达到60 min时,LIBMOs对几种重金属离子的吸附速率均趋于平缓,吸附90 min时均达到吸附平衡(图 5)。这是由于在吸附初始阶段重金属吸附于LIBMOs表面的过程较快且效果明显。随着吸附时间延长,传质动力减小,金属离子开始渗透到LIBMOs的内部孔隙结构中,吸附位点与重金属离子的接触时间延长,吸附过程趋于缓慢。
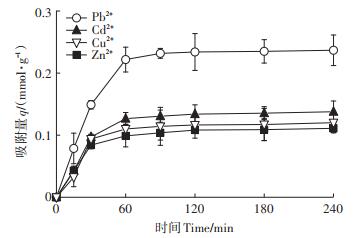
|
图 5 吸附时间对LIBMOs吸附重金属离子的影响 Figure 5 Effect of contact time on heavy metal ions adsorption onto LIBMOs |
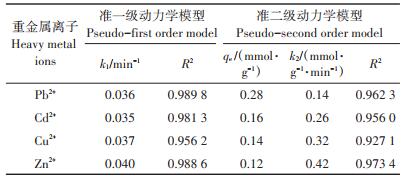
用准一级动力学模型和准二级动力学模型拟合的吸附动力学参数见表 4。结果表明,准一级动力学模型均较好地拟合4种重金属离子的吸附过程(R2 > 0.95)。同时,Pb2+、Cd2+和Zn2+的吸附过程也符合准二级动力学模型(R2 > 0.95),表明LIBMOs吸附3种重金属离子的过程(包括液膜扩散、表面吸附和颗粒内扩散)存在相似性;Cu2+吸附于LIBMOs的过程更符合准一级动力学模型,表明其仅在初始阶段的快速吸附过程与另外3种重金属离子相似,而在进入LIBMOs内部结构的吸附过程可能有其自身特点。另外,Cu2+作为重要的辅因子参与丝瓜络表面CP133芽孢氧化锰的过程[9-11],这也会增加Cu2+吸附过程的复杂性。
|
|
表 4 LIBMOs吸附重金属离子的动力学模型拟合参数 Table 4 Kinetic parameters for the adsorption of heavy metal ions onto LIBMOs |
(1)利用锰氧化细菌将生物氧化锰成功固定于NaOH预处理的丝瓜络表面,制成植物-微生物复合吸附剂LIBMOs。
(2)将LIBMOs用于吸附溶液中重金属离子Pb2+、Cd2+、Zn2+和Cu2+,其理论饱和吸附量与其他丝瓜络吸附剂相比有一定优势。其中LIBMOs对Pb2+和Cd2+的吸附行为同时符合Langmuir和Freundlich等温吸附模型,表明LIBMOs对这2种重金属离子有较强的吸附潜力。
(3)LIBMOs环境友好且成本低廉,在水环境重金属离子去除应用中有较好的前景。
| [1] |
Qin H Q, Hu T J, Zhai Y B, et al. The improved methods of heavy metals removal by biosorbents: A review[J]. Environmental Pollution, 2020, 258: 113777. DOI:10.1016/j.envpol.2019.113777 |
| [2] |
Tang X N, Zhang Q, Liu Z J, et al. Removal of Cu(Ⅱ) by loofah fibers as a natural and low-cost adsorbent from aqueous solutions[J]. Journal of Molecular Liquids, 2014, 199: 401-407. DOI:10.1016/j.molliq.2014.09.033 |
| [3] |
王天杰, 苏丹, 李雪, 等. 丝瓜络固定化微生物对土壤多环芳烃吸附-降解作用[J]. 农业环境科学学报, 2020, 39(1): 108-117. WANG Tian-jie, SU Dan, LI Xue, et al. Adsorption-degradation of polycyclic aromatic hydrocarbons in soil by immobilized microorganisms in loofah[J]. Journal of Agro-Environment Science, 2020, 39(1): 108-117. |
| [4] |
Sriharsha D V, Kumar R L, Savitha J. Immobilized fungi on Luffa cylindrica: An effective biosorbent for the removal of lead[J]. Journal of the Taiwan Institute of Chemical Engineers, 2017, 80: 589-595. DOI:10.1016/j.jtice.2017.08.032 |
| [5] |
Iqbal M, Saeed A E, dyvean R G J. Biosorption of lead(Ⅱ) by free and immobilised fungal biomass of Phanerochaete chrysosporium: A comparative study[J]. International Journal of Environment and Pollution, 2008, 34(1-4): 353-363. |
| [6] |
冯伟, 王雪青, 张译丹, 等. 丝瓜络固定化非活性颤藻对Pb2+的吸附特性[J]. 环境化学, 2020, 39(4): 1129-1136. FENG Wei, WANG Xue-qing, ZHANG Yi-dan, et al. Biosorption characteristics of nonliving Oscillatoria lutea immobilized in loofa sponge for removal of Pb2+[J]. Environmental Chemistry, 2020, 39(4): 1129-1136. |
| [7] |
Chen B Y, Chen C Y, Guo W Q, et al. Fixed-bed biosorption of cadmium using immobilized Scenedesmus obliquus CNW-N cells on loofa (Luffacylindrica) sponge[J]. Bioresource Technology, 2014, 160(Suppl 1): 175-181. |
| [8] |
Akhtar N, Iqbal J, Iqbal M. Enhancement of lead(Ⅱ) biosorption by microalgal biomass immobilized onto loofa(Luffa cylindrica) sponge[J]. Engineering in Life Sciences, 2004, 4(2): 171-178. DOI:10.1002/elsc.200420019 |
| [9] |
Tebo B M, Bargar J R, Clement B G, et al. Biogenic manganese oxides: Properties and mechanisms of formation[J]. Annual Review of Earth and Planetary Sciences, 2004, 32(1): 287-328. DOI:10.1146/annurev.earth.32.101802.120213 |
| [10] |
Geszvain K, Smesrud L, Tebo B M. Identification of a third Mn(Ⅱ) oxidase enzyme in Pseudomonas putida GB-1[J]. Applied and Environmental Microbiology, 2016, 82(13): 3774-3782. DOI:10.1128/AEM.00046-16 |
| [11] |
Zeng X P, Zhang M T, Liu Y Y, et al. Manganese(Ⅱ) oxidation by the multi-copper oxidase CopA from Brevibacillus panacihumi MK-8[J]. Enzyme and Microbial Technology, 2018, 117: 79-83. DOI:10.1016/j.enzmictec.2018.04.011 |
| [12] |
Santelli C M, Webb S M, Dohnalkova A C, et al. Diversity of Mn oxides produced by Mn (Ⅱ) -oxidizing fungi[J]. Geochimica et Cosmochimica Acta, 2011, 75(10): 2762-2776. DOI:10.1016/j.gca.2011.02.022 |
| [13] |
Hastings D, Emerson S. Oxidation of manganese by spores of a marine bacillus: Kinetic and thermodynamic considerations[J]. Geochimica et Cosmochimica Acta, 1986, 50(8): 1819-1824. DOI:10.1016/0016-7037(86)90141-9 |
| [14] |
Tebo B M, Johnson H A, McCarthy J K, et al. Geomicrobiology of manganese(Ⅱ) oxidation[J]. Trends in Microbiology, 2005, 13(9): 421-428. DOI:10.1016/j.tim.2005.07.009 |
| [15] |
Soldatova A V, Tao L Z, Romano C A, et al. Mn(Ⅱ) oxidation by the multicopper oxidase complex Mnx: A binuclear activation mechanism[J]. Journal of the American Chemical Society, 2017, 139(33): 11369-11380. DOI:10.1021/jacs.7b02771 |
| [16] |
Das R, Liang Z S, Li G Y, et al. A non-blue laccase of Bacillus sp. GZB displays manganese-oxidase activity: A study of laccase characterization, Mn(Ⅱ) oxidation and prediction of Mn(Ⅱ) oxidation mechanism[J]. Chemosphere, 2020, 252: 126619. DOI:10.1016/j.chemosphere.2020.126619 |
| [17] |
Andeer P F, Learman D R, McIlvin M, et al. Extracellular haem peroxidases mediate Mn(Ⅱ) oxidation in a marine Roseobacter bacterium via superoxide production[J]. Environmental Microbiology, 2015, 17(10): 3925-3936. DOI:10.1111/1462-2920.12893 |
| [18] |
Meng Y T, Zheng Y M, Zhang L M, et al. Biogenic Mn oxides for effective adsorption of Cd from aquatic environment[J]. Environmental Pollution, 2009, 157(8/9): 2577-2583. |
| [19] |
Nelson Y M, Lion L W, Shuler M L, et al. Effect of oxide formation mechanisms on lead adsorption by biogenic manganese(hydr) oxides, iron(hydr) oxides, and their mixtures[J]. Environmental Science & Technology, 2002, 36(3): 421-425. |
| [20] |
Sasaki K, Matsuda M, Urata T, et al. Sorption of Co2+ ions on the biogenic Mn oxide produced by a Mn-oxidizing fungus, Paraconiothyrium sp. WL-2[J]. Materials Transactions, 2008, 49(3): 605-611. DOI:10.2320/matertrans.M-MRA2007888 |
| [21] |
Ioannou K, Hadjiyiannis P, Liatsou I, et al. U(Ⅵ) adsorption by biochar fiber-MnO2 composites[J]. Journal of Radioanalytical and Nuclear Chemistry, 2019, 320(2): 425-432. DOI:10.1007/s10967-019-06479-9 |
| [22] |
Sasaki K, Yu Q Q, Momoki T, et al. Adsorption characteristics of Cs+ on biogenic birnessite[J]. Applied Clay Science, 2014, 101: 23-29. DOI:10.1016/j.clay.2014.06.028 |
| [23] |
Watanabe J, Tani Y, Chang J N, et al. As(Ⅲ) oxidation kinetics of biogenic manganese oxides formed by Acremonium strictum strain KR21-2[J]. Chemical Geology, 2013, 347: 227-232. DOI:10.1016/j.chemgeo.2013.03.012 |
| [24] |
Yu Z H, Zhou L, Huang Y F, et al. Effects of a manganese oxide-modified biochar composite on adsorption of arsenic in red soil[J]. Journal of Environmental Management, 2015, 163: 155-162. DOI:10.1016/j.jenvman.2015.08.020 |
| [25] |
Kim D G, Nhung T T, Ko S O. Enhanced adsorption of heavy metals with biogenic manganese oxide immobilized on zeolite[J]. Ksce Journal of Civil Engineering, 2016, 20(6): 2189-2196. DOI:10.1007/s12205-016-0356-1 |
| [26] |
郑洁, 孟佑婷, 方瑶瑶, 等. 一株锰氧化细菌的分离、鉴定及其锰氧化特性[J]. 微生物学报, 2016, 56(11): 1699-1708. ZHENG Jie, MENG You-ting, FANG Yao-yao, et al. Isolation and characterization of a manganese-oxidizing bacterium from soils[J]. Acta Microbiologica Sinica, 2016, 56(11): 1699-1708. |
| [27] |
Boogerd F C, de Vrind J P. Manganese oxidation by Leptothrix discophora[J]. Journal of Bacteriology, 1987, 169(2): 489-494. DOI:10.1128/JB.169.2.489-494.1987 |
| [28] |
闫红芹, 徐文正, 严庆帅, 等. 预处理方法对丝瓜络纤维性能的影响[J]. 纺织学报, 2018, 39(12): 72-77. YAN Hong-qin, XU Wen-zheng, YAN Qing-shuai, et al. Influence of pretreatment process on luffa fiber's properties[J]. Journal of Textile Research, 2018, 39(12): 72-77. |
| [29] |
颜婷婷, 吴东辉, 严雪峰, 等. 黄麻和红麻纤维磨木木质素的红外光谱特征[J]. 中国麻业科学, 2008, 30(6): 316-320. YAN Ting-ting, WU Dong-hui, YAN Xue-feng, et al. The FTIR characteristics of the milled wood lignin of jute and kenaf fibers[J]. Plant Fiber Science in China, 2008, 30(6): 316-320. DOI:10.3969/j.issn.1671-3532.2008.06.007 |
| [30] |
赵晶, 张福蓉, 陈明, 等. NaOH预处理对玉米秸秆纤维结构特性和酶解效率的影响[J]. 农业环境科学学报, 2016, 35(7): 1407-1412. ZHAO Jing, ZHANG Fu-rong, CHEN Ming, et al. Effect of NaOH pretreatments on cellulosic structure and enzymatic hydrolysis of corn stover[J]. Journal of Agro-Environment Science, 2016, 35(7): 1407-1412. |
| [31] |
Miyata N, Tani Y, Sakata M, et al. Microbial manganese oxide formation and interaction with toxic metal ions[J]. Journal of Bioscience and Bioengineering, 2007, 104(1): 1-8. DOI:10.1263/jbb.104.1 |
| [32] |
Zhu S S, Ho S H, Jin C, et al. Nanostructured manganese oxides: Natural/artificial formation and their induced catalysis for wastewater remediation[J]. Environmental Science-Nano, 2020, 7(2): 368-396. DOI:10.1039/C9EN01250H |
| [33] |
Shahidi A, Jalilnejad N, Jalilnejad E. A study on adsorption of cadmium(Ⅱ) ions from aqueous solution using Luffa cylindrica[J]. Desalination and Water Treatment, 2015, 53(13): 3570-3579. DOI:10.1080/19443994.2013.873878 |
| [34] |
滕艳华, 李宏燕, 陆曼, 等. 改性丝瓜络对铜离子吸附的研究[J]. 化工新型材料, 2015, 43(2): 126-128. TENG Yan-hua, LI Hong-yan, LU Man, et al. Adsorption of Cu(Ⅱ) onto modified Luffa cylindrica[J]. New Chemical Materials, 2015, 43(2): 126-128. |
| [35] |
毛金浩, 刘引烽, 杨红, 等. 丝瓜络的化学改性及其对金属离子的吸附[J]. 水处理技术, 2008, 34(7): 46-50. MAO Jin-hao, LIU Yin-feng, YANG Hong, et al. Chemical modification of luffa sponge and its adsorption characteristic for metal ions[J]. Technology of Water Treatment, 2008, 34(7): 46-50. |
 2021, Vol. 40
2021, Vol. 40