抗生素是一类治疗和预防各种细菌、致病微生物感染疾病的化学物质,畜禽养殖中通过注射、口服、饮水等方式进入动物体内的抗生素,只有极少部分会被动物吸收利用,绝大多数(60%~90%)会以原药或代谢产物的形式通过粪便和尿液排出体外[1-3],残留的药物仍然具有活性,因此对环境和人体健康构成巨大的潜在危害。残留在养殖场废水和废物中的抗生素进入周边土壤,可杀死部分土壤及根际微生物、改变土壤生物群落结构和功能[4],从而破坏土壤的微生态环境[5];进入水体,对水生生物造成不可逆的毒害[6]。同时,残留在土壤和水体中的抗生素可通过食物链或饮用水途径进入人体,诱导体内细菌产生抗性,使细菌耐药性增强,降低抗菌药物疗效,从而降低抗生素治疗疾病的能力[7],严重的会造成免疫系统功能紊乱,甚至致畸、致癌[8],威胁人类健康。抗生素污染已成为不可忽视的环境问题之一[9]。因此,最大限度地削减残留在养猪场废水中的抗生素成为当前研究者关注的焦点[10-11]。
越来越多的规模化养猪场建立了较完善的废水处理设施,以减少废水中的有机物等,但关于抗生素在不同污水处理阶段废水中的分布、去除率和废水综合利用的生态环境风险报道较少。本文选定广东一规模化养猪场,连续2 a于夏、冬两季采集饲料、不同处理阶段废水和鱼塘水,用超高效液相色谱-质谱联用(UPLC-MS/MS)测定抗生素含量,通过分析规模化猪场废水中抗生素污染特征及去除效率,探明养猪产生的废水中兽用抗生素污染现状,测算经处理后废水抗生素日排放量,评估处理后废水和鱼塘水的抗生素生态风险,以期为规模养猪场中兽用抗生素的污染削减、废水综合利用及环境治理提供数据支撑。
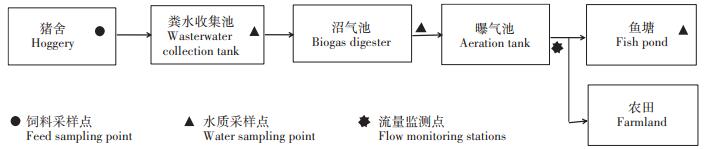
1 材料与方法 1.1 养猪场概况监测猪场位于广东省某市,养殖类型为自繁自养型,生猪存栏量2 100头,占地约16.5 hm2,其中猪舍7 000 m2,猪舍清污方式主要采用水冲式,日产污水约45 m3。猪场建设有废水处理系统,包括池容40 m3的粪水收集池,池容200 m3的酸化调节池,容积1 200 m3的圆形钢板焊接一体化结构的上流式厌氧消化池(沼气池),池容500 m3的好氧-膜生物反应器(曝气池)。该猪场配套废水综合利用设施,包括种植饲草的10.0 hm2农田和约6 600 m2的鱼塘。
1.2 采样点设置设置4个水质样品和1个饲料样品采样点(图 1)。根据废水处理不同阶段分别采原水、沼液、曝气池排水和鱼塘水样,采样点分别布设在粪水收集池、沼气池排水口、曝气池排水口和接纳处理废水的鱼塘。采集饲料混合样1个。同时监测曝气池排水流量。
|
图 1 养猪场废水处理过程及采样点设置示意图 Figure 1 Wastewater treatment processes and sampling points setting in the piggery |
在养猪场冲栏污水产生的高峰时段采样,采样前先润洗2~3次采样器具。原水在粪水收集池中采集,搅拌泵充分搅拌均匀后用水质采集器多点采混合样;沼气池排水和曝气池排水,分别在沼气池排水口和曝气池排水口采集,排水5 min后在单次出水时间段内多次采集混合样。鱼塘水在接纳处理废水的鱼塘中用水质采样器采集水面以下0.5 m处多点混合水样。种猪料、小猪料、中猪料和大猪料在2017年7月、2018年6月和2018年11月的用量比分别为19∶18∶29∶34、19∶18∶29∶34和20∶18∶27∶34,按各饲料用量比组成500 g混合饲料样。采样完成后,立即冷藏(0~4 ℃)、避光保存,尽快带回实验室分析。在2017—2018年,每年夏、冬各进行1次监测,结合广东的气候特点,选择温度高、湿度大的6—8月进行夏季监测,温度低、湿度小的11—12月进行冬季监测,具体时间分别为2017年7月15日、11月27日和2018月6月27日、12月25日。
1.4 分析方法 1.4.1 试剂与仪器本研究参照《全国规模化养殖污染监测国控点工作方案》中要求,选取养殖业常用的4类19种抗生素作为目标监测物,包括2种大环内酯类(MAs)抗生素:红霉素(Erythromycin,ETM)、泰乐菌素(Tylosin,TYL);4种喹诺酮类(QLs)抗生素:环丙沙星(Ciprofloxacin,CIP)、恩诺沙星(Enrofloxacin,ENR)、诺氟沙星(Norfloxacin,NFX)、氧氟沙星(Ofloxacin,OFX);9种磺胺类(SAs)抗生素:磺胺氯哒嗪(Sulfachloropyridazine,SCP)、磺胺间二甲氧嘧啶(Sulfadimethoxypyrimidine,SDM)、磺胺嘧啶(Wulfadiazine,SDZ)、磺胺脒(Sulfaguanidine,SGN)、磺胺二甲嘧啶(Sulfadimidine,SM2)、磺胺对甲氧嘧啶(Sulfameter,SMD)、磺胺间甲氧嘧啶(Sulfamonomethoxine,SMM)、磺胺甲噁唑(Sulfamethoxazole,SMZ)、磺胺噻唑(Sulfathiazole,ST);4种四环素类(TCs)抗生素:金霉素(Chlortetracycline,CTC)、强力霉素(Doxycycline,DOX)、土霉素(Oxytetracycline,OTC)、四环素(Tetracycline,TC)。以上抗生素标准品均购于德国Dr. Ehrenstorfer GmbH公司。
内标:环丙沙星-d8(Ciprofloxacin-d8,98.0%)、磺胺二甲嘧啶-d6(Sulfamethazine-d6,98.0%)、四环素- d6(Tetracycline-d6,95.0%)、红霉素- d4(Erythromycin-d4,99.0%),均购自美国多伦多研究化学品公司。色谱纯试剂:乙腈、甲醇和甲酸均购自德国Merck公司;分析纯试剂:柠檬酸、丙酮、NaH2PO4和Na2EDTA均购自国药集团化学试剂有限公司。
Agilent 1290-6470超高效液相色谱串联三重四极杆质谱仪,Dionex AutoTrace 280全自动固相萃取仪,Agilent Bond ElutPlexa 200 mg 6 mL固相萃取柱,Thermo Scientific Soravll Legend plus高速冷冻离心机,德祥Organomation全自动氮吹浓缩仪,实验用水用Milli-Q超纯水机(过0.22 μm孔径滤膜)制备。
1.4.2 色谱条件和质谱条件基本质谱条件:ESI源(+),脱溶剂气温度500 ℃,气体流速500 L·h-1,毛细管电压(Capillary voltage)3.5 kV,锥孔电压25 V,锥孔气体流速150 L·h-1。色谱和质谱参数采用已优化的方法[12-13]。
1.4.3 样品处理及测定准确称取已粉碎、匀质后的饲料样品5.00 g(精确至0.01 g),置于50 mL聚丙烯离心管中,加入5.00 mL 0.1 mol·L-1 Na2EDTA溶液,在快速混匀器上充分涡旋混匀1 min,加入20.00 mL甲醇-乙腈(50∶50)溶液,涡旋混匀,超声提取15 min,4 000 r·min-1离心10 min,移取上清液10 mL于聚丙烯离心管中,加入300 mg Bondesil-PSA吸附剂,涡旋1 min,4 000 r·min-1离心5 min,过0.22 μm滤膜,待上机测定[14]。
准确量取混合均匀的水质样品200 mL于5 000 r·min-1离心10 min,取上清液过0.45 μm滤膜,用1 mol·L-1的盐酸调节滤液pH值至3.8,加入100 μL饱和Na2EDTA溶液。SPE固相萃取柱,预先采用5 mL乙酸乙酯、5 mL甲醇、5 mL纯水(用1 mol·L-1的盐酸调节pH至3.85)依次淋洗活化。开启真空泵,控制流速为3~5 mL·min-1,将过膜上清液上柱,进样量为5 mL。过柱完成后,分别用5 mL 5%甲醇水、5 mL超纯水冲洗小柱,对HLB柱抽真空干燥30 min,最后用4.5 mL甲醇和4.5 mL 50% 甲醇+50% 乙酸乙酯洗脱,收集洗脱液并在室温下用N2吹扫至近干,用10% 甲醇定容至1 mL,采用UPLC-MS/MS定量分析[13],平行双样测定。
1.4.4 检出限和加标回收率ETM、TYL、CIP、ENR、NFX、OFX、SCP、SDM、SDZ、SGN、SM2、SMD、SMM、SMZ、ST、CTC、DOX、OTC和TC在水质中的检出限分别为0.011、0.008、0.022、0.023、0.016、0.008、0.026、0.009、0.011、0.010、0.005、0.014、0.033、0.021、0.005、0.026、0.031、0.021 µg·L-1和0.023 µg·L-1,在饲料中的检出限分别为0.20、0.14、0.15、0.15、0.28、0.23、0.038、0.016、0.020、0.10、0.025、0.035、0.016、0.22、0.050、1.95、2.07、1.26 µg · kg-1和1.80 µg·kg-1。
为保证实验数据的可靠性,每批样品均设置加标实验,测定加标回收率。水质中ETM、TYL、CIP、ENR、NFX、OFX、SCP、SDM、SDZ、SGN、SM2、SMD、SMM、SMZ、ST、CTC、DOX、OTC和TC的加标回收率分别为78.1%~92.9%、80.3%~96.6%、90.6%~111.0%、91.9%~110.0%、88.1%~109.1%、78.1%~93.3%、75.2%~98.3%、77.4%~85.1%、83.1%~110.5%、79.3%~96.2%、82.9%~110.1%、80.1%~90.0%、78.6%~90.1%、77.6%~87.3%、75.6%~93.2%、69.8%~83.1%、70.1%~80.0%、73.3%~85.6% 和68.8%~83.9%。饲料中CTC、DOX、OTC和TC的加标回收率分别为71.2%~90.3%、68.3%~83.2%、75.3%~95.2% 和69.6%~82.6%。检测结果的相对标准偏差(RSD)均小于15.0%。
1.5 猪场抗生素使用现状调查监测前1个月内猪场抗生素使用情况,2017年7月采用肌注使用ENR、SDZ和SM2,通过饲料使用CTC、OTC和TC;2017年12月采用肌注使用CIP、ENR、SM2和SMM,通过饮水使用DOX,通过饲料使用CTC、OTC和TC;2018年6月采用肌注使用CIP、ENR、SDZ、SM2、SMM和SMZ,通过饮水使用ETM,通过饲料使用CTC、DOX、OTC和TC;2018年11月采用肌注使用SM2,通过饮水使用ETM和OTC,通过饲料使用TC、DOX和TC。该猪场采用自繁自养型养殖模式,有各生育期、不同猪龄的猪,同时段既有猪处于用药期,也有猪处于休药期。
1.6 去除率及日排放量抗生素去除率(R)计算公式如下:

|
(1) |
式中:R为某处理设备(工艺)抗生素去除率,%;Ci(Front)为进入某处理设备(工艺)前水中第i种(类)抗生素浓度,µg·L-1;Ci(After)为该设备(工艺)排水中第i种(类)抗生素浓度,µg·L-1。
抗生素日排放量(Wi)和单头猪抗生素日排放量(Wsi)计算公式如下:

|
(2) |

|
(3) |
式中:Wi为第i种(类)抗生素日排放量,mg·d-1;Wsi为单头猪第i种(类)抗生素日排放量µg·d-1 · pig-1;Ci(Aeration)为曝气池排水中第i种(类)抗生素浓度,µg· L-1;Q为曝气池日排水量,m3·d-1;Amount为生猪存栏量,头。
1.7 风险评估方法养猪场原水依次经沼气池和曝气池处理后部分进入农田,部分进入鱼塘。按欧盟的技术指导文件中关于环境风险评价的方法[15],本文对曝气池排水和鱼塘水采用生态风险商值(Risk quotient)评价抗生素的生态风险。计算公式如下:

|
(4) |
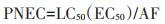
|
(5) |
式中:RQ为风险商值;MEC为抗生素的测定浓度;PNEC为预测的无效浓度;LC50为最低效应浓度,EC50为半效应浓度,毒性数据可通过EPA ECTOX数据库查询获得;AF为评估因子,其数值根据欧盟的技术指导文件(TGD)中生物毒性数据情况选取,急性毒性数据AF取值1 000,慢性毒性数据满足一个营养级时AF取100,慢性毒性数据满足两个营养级时AF取50,慢性毒性数据满足3个营养级时AF取10,综合考虑后AF取值1 000。
按照Hernando等[16]提出的RQ分类方法表征生态风险等级,共分为3个环境风险等级:0.01≤RQ < 0.1时,为低环境风险;0.1≤RQ < 1时,为中等环境风险;RQ≥1时,为高环境风险。
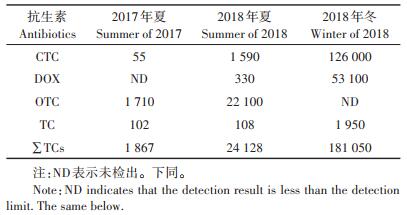
2 结果与讨论 2.1 饲料中抗生素的种类及含量猪饲料中仅检出CTC、DOX、OTC和TC 4种抗生素,均为TCs抗生素,浓度为1 867~181 050 μg·kg-1(表 1)。DOX在2017年夏样品中未检出,OTC在2018年冬样品中未检出。监测期间猪饲料中添加抗生素种类有所差异,其中2017年夏和2018年夏饲料样品中均以OTC为主,占总抗生素的91.6%,2018年冬饲料中CTC占比较高,为69.6%。OTC和CTC是猪饲料中主要添加抗生素,与这两种抗生素的使用成本较低有关。
|
|
表 1 饲料中抗生素含量(µg·kg-1) Table 1 Antibiotics content in pig feed(µg·kg-1) |
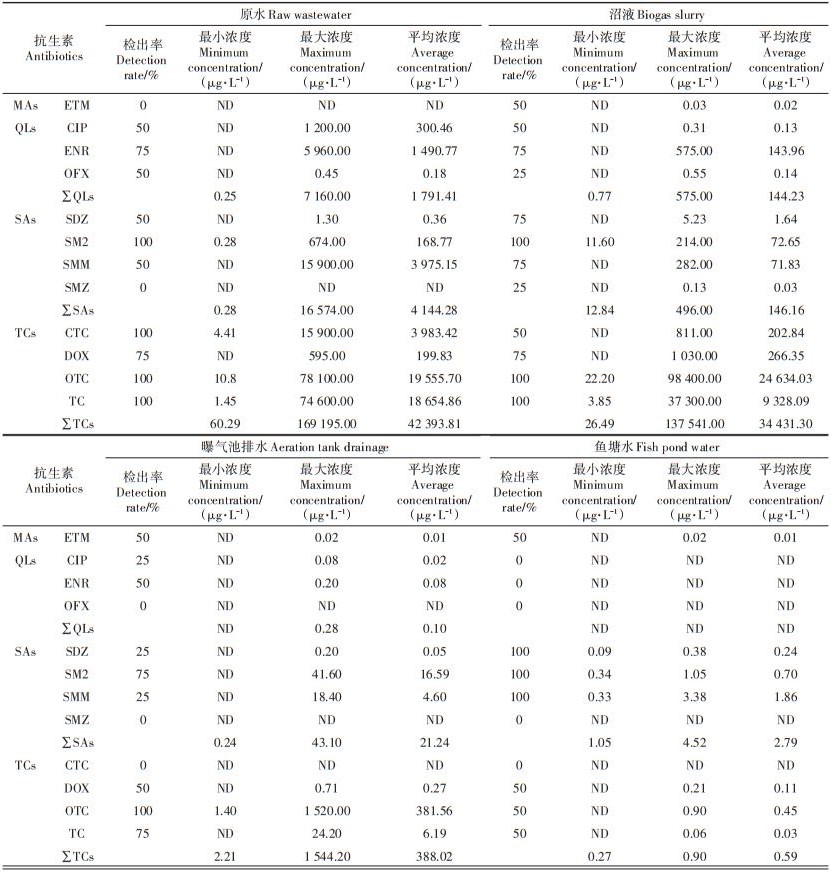
19种抗生素中,在猪场原水、沼液、曝气池排水和鱼塘水中均未检出TYL、NFX、SCP、SDM、SGN、SMD和ST等7种,检出的12种抗生素情况见表 2。MAs浓度相对较低,在原水中未检出,沼液、曝气池排水中平均浓度在0.01~0.02 μg·L-1之间。QLs、SAs和TCs浓度大小依次均为原水 > 沼液 > 曝气池排水 > 鱼塘水,在原水、沼液和曝气池排水中QLs浓度分别为1 791.41、144.23 μg·L-1和0.10 μg·L-1,SAs的浓度分别为4 144.28、146.16 μg·L-1和21.24 μg·L-1,TCs的浓度分别为42 393.81、34 431.30 μg·L-1和388.02 μg· L-1。TCs在原水、沼液和曝气池排水中分别占检出抗生素的87.7%、99.2% 和94.8%,表明该养猪场废水中兽用抗生素污染以TCs为主。这与陈永山等[17]的研究结果一致,主要是因为饲料抗生素添加是养猪场兽药利用的主要形式[18],该养猪场在饲料中大量添加OTC和CTC,且添加的抗生素60%~90% 通过原药形式代谢[1-3]。鱼塘水中SAs浓度为2.79 μg·L-1,与国彬等[19]对鱼塘水中SAs(2.82 μg·L-1)的研究结果基本相当。鱼塘水中TCs浓度为0.59 μg·L-1,QLs未检出。
|
|
表 2 猪场水环境中12种抗生素的浓度及检出率 Table 2 Concentrations of 12 selected antibiotics in the large-scale piggery wastewater and slurry |
ETM在原水中未检出,在沼液、曝气池排水和鱼塘水中检出率均为50%,平均浓度分别为0.02、0.01 µg·L-1和0.01 µg·L-1,这可能是原水中含有ETM代谢产物,在生物处理过程中该代谢产物被转化为其母体化合物[20]。该猪场养殖废水中的ETM通过饮水途径进入。
原水中CIP和OFX检出率为50%,ENR检出率为75%,ENR和CIP通过肌注经猪代谢后进入原水。经过处理设施(沼气池+曝气池)后的废水中CIP检出率为25%,ENR检出率为50%,OFX未检出;鱼塘水中CIP、OFX和ENR均未检出。ENR在原水、沼液和曝气池排水中浓度最高,分别占QLs的83.2%、99.8%和80.0%。CIP在原水、沼液和曝气池排水中浓度分别为300.46、0.13 μg·L-1和0.02 μg·L-1。
原水中SDZ和SMM检出率为50%,SM2检出率为100%,其均通过肌注经猪代谢后进入原水。经过处理设施(沼气池+曝气池)后废水中SDZ和SMM检出率为25%,SM2检出率为75%;鱼塘水中SDZ、SM2和SMM检出率均为100%。原水中SMM浓度为3 975.15 µg·L-1,占SAs比例高达95.9%,与韩跃飞[21]、杨钊等[22]和周婧等[23]的研究结果相似;鱼塘水中SMM浓度为1.86 µg·L-1,占SAs的66.6%。沼液和曝气池排水中以SM2浓度最高,分别占SAs的49.7% 和78.1%。SMZ仅在沼液中有检出,检出率为25%,浓度为0.03 µg·L-1,可能因为原水中该抗生素浓度较低,且含有目标抗生素代谢物,通过厌氧处理后该代谢物部分转化为其母体[22],从而被检出有关。
原水中DOX检出率为75%,CTC、OTC和TC检出率均为100%。2017年冬,DOX通过饮水途径进入原水,原水中DOX占TCs的0.3%;2018年冬,OTC通过饮水途径进入原水,原水中OTC占TCs的4.5%;其他监测时段原水中CTC、DOX、OTC和TC通过饲料添加的途径进入原水,饲料是猪场废水中CTC、DOX、OTC和TC的主要来源。经过处理设施(沼气池+曝气池)后废水中CTC未检出,DOX、OTC和TC检出率分别为50%、100% 和75%;鱼塘水中CTC未检出,DOX、OTC和TC检出率均为50%。OTC和DOX浓度均为沼液 > 原水 > 曝气池排水 > 鱼塘水,沼液中OTC和DOX浓度高于原水可能是因为原水中含有目标抗生素的代谢产物,在生物处理过程中代谢产物转化为其母体化合物被检出,这与杨钊等[22]和Göbel等[20]的研究结果相似。CTC和TC检出浓度均为原水 > 沼液 > 曝气池排水≥鱼塘水,CTC在曝气池排水和鱼塘水中未检出。TCs中OTC在原水、沼液、曝气池排水和鱼塘水占比分别为46.1%、71.5%、98.3% 和99.8%,在养猪场废水和鱼塘水TCs中均以OTC的占比最高,这与陈永山等[17]对浙江规模猪场,魏瑞城等[24]对江苏规模猪场及陈乾等[25]对天津规模化奶牛场的废水中抗生素污染特征的研究结果一致。这可能与OTC和CTC是该猪场饲料中主要的添加抗生素有关。
2.3 厌氧和好氧处理对抗生素的去除效果沼气池是猪场废水处理过程中典型的厌氧处理设施,主要利用厌氧和兼性厌氧微生物在厌氧条件下对废水中的有机物进行生化降解;曝气池是猪场废水处理过程中最常使用的好氧处理设施,主要利用好氧和兼性厌氧微生物在有氧条件下氧化、降解废水中的有机污染物。该猪场沼气池和曝气池对养殖废水中抗生素去除率见图 2。

|
图 2 猪场沼气池和曝气池对废水中抗生素的去除率 Figure 2 Removal rate of antibiotics from wasterwater by biogas tank and aeration tank in the piggery |
曝气池对沼液ETM去除率为33.33%。沼气池对原水中CIP、ENR和OFX的去除率分别为99.96%、90.34% 和21.43%,对QLs的平均去除率为91.95%。曝气池对沼液中CIP、ENR和OFX的去除率分别为84.62%、99.94% 和100%,对QLs的平均去除率为99.93%。曝气池对沼液中QLs的去除率高于沼气池对原水的处理效率,这与周婧等[23]的好氧处理阶段对QLs去除率高于厌氧处理阶段的结果一致。沼气池对原水中SDZ、SM2和SMM的去除率分别为-359.44%、56.95%和98.19%,对SAs的平均去除率为96.47%。沼气池对SDZ的去除率为负值,与杨钊等[22]厌氧发酵池对SDZ去除出现负迁移现象的研究结果一致,这可能是SDZ的乙酰化代谢物在生物处理过程中发生生物转化的结果[20]。曝气池对沼液中SDZ、SM2、SMM和SMZ的去除率分别为96.96%、77.17%、93.6% 和100%,对沼液中SAs的平均去除率为85.47%。沼气池对SAs的去除率高于曝气池,这可能与废水中SAs以SMM占比高,且SMM分子结构中存在氮原子和硫原子,在厌氧条件下易于生物降解有关[26-27]。沼气池对原水中CTC、DOX、OTC和TC的去除率分别为94.91%、-33.29%、-25.97% 和50.00%,对原水中TCs的平均去除率为18.78%。曝气池对经过沼气池处理的废水中CTC、DOX、OTC和TC的去除率分别为100%、99.90%、98.45%和99.93%,对沼液中TCs的平均去除率为98.87%。沼气池对TCs的去除率低于曝气池,好氧处理阶段对TCs的去除率高于厌氧处理阶段,这与周婧等[23]和靳红梅等[28]的研究结果一致。一般抗生素的生物降解依赖于氧分子的存在,曝气池处理废水过程中,由于氧分子增加,抗生素可能发生水解、光解和微生物降解等一种或者多种降解反应[29]。
猪场废水处理系统(沼气池+曝气池)对原水中CIP、ENR和OFX的去除率分别为99.99%、99.99% 和100%,对原水中QLs的平均去除率为99.99%。沼气池+曝气池对原水中SDZ、SM2和SMM去除率分别为86.01%、90.17%和99.88%,对原水中SAs的平均去除率为99.49%。沼气池+曝气池对原水中CTC、DOX、OTC和TC的去除率分别为100%、99.86%、98.05% 和99.97%,对原水中TCs的平均去除率为99.08%。
综上所述,沼气池对QLs、SAs和TCs的平均去除率分别为91.95%、96.47% 和18.78%,曝气池的平均去除率则分别为99.93%、85.47% 和98.87%。而沼气池+曝气池组合对原水中QLs、SAs和TCs的平均去除率分别达到99.99%、99.49% 和99.08%,去除效果均优于单项处理设施。由此可见,厌氧与好氧处理可对不同类型抗生素提供适于其降解的条件和环境,组合使用能够提升废水中抗生素的综合去除效果[23]。
2.4 抗生素排放量经曝气池处理后的废水通过水产养殖和农田灌溉进入水体和土壤环境,对周边环境造成影响。该猪场通过曝气池排水排放抗生素的量见表 3。
|
|
表 3 猪场通过废水向环境排放抗生素的量 Table 3 Amount of antibiotics discharged into the environment by piggery wastewater |
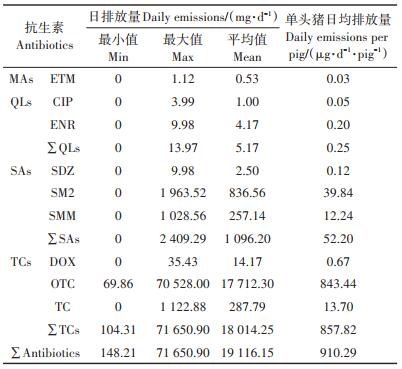
猪场通过经处理的废水向水体和土壤排放的单体抗生素平均在0.53~17 712.30 mg·d-1之间,抗生素总排放量为19 116.15 mg·d-1,单头猪抗生素总排放量为910.29 μg·d-1·pig-1。单头猪的4类抗生素日均排放量大小依次TCs、SAs、QLs和MAs,分别为857.82、52.20、0.25 μg·d-1·pig-1和0.03 μg·d-1·pig-1。猪场废水向环境排放的抗生素以TCs最大,单体抗生素以OTC最大,占单头猪抗生素总排放量的92.7%,这与魏瑞成等[24]的研究结果相一致。抗生素的排放主要与养猪规模、饲养方式、抗生素使用[10]和处理工艺效果有关。饲料又是该规模养猪场养殖废水中抗生素的主要来源。
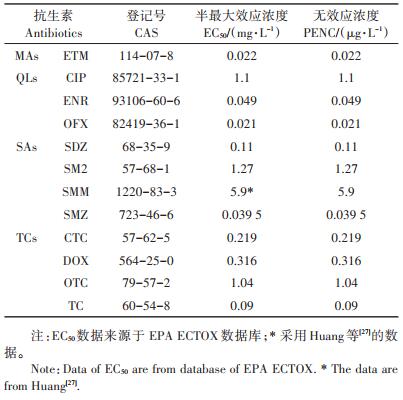
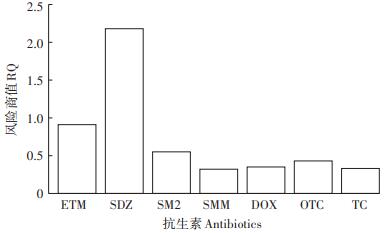
2.5 曝气池排水及鱼塘水抗生素的风险评估该猪场原水虽经处理,但处理后废水中仍然含有相当浓度的抗生素,残留的抗生素通过农田灌溉和水产养殖等进入环境中,从而对排放环境中的生物造成潜在的危害。风险商值法常用于药物的生态风险评价,本文用此法评估猪场曝气池排水和鱼塘水中抗生素对环境的生态风险。曝气池排水和鱼塘水中残留抗生素的PENC和EC50见表 4,风险商值见图 3和图 4。
|
|
表 4 曝气池排水和鱼塘水中残留抗生素的半效应浓度和无效应浓度 Table 4 Half effect concentration and ineffective concentration of 12 antibiotics |

|
图 3 猪场曝气池排水中抗生素残留风险商值 Figure 3 RQ of the antibiotic residues in the effluent of aeration tank in the piggery |
|
图 4 猪场鱼塘水中抗生素残留风险商值 Figure 4 RQ of the antibiotic residues in fish pond water of the piggery |
猪场曝气池排水中CIP的RQ处于低风险,ETM、SDZ、SMM和DOX处于中等风险,ENR、SM2、OTC和TC处于高风险,其中OTC和TC的RQ分别高达366.9和68.8,说明猪场原水经厌氧和好气设施处理后的废水中抗生素对环境仍有较高的生态风险。这与陈乾等[25]研究规模奶牛场的处理废水有较高生态风险的结论基本一致。鱼塘水中ETM、SM2、SMM、DOX、OTC和TC处于中等风险,SDZ处于高风险。曝气池排水用于农田灌溉会导致抗生素大量进入农田,造成土壤抗生素污染,进而被农作物吸收积累[30],而在抗生素高风险的水中从事水产养殖,会对环境及水生动、植物造成一定伤害[31],且最终通过食物链影响人类健康。本研究结果表明养猪场经处理的废水用于灌溉和养殖时均存在抗生素生态风险,但对于食物链的具体风险性评价还有待于进一步的研究。
3 结论(1)MAs在原水中未检出,在不同处理阶段平均浓度在0.01~0.02 μg·L-1之间。QLs、SAs和TCs浓度均为原水 > 沼液 > 曝气池排水 > 鱼塘水。原水、沼液和曝气池排水中抗生素均以TCs为主,占检出抗生素的87.7%~99.2%,鱼塘水中SAs占比最高为70.4%。
(2)沼气池对原水中QLs和SAs的去除率高于曝气池对沼液的去除率,对TCs的去除率低于曝气池。
(3)该规模化养猪场通过废水排放的抗生素量为910.29 μg·d-1·pig-1,4类抗生素日均排放量大小依次为TCs、SAs、QLs和MAs,单体抗生素排放量在0.03~843.44 μg· d-1 · pig-1之间,排放量由大到小依次为OTC、SM2、TC、SMM、DOX、ENR、SDZ、CIP和ETM,其中OTC占抗生素总排放量的92.7%。
(4)ENR、SM2、OTC和TC为曝气池排水中的高风险污染物,ETM、SDZ、SMM和DOX为中等风险,CIP为低风险污染物。接纳经处理的部分废水的鱼塘水中SDZ为高风险污染物,ETM、SM2、SMM、DOX、OTC和TC为中等风险污染物。规模化养猪场经处理后废水和接纳部分废水的鱼塘水中抗生素对环境仍有较高的生态风险。
| [1] |
Zhu Y G, Johnson T A, Su J Q, et al. Diverse and abundant antibiotic resistance genes in Chinese swine farms[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(9): 3435-3440. DOI:10.1073/pnas.1222743110 |
| [2] |
Massé D I, Saady N M, Gilbert Y. Potential of biological processes to eliminate antibiotics in livestock manure: An overview[J]. Animals, 2014, 4(2): 146-163. DOI:10.3390/ani4020146 |
| [3] |
Zhang Q Q, Ying G G, Pan C G, et al. Comprehensive evaluation of antibiotics emission and fate in the river basins of China: Source analysis, multimedia modeling, and linkage to bacterial resistance[J]. Environmental Science & Technology, 2015, 49(11): 6772-6782. |
| [4] |
Tasho R P, Cho J Y. Veterinary antibiotics in animal waste, its distribution in soil and uptake by plants: A review[J]. Science of the Total Environment, 2016, 563/56: 366-376. |
| [5] |
Richardson B J, Lam P K S, Martin M. Emerging chemicals of concern: Pharmaceuticals and personal care products(PPCPs) in Asia, with particular reference to southern China[J]. Marine Pollution Bulletin, 2005, 50(9): 913-920. DOI:10.1016/j.marpolbul.2005.06.034 |
| [6] |
魏瑞成, 包红朵, 郑勤, 等. 粪源抗生素金霉素和喹乙醇在养殖水体中的残留及对锦鲤的生态毒理效应研究[J]. 农业环境科学学报, 2009, 28(9): 1800-1805. WEI Rui-cheng, BAO Hong-duo, ZHENG Qin, et al. Chlortetracycline and olaquindox residues of manure-derived antibiotics in the aquatic water and their ecotoxicological effects on Koi Carp[J]. Journal of Agro-Environment Science, 2009, 28(9): 1800-1805. DOI:10.3321/j.issn:1672-2043.2009.09.005 |
| [7] |
Li W H, Shi Y L, Gao L H, et al. Occurrence, distribution and potential affecting factors of antibiotics in sewage sludge of wastewater treatment plants in China[J]. Science of the Total Environment, 2013, 445/446: 306-313. DOI:10.1016/j.scitotenv.2012.12.050 |
| [8] |
Wu N, Qiao M, Zhan B, et al. Abundance and diversity of tetracycline resistance genes in soils adjacent to representative swine feedlots in China[J]. Environmental Science & Technology, 2010, 44(18): 6933-6939. |
| [9] |
王娜, 王昝畅, 郭欣妍, 等. 兽药抗生素环境风险控制管理政策探析[J]. 生态与农村环境学报, 2017, 33(7): 586-591. WANG Na, WANG Zan-chang, GUO Xin-yan, et al. Management policies for control of environmental risks of veterinary antibiotics[J]. Journal of Ecology and Rural Environment, 2017, 33(7): 586-591. |
| [10] |
Zhang M, Liu Y S, Zhao J L, et al. Occurrence, fate and mass loadings of antibiotics in two swine wastewater treatment systems[J]. Science of the Total Environment, 2018, 639: 1421-1431. DOI:10.1016/j.scitotenv.2018.05.230 |
| [11] |
Wang R, Feng F, Chai Y F, et al. Screening and quantitation of residual antibiotics in two different swine wastewater treatment systems during warm and cold seasons[J]. Science of the Total Environment, 2019, 660: 1542-1554. DOI:10.1016/j.scitotenv.2019.01.127 |
| [12] |
郭欣妍, 王娜, 郝利君, 等. 超高效液相色谱/串联质谱法同时测定水、土壤及粪便中25种抗生素[J]. 分析化学, 2015, 43(1): 13-20. GUO Xin -yan, WANG Na, HAO Li-jun, et al. Simultaneous detection of 25 kinds of veterinary antibiotics in soil, manure and water samples using liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Analytical Chemistry, 2015, 43(1): 13-20. |
| [13] |
柴玉峰, 冯玉启, 张玉秀, 等. 猪场废水中24种抗生素同时检测方法优化[J]. 环境化学, 2017, 36(10): 2147-2154. CHAI Yu-feng, FENG Yu -qi, ZHANG Yu -xiu, et al. Optimization of an analytical method for the simultaneous determinationof 24 antibiotics in swine wastewater[J]. Environmental Chemistry, 2017, 36(10): 2147-2154. |
| [14] |
罗辉泰, 黄晓兰, 吴惠勤, 等. 分散固相萃取/高效液相色谱-串联质谱法快速测定饲料中87种药物残留[J]. 分析测试学报, 2015, 34(9): 979-985. LUO Hui-tai, HUANG Xiao-lan, WU Hui-qin, et al. Dispersive solid-phase extraction followed by liquid chromatography-tandem mass spectrometry for rapid determination of 87 kinds of drug residues in feeding stuffs[J]. Journal of Instrumental Analysis, 2015, 34(9): 979-985. DOI:10.3969/j.issn.1004-4957.2015.09.001 |
| [15] |
European Chemicals Bureau. Technical guidance document on risk assessment[J]. European Communities: European Commission Joint Research Center, 2003, 93-101. |
| [16] |
Hernando M D, Mezcua M, Fernández-Alba A R, et al. Environmental risk assessment of pharmaceutical residues in wastewater effluents, surface waters and sediments[J]. Talanta, 2006, 69(2): 334-342. DOI:10.1016/j.talanta.2005.09.037 |
| [17] |
陈永山, 章海波, 骆永明, 等. 典型规模化养猪场废水中兽用抗生素污染特征与去除效率研究[J]. 环境科学学报, 2010, 30(11): 2205-2212. CHEN Yong-shan, ZHANG Hai-bo, LUO Yong-ming, et al. A preliminary study on the occurrence and dissipation of antibiotics in swine wastewater[J]. Acta Scientiae Circumstantiae, 2010, 30(11): 2205-2212. |
| [18] |
Sarmah A K, Meyer M T, Boxall A B A. A global perspective on the use, sales, exposure pathways, occurrence, fate and effects of veterinary antibiotics(VAs) in the environment[J]. Chemosphere, 2006, 65: 725-759. DOI:10.1016/j.chemosphere.2006.03.026 |
| [19] |
国彬, 姚丽贤, 刘忠珍, 等. 广州市兽用抗生素的环境残留研究[J]. 农业环境科学学报, 2011, 30(5): 938-945. GUO Bin, YAO Li-xian, LIU Zhong-zhen, et al. Environmental residues of veterinary antibiotics in Guangzhou City, China[J]. Journal of Agro-Environment Science, 2011, 30(5): 938-945. |
| [20] |
Göbel A, Thomsen A, Mcardell C S, et al. Occurrence and sorption behavior of sulfonamides, macrolides, and trimethoprim in activated sludge treatment[J]. Environmental Science and Technology, 2005, 39(11): 3981-3989. DOI:10.1021/es048550a |
| [21] |
韩跃飞. 养猪场废水中抗生素去除技术研究[D]. 上海: 华东理工大学, 2019: 73-74. HAN Yue-fei. Research on treatment technology of antibiotics in swine wastewater[D]. Shanghai: East China University of Science and Technology, 2019: 73-74. |
| [22] |
杨钊, 李江, 向福亮, 等. 贵州某规模化养猪场废水中抗生素的污染特征及去除效果[J]. 环境科学, 2020, 41(5): 2320-2328. YANG Zhao, LI Jiang, XIANG Fu-liang, et al. Pollution characteristics and removal effects of antibiotics in wastewater from a large-scale pig farms in Guizhou[J]. Environmental Science, 2020, 41(5): 2320-2328. |
| [23] |
周婧, 支苏丽, 宫祥静, 等. 三类抗生素在两种典型猪场废水处理工艺中的去除效果[J]. 农业环境科学学报, 2019, 38(2): 430-438. ZHOU Jing, ZHI Su-li, GONG Xiang-jing, et al. The removal effect of three classes of antibiotics in two typical swine wastewater treatment systems[J]. Journal of Agro-Environment Science, 2019, 38(2): 430-438. |
| [24] |
魏瑞成, 葛峰, 陈明, 等. 江苏省畜禽养殖场水环境中四环类抗生素污染研究[J]. 农业环境科学学报, 2010, 29(6): 1205-1210. WEI Rui-cheng, GE Feng, CHEN Ming, et al. Pollution of tetracyclines from livestock and poultry farms in aquatic environment in Jiangsu Province, China[J]. Journal of Agro-Environment Science, 2010, 29(6): 1205-1210. |
| [25] |
陈乾, 赵润, 牟美睿, 等. 天津市规模化奶牛养殖场废水中典型抗生素处理效果及生态风险评估[J]. 环境科学, 2019, 40(11): 5015-5023. CHEN Qian, ZHAO Run, MOU Mei-rui, et al. Treatment effect and ecological risk assessment of typical antibiotics in wastewater from 12 large-scale dairy farms in Tianjin[J]. Environmental Science, 2019, 40(11): 5015-5023. |
| [26] |
Mitchell S M, Ullman J L, Teel A L, et al. The effects of the antibiotics ampicillin, florfenicol, sulfamethazine, and tylosin on biogas production and their degradation efficiency during anaerobic digestion[J]. Bioresource Technology, 2013, 149(10): 244-252. |
| [27] |
Huang D J, Hou J H, Kuo T F, et al. Toxicity of the veterinary sulfonamide antibiotic sulfamonomethoxine to five aquatic organisms[J]. Environmental Toxicology and Pharmacology, 2014, 38(3): 874-880. DOI:10.1016/j.etap.2014.09.006 |
| [28] |
靳红梅, 黄红英, 管永祥, 等. 规模化猪场废水处理过程中四环素类和磺胺类抗生素的降解特征[J]. 生态与农村环境学报, 2016, 32(6): 978-985. JIN Hong-mei, HUANG Hong-ying, GUAN Yong-xiang, et al. Characteristics of degradation tetracyclines and sulfonamides during wastewater treating processes in an intensive swine farm[J]. Journal of Ecology and Rural Environment, 2016, 32(6): 978-985. |
| [29] |
Mohring S A I, Strzysch I, Fernandes M R, et al. Degradation and elimination of various sulfonamides during anaerobic fermentation: A promising step on the way to sustainable pharmacy?[J]. Environmental Science & Technology, 2009, 43(7): 2569-2574. |
| [30] |
李彦文, 张艳, 莫测辉, 等. 广州市蔬菜中喹诺酮类抗生素污染特征及健康风险初步研究[J]. 环境科学, 2010, 31(10): 2445-2449. LI Yan-wen, ZHANG Yan, MO Ce-hui, et al. Preliminary study on occurrence and health risk assessment of quinolone antibiotics in vegetables from Guangzhou, China[J]. Environmental Science, 2010, 31(10): 2445-2449. |
| [31] |
Harrison E M, Paterson G K, Holden M T G, et al. Whole genome sequencing identifies zoonotic transmission of MRSA isolates with the novel mecA homologue mecC[J]. EMBO Molecular Medicine, 2013, 5(4): 509-515. |
 2021, Vol. 40
2021, Vol. 40