2. 土壤生态系统健康与调控福建省高校重点实验室, 福州 350002
2. Fujian Provincial Key Laboratory of Soil Ecosystem Health and Regulation, Fuzhou 350002, China
土壤可溶性有机氮(Soluble organic nitrogen,SON)是土壤氮素矿化为无机氮的中间产物,其转化速率(VSON)在农田生态系统氮循环中具有重要作用[1]。近年来的研究表明,土壤蛋白转化为氨基酸是氮素矿化的限速步骤,其转化速率与土壤氮素的有效性密切相关[2]。Schimel等[3]研究也指出,高分子量SON转化为低分子量SON的速率是控制新的可利用氮向生态系统持续流动和氮素循环的关键。然而,目前的研究主要集中于土壤SON含量方面,而对土壤VSON的研究欠缺,因此水稻生育期土壤VSON还有待进一步研究。
微生物在土壤氮循环中起着关键的作用,其可通过矿化作用将大分子有机氮转化为SON,包括植物可吸收的多肽和氨基酸,并通过氨化和硝化作用将SON转化为可溶性无机氮(SIN,即NH4+-N和NO3--N)[4]。此外,微生物可直接吸收低分子量SON如氨基酸,并通过转氨作用进行同化,多余氮素以NH4+-N形式排出体外[5]。植物根系捕获SON和SIN的相对数量也依赖于根际微生物群落对氮素的竞争能力[6]。因此,微生物在SON转化过程中至关重要。但已有的研究大部分局限于土壤物理性质(温度和黏粒含量)、化学性质(pH和有机质含量)及生物性质(酶活性和微生物量氮)对SON含量的影响[7-9]。微生物数量、多样性和群落结构对土壤VSON的影响还有待研究。
施肥是农业生产的重要措施,也是农田土壤SON的重要来源。长期施用氮肥能够提高土壤SON的含量,且SON含量随施氮量增加而升高[10],但尿素、硫酸铵和缓释尿素处理间无显著差异[11]。有机物料施用可显著提高土壤SON的含量,但不同种类有机物料对SON动态变化的影响不同,低C/N的有机物料施入土壤后,显著提高了SON累积量,而高C/N的有机物料施用后,土壤SON累积量较长时间内无明显增加[12]。可见,氮肥类型对SON累积量具有显著影响。但目前的研究主要集中于不同氮肥对农田系统中SON含量的影响方面,而不同氮肥施用后对水稻土VSON的研究鲜见报道,有关紫云英施用对水稻土VSON的影响及该过程中微生物的作用仍待进一步研究。因此,本研究以南方典型的灰黄泥田水稻土为研究对象,分析水稻生育期不同施肥方式(单施化肥、化肥配施紫云英和单施紫云英)下土壤VSON的差异及VSON对细菌群落的响应,为完善水田生态系统SON转化过程提供科学依据。
1 材料与方法 1.1 试验地概况试验地位于福建省闽侯县白沙镇(119°04'10"E,26° 13' 31" N),该地属于亚热带气候,年均气温19.5 ℃,年均降水量1 350 mm,年日照时数1 812.5 h。试验地土壤类型为灰黄泥田,成土母质为中性岩红壤,质地类型为壤质黏土。耕层土壤的初始基本理化性质为:pH 5.53,有机质含量17.65 g·kg-1,碱解氮含量29.95 mg·kg-1,速效磷含量20.85 mg·kg-1,速效钾含量96.65 mg·kg-1。
1.2 试验设计根据当地的施肥模式及紫云英的常规施用量,试验设置单施化肥(对照,CK)、紫云英配施化肥(紫云英翻压量30 000 kg·hm-2,CMV1)、单施紫云英(紫云英翻压量45 000 kg·hm-2,CMV2)3种处理,每种处理设置3个重复,小区面积为12 m2(3 m×4 m),采用随机区组排列。试验采用等氮磷钾的施肥方案,施用的化肥为尿素481.7 kg·hm-2、过磷酸钙900 kg·hm-2和氯化钾300 kg·hm-2,尿素和氯化钾的50%作基肥(紫云英翻压后第9 d),50% 作分蘖肥施用(紫云英翻压后第25 d),过磷酸钙均作基肥施用。供试紫云英品种为闽紫7号,于2017年10月21日种植,2018年4月6日紫云英盛花期收获后进行异地翻压。紫云英干物质中有机质、全氮、全磷和全钾的含量分别为752.75、30.94、5.91 g·kg-1和32.47 g·kg-1,含水量为90%。施用紫云英处理中氮磷钾不足的部分在施用基肥时用化肥补齐。试验区种植再生稻,品种为Ⅱ优673,于紫云英翻压后第10 d移栽,株距20 cm,行距15 cm,水稻农事管理措施与当地保持一致。
1.3 样品采集与处理在紫云英翻压后10 d(水稻移栽期)、17 d(水稻幼苗期)、24、38 d(水稻分蘖期)、59、80 d(水稻扬花期)、101、122 d(水稻成熟期)分别采用梅花形采样法采集各处理耕层土壤(0~20 cm)样品。去除土样中的侵入体、植物残体和根系并混合均匀后,采用棋盘式采样法将样品分为两份,一份鲜样直接用于土壤SON测定,另一份鲜样用于水稻生育期土壤细菌数量和群落分析。
1.4 测定项目与方法 1.4.1 土壤SON测定土壤SON采用差减法测定。称取5 g新鲜土样于50 mL三角瓶中,根据土水比1∶5加入蒸馏水后置于恒温振荡器中70 ℃浸提18 h,浸提液采用0.45 μm滤膜过滤。滤液中的可溶性总氮(TSN)和SIN(NH+4-N、NO3--N、NO2--N之和)分别采用带有氮检测器的总有机碳分析仪(TOC-L,Shimadzu,日本)和连续流动注射分析仪(Flowsys,Systea,意大利)进行测定。土壤SON通过TSN和SIN差减法获得,即SON=TSN-SIN[13]。
1.4.2 土壤DNA提取与实时荧光定量PCR称取0.25 g新鲜土壤,参照PowerSoil DNA试剂盒(MoBio Laboratories,美国)的具体方法和步骤提取土壤DNA。提取得到的DNA样品用1% 琼脂糖凝胶电泳和分光光度法(260 nm/280 nm光密度比)进行检测。采用引物515F和806R对土壤细菌16S rRNA基因进行实时荧光定量扩增,测定细菌16S rRNA基因拷贝数。反应体系构成:1 μL模板DNA,5 μL 2× SYBR Premix Ex TaqTM,正反向引物(10 μmol·L-1)各0.5 μL、3 μL ddH2O。荧光定量采用两步法进行,具体条件为94 ℃预变性5 min,94 ℃ 30 s、55 ℃ 30 s、72 ℃ 30 s,30个循环,循环结束后72 ℃延伸10 min。提取质粒作为制备标准曲线的标准品,建立定量标准曲线,具体方法参考文献[14]。
1.4.3 高通量测序及数据分析通过Illumina Miseq PE300高通量测序平台,采用338F和806R引物对细菌16S rRNA基因的V3~V4区进行PCR扩增和测序[15]。PCR反应体系:2 μL模板DNA,正反向引物(5 μmol·L-1)各0.5 μL,12.5 μL 2×Taq PCR MasterMix,3 μL BSA(2 ng·μL-1),5.5 μL ddH2O。反应参数:95 ℃预变性5 min;95 ℃变性45 s、55 ℃退火50 s、72 ℃延伸45 s,32个循环;72 ℃延伸10 min。测序原始序列上传至NCBI的SRA数据库。测序结束后,对原始下机数据进行质控处理。使用QIIME(v1.8.0)软件对原始序列进行过滤、拼接、去除嵌合体,去除引物错配或测序长度小于150 bp的序列[14]。根据Barcodes归类将各处理组序列信息划分为用于物种分类的OTU(Operational taxonomic units),OTU相似性设为97%。对比Silva数据库,得到每个OTU对应的物种分类信息,并用于后续分析。
1.5 数据统计与分析利用Excel 2007和SPSS 19.0软件进行数据统计分析、Origin 2019和R 3.5.1软件作图,采用单因素方差分析法(One-way analysis of variance,ANOVA)对不同处理间差异显著性进行分析,水稻生育期耕层土壤SON含量及其变化速率采用Origin 2019软件进行拟合计算,耕层土壤VSON对细菌群落结构的响应采用CANOCO 4.5统计软件中的冗余分析方法(RDA)分析。
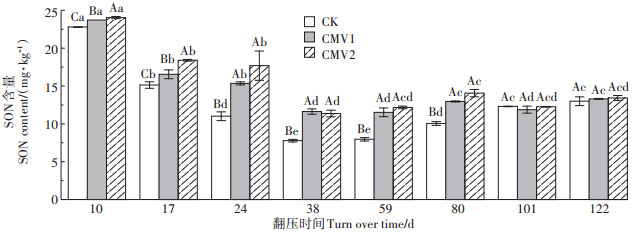
2 结果与分析 2.1 耕层土壤SON含量及其变化速率 2.1.1 不同施肥处理耕层土壤SON含量水稻生育期内不同施肥处理耕层土壤SON含量变化均呈"快速下降-缓慢波动-趋于平稳"的变化趋势(图 1)。紫云英翻压10 d(移栽期),不同施肥处理土壤SON含量达到峰值,CK、CMV1和CMV2处理的SON含量分别较其他时期高50.63%~192.94%、43.29%~105.73% 和30.59%~111.44%(P<0.05);紫云英翻压38 d(分蘖期),CK、CMV1和CMV2处理土壤SON含量最低,仅分别为移栽期的34.14%、49.04%和47.29%。水稻生育期内CMV1和CMV2处理土壤SON含量均值分别较CK处理高16.90%和20.02%,水稻生长中前期(0~80 d),CMV1和CMV2处理土壤SON含量均显著高于CK处理,而水稻生长后期(101~122 d),不同施肥处理间土壤SON含量无显著差异。可见,施用紫云英能够显著增加水稻生育中前期耕层土壤的SON含量,且在移栽期达到峰值。
|
不同大写字母表示不同施肥处理间差异显著,不同小写字母表示不同生育期间差异显著(P<0.05)。下同 Different capital letters show significant differences among treatments, and different lowercase letters show significant differences among sampling time(P < 0.05). The same below 图 1 水稻生育期不同施肥处理耕层土壤SON含量 Figure 1 SON content of topsoil under different fertilization treatments in the rice growth period |
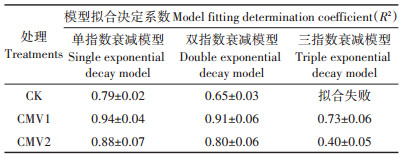
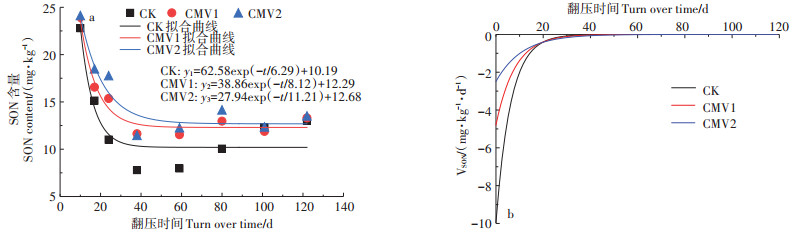
根据水稻生育期内耕层土壤SON含量呈快速下降-缓慢波动-趋于平稳的变化趋势,分别采用单指数衰减、双指数衰减和三指数衰减模型对土壤SON含量变化进行拟合,结果表明单指数衰减模型拟合试验数据的R2最接近于1(表 1),表明采用单指数衰减模型对供试土壤SON含量变化的拟合效果最佳,CK、CMV1和CMV2处理水稻土耕层土壤SON含量(y)随时间(t)变化的单指数衰减拟合模型分别为y1= 62.58exp(-t/6.29)+10.19,y2=38.86exp(-t/8.12)+12.29和y3=27.94exp(-t/11.21)+12.68(图 2a)。通过对上述最佳拟合曲线进行求导,获得CK、CMV1和CMV2处理水稻生育期内耕层土壤SON含量变化速率(y') 随时间(t)的模型分别为y'1=-9.95exp(-t/6.29),y'2= -4.79exp(-t/8.12)和y'3=-2.49exp(-t/11.21)(图 2b)。
|
|
表 1 水稻生育期耕层土壤SON含量变化的不同模型拟合效果 Table 1 Fitting effects of different models on variation of SON content in topsoil during the rice growth period |
|
图 2 水稻生育期不同施肥处理耕层土壤SON含量变化曲线(a)及变化速率(b) Figure 2 SON content variation curve(a)and variation rate(b)of topsoil under different fertilization treatments in the rice growth period |
由不同处理土壤SON含量及其变化速率曲线可以看出(图 2),不同施肥处理耕层土壤SON含量在水稻生育前期(0~24 d)呈快速下降趋势,其中以移栽期土壤VSON值最大,不同施肥处理VSON值介于1.02~2.02 mg·kg-1·d-1之间,是幼苗期的1.87~3.04倍。CK处理土壤SON含量下降速率最快,水稻生育期内CK处理VSON分别是CMV1和CMV2处理的1.29倍和1.50倍。可见,水稻生育前期耕层土壤SON含量降低速率较快,施用紫云英能够减缓耕层土壤SON含量的变化速率,在一定时期内维持耕层土壤中SON含量的相对稳定。
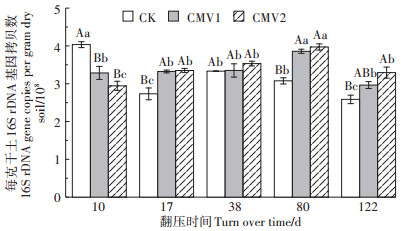
2.2 耕层土壤细菌数量、多样性及其与SON变化速率的关系 2.2.1 耕层土壤细菌数量水稻生育期不同施肥处理耕层土壤细菌数量具有一定差异(图 3)。CK处理移栽期耕层土壤细菌数量较CMV1和CMV2处理分别显著增加22.77% 和37.01%(P<0.05);幼苗期耕层土壤细菌数量显著降低,CK处理幼苗期耕层土壤细菌数量较移栽期显著降低了32.27%。施用分蘖肥后,耕层土壤细菌数量呈先逐渐升高后降低的变化规律。随着紫云英的不断腐解,水稻生育期内施用紫云英处理的耕层土壤细菌数量逐渐增加,且随施用量的增加而增大,并于扬花期达到峰值,CMV1和CMV2处理水稻扬花期土壤细菌数量分别较CK处理显著提高25.44% 和29.15%(P<0.05)。可见,施肥能够显著增加耕层土壤细菌数量,CK处理耕层土壤细菌数量波动较大,而施用紫云英处理耕层土壤细菌数量随水稻生育期推移逐渐增加。
|
图 3 水稻生育期不同施肥处理耕层土壤细菌数量 Figure 3 The bacterial biomass of topsoil under different fertilization treatments in the rice growth period |
水稻移栽期和分蘖期CK处理耕层土壤细菌Chao1指数显著低于其他生育期,而施用紫云英处理的细菌Chao1指数均有一定程度提高(图 4a)。分蘖期CMV1和CMV2处理细菌Chao1指数显著高于CK处理,较CK处理分别提高61.83% 和33.03%,但其他时期不同施肥处理间细菌Chao1指数无显著差异。不同施肥处理间耕层土壤细菌Shannon指数无显著差异。成熟期不同施肥处理细菌Shannon指数最高,CK、CMV1和CMV2处理的细菌Shannon指数分别较移栽期显著提高22.22%、20.52%和26.02%。可见,不同施肥处理对耕层土壤细菌丰富度和多样性具有一定影响,单施化肥可显著抑制耕层土壤细菌群落的丰富度,而施用紫云英则会有一定的减缓作用,不同施肥处理成熟期耕层土壤细菌群落的多样性显著提高。
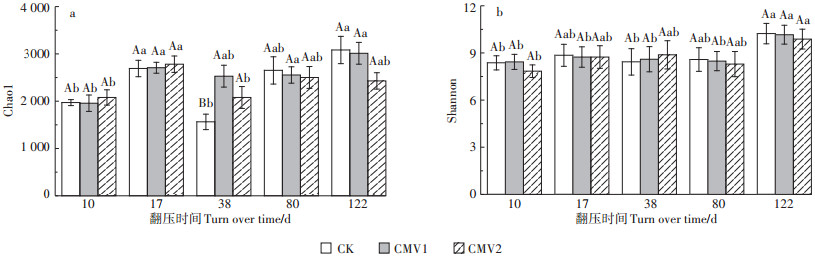
|
图 4 水稻生育期不同施肥处理耕层土壤细菌多样性指数 Figure 4 The bacterial diversity of topsoil under different fertilization treatments in the rice growth period |
如表 2所示,相关性分析结果表明,耕层土壤细菌Shannon指数和Chao1与VSON呈极显著负相关,相关系数分别为-0.461和-0.430,而细菌数量与VSON无显著相关,相关系数仅为0.128。可见,耕层土壤细菌物种数目和多样性提高,可显著减缓土壤SON的变化速率,而细菌数量对VSON无显著影响。
|
|
表 2 水稻生育期不同施肥处理细菌数量及多样性与VSON的相关分析 Table 2 Correlation analysis between bacterial biomass and diversity and the VSON under different fertilization treatments in the rice growth period |
水稻生育期内不同施肥处理耕层土壤细菌群落门水平以变形菌门(Proteobacteria)、绿弯菌门(Chloro⁃ flexi)、酸杆菌门(Acidobacteria)和放线菌门(Actino⁃ bacteria)为主,合计相对丰度达79.30%~90.90%(图 5a)。成熟期耕层土壤绿弯菌门和酸杆菌门生长较旺盛,而变形菌门和放线菌门的生长则受到抑制。与CK处理相比,水稻生育期内CMV2处理土壤变形菌门相对丰度均值显著降低19.60%,放线菌门相对丰度均值显著增加28.93%,绿弯菌门和酸杆菌门无显著差异,而CMV1处理4种菌群均与CK处理无显著差异。在科水平(图 5b),水稻生长发育中前期(0~80 d)耕层土壤细菌均以草酸杆菌科(Oxalobacteraceae)、微球菌科(Micrococcaceae)和Acidobacteriaceae_(Subgroup_1) 科为主,合计相对丰度达29.30%~50.90%,而成熟期耕层土壤草酸杆菌科和微球菌科生长受到抑制,未出现明显的优势菌种。与CK处理相比,水稻生育期内CMV2处理土壤草酸杆菌科相对丰度均值显著降低45.09%,微球菌科相对丰度均值显著增加39.67%,Ac⁃ idobacteriaceae_(Subgroup_1)科无显著差异,而CMV1处理3种菌群均与CK处理无显著差异。
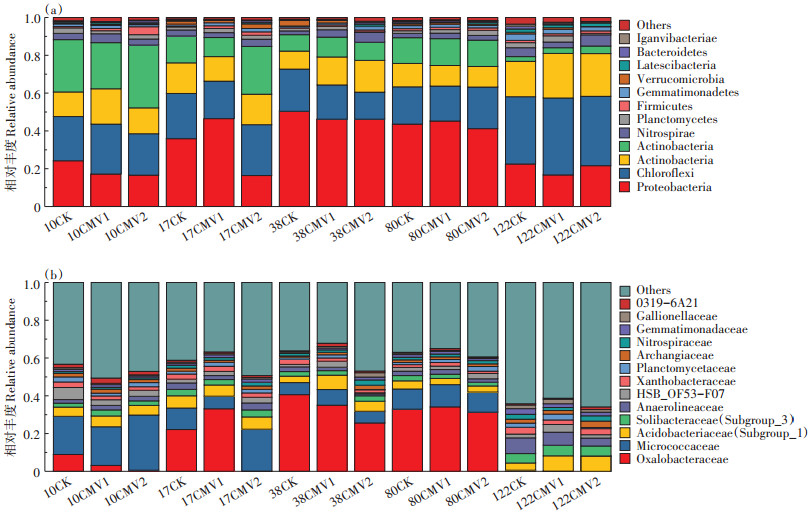
|
图 5 水稻生育期不同施肥处理耕层土壤细菌门水平(a)和科水平(b)相对丰度 Figure 5 Relative abundances of bacteria at the phylum level (a) and family level (b) of topsoil under different fertilization treatments in the rice growth period |
水稻生育期VSON与细菌门水平相对丰度的冗余分析结果表明(图 6a),第一和第二排序轴分别解释了土壤VSON变异的86.0%和6.2%,说明前两排序轴尤其是第一排序轴可较好地反映土壤VSON与细菌门水平的关系。在13个门水平的细菌群落中,放线菌门相对丰度与第一排序轴呈最大正相关(r=0.834),变形菌门相对丰度与第一排序轴呈最大负相关(r=-0.568)。水稻生育期VSON与细菌科水平相对丰度的冗余分析结果表明(图 6b),第一排序轴和第二排序轴分别解释了土壤VSON变异的90.5% 和7.1%,累积解释了97.6% 的土壤VSON变异。在14个科水平的细菌群落中,微球菌科相对丰度与第一排序轴呈最大正相关(r=0.790),0319-6A21科相对丰度与第一排序轴呈最大负相关(r=-0.552),其次为草酸杆菌科(r=-0.490)。可见,水稻生育期内放线菌门和微球菌科的相对丰度与VSON呈显著正相关,而变形菌门和草酸杆菌科的相对丰度与VSON呈显著负相关。

|
图 6 水稻生育期耕层土壤VSON与微生物门(a)和科(b)水平相对丰度的冗余分析 Figure 6 Redundancy analysis (RDA) ordination of topsoil VSON and relative abundance of bacterial phylum level (a) and family level (b) under different fertilization treatments in the rice growth period |
由于不同施肥处理间差异物种的影响均较小(LDA差异分析的对数得分值均<3.0),因此本研究仅对不同生育期耕层土壤具有显著性差异的关键细菌菌群进行LEfSe分析。结果表明(图 7),5个时期共有12个显著性差异物种,其中,移栽期4个,分蘖期3个,成熟期5个。水稻移栽期耕层土壤放线菌门、放线菌纲(Actinobacteria)、微球菌目(Micrococcales)、微球菌科的相对丰度较高;分蘖期耕层土壤变形菌门、伯克氏菌目(Burkholderiales)、草酸杆菌科的相对丰度最高。而绿弯菌门、酸杆菌门的索利氏菌纲(Solibacteres)、索利氏菌目(Solibacterales)、Solibacteraceae Subgroup_3科和变形菌门的a-变形菌纲(Alphaproteobacteria)是成熟期耕层土壤较丰富的菌群。水稻幼苗期和扬花期耕层土壤细菌科水平上无显著差异菌群。可见,耕层土壤细菌显著差异物种的组成因水稻生育期不同而异。
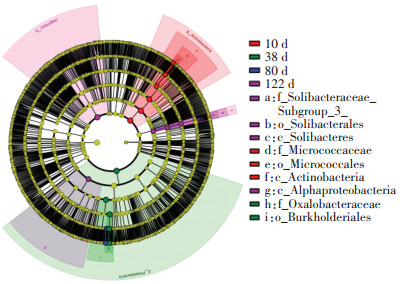
|
进化分支图展示了样本群落中门至种的分类级别(由内至外依次排列);节点直径大小对应相对丰度大小。未分类和未培养的细菌种属未体现 The branch diagram shows the taxonomic level from phylum to species (from inside to outside)in the sample community. The node diameter corresponds to the relative abundance. Unclassified and uncultured bacterial species are not reflected 图 7 水稻不同生育期土壤细菌群落间LEfSe分析的分支图 Figure 7 Diagram based on linear discriminant analysis effect size (LEfSe) analysis of soil bacterial communities during the different rice growth periods |
不同生育期耕层土壤VSON和显著性差异物种相对丰度的相关分析结果表明(图 8),移栽期耕层土壤VSON与微球菌目、微球菌科的相对丰度呈极显著正相关,与伯克氏菌目、草酸杆菌科的相对丰度呈极显著负相关。分蘖期耕层土壤VSON与索利氏菌纲、索利氏菌目、Solibacteraceae Subgroup_3科的相对丰度均呈极显著正相关,与伯克氏菌目、草酸杆菌科的相对丰度呈极显著负相关。成熟期耕层土壤VSON与放线菌门的相对丰度呈极显著正相关。可见,在水稻移栽期土壤VSON对微球菌科和草酸杆菌科的响应较为敏感,分蘖期土壤VSON对草酸杆菌科、绿弯菌门和Solibacte⁃ raceae Subgroup_3科的响应较为敏感,而成熟期土壤VSON则对放线菌门的响应更为敏感。
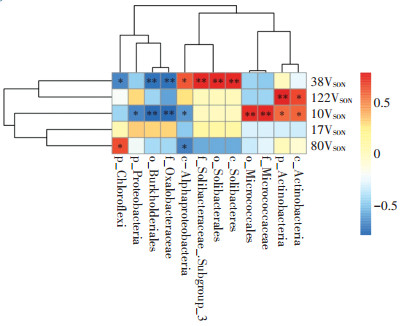
|
图 8 显著性差异物种相对丰度与耕层土壤VSON的相关性 Figure 8 Correlation between relative abundance of biomarkers and topsoil VSON |
土壤SON是土壤氮库中最活跃的组分之一,其转化速率与土壤氮素有效性密切相关。刘春增等[10]的研究表明,单施紫云英和紫云英配施化肥均可显著提高土壤SON的含量。本研究结果也表明施用紫云英可显著增加稻田土壤SON含量(图 1),降低VSON(图 2),且紫云英施用量越大影响越明显。究其原因是因为CMV1处理中添加的尿素属于低分子量SON,其施入土壤后能被快速降解为无机氮,周转速度较快[16],导致SON含量快速降低;而CMV2处理中由于供试紫云英自身含有大量的蛋白质(193.4 g·kg-1)和酸解氨基酸(82.35 mg·kg-1),施入土壤后不但可快速增加土壤中SON含量,且有利于水稻生长,促进根系分泌物增加,从而刺激微生物生长[17];紫云英的施用向土壤输入了大量的外源有机质(CMV2和CMV1分别输入3 429.04 kg·hm-2和2 286.02 kg·hm-2外源有机质),这为土壤微生物活动提供了大量的能量和营养物质,增强了土壤微生物活性,加速有了机质分解产生低分子量SON[18],从而减缓土壤SON含量的变化,降低了VSON。然而,程会丹等[19]的研究表明紫云英翻压量超过22 500 kg·hm-2时,腐解产生的还原性气体和有害离子会使微生物数量降低,从而降低土壤SON含量,这与本研究结果有所差异,可能与土壤类型、有机无机肥配施比例及田间管理等不同有关。
水稻不同生育期耕层土壤VSON也各异。水稻生育前期耕层土壤SON含量快速降低,VSON变化大,其中以移栽期的VSON最高,这主要是由于水稻生长前期施入土壤中的紫云英分解处于营养控制阶段,有机物的分解和氮矿化过程迅速进行[20],导致不同施肥处理耕层土壤SON均快速周转。水稻分蘖期耕层土壤SON含量及变化速率降至最低,这可能是由于该时期紫云英所含的易分解可溶性有机物质已基本分解[21],致使土壤SON的补充减少,且该时期水稻生长旺盛,根系吸收无机氮和低分子量SON的能力增强[22],导致土壤SON含量和变化速率下降。分蘖期后VSON逐渐平稳并趋于0,主要是由于水稻生长后期紫云英的分解处于木质素控制阶段,分解速率缓慢并停留在一个较低的水平[20],因此水田耕层土壤的VSON低。
3.2 耕层土壤VSON对细菌的响应VSON主要取决于土壤有机氮矿化为SON及SON通过氨化作用产生NH4+-N的过程,且均受微生物调控。本研究结果表明土壤细菌群落结构多样性与耕层土壤VSON呈极显著负相关,这可能是由于微生物多样性的提高利于有机氮分解[23],从而提高了土壤SON的保留量,降低了土壤VSON。土壤微生物群落组成是调控土壤SON含量的主要因素[24]。本研究冗余分析结果表明,放线菌门微球菌科相对丰度与VSON呈正相关,变形菌门草酸杆菌科相对丰度与VSON呈负相关,表明放线菌门微球菌科可能与SON的累积显著相关,而草酸杆菌科则可能与SON的分解显著相关。草酸杆菌科是与有机质降解有关的细菌群落,其参与植物残体的矿化[25],能够将土壤有机质降解为低分子量有机氮如氨基酸、氨基糖等,从而提高SON的保留量,降低VSON。而微球菌科参与易分解有机化合物(如蛋白质、多肽和断链碳水化合物等)的降解[25],促进SON的分解转化。
水稻不同生育期土壤中差异性微生物有所不同,导致VSON也有所差异。水稻移栽期耕层土壤中微球菌科富集,其丰度与VSON呈极显著正相关(图 8),这一时期微球菌科的富集主要是由于该科中Pseudarthrobacter属(数据未显示)的显著富集促进了SON的周转。Liu等[26]的研究发现Pseudarthrobacter有利于提高土壤NH4+-N的含量,本研究中水稻移栽期不同施肥处理NH4+-N的含量较背景土壤显著提高了4.25~ 6.59 mg·kg-1。Pseudarthrobacter原名节杆菌(Arthrobacter),其可促进有机氮分解为氨[27],从而加速SON的转化。冗余分析结果也表明微球菌科丰度与VSON呈正相关,且主要作用于水稻生育前期。水稻分蘖期耕层土壤中草酸杆菌科富集,其丰度与VSON呈极显著负相关(图 8),该时期草酸杆菌科富集主要是由于该科的Massilia属富集,这与Obermeier等[28]的研究结果一致。Massilia被认为是农业土壤中几丁质的初级降解者之一[29],其可将几丁质分解为低分子量SON(N- 乙酰葡糖胺),从而提高土壤SON的保留量,降低VSON。VSON和差异性细菌菌群相对丰度的相关分析结果表明,分蘖期VSON还与酸杆菌门中的Solibacterace⁃ ae Subgroup_3科呈极显著正相关,这可能是由于水稻分蘖期追施氮肥,导致不同施肥处理土壤pH较幼苗期显著减低0.20~0.31个单位,酸性土壤环境有利于酸杆菌门细菌的代谢活动[30]。研究表明酸杆菌门在氮循环中起重要作用,其可降低土壤中硝酸盐和亚硝酸盐含量[31]。水稻分蘖期不同施肥处理硝酸盐含量较移栽期降低1.91~6.57 mg·kg-1,SON转化产物降低,促进了SON的转化。此外,研究表明酸杆菌门与土壤脲酶显著相关,其可能是土壤脲酶的重要来源,可促进尿素分解,从而加速SON的转化[32]。水稻分蘖期后,VSON逐渐平稳并于水稻成熟期趋于0。水稻成熟期差异性菌群相对丰度与VSON的相关性结果表明,放线菌门与VSON呈极显著相关,而与微球菌目无显著相关性,表明水稻成熟期VSON对放线菌门的响应较为敏感,但响应敏感的具体科属还有待进一步研究。
4 结论(1) 水田耕层土壤可溶性有机氮变化速率受外源有机物料输入及水稻生育期的显著影响,紫云英还田能够显著减缓水田耕层土壤可溶性有机氮的下降速率。
(2) 水稻生育期内耕层土壤可溶性有机氮变化速率呈"快速降低-缓慢波动-趋于平稳"的变化趋势,其中以水稻移栽期的可溶性有机氮变化速率最高。
(3) 水稻生育期内耕层土壤可溶性有机氮变化速率与细菌群落多样性和丰富度显著相关,且对微生物种群的响应因水稻生育期而异。
| [1] |
MURPHY D V, MACDONALD A J, STOCKDALE E A, et al. Soluble organic nitrogen in agricultural soils[J]. Biology and Fertility of Soils, 2000, 30(5): 374-387. |
| [2] |
王文颖, 刘俊英. 植物吸收利用有机氮营养研究进展[J]. 应用生态学报, 2009, 20(5): 1223-1228. WANG W Y, LIU J Y. Research advances in organic nitrogen acquisition by plants[J]. Chinese Journal of Applied Ecology, 2009, 20(5): 1223-1228. |
| [3] |
SCHIMEL J P, BENNETT J. Nitrogen mineralization: Challenges of a changing paradigm[J]. Ecology, 2004, 85(3): 591-602. DOI:10.1890/03-8002 |
| [4] |
GEISSELER D, HORWATH W R, JOERGENSEN R G, et al. Pathways of nitrogen utilization by soil microorganisms: A review[J]. Soil Biology and Biochemistry, 2010, 42(12): 2058-2067. DOI:10.1016/j.soilbio.2010.08.021 |
| [5] |
赵彤, 蒋跃利, 闫浩, 等. 土壤氨化过程中微生物作用研究进展[J]. 应用与环境生物学报, 2014, 20(2): 315-321. ZHAO T, JIANG Y L, YAN H, et al. Research advances on microbial function in soil ammonifying process[J]. Chinese Journal of Applied and Environmental Biology, 2014, 20(2): 315-321. |
| [6] |
JONES D L, HEALEY J R, WILLETT V B, et al. Dissolved organic nitrogen uptake by plants: An important N uptake pathway?[J]. Soil Biology and Biochemistry, 2005, 37(3): 413-423. DOI:10.1016/j.soilbio.2004.08.008 |
| [7] |
JIANG L, WANG S, LUO C Y, et al. Effects of warming and grazing on dissolved organic nitrogen in a Tibetan alpine meadow ecosystem[J]. Soil & Tillage Research, 2016, 158: 156-164. |
| [8] |
XING S H, ZHOU B Q, ZHANG L M, et al. Evaluating the mechanisms of the impacts of key factors on soil soluble organic nitrogen concentrations in subtropical mountain ecosystems[J]. Science of the Total Environment, 2019, 651(2): 2187-2196. |
| [9] |
SU M Z, ZHANG J T, HUO S L, et al. Microbial bioavailability of dissolved organic nitrogen(DON) in the sediments of Lake Shankou, northeastern China[J]. Journal of Environmental Sciences, 2016, 42(4): 79-88. |
| [10] |
刘春增, 常单娜, 李本银, 等. 种植翻压紫云英配施化肥对稻田土壤活性有机碳氮的影响[J]. 土壤学报, 2017, 54(3): 657-669. LIU C Z, CHANG D N, LI B Y, et al. Effects of planting and incorporation of Chinese milk vetch coupled with application of chemical fertilizer on active organic carbon and nitrogen in paddy soil[J]. Acta Pedologica Sinica, 2017, 54(3): 657-669. |
| [11] |
SHANG F Z, REN S M, YANG P L, et al. Effects of different fertilizer and irrigation water types, and dissolved organic matter on soil C and N mineralization in crop rotation farmland[J]. Water, Air, and Soil Pollution, 2015, 226(12): 396. DOI:10.1007/s11270-015-2667-0 |
| [12] |
沈玉芳, 陶武辉, 李世清. 有机物料输入对干润砂质新成土可溶性有机碳、氮的影响[J]. 农业环境科学学报, 2011, 30(1): 139-145. SHEN Y F, TAO W H, LI S Q. Effects of exogenous organic materials on dissolved organic carbon and nitrogen in ust sandic entisols[J]. Journal of Agro-Environment Science, 2011, 30(1): 139-145. |
| [13] |
CHEN C R, XU Z H, ZHANG S L, et al. Soluble organic nitrogen pools in forest soils of subtropical Australia[J]. Plant and Soil, 2005, 277(1/2): 285-297. DOI:10.1007/s11104-005-7530-4 |
| [14] |
袁红朝, 吴昊, 葛体达, 等. 长期施肥对稻田土壤细菌、古菌多样性和群落结构的影响[J]. 应用生态学报, 2015, 26(6): 210-216. YUAN H C, WU H, GE T D, et al. Effects of long-term fertilization on bacterial and archaeal diversity and community structure within subtropical red paddy soils[J]. Chinese Journal of Applied Ecology, 2015, 26(6): 210-216. |
| [15] |
HUSE S M, HUBER J A, MORRISON H G, et al. Accuracy and quality of massively parallel DNA pyrosequencing[J]. Genome Biology, 2007, 8(7): 143. DOI:10.1186/gb-2007-8-7-r143 |
| [16] |
田飞飞, 纪鸿飞, 王乐云, 等. 施肥类型和水热变化对农田土壤氮素矿化及可溶性有机氮动态变化的影响[J]. 环境科学, 2018, 39(10): 4717-4726. TIAN F F, JI H F, WANG L Y, et al. Effects of various combinations of fertilizer, soil moisture, and temperature on nitrogen mineralization and soluble organic nitrogen in agricultural soil[J]. Environmental Science, 2018, 39(10): 4717-4726. |
| [17] |
袁铭章, 刘树堂, 陈延玲, 等. 16S rDNA扩增子测序揭示长期定位秸秆还田对土壤细菌群落的影响[J]. 华北农学报, 2016, 31(6): 157-163. YUAN M Z, LIU S T, CHEN Y L, et al. Illumina amplicon sequencing of 16S rDNA tag reveals bacteria community development of long-term straw returning soil[J]. Acta Agriculture Boreali-Sinica, 2016, 31(6): 157-163. |
| [18] |
PROSSER J I. Molecular and functional diversity in soil micro-organisms[J]. Plant and Soil, 2002, 244(1/2): 9-17. DOI:10.1023/A:1020208100281 |
| [19] |
程会丹, 鲁艳红, 聂军, 等. 减量化肥配施紫云英对稻田土壤碳、氮的影响[J]. 农业环境科学学报, 2020, 39(6): 1259-1270. CHENG H D, LU Y H, NIE J, et al. Effects of reducing chemical fertilizer combined with Chinese milk vetch on soil carbon and nitrogen in paddy fields[J]. Journal of Agro-Environment Science, 2020, 39(6): 1259-1270. |
| [20] |
BERG B. Nutrient release from litter and humus in coniferous forest soils: A mini review[J]. Scandinavian Journal of Forest Research, 1986, 1(4): 359-369. |
| [21] |
王飞, 林诚, 李清华, 等. 亚热带单季稻区紫云英不同翻压量下有机碳和养分释放特征[J]. 草业学报, 2012, 21(4): 319-324. WANG F, LIN C, LI Q H, et al. A study on organic carbon and nutrient releasing characteristics of different Astragalus sinicus manure use levels in a single cropping region of subtropical China[J]. Acta Prataculturae Sinica, 2012, 21(4): 319-324. |
| [22] |
MA Q X, WU L G, WANG J, et al. Fertilizer regime changes the competitive uptake of organic nitrogen by wheat and soil microorganisms: An in-situ uptake test using 13C, 15N labelling, and 13C-PLFA analysis[J]. Soil Biology and Biochemistry, 2018, 125: 319-327. DOI:10.1016/j.soilbio.2018.08.009 |
| [23] |
MARON P A, SARR A, KAISERMANN A, et al. High microbial diversity promotes soil ecosystem functioning[J]. Applied and Environmental Microbiology, 2018, 84(9): 1-13. |
| [24] |
XING S H, CHEN C R, ZHANG H. Genotype and slope position control on the availability of soil soluble organic nitrogen in tea plantations[J]. Biogeochemistry, 2011, 103: 245-261. DOI:10.1007/s10533-010-9460-3 |
| [25] |
CRUZ-BARR & #211;N M D, CRUZ-MENDOZA A, NAVARRO-NOYA Y E, et al. The bacterial community structure and dynamics of carbon and nitrogen when maize(Zea mays L.)and its neutral detergent fibre were added to soil from zimbabwe with contrasting management practices[J]. Microbial Ecology, 2017, 73(1): 135-152. DOI:10.1007/s00248-016-0807-8 |
| [26] |
LIU N, SHAO C, SUN H, et al. Arbuscular mycorrhizal fungi biofertilizer improves American ginseng(Panax quinquefolius L.)growth under the continuous cropping regime[J]. Geoderma, 2020, 363: 114155. DOI:10.1016/j.geoderma.2019.114155 |
| [27] |
王小花, 黄莺, 陈雪, 等. 植烟土壤高活性氨化菌的筛选鉴定及其氨化能力分析[J]. 中国烟草科学, 2019, 40(3): 31-38. WANG X H, HUANG Y, CHEN X, et al. Screening, identification and ammoniation ability analysis of high activity ammonia bacteria in tobacco growing soil[J]. Chinese Tobacco Science, 2019, 40(3): 31-38. |
| [28] |
OBERMEIER M M, GN ÄDINGER F, DURAI Raj A C, et al. Under temperate climate, the conversion of grassland to arable land affects soil nutrient stocks and bacteria in a short term[J]. Science of the Total Environment, 2020, 703: 135494. DOI:10.1016/j.scitotenv.2019.135494 |
| [29] |
WIECZOREK A S, SCHMIDT O, CHATZINOTAS A, et al. Ecological functions of agricultural soil bacteria and microeukaryotes in chitin degradation: A case study[J]. Frontiers in Microbiology, 2019, 10: 1-13. DOI:10.3389/fmicb.2019.00001 |
| [30] |
丁新景, 黄雅丽, 敬如岩, 等. 基于高通量测序的黄河三角洲4种人工林土壤细菌结构及多样性研究[J]. 生态学报, 2018, 38(16): 5857-5864. DING X J, HUANG Y L, JING R Y, et al. Bacterial structure and diversity of four plantations in the Yellow River Delta by high -throughput sequencing[J]. Acta Ecologica Sinica, 2018, 38(16): 5857-5864. |
| [31] |
刘彩霞, 董玉红, 焦如珍. 森林土壤中酸杆菌门多样性研究进展[J]. 世界林业研究, 2016, 29(6): 17-22. LIU C X, DONG Y H, JIAO R Z. Research progress in acidobacteria diversity in forest soil[J]. World Forestry Research, 2016, 29(6): 17-22. |
| [32] |
李冰, 李玉双, 陈琳, 等. 沈北新区不同利用类型土壤脲酶活性及其影响因素分析[J]. 生态科学, 2019, 38(3): 1-8. LI B, LI Y S, CHEN L, et al. Change characteristics and influencing factors of soil urease activity in different types of land in Shenyang North New Area[J]. Ecological Science, 2019, 38(3): 1-8. DOI:10.3969/j.issn.2095-7300.2019.03.001 |
 2021, Vol. 40
2021, Vol. 40