由于铅锌矿的开采、金属冶炼等工业生产活动,其周边农田土壤Pb含量超过正常范围,对环境造成污染[1]。《全国土壤污染状况调查公报》显示,Pb污染点位超标达到1.5%,已严重威胁到我国耕地安全[2]。Pb会影响植物的光合作用[3]、呼吸作用[4]、细胞代谢[5],引起植物生理功能紊乱,并降低农作物产量及品质[6]。利用植物去除土壤中的重金属是一种安全有效的方法,ZU等[7]发现云南矿区生长的本土植物小花南芥地上部Pb含量可达1 963.2 mg·kg-1,且富集系数和转运系数均大于1,可作为超富集植物有效修复Pb污染土壤。
重金属胁迫会导致植物矿质营养的缺乏,使其生理和代谢过程发生紊乱[8]。硫是一种植物必需的营养元素,在调节植物生长发育和生理代谢过程中发挥着重要作用[9]。其不仅能影响植物的生长和生理过程,还能改变重金属的累积特征,减缓重金属对植物的毒害[10]。李会合等[11]的研究表明,施硫促进了超累积植物东南景天对Cd的转运与累积,增加了东南景天的生物量。ZHANG等[12]的研究表明,施硫能减少水稻中Cd从根部到地上部的转运,降低水稻籽粒中Cd的浓度。王吉秀等[13]的研究表明,施硫促进了小花南芥对Pb的累积,提高了植株对Pb的富集系数和转运系数。
土壤中的硫以SO42-的形式被植物吸收,在植物体内经过一系列代谢过程生成半胱氨酸(Cys)[14]。植物以Cys为前体合成多种含硫化合物,如谷胱甘肽(GSH)、植物络合素(PCs)和金属硫蛋白(MTs)[15]。含硫化合物能与重金属螯合形成无毒或者低毒的螯合物,降低重金属的毒性[16]。植物硫代谢过程中调控合成含硫化合物的关键酶在抵御重金属胁迫时也起着至关重要的作用[17]。施加硫元素可以缓解或解除重金属胁迫对植物产生的毒害作用,但目前小花南芥体内含硫化合物如何缓解或解除Pb胁迫的机理尚不明确。
本研究选取云南会泽铅锌矿周边Pb污染土壤种植超富集植物小花南芥,通过外源添加不同浓度硫,研究其对土壤有效态Pb、小花南芥富集Pb、小花南芥体内含硫化合物和酶活性对Pb累积的影响,旨在探究外源添加硫元素条件下小花南芥体内的含硫化合物如何影响Pb富集的机理。
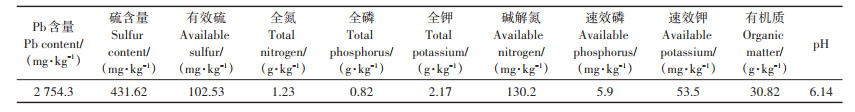
1 材料与方法 1.1 试验材料小花南芥(Arabis alpina L. var. Parviflora Franch):十字花科,南芥属,基生莲座状草本植物。小花南芥种子和试验用土采自云南省会泽铅锌矿区废弃地,试验用土基本理化性质见表 1,采样区位于103°03′ ~ 103°55′E,25°48′~26°28′N,海拔2 263~2 516 m。
|
|
表 1 试验用土基本理化性质 Table 1 Basic physical and chemical properties of test soil |
挑选大小一致且籽粒饱满的小花南芥种子,在云南农业大学后山大棚进行种子育苗,待幼苗长到3个月进行移栽。将长势一致的幼苗移栽到试验用土中,每盆(22 cm×17 cm)装4 kg土壤,移栽7株植物。采用Na2SO(4分析纯)配制浓度为0.59、1.18、1.78、2.37 mg·mL-1的溶液(以SO42-计),向土壤中喷施500 mL,使各处理土壤硫含量分别为0(CK)、50(S50)、100(S100)、150(S150)、200(S200)mg·kg-1。风干后再次混匀加快均质化过程,均质期20 d。每个处理设置3个重复,共计15盆。移栽培养60 d收集植物,分地上部、地下部制样备用,收集小花南芥根际土壤,自然风干后,过筛备用。
1.3 指标测定 1.3.1 试验土基本理化性质测定硫含量、有效硫、全氮、全磷、全钾、碱解氮、速效磷、速效钾、有机质和pH的测定参照《土壤农化分析》[18]。
1.3.2 生物量测定收获的植株样先用自来水反复冲洗,后用去离子水浸泡10 min,以除去植株根部吸附的Pb2+,最后再用去离子水洗净,用吸水纸吸干多余水分。将植株地上部和地下部置于105 ℃烘箱中杀青30 min,然后75 ℃烘干至恒质量,称取干质量,计算生物量。
1.3.3 土壤和植物Pb含量测定土壤Pb含量:称取过0.149 mm孔径筛的风干土0.5 g置于100 mL三角瓶中,用少量蒸馏水湿润土样,加王水(VHNO3∶VHCl=1∶3)5 mL,封口过夜,在石墨电热板(DB-2EFS)上低温加热至微沸(140~160 ℃),待棕色氮氧化物基本赶完后,取下冷却。沿壁加入5 mL高氯酸,继续加热至样品呈灰白色糊状,取下冷却。将消化好的溶液过滤到50 mL容量瓶中,用去离子水多次洗涤三角瓶,最后用去离子水定容。用火焰原子吸收分光光度计(Thermo ICE3000 SERIES)测定。
植物Pb含量:称取0.1 g植物干样于消解罐中,加入3 mL硝酸后过夜,第2 d加入2 mL 30% 过氧化氢,随后将消解罐放入140 ℃烘箱(DHG-9145A)消解4 h[19]。4 h后,取出冷却至室温。过滤到50 mL容量瓶中,后用去离子水定容。用火焰原子吸收分光光度计测定。
土壤有效态Pb含量:称取过2 mm孔径筛的风干土5 g置于50 mL离心管中,加入25 mL DTPA-TEA-CaCl(2pH 7.3)混合提取液,在(25±2)℃的室温下置于180 r·min-1的恒温摇床(TS-100C)上振荡2 h,离心过滤上清液,用火焰原子吸收分光光度计测定[20]。
富集系数等于植株地上部Pb含量(mg·kg-1)除以土壤Pb含量(mg·kg-1)。
转运系数等于植株地上部Pb含量(mg·kg-1)除以植株地下部Pb含量(mg·kg-1)。
1.3.4 植物体内含硫化合物含量及酶活性测定样本制备:称取地上部或地下部0.1 g鲜样于2 mL离心管中,加入提取液,置冰箱冰浴30 min,使用高通量组织研磨器(SCIENTZ-48)研磨成匀浆。然后置于高速冷冻离心机(HC-3018R)中冷冻离心,取上清液置冰上待测。
根据试剂盒说明书(购自苏州格锐思生物技术有限公司)使用紫外可见分光光度计(UV-5800)测定,谷氨酸(Glu):在340 nm读取吸光值。半胱氨酸(Cys):在710 nm读取吸光值。还原型谷胱甘肽(Reduced glutathione,GSH):在412 nm读取吸光值。氧化型谷胱甘肽(Oxidized glutathione,GSSG):在412 nm比色,记录立即读数和5 min后吸光值。γ-谷氨酰半胱氨酸(γ-GCS):在700 nm读取吸光值。谷胱甘肽还原酶(GR):在412 nm比色,记录30 s和10 min吸光值。谷胱甘肽过氧化物酶(Glutathione peroxidase,GPX):在412 nm读取吸光值。谷胱甘肽S-转移酶(GST):在340 nm比色,记录立即读数和10 min吸光值。
1.4 数据分析试验数据采用Excel对其整理与处理,采用SPSS 22.0软件进行单因素方差分析(One-way ANOVA)和差异显著性检验(Duncan,P < 0.05)及相关性分析(Pearson),采用Origin 2018绘图。图中数据用3个重复的平均值±标准偏差表示。
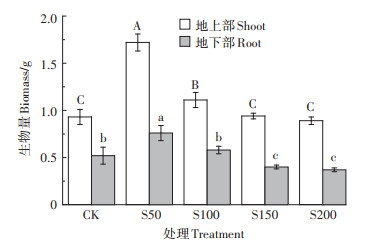
2 结果与分析 2.1 不同硫浓度对小花南芥生物量的影响不同硫浓度下,小花南芥生物量的变化如图 1所示。小花南芥地上部、地下部生物量呈现出随硫浓度的增加先增加后减少的趋势,且均在S50处理下达到最大值。与对照相比,小花南芥地上部生物量在S50和S100处理下分别增加了85.0% 和19.4%。小花南芥地下部生物量在S50处理下与对照相比存在显著差异(P < 0.05,下同),生物量增加了46.2%,而S100处理与对照相比无显著差异,且随着硫浓度的增加,地下部生物量显著降低,S150和S200处理时,分别降低23.1% 和28.9%。由此可以得出,不同硫浓度对小花南芥地上部生物量的影响大于地下部,说明小花南芥地上部对硫表现更敏感,且低硫处理对小花南芥生长有促进作用。
|
不同大写字母表示地上部处理间显著差异(P < 0.05),不同小写字母表示地下部处理间显著差异(P < 0.05)。下同 Different uppercase letters indicate significant differences among treatments in shoot(P < 0.05), different lowercase letters indicate significant differences among treatments in root(P < 0.05). The same below 图 1 不同硫浓度对小花南芥生物量的影响 Figure 1 Effects of different sulfur concentrations on the biomass of A. alpina |
不同硫浓度处理下土壤中有效态Pb含量存在明显变化(图 2)。S50和S100处理下,土壤中有效态Pb含量较对照降低了7.3% 和5.5%;S150和S200处理下,土壤中有效态Pb含量较对照提高了3.6% 和4.1%。总的来说,低硫处理使得土壤有效态Pb含量减少,高硫处理使得土壤有效态Pb含量增加,进而可能影响小花南芥对Pb的积累。

|
不同字母代表处理间差异显著(P < 0.05) Different letters indicate significant differences among treatments(P < 0.05) 图 2 不同硫浓度对土壤有效态Pb含量的影响 Figure 2 Effects of different sulfur concentrations on the content of available Pb in the soil |
由图 3可知,不同硫浓度对小花南芥地上部、地下部Pb含量有显著影响。小花南芥地上部Pb含量与对照相比分别降低了33.0%、12.5%、8.1% 和9.4%。硫处理为S50和S100时,小花南芥地下部Pb含量较对照降低8.1%和8.9%。硫处理为S150和S200时,地下部Pb含量较对照增加23.1% 和32.8%。小花南芥地上部、地下部Pb含量与土壤有效态Pb含量存在一定的关系。总的来说,外源添加硫抑制了小花南芥地上部对Pb的吸收;低硫处理抑制了小花南芥地下部对Pb的吸收,高硫处理促进了小花南芥地下部对Pb的吸收。
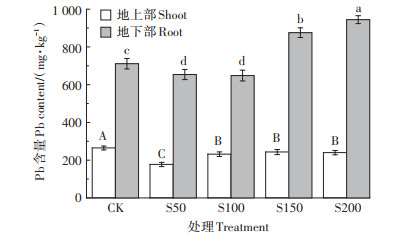
|
图 3 不同硫浓度对小花南芥Pb含量的影响 Figure 3 Effects of different sulfur concentrations on the content of Pb in A. alpine |
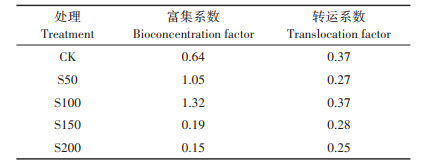
从表 2可知,不同硫浓度对小花南芥Pb累积特征的影响不同。当硫处理为S50和S100时,小花南芥富集系数都大于1,与对照相比增加0.6倍和1.1倍, 而当硫处理为S150和S200时,富集系数与对照相比反而下降70% 和77%。外源添加硫抑制了小花南芥对Pb的转运,当硫处理为S200时,小花南芥转运系数最小,较对照下降了32%。
|
|
表 2 不同硫浓度对小花南芥Pb富集系数与转运系数的影响 Table 2 Effects of different sulfur concentrations on the Pb bioconcentration factor and translocation factor of A. alpine |
不同硫浓度对小花南芥体内谷氨酸(Glu)和半胱氨酸(Cys)含量(以鲜质量计,下同)的影响见图 4。从图中可以看出不同硫浓度下,小花南芥地上部Glu含量随着硫浓度增加而增加,在S200处理下达最大值,为104.05 μg·g-1;地下部Glu含量随着硫浓度增加先增加后下降,在S100处理下达最大值,为216.26 μg·g-1。小花南芥地上部Cys含量随着硫浓度增加先增加后下降,在S150处理下达最大值,为93.58 mg· g-1;地下部Cys含量随着硫浓度增加而增加,在S200处理下达最大值,为114.04 mg·g-1。
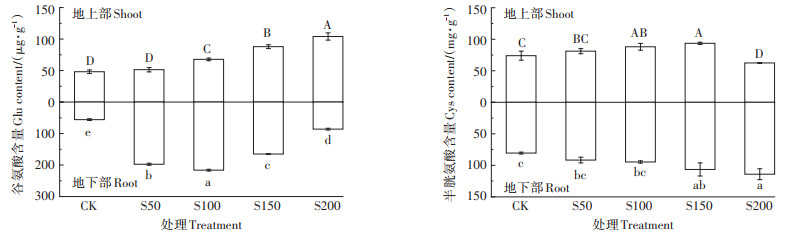
|
图 4 不同硫浓度对小花南芥体内谷氨酸和半胱氨酸含量的影响 Figure 4 Effects of different sulfur concentrations on the contents of Glu and Cys in A. alpina |
不同硫浓度对小花南芥体内还原型谷胱甘肽(GSH)和氧化型谷胱甘肽(GSSG)含量的影响见图 5。从图中可以看出不同硫处理下,小花南芥地上部GSH含量无显著差异;地下部GSH含量在S50处理下达最大值,为0.75 μmol·g-1,其他处理与对照之间无显著差异。小花南芥地上部、地下部GSSG含量都随着硫浓度增加先增加后下降,均在S100处理下达最大值,分别为28.92 nmol·g-1和28.09 nmol·g-1。
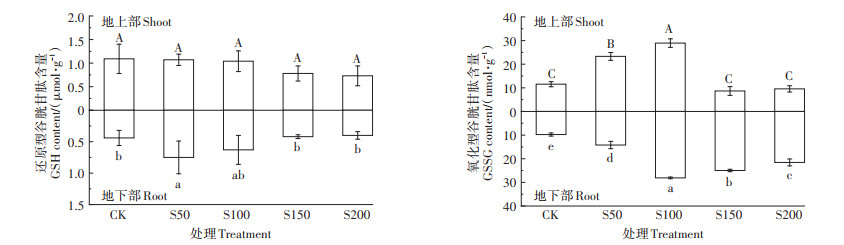
|
图 5 不同硫浓度对小花南芥体内还原型和氧化型谷胱甘肽含量的影响 Figure 5 Effects of different sulfur concentrations on the contents of GSH and GSSG in A. alpine |
不同硫浓度对小花南芥体内γ-谷氨酰半胱氨酸合成酶(γ-GCS)和谷胱甘肽还原酶(GR)活性有不同影响(图 6)。小花南芥地上部γ-GCS活性随着硫浓度增加而增加,在S200处理下达最大值,为92.32 μmol·h-1·g-1;地下部γ-GCS活性随着硫浓度增加先增加后下降,在S150处理下活性最高,为287.45 μmol·h-1·g-1。小花南芥地上部、地下部GR活性都随着硫浓度增加而增加,均在S200处理下活性最高,分别为57.90 nmol ·min-1·g-1和104.99 nmol ·min-1·g-1。
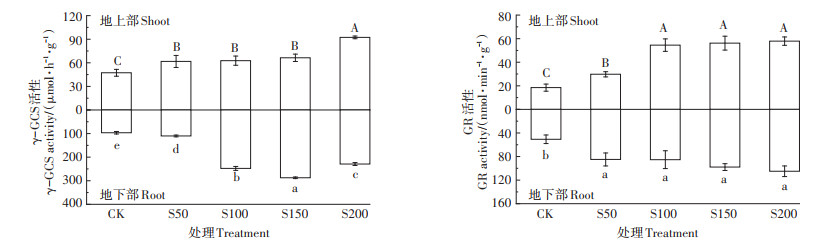
|
图 6 不同硫浓度对小花南芥体内γ-GCS和GR活性的影响 Figure 6 Effects of different sulfur concentrations on the activities of γ-GCS and GR in A. alpine |
图 7为不同硫浓度对小花南芥体内谷胱甘肽过氧化物酶(GPX)和谷胱甘肽S-转移酶(GST)活性的影响,可以看出,小花南芥地上部、地下部GPX活性都随着硫浓度增加先增加后下降,均在S50处理下活性最高,分别为1 545.52 nmol·min-1·g-1和1 413.38 nmol ·min-1·g-1。小花南芥地上部GST活性随着硫浓度增加先增加后下降,在S150处理下活性最高,为176.76 nmol·min-1·g-1;地下部GST活性随着硫浓度增加而增加,在S200处理下活性最高,为290.46 nmol· min-1·g-1。
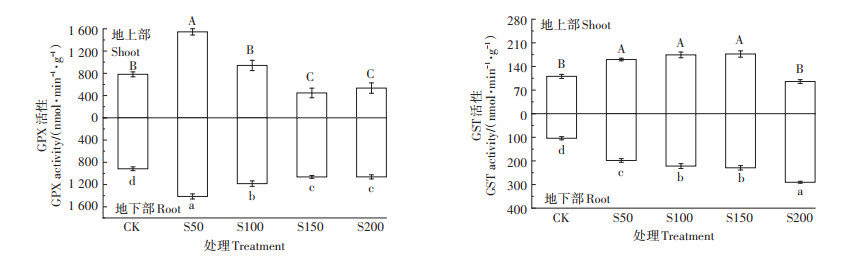
|
图 7 不同硫浓度对小花南芥体内GPX和GST活性的影响 Figure 7 Effects of different sulfur concentrations on the activities of GPX and GST in A. alpine |
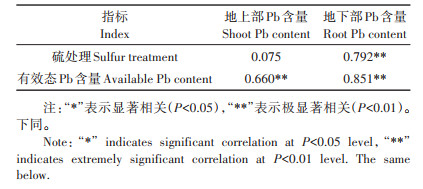
如表 3所示,硫处理与小花南芥地下部Pb含量呈极显著正相关(P < 0.01,下同),土壤有效态Pb含量与小花南芥地上部、地下部Pb含量呈极显著正相关。
|
|
表 3 小花南芥硫处理、有效态Pb含量与Pb含量的相关性 Table 3 Correlation between sulfur treatments, available Pb content and Pb content in A. alpine |
如表 4所示,小花南芥地上部Pb含量与地上部GSSG含量呈显著负相关(P < 0.05,下同),与地上部GPX活性呈极显著负相关;小花南芥地下部Pb含量与地上部Glu含量呈极显著正相关,与地上部GSH含量呈显著负相关,与地上部GSSG含量和GPX活性呈极显著负相关,与地上部γ-GCS和GR活性呈显著正相关。
|
|
表 4 小花南芥体内Pb含量与地上部含硫化合物及酶活性的相关性 Table 4 Correlation between Pb content in A. alpine and shoot sulfur-containing compounds and enzyme activities |
如表 5所示,小花南芥地上部Pb含量与地下部Glu含量呈显著负相关,与地下部GPX活性呈极显著负相关;小花南芥地下部Pb含量与地下部Cys含量呈极显著正相关,与地下部GSH含量呈显著负相关,与地下部γ-GCS、GR和GST活性呈显著正相关。
|
|
表 5 小花南芥体内Pb含量与地下部含硫化合物及酶活性的相关性 Table 5 Correlation between Pb content in A. alpine and root sulfur-containing compounds and enzyme activities |
硫元素在植物整个生命周期中起着无法替代的作用。硫不仅参与植物光合作用、氨基酸和蛋白质合成及酶促反应等生理过程,还调节植物的生长发育过程[21]。在重金属胁迫下,外源施加硫可以改善植物的生长、生理代谢过程。已有研究发现施硫处理促进小麦的生长,增加叶绿素含量,缓解铜镉复合胁迫对小麦的毒害[22]。外源添加硫显著增加了三叶草[23]、印度芥菜[24]和东南景天[11]的生物量。但过量的硫会导致土壤酸化和硫的富营养化,抑制植物的生长[25]。本研究发现,在Pb胁迫下,适量的硫供应显著增加了小花南芥地上部和地下部生物量,高硫处理抑制了小花南芥地下部生物量。
硫的添加会改变土壤的理化性质,使土壤pH值从6.08下降到5.47,有效硫增加20.3%~41.5%,从而影响植物对重金属的吸收。本试验表明,除植株小花南芥地上部Pb含量在高硫处理下无显著变化外,土壤有效态Pb含量与小花南芥吸收Pb含量变化趋势一致。在S50和S100处理下,土壤有效态Pb含量降低,其可能原因是低硫处理下,SO42-与土壤中游离的Pb2+形成PbSO4沉淀,降低了土壤中Pb的有效性,同时施硫亦可增加土壤负电荷,促进土壤胶体对Pb2+的吸附[26]。S150和S200处理下,土壤有效态Pb含量增加,主要与硫的施加导致土壤酸化,使得土壤中Pb向活性较高的有效态转化有关,从而促进了植物对Pb的累积[27],如WANG等[28]发现施硫降低了土壤pH,促进了植物对Cu和Zn的吸收累积。
本研究发现S50、S100处理提高了小花南芥Pb的富集系数,与王吉秀等[13]的结论一致,但S150、S200处理抑制了小花南芥对Pb的富集,且施硫均降低了小花南芥对Pb的转运系数。其原因可能是外源施硫增加了小花南芥体内含硫化合物的形成,将Pb更多固定在地下部,减少了向地上部的转移,从而减少小花南芥对Pb的转运。
3.2 含硫化合物及酶活性对小花南芥累积Pb的影响重金属胁迫下,施硫可以促进植物含硫化合物的合成,从而螯合重金属以减轻其毒性[29]。Cys是唯一一种含巯基的氨基酸[30],是含硫化合物的前体物质,可直接或间接合成GSH、PCs和MTs等物质应对重金属胁迫[31]。因此Cys和GSH的合成对植物的氧化胁迫反应有重要作用[32],同时Glu的充足供应对合成Cys也十分重要[33]。本试验中,在Pb胁迫下,施硫增加了小花南芥体内Glu和Cys的含量,且地下部Pb吸收量大于地上部,相关性分析表明小花南芥地下部Pb含量与地下部Cys含量呈极显著正相关。研究表明Cys含量的增加提高了拟南芥对Cd的耐性和积累的能力[34]。GSH是以Cys为底物合成的物质,是一种抗氧化剂。当重金属胁迫时,植物体内的活性氧(ROS)物质会增加,产生氧化应激反应[35],而GSH以还原形式存在于细胞中,它在抗氧化过程中被氧化为GSSG[36]。植物细胞中的GSH和PCs可以通过螯合重金属离子来缓解过量ROS造成的毒性作用[37]。如SUN等[38]通过施加硫肥提高了水稻茎叶中GSH的含量,降低了水稻对Cu的吸收。本研究中,施硫减少了小花南芥地上部GSH含量,增加了小花南芥地下部GSSG含量。其可能原因是施硫使小花南芥地下部GSH更多被合成PCs和氧化成GSSG,将Pb更多固定在根部,减少向地上部转运。FAN等[39]研究表明外源添加硫使水稻叶片中还原型GSH合成的PCs含量增加,缓解了Cd对水稻生长的胁迫。
上述含硫化合物的合成涉及以下几种酶:γ- GCS、GR、GPX和GST。γ-GCS是GSH合成中起关键作用的酶,是植物应对重金属胁迫必不可少的酶[40]。GR能催化GSSG还原成GSH,因此GR活性直接影响GSH含量[41]。GPX和GST是以GSH为底物合成的抗氧化酶,参与重金属的解毒[42]。在受到重金属胁迫时,在GST的作用下GSH可与重金属离子反应,将其转移到液泡中使其失去活性[27]。孙惠莉等[43]的研究表明,施硫增加了Cd胁迫下小白菜中GSH含量和GR活性。本研究显示,硫处理增加了小花南芥地上部、地下部γ-GCS和GR活性;低硫处理增加了小花南芥地上部、地下部GPX活性,高硫处理降低了GPX活性;施硫增加了小花南芥体内GST活性。相关性分析表明小花南芥地下部Pb含量与地下部γ-GCS、GR和GST活性呈显著正相关。施硫处理提高了小花南芥地下部γ-GCS、GR和GST活性,其原因可能是高硫处理提高了土壤有效态Pb含量,从而促进了小花南芥地下部对Pb的吸收,酶活性的增加促进了含硫化合物的合成,使Pb被更多地螯合在根部。
重金属胁迫增加了植物对硫的需求,从而激活了SO42-转运蛋白和同化酶的表达,促进了含硫化合物的生成[44]。本试验结果表明,硫处理提高了含硫化合物含量和酶活性,与小花南芥植物体内Pb含量存在相关关系,减轻了Pb对植物的胁迫。因此,含硫化合物在植物代谢、胁迫反应、细胞适应和解毒中起重要作用。
4 结论(1) 低硫处理提高了小花南芥地上部和地下部生物量,降低了土壤有效Pb含量和植株对Pb的吸收;高硫处理抑制了小花南芥地上部和地下部生物量,增加了土壤有效Pb含量和植株地下部对Pb的吸收。
(2) 硫处理促进了小花南芥对Pb的累积,当硫浓度为50 mg·kg-1和100 mg·kg-1时,富集系数大于1,有利于小花南芥对Pb的富集和转运。
(3) 硫处理增加了小花南芥体内含硫化合物的含量,增强了小花南芥对Pb胁迫的耐性;提高了小花南芥体内含硫化合物中关键酶的活性,促进了含硫化合物的生成,对植株抵御Pb胁迫起重要作用。
| [1] |
ZDRAVKOVI A, CVETKOVI V, ARI K, et al. Waste rocks and medieval slag as sources of environmental pollution in the area of the Pb-Zn mine Rudnik(Serbia)[J]. Journal of Geochemical Exploration, 2020, 218: 106629. DOI:10.1016/j.gexplo.2020.106629 |
| [2] |
陈能场, 郑煜基, 何晓峰, 等. 《全国土壤污染状况调查公报》探析[J]. 农业环境科学学报, 2017, 36(9): 1689-1692. CHEN N C, ZHENG Y J, HE X F, et al. Analysis of the Report on the National General Survey of Soil Contamination[J]. Journal of Agro-Environment Science, 2017, 36(9): 1689-1692. |
| [3] |
张娜, 朱阳春, 李志强, 等. 淹水和干旱生境下铅对芦苇生长、生物量分配和光合作用的影响[J]. 植物生态学报, 2018, 42(2): 229-239. ZHANG N, ZHU Y C, LI Z Q, et al. Effect of Pb pollution on the growth, biomass allocation and photosynthesis of Phragmites australis in flood and drought environment[J]. Chinese Journal of Plant Ecology, 2018, 42(2): 229-239. |
| [4] |
刘泽伟, 赖金龙, 李俊柯, 等. 铀对蚕豆幼苗光合特性和呼吸代谢的毒害机理[J]. 农业环境科学学报, 2020, 39(9): 1916-1924. LIU Z W, LAI J L, LI J K, et al. Toxic mechanism of uranium on photosynthetic characteristics and respiratory metabolism of Vicia faba L.[J]. Journal of Agro-Environment Science, 2020, 39(9): 1916-1924. |
| [5] |
PARYS E, ROMANOWSKA E, SIEDLECKA M, et al. The effect of lead on photosynthesis and respiration in detached leaves and in mesophyll protoplasts of Pisum sativum[J]. Acta Physiologiae Plantarum, 1998, 20(3): 313-322. DOI:10.1007/s11738-998-0064-7 |
| [6] |
杨素勤, 程海宽, 张彪, 等. 不同品种小麦Pb积累差异性研究[J]. 生态与农村环境学报, 2014, 30(5): 646-651. YANG S Q, CHENG H K, ZHANG B, et al. Differences in Pb accumulation between wheat varieties[J]. Journal of Ecology and Rural Environment, 2014, 30(5): 646-651. |
| [7] |
ZU Y Q, LI Y, CHRLSTIAN S, et al. Accumulation of Pb, Cd, Cu and Zn in plants and hyperaccumulator choice in Lanping lead-zinc mine area, China[J]. Environment International, 2004, 30(4): 567-576. DOI:10.1016/j.envint.2003.10.012 |
| [8] |
宋雅娟, 李师翁. 水杨酸在植物缓解重金属镉胁迫中的作用[J]. 环境科学与技术, 2020, 43(2): 177-186. SONG Y J, LI S W. Role of salicylic acid in resistance on cadmium stress in plant[J]. Environmental Science & Technology, 2020, 43(2): 177-186. |
| [9] |
KOPRIVA S, MALAGOLI M, TAKAHASHI H. Sulfur nutrition: Impacts on plant development, metabolism, and stress responses[J]. Journal of Experimental Botany, 2019, 70(16): 4069-4073. DOI:10.1093/jxb/erz319 |
| [10] |
TANG X J, LI L Y, WU C, et al. The response of arsenic bioavailability and microbial community in paddy soil with the application of sulfur fertilizers[J]. Environmental Pollution, 2020, 264: 114679. DOI:10.1016/j.envpol.2020.114679 |
| [11] |
李会合, 胡绵好, 李廷强, 等. 硫对超积累植物东南景天生长和镉累积的影响[J]. 水土保持学报, 2008, 22(6): 71-74. LI H H, HU M H, LI T Q, et al. Effects of sulfur on growth, cadmium absorption and accumulation in hyperaccumulator-Sedum alfredii Hance[J]. Journal of Soil and Water Conservation, 2008, 22(6): 71-74. DOI:10.3321/j.issn:1009-2242.2008.06.015 |
| [12] |
ZHANG D X, DU G H, CHEN D, et al. Effect of elemental sulfur and gypsum application on the bioavailability and redistribution of cadmium during rice growth[J]. Science of the Total Environment, 2019, 657: 1460-1467. DOI:10.1016/j.scitotenv.2018.12.057 |
| [13] |
王吉秀, 太光聪, 祖艳群, 等. 硫营养对小花南芥(Arabis alpina var. parviflora Franch) 累积铅锌的影响研究[J]. 农业环境科学学报, 2011, 30(6): 1064-1069. WANG J X, TAI G C, ZU Y Q, et al. Effects of sulfur application on growth and lead and zinc accumulation contents in Arabis alpinal var. parviflora Franch[J]. Journal of AgroEnvironment Science, 2011, 30(6): 1064-1069. |
| [14] |
范旭杪, 秦丽, 王吉秀, 等. 植物谷胱甘肽代谢与镉耐性研究进展[J]. 西部林业科学, 2019, 48(4): 50-56. FAN X M, QIN L, WANG J X, et al. A Review of glutathione metabolism and cadmium tolerance in plants[J]. Journal of West China Forestry Science, 2019, 48(4): 50-56. |
| [15] |
DAVID M C, HERMINIA L T, ANDREA H N, et al. Sulfur assimilation and glutathione metabolism under cadmium stress in yeast, protists and plants[J]. Fems Microbiology Reviews, 2005, 29(4): 653-671. DOI:10.1016/j.femsre.2004.09.004 |
| [16] |
SYTAR O, KUMAR A, LATOWSKI D, et al. Heavy metal-induced oxidative damage, defense reactions, and detoxification mechanisms in plants[J]. Acta Physiologiae Plantarum, 2013, 35(4): 985-999. DOI:10.1007/s11738-012-1169-6 |
| [17] |
TELMAN W, DIETZ K J. Thiol redox-regulation for efficient adjustment of sulfur metabolism in acclimation to abiotic stress[J]. Journal of Experimental Botany, 2019, 70(16): 4223-4236. DOI:10.1093/jxb/erz118 |
| [18] |
鲍士旦. 土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2000: 25-111. BAO S D. Agricultural soil analysis[M]. 3rd Edition. Beijing: China Agriculture Press, 2000: 25-111. |
| [19] |
刘梅, 李祖然, 张光群, 等. 野生小花南芥体内AsA-GSH循环对土壤Cd、Pb胁迫的响应[J]. 农业资源与环境学报, 2021, 38(4): 558-569. LIU M, LI Z R, ZHANG G Q, et al. Response of ascorbate-glutathione cycle in wild Arabis alpina L. to soil Cd and Pb stress[J]. Journal of Agricultural Resources and Environment, 2021, 38(4): 558-569. |
| [20] |
于培鑫, 潘芳慧, 王友保, 等. 叶绿醇对铅污染土壤酶活性及土壤铅有效态影响[J]. 水土保持学报, 2019, 33(5): 358-363. YU P X, PAN F H, WANG Y B, et al. Effects of phytol on soil enzyme activity and lead availability in lead-contaminated soil[J]. Journal of Soil and Water Conservation, 2019, 33(5): 358-363. |
| [21] |
李海云, 张复君, 齐辉, 等. 植物硫营养研究进展[J]. 北方园艺, 2009(7): 143-145. LI H Y, ZHANG F J, QI H, et al. Research progress on sulfur nutrition of plant[J]. Northern Horticulture, 2009(7): 143-145. |
| [22] |
翁南燕, 周东美, 汪鹏, 等. 铜镉复合胁迫下硫素对小麦幼苗铜镉吸收、亚细胞分布及毒性的影响[J]. 生态毒理学报, 2011, 6(1): 87-93. WENG N Y, ZHOU D M, WANG P, et al. Influence of sulfur on subcellular distribution, uptake and toxicity of Cu and Cd to wheat seedlings[J]. Asian Journal of Ecotoxicology, 2011, 6(1): 87-93. |
| [23] |
VARIN S, CLIQUET J B, PERSONENI E, et al. How does sulphur availability modify N acquisition of white clover(Trifolium repens L.)?[J]. Journal of Experimental Botany, 2010, 61(1): 225-234. DOI:10.1093/jxb/erp303 |
| [24] |
王建旭, 冯新斌, 商立海, 等. 添加硫代硫酸铵对植物修复汞污染土壤的影响[J]. 生态学杂志, 2010, 29(10): 1998-2002. WANG J X, FENG X B, SHANG L H, et al. Effects of ammonium thiosulphate amendment on phytoremediation of mercury-polluted soil[J]. Chinese Journal of Ecology, 2010, 29(10): 1998-2002. |
| [25] |
姜勇, 李天鹏, 冯雪, 等. 外源硫输入对草地土壤-植物系统养分有效性的影响[J]. 生态学杂志, 2019, 38(4): 1192-1201. JIANG Y, LI T P, FENG X, et al. Effects of exogenous sulfur input on nutrient availability in soil-plant system of grassland[J]. Chinese Journal of Ecology, 2019, 38(4): 1192-1201. |
| [26] |
孙洪欣, 薛培英, 赵全利, 等. 配施硫基肥对夏玉米镉铅累积的阻控效应[J]. 农业工程学报, 2017, 33(1): 182-189. SUN H X, XUE P Y, ZHAO Q L, et al. Inhibiting Cd and Pb accumulation in summer maize by sulphate-based fertilizers application[J]. Transactions of the Chinese Society of Agricultural Engineering, 2017, 33(1): 182-189. |
| [27] |
孙丽娟, 段德超, 彭程, 等. 硫对土壤重金属形态转化及植物有效性的影响研究进展[J]. 应用生态学报, 2014, 25(7): 2141-2148. SUN L J, DUAN D C, PENG C, et al. Influence of sulfur on the speciation transformation and phyto-availability of heavy metals in soil: A review[J]. Chinese Journal of Applied Ecology, 2014, 25(7): 2141-2148. |
| [28] |
WANG Y P, LI Q B, HUI W, et al. Effect of sulphur on soil Cu/Zn availability and microbial community composition[J]. Journal of Hazardous Materials, 2008, 159(2/3): 385-389. |
| [29] |
ZHANG W, LIN K F, ZHOU J, et al. Spatial distribution and toxicity of cadmium in the joint presence of sulfur in rice seedling[J]. Environmental Toxicology & Pharmacology, 2013, 36(3): 1235-1241. |
| [30] |
梅磊, 朱晔, 肖钦之, 等. 植物络合素合酶及其基因研究进展[J]. 浙江大学学报(农业与生命科学版), 2018, 44(5): 530-538. MEI L, ZHU Y, XIAO Q Z, et al. Advances in study on phytochelatin synthase in plants[J]. Journal of Zhejiang University(Agriculture and Life Sciences), 2018, 44(5): 530-538. |
| [31] |
DAVID M C, HERMINIA L T, ANDREA H N, et al. Sulfur assimilation and glutathione metabolism under cadmium stress in yeast, protists and plants[J]. Fems Microbiology Reviews, 2005, 29(4): 653-671. DOI:10.1016/j.femsre.2004.09.004 |
| [32] |
GOTOR C, LAUREANO-MARÍN A M, Moreno I, et al. Signaling in the plant cytosol: Cysteine or sulfide?[J]. Amino Acids, 2015, 47(10): 2155-2164. DOI:10.1007/s00726-014-1786-z |
| [33] |
STANISLAV K, HEINZ R. Control of sulphate assimilation and gluta-thione synthesis: Interaction with N and C metabolism[J]. Journal of Experimental Botany, 2004, 55(404): 1831-1842. DOI:10.1093/jxb/erh203 |
| [34] |
DOMÍNGUEZ-SOLÍS J R, LÓPEZ-MARTÍN M C, AGER F J, et al. Increased cysteine availability is essential for cadmium tolerance and accumulation in Arabidopsis thaliana[J]. Plant Biotechnology Journal, 2004, 2(6): 469-476. DOI:10.1111/j.1467-7652.2004.00092.x |
| [35] |
ZHANG H, LI X, XU Z, et al. Toxic effects of heavy metals Pb and Cd on mulberry(Morus alba L.) seedling leaves: Photosynthetic function and reactive oxygen species(ROS) metabolism responses[J]. Ecotoxicology and Environmental Safety, 2020, 195: 110469. DOI:10.1016/j.ecoenv.2020.110469 |
| [36] |
NAGALAKSHMI N, PRASAD M N V. Responses of glutathione cycle enzymes and glutathione metabolism to copper stress in Scenedesmus bijugatus[J]. Plant Science, 2001, 160(2): 291-299. DOI:10.1016/S0168-9452(00)00392-7 |
| [37] |
CAPALDI F R, GRATÃO P L, REIS A R, et al. Sulfur metabolism and stress defense responses in plants[J]. Tropical Plant Biology, 2015, 8(3): 60-73. |
| [38] |
SUN L, YANG J, FANG H, et al. Mechanism study of sulfur fertilization mediating copper translocation and biotransformation in rice(Oryza sativa L.) plants[J]. Environmental Pollution, 2017, 226: 426-434. DOI:10.1016/j.envpol.2017.03.080 |
| [39] |
FAN J L, HU Z Y, ZIADI N, et al. Excessive sulfur supply reduces cadmium accumulation in brown rice(Oryza sativa L.)[J]. Environmental Pollution, 2010, 158(2): 409-415. DOI:10.1016/j.envpol.2009.08.042 |
| [40] |
NA G, SALT D E. The role of sulfur assimilation and sulfur-containing compounds in trace element homeostasis in plants[J]. Environmental and Experimental Botany, 2011, 72(1): 18-25. DOI:10.1016/j.envexpbot.2010.04.004 |
| [41] |
PALLAVI S, BHUSHAN J A, SHANKER D R, et al. Reactive oxygen species, oxidative damage, and antioxidative defense mechanism in plants under stressful conditions[J]. Journal of Botany, 2012, 2012: 1-26. |
| [42] |
杨卫东, 李廷强, 丁哲利, 等. 旱柳幼苗抗坏血酸-谷胱甘肽循环及谷胱甘肽代谢对镉胁迫的响应[J]. 浙江大学学报(农业与生命科学版), 2014, 40(5): 551-558. YANG W D, LI T Q, DING Z L, et al. Responses of ascorbate-glutathione cycle and glutathione metabolism to cadmium stress in Salix matsudana Koidz seedlings[J]. Journal of Zhejiang University(Agriculture and Life Sciences), 2014, 40(5): 551-558. |
| [43] |
孙惠莉, 吕金印, 贾少磊. 硫对镉胁迫下小白菜叶片AsA-GSH循环和植物络合素含量的影响[J]. 农业环境科学学报, 2013, 32(7): 1294-1301. SUN H L, LÜ J Y, JIA S L. Effects of sulfur on ascorbate-glutathione cycle and the content of phytochelatins in the leaves of pakchoi(Brassica chinensis L.) under cadmium stress[J]. Journal of Agro-Environment Science, 2013, 32(7): 1294-1301. |
| [44] |
HAWKESFORD M J, KOK L J D. Managing sulphur metabolism in plants[J]. Plant Cell & Environment, 2010, 29(3): 382-395. |
 2021, Vol. 40
2021, Vol. 40