2. 福建师范大学地理科学学院, 福州 350007
2. School of Geographical Sciences, Fujian Normal University, Fuzhou 350007, China
氧化亚氮(N2O)是仅次于二氧化碳(CO2)和甲烷(CH4)的痕量温室气体,但是其增温潜能在百年尺度上约为CO2的265倍,对全球气温升高和酸雨形成起着重要作用,且可对臭氧层造成严重破坏[1]。据报道,2016年全球大气N2O浓度已增至328 nL·L-1,相比工业化前浓度(270 nL·L-1)增加了22%,且仍以每年0.25%~0.30%的速率增长[2]。水生生态系统是温室气体N2O的重要来源,国内外学者对海洋、湖泊、水库、河流等自然水生生态系统做了大量的研究工作[3],人工水产养殖生态系统富含各种营养盐物质,养殖水体的高氮负荷使其成为N2O的潜在释放源[4]。据估算,2009年全球水产养殖生态系统的N2O排放量为9.30×1010 g,如果按照年增长速率7.1%持续扩大养殖业,其排放量将在2030年达到3.83×1011g,并占人类活动N2O排放总量的5.72%[5]。
中国滨海水产养殖规模及增加速率均居世界首位,卫星遥感监测显示其规模从1984年的2 612 km2增加到2016年的13 075 km2,其中福建省滨海养殖塘面积达到698 km2 [6]。目前,在闽江河口[7-9]和黄河三角洲[10]开展了水产养殖塘的温室气体产生与排放研究,但是相对于广泛分布且受人类活动影响显著的滨海水产养殖生态系统而言,已有的研究比较有限,且研究结果还存在不确定性[11-13]。基于此,选择鲜见报道的九龙江河口湿地围垦养虾塘为研究对象,研究其N2O排放特征及影响机制,为进一步完善滨海水产养殖生态系统N2O排放清单和减少N2O排放提供科学参考。
1 材料与方法 1.1 试验区概况研究区位于福建省九龙江河口紫泥镇浒茂州甘文农场(117°53′ 36″ E,24°26′ 10″ N),属于南亚热带海洋性季风气候,温暖湿润,年平均气温和降水量分别为21.0 ℃和1 371 mm,滩涂面积约2 666 hm2。该研究区处于九龙江河口咸淡水交汇处,水质较好,水产养殖条件优越。近些年来,随着人们对鱼虾类水产品需求的增长,河口出现了大规模围垦潮滩湿地的水产养殖生态系统,养殖品种主要为南美白对虾(Itopenaeus vannamei),养殖密度约为45尾·m2,养殖活动通常是在5月中下旬投放虾苗,10月上中旬将虾全部收获。养殖期间,每日向养虾塘投放人工配制饵料,日投饵量为虾体质量的3%~10%,具体饵料投放量根据虾的生长及摄食情况进行调整。本试验选择2个典型的养虾塘,每个养虾塘均由滩涂湿地围垦而成,水域面积约为7 000 m2,水深约1.54 m,水体盐度约为0.9%。
1.2 试验设计水-气界面N2O排放通量测定采用悬浮箱-气相色谱仪法。在选定的2个典型养虾塘均布设3个悬浮箱采样点,样点分布呈等边三角形,间距约5 m。悬浮箱是将透明有机玻璃箱外包锡箔纸固定在泡沫制作的载体上,箱上安装用于平衡箱内外压力的通风管,箱内顶部安装1个用于混合气体的小风扇。鉴于对虾养殖周期和养殖户准许采样频次情况,分别在养殖初期(6月20日)、养殖中期(8月19日)和养殖末期(10月8日)乘小木船进行悬浮箱气样采集,1个通量测定共抽气4次(间隔15 min),1次采样量为60 mL,将气体注入铝箔复合膜材料采样袋带回实验室。综合考虑采样耗时和采样操作可行性等情况,白天每间隔3 h,分别于8:00、11:00、14:00和17:00进行一次气体采集,以分析水-气界面N2O通量日间动态变化。采集的气样用气相色谱仪(Shimadzu GC-2014,Japan)测定其N2O浓度,测定采用ECD检测器,载气为高纯氦气,检测器、柱箱和进样口温度分别为320、60 ℃和50 ℃,气体流速为30 mL·min-1。N2O排放通量的计算公式[7]为:
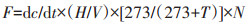
|
(1) |
式中:F为N2O排放通量,µmol·h-1;dc/dt为N2O气体浓度单位时间的变化,µmol·h-1;V为标准状态下的气体摩尔体积,22.4 L;H为采样箱的箱高,m;T为采样箱内温度,℃;N为量纲转化系数,1 000。计算通量的一组N2O浓度变化数据在关于时间的线性函数中R2>0.80时才有效。气体通量为正值表示N2O由水体进入大气,为负值表示N2O从大气进入水体。
1.3 环境因子测定与样品分析与采集气样同步,采用便携式气象仪(Kestrel- 3500,USA)在野外现场测定距水面1.5 m高度处的气温和风速;原位测定各悬浮箱旁边表层(10 cm深度)水体的pH、温度、盐度和溶解氧(DO)浓度,其中pH和水温采用IQ150便携式pH/温度计(IQ Scientific Instruments,USA)测定,盐度采用盐度计(Eutech Instruments SALT 6+,USA)测定,DO采用多参数水质监测仪(YSI500A,USA)测定。
利用Sea-Bird Ⅱ型采水器(Sea-bird Electronics,USA)分别采集各悬浮箱旁边表层(10 cm深度)水样100 mL,加入1 mL 1 mol·L-1 HgCl2溶液密封后带回实验室进行水质测定。利用总有机碳分析仪(Shimadzu,Japan)测定溶解性有机碳(DOC)浓度,利用流动注射分析仪(SKALAR San++,Netherlands)测定NH4+-N、NO3--N、NO2--N和PO43--P浓度,叶绿素a(Chl-a)浓度是将水样过滤后用丙酮浸提,采用紫外-可见分光光度计(Shimadzu UV-2450,Japan)测定[14]。
1.4 数据统计分析采用Excel 2010和Origin 8.0软件对测定数据进行处理和制图,采用SPSS 19.0软件中单因素方差分析(One-way ANOVA)的LSD法进行不同样品实验数据间的差异及显著性检验,采用Pearson相关分析和多元逐步回归分析,分析气象要素和水环境因子与N2O排放通量的关系。以上统计分析中显著性水平α= 0.05,文中数值为平均值±标准误,图中误差线均为标准误差。
2 结果与分析 2.1 气象要素与水环境因子研究期间,九龙江河口养虾塘的气象要素与水环境因子的变化如图 1所示。气温的变化范围和均值分别是24.41~36.91 ℃和(28.40±2.20)℃,养殖中期气温显著高于养殖初期和末期(P < 0.05);风速的变化范围和均值分别是0.91~3.57 m·s-1和(2.28±0.58)m·s-1,河口区风速随养殖期推移显著增大(P < 0.05);气温与风速在各养殖期的不同时刻均存在一定的显著差异(P < 0.05)。水温的变化范围和均值分别是28.03~35.05 ℃和(31.71±1.22)℃,水体盐度的变化范围和均值分别是0.64%~1.42% 和0.92%±0.12%;水体pH的变化范围和均值分别是8.53~9.85和(9.15 ± 0.22),DO的变化范围和均值分别是5.83~14.86 mg·L-1和(10.17±1.60)mg·L-1;DOC浓度的变化范围和均值分别是4.80~10.18 mg·L-1和(7.00±1.22)mg ·L-1,NH4+-N浓度的变化范围和均值分别是0.16~0.74 mg·L-1和(0.48±0.12)mg·L-1;NO2--N浓度的变化范围和均值分别是4.07~36.48 µg·L-1和(12.46±3.17)µg·L-1,NO3--N浓度的变化范围和均值分别是6.43~ 96.87 µg·L-1和(42.23±8.02)µg·L-1;PO43--P浓度的变化范围和均值分别是44.03~129.77 µg·L-1和(75.27±8.60)µg·L-1,Chl-a浓度的变化范围和均值分别是28.67~95.78 µg·L-1和(65.94±8.41)µg·L-1。方差分析的结果表明,养殖水体的温度、盐度、pH、DO、DOC、NH4+-N、NO2--N、NO3--N、PO43--P和Chl-a浓度在各养殖期均存在一定的显著差异(P < 0.05),且在同一养殖期的不同时刻也存在一定的差异显著性(P < 0.05)。

|
图 1 九龙江河口养虾塘主要气象要素与水环境因子 Figure 1 The main meteorological parameters and water environment indicators of shrimp ponds in the Jiulong River estuary |
研究期间,九龙江河口养虾塘水-气界面N2O排放通量如图 2所示。养殖初期、中期和末期N2O排放通量的变化范围分别为0.10~0.27、0.11~0.34 µmol·m-2·h-1和0.21~0.64 µmol·m-2·h-1,均值分别为(0.20± 0.04)、(0.22±0.06)µmol·m-2·h-1和(0.35±0.11)µmol·m-2·h-1。时间变化上,养殖末期的排放通量显著高于养殖初期和中期(P < 0.05),而养殖初期与中期之间无显著差异(P > 0.05);观测时刻上,在养殖初期和中期呈现自8:00开始持续增加,而在养殖末期则是在14:00达到峰值后开始下降,各养殖期不同时刻的排放通量均存在一定的显著差异(P < 0.05)。

|
图中大写字母表示不同养殖期同一时刻的显著差异性(P < 0.05),小写字母表示同一养殖期不同时刻的显著差异性(P < 0.05) Different capital letters indicate significant differences among the same time of different aquaculture stages(P < 0.05); Different lowercase letters indicate significant differences among different times of every aquaculture stages (P < 0.05) 图 2 九龙江河口养虾塘水-气界面N2O排放通量 Figure 2 N2O fluxes at water-air interface of shrimp ponds in the Jiulong River estuary |
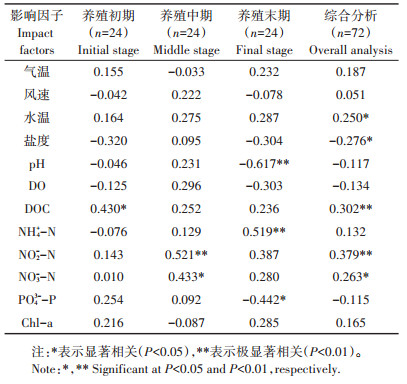
相关分析表明(表 1),九龙江河口养虾塘水-气界面N2O排放通量总体上与水温和NO3--N浓度显著正相关(P < 0.05),与水体DOC和NO2--N浓度达到极显著正相关(P < 0.01),而与盐度呈显著负相关(P < 0.05);气温、风速、水体pH、DO、NH4+-N、PO43--P和Chl-a浓度的影响总体上均不显著(P > 0.05),但在部分养殖期的分析中,pH、NH4+-N和PO43--P浓度存在显著影响(P < 0.05)。为了进一步探讨气象要素与水环境中主要因子及其对N2O排放通量的贡献大小,利用多元逐步回归分析得到最优方程为y=1.467+4.363x1 + 1.127x2-2.206x3(R2=0.785,P < 0.01,n=72)(式中,y为N2O排放通量;x1为NO2--N含量;x2为NO3--N含量;x3为盐度),这表明水体盐度、NO2--N和NO3--N浓度是九龙江河口养虾塘水-气界面N2O排放通量的主要影响因素,三者共同解释了78.5%的变化。
|
|
表 1 水-气界面N2O排放通量与环境因子的相关系数 Table 1 Correlation coefficients between N2O fluxes at water-air interface and environmental indicators |
九龙江河口养虾塘水-气界面N2O排放通量的均值为(0.26±0.07)µmol·m-2·h-1,总体表现为向大气释放N2O的源。这主要是因为水产养殖过程中,投放的含有大量碳、氮的饲料及其他物质,可以为水体N2O的产生提供底物。N2O排放通量在不同养殖期和白天的不同时刻均存在一定的显著变化(图 2),其原因一方面是由于水质参数变化,养虾塘水体的NO3--N浓度在养殖末期显著高于养殖初期和中期(图 1),而盐度在养殖末期和中期显著低于养殖初期(图 1),它们都是九龙江河口养虾塘N2O排放的主要影响因素(表 1);另一方面,养殖末期的对虾个体较大,活动性较强,对水体扰动较大,促进了N2O释放,从而出现养殖末期N2O排放通量显著高于养殖初期和中期的现象。观测时刻上,N2O排放通量在养殖末期与温度变化一致,表现为午后14:00达到最高后开始降低,但在养殖初期和中期均是持续增加到17:00,与温度变化相比存在一定的滞后性(图 2),这可能和参与N2O产生过程的微生物活性对温度环境的响应存在一定的滞后性有关,这种滞后效应在其他相关研究中也有出现[8]。
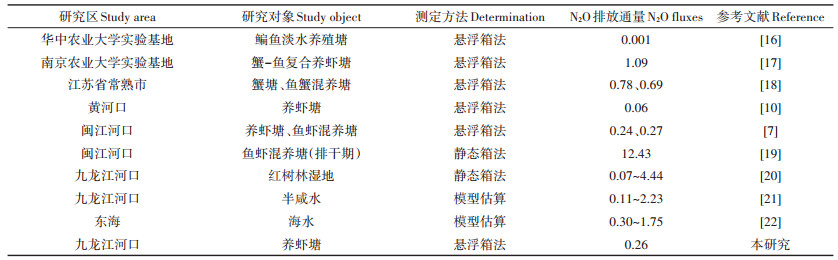
表 2总结了一些养殖水体以及九龙江河口红树林湿地和水体的N2O排放通量。比较发现,除了华中农业大学实验基地的鳊鱼养殖塘N2O排放通量很低外,南京农业大学实验农场和江苏常熟的淡水养殖塘N2O通量均高于河口区盐水养殖塘,这主要是由于河口区养殖水体具体一定的盐度,而内陆淡水养殖水体的盐度情况可忽略,多数研究表明盐度在一定程度上抑制了N2O的产生与排放[15]。地处高纬度的黄河口养殖塘N2O排放通量低于闽江和九龙江河口区,这是由于纬度越高,温度越低,而温度通常与水生生态系统N2O排放成正比[3]。在九龙江河口,养虾塘N2O排放通量要低于河口半咸水和近海海水的N2O释放(表 2),一方面是由于养殖水体相对稳定,而流动的河口水体和海水促进了气体的逸散[23];另一方面,本研究中N2O排放通量是采用悬浮箱法测定的,而其他水体的N2O排放通量多是基于模型计算的扩散通量,采用不同模型的结果存在很大不确定性,且受到采样时风速的显著影响[9]。此外,养殖塘N2O排放通量也低于红树林湿地,这些结果在一定程度上表明养殖结束后的水体排泄活动不会增加九龙江河口自然水体和红树林湿地的N2O释放。综上所述,水产养殖塘水-气界面N2O排放具有一定的时空变化特征,在今后的研究中需要加强不同区域、不同类型养殖水体N2O排放的年际、季节和日动态研究,以便更好地揭示其变化规律,为我国水产养殖生态系统N2O排放估算和清单编制提供更加准确全面的数据。
|
|
表 2 相关研究的N2O排放通量比较(µmol·m-2·h-1) Table 2 N2O fluxes of the other and relevant research(µmol·m-2·h-1) |
温度因素包括气温和水温,两者密切相关并均对养虾塘水-气界面N2O排放产生积极影响,总体上N2O排放与水温呈显著正相关(表 1)。水温可以影响沉积物和水体中有机氮矿化、硝化和反硝化作用的反应速率,进而促进N2O产生[24];温度还会通过影响N2O在水中的溶解度和气泡形成来影响排放通量[10],温度升高,N2O溶解度降低,促进了气体从水面逸出。此外,高密度养殖的鱼、虾等水生生物的生命活动(如觅食、代谢等)也受到温度影响,高温条件下它们的活动比较旺盛,对水体的扰动作用比较强烈,使得沉积物中无机氮进入水体,为水体硝化与反硝化过程提供物质来源,加大微生物硝化或反硝化潜力,从而有利于N2O的产生[25]。因此,N2O排放通量随温度上升而增加,这在河流、湖泊、海洋等多种水生生态系统中具有相同的结果[3],这也是纬度较高、温度较低的黄河口养殖塘N2O排放通量低于闽江和九龙江河口的重要原因。风速对九龙江河口养虾塘水-气界面N2O排放通量的影响并不显著,甚至呈现一定的负相关(表 1)。究其原因,一方面是由于N2O释放变化是多因素共同作用的结果;另一方面是本研究中排放通量是采用悬浮箱法测定的,在悬浮箱内部的风速几乎为零,与外界实际风速差异较大,因此与其他基于风速计算的扩散模型通量呈现的显著正相关有所不同[9]。
盐度主要通过直接影响微生物的N2O产生过程,进而影响N2O的产生量[15]。多数研究表明N2O排放通量随盐度增加而减小,但也有研究认为盐度的增加可以提高河口湿地N2O的产生和排放通量或无显著的影响[15]。九龙江河口养虾塘水体的盐度相对较高,为0.64%~1.42%,与N2O排放通量呈显著负相关(表 1),表现出一定的抑制作用,这与其他河口区养殖塘的研究结果较为一致。詹力扬等[23]在研究九龙江河口近海的海-气界面N2O排放通量时也发现其有由高盐处向低盐处递增的趋势。但在闽江河口,养虾塘水-气界面N2O排放通量与盐度出现了显著正相关的结果[26],并认为这是由于硝化作用比反硝化作用对盐度更为敏感,盐度对硝化过程产生抑制作用使其反应不完全,导致水体中NO2--N累积而抑制了N2O还原酶活性,使得N2O转化率和排放通量增加。与盐度相同,pH也是通过影响微生物活性而引起N2O排放通量变化[27]。硝化作用和反硝化作用是水生生态系统中N2O产生的主要过程,研究表明硝化细菌的pH适宜范围为7.7~8.1,反硝化细菌为7.0~8.0[28]。九龙江河口养虾塘水体pH高达9.15,过高的pH值降低了微生物活性,影响到N2O的产生;同时,过高的pH刺激了N2O还原酶活性,提高了反硝化产物中N2∶N2O,不利于N2O的累积与释放,因此pH与N2O排放通量呈现一定的负相关关系(表 1)。
养殖过程中由于投放的人工饵料残余和水生生物的代谢产物,使得水体中含有大量的溶解性有机质和无机氮,丰富的碳源可以增强微生物活性并促进厌氧环境的形成,从而有利于N2O的产生[29],因此养殖水体N2O排放通量与DOC浓度呈显著正相关(表 1),在其他水生生态系统研究中也表明N2O排放与有机质含量呈正相关[3]。水体溶解性氮是N2O产生过程的主要驱动因素之一,多数研究表明无机氮浓度与水生生态系统N2O的产生与排放呈正相关,如地中海Rhone河口水体中NH4+-N浓度可解释硝化速率变化的72%[30],YANG等[31]在巢湖流域的河流研究中也发现N2O排放通量与无机氮浓度呈显著正相关。九龙江河口养虾塘水-气界面N2O排放通量与NH4+-N浓度在养殖末期呈极显著正相关(P < 0.01),但在整个养殖期内相关性不显著(P > 0.05),而在整个养殖期内与NO2--N和NO3--N分别呈现极显著和显著正相关(表 1),由此推测养虾塘N2O产生可能主要来源于反硝化作用。尽管养殖塘表层水体DO浓度较高,但由于其具有稳定的水文条件,长期的淹水状态和流动性较差使其下部水体和底部沉积物的厌氧环境明显,加上充足的NO2--N和NO3--N供给,从而促进了反硝化作用进行。此外,NO3--N可以抑制N2O还原酶活性,而没有降低将NO3--N转化为N2O的酶的活性,从而降低了反硝化产物的N2∶N2O,提高了N2O的产生与释放量[32]。
相比碳、氮的影响,磷对水生生态系统N2O产生与排放的影响研究较少,但已有研究认为,在农田陆生生态系统中施用磷肥能提高磷酸酶活性,从而降低了植物体内硝酸根离子含量,减少了土壤N2O的排放[33]。九龙江河口养虾塘N2O排放通量与水体PO43--P浓度在养殖末期呈显著负相关(P < 0.05),但总体上相关性不显著,这与宋红丽等[10]在黄河口养虾塘的研究结果基本一致。水体Chl-a浓度影响未达到显著水平,但可起到促进作用,这是由于养殖过程中投放的大量饵料引起了硝态氮等无机氮浓度的升高,进而引起浮游藻类的繁殖,而大量藻类的光合作用能够增加水体DO和NO3--N浓度,从而促进了耦合的硝化反硝化作用,产生并释放出N2O气体[34];另外,浮游藻类的吸收固定过程也会产生N2O[35]。
4 结论(1)N2O排放通量随养殖时间推迟不断增加,且在白天不同时刻存在一定的变化特征,总体表现为向大气排放N2O的源,排放通量均值为0.26 µmol·m-2·h-1。
(2)N2O排放通量的主要影响因子是盐度和硝态氮浓度,分别呈显著负相关和正相关,另外水温和DOC浓度也有显著作用。
(3)由于地理位置差异、养殖方式以及采样方式的不同,九龙江河口养虾塘N2O排放与其他地区存在一定的差异,在今后的研究中需要不断加强其年际、季节和日动态研究,以期更好地揭示其时空变化规律。
| [1] |
IPCC. Climate change 2013: The physical science basis. Contribution of working group I to the fifth assessment report of the IPCC[R]. Cambridge: Cambridge University Press, 2013.
|
| [2] |
World Meteorological Organization. Annual greenhouse gas bulletin[R]. No. 12, 2016. Geneva: WMO-GAW
|
| [3] |
杨平, 仝川. 淡水水生生态系统温室气体排放的主要途径及影响因素研究进展[J]. 生态学报, 2015, 35(20): 6868-6880. YANG P, TONG C. Emission paths and measurement methods for greenhouse gas flux from freshwater ecosystems: A review[J]. Acta Ecologica Sinica, 2015, 35(20): 6868-6880. |
| [4] |
WILLIAMS J, CRUTZEN P J. Nitrous oxide from aquaculture[J]. Nature Geoscience, 2010, 3(3): 143. DOI:10.1038/ngeo804 |
| [5] |
HU Z, LEE J W, CHANDRAN K, et al. Nitrous oxide(N2O)emission from aquaculture: A review[J]. Environmental Science & Technology, 2012, 46(12): 6470-6480. |
| [6] |
REN C, WANG Z, ZHANG Y, et al. Rapid expansion of coastal aquaculture ponds in China from Landsat observations during 1984-2016[J]. International Journal of Applied Earth Observation and Geoinformation, 2019, 82: 101902. DOI:10.1016/j.jag.2019.101902 |
| [7] |
YANG P, HE Q H, HUANG J F, et al. Fluxes of greenhouse gases at two different aquaculture ponds in the coastal zone of southeastern China[J]. Atmospheric Environment, 2015, 115: 269-277. DOI:10.1016/j.atmosenv.2015.05.067 |
| [8] |
金宝石, 闫鸿远, 杨平, 等. 闽江河口养虾塘沉积物氧化亚氮产生及影响因素研究[J]. 农业工程学报, 2019, 35(2): 213-220. JIN B S, YAN H Y, YANG P, et al. Study on production processes of nitrous oxide and its influencing factors from sediment of aquaculture ponds in Min River estuary[J]. Transactions of the Chinese Society of Agricultural Engineering, 2019, 35(2): 213-220. |
| [9] |
金宝石, 杨平, 赵宽, 等. 闽江河口养殖塘水体溶存氧化亚氮浓度及扩散通量研究[J]. 环境科学学报, 2019, 39(7): 2296-2305. JIN B S, YANG P, ZHAO K, et al. Dissolved nitrous oxide concentration and diffusive nitrous oxide fluxes in the aquaculture ponds in the Min River estuary[J]. Acta Scientiae Circumstantiae, 2019, 39(7): 2296-2305. |
| [10] |
宋红丽, 刘兴土, 文波龙. 黄河三角洲养殖塘水-气界面CO2、CH4和N2O通量特征[J]. 生态环境学报, 2017, 26(9): 1554-1561. SOGN H L, LIU X T, WEN B L. Greenhouse gases fluxes at water-air interface of aquaculture ponds in the Yellow River estuary[J]. Ecology and Environmental Sciences, 2017, 26(9): 1554-1561. |
| [11] |
YUAN J J, XIANG J, LIU D Y, et al. Rapid growth in greenhouse gas emissions from the adoption of industrial scale aquaculture[J]. Nature Climate Change, 2019, 9: 318-322. DOI:10.1038/s41558-019-0425-9 |
| [12] |
罗国芝, 邵李娜. 水产养殖活动中N2O的排放研究进展[J]. 中国水产科学, 2019, 26(3): 604-619. LUO G Z, SHAO L N. Analysis of current research status and prospects of N2O emission from aquaculture production[J]. Journal of Fishery Sciences of China, 2019, 26(3): 604-619. |
| [13] |
丁维新, 袁俊吉, 刘德燕, 等. 淡水养殖系统温室气体CH4和N2O排放量研究进展[J]. 农业环境科学学报, 2020, 39(4): 749-761. DING W X, YUAN J J, LIU D Y, et al. CH4 and N2O emissions from freshwater aquaculture[J]. Journal of Agro - Environment Science, 2020, 39(4): 749-761. |
| [14] |
杨平, 谭立山, 金宝石, 等. 九龙江河口区养虾塘水体营养盐与叶绿素a含量的变化特征及影响因素[J]. 湿地科学, 2017, 15(6): 794-801. YANG P, TAN L S, JIN B S, et al. Variation of nutrients and chlorophyll a contents in the shrimp ponds of Jiulong River estuary and their influencing factors[J]. Wetland Science, 2017, 15(6): 794-801. |
| [15] |
汪旭明, 任洪昌, 仝川. 盐度对河口潮汐湿地温室气体产生和排放的影响研究进展[J]. 湿地科学, 2014, 12(6): 814-820. WANG X M, REN H C, TONG C. Effect of salinity on production and emission of greenhouse gases in estuarine tidal wetlands: A review[J]. Wetland Science, 2014, 12(6): 814-820. |
| [16] |
兰晶. 养殖塘水体温室气体的溶存与排放及其影响因素研究[D]. 武汉: 华中农业大学, 2015. LAN J. Greenhouse gases concentration, emission and influence factors in farming waters[D]. Wuhan: Huazhong Agricultural University, 2015. |
| [17] |
LIU S W, HU Z Q, WU S, et al. Methane and nitrous oxide emissions reduced following conversion of rice paddies to inland crab-fish aquaculture in southeast China[J]. Environmental Science & Technology, 2015, 50(2): 633-642. |
| [18] |
MA Y C, SUN L Y, LIU C Y, et al. A comparison of methane and nitrous oxide emissions from inland mixed-fish and crab aquaculture ponds[J]. Science of the Total Environment, 2018, 637/638: 517-523. DOI:10.1016/j.scitotenv.2018.05.040 |
| [19] |
YANG P, LAI D, HUANG J F, et al. Effect of drainage on CO2, CH4, and N2O fluxes from aquaculture ponds during winter in a subtropical estuary of China[J]. Journal of Environmental Sciences, 2018, 65: 72-82. DOI:10.1016/j.jes.2017.03.024 |
| [20] |
ALONGI D M, PFITZNER J, TROTT L A, et al. Rapid sediment accumulation and microbial mineralization in forests of the mangrove kandelia candel in the Jiulongjiang estuary, China[J]. Estuarine Coastal and Shelf Science, 2005, 63(4): 605-618. DOI:10.1016/j.ecss.2005.01.004 |
| [21] |
WU J Z, CHEN N W, HONG H S, et al. Direct measurement of dissolved N2 and denitrification along a subtropical river-estuary gradient, China[J]. Marine Pollution Bulletin, 2013, 66(1/2): 125-134. |
| [22] |
WANG L, ZHANG G L, ZHU Z Y, et al. Distribution and sea-to-air flux of nitrous oxide in the East China Sea during the summer of 2013[J]. Continental Shelf Research, 2016, 123: 99-110. DOI:10.1016/j.csr.2016.05.001 |
| [23] |
詹力扬, 陈立奇, 张介霞, 等. 冬季九龙江河口表层水体N2O分布特征及海气通量的初步研究[J]. 台湾海峡, 2011, 30(2): 189-195. ZHAN L Y, CHEN L Q, ZHANG J X, et al. Distribution of N2O in the Jiulongjiang River estuary and estimation of its air-sea flux during winter[J]. Journal of Oceanography in Taiwan Strait, 2011, 30(2): 189-195. |
| [24] |
谭永洁, 王东启, 周立旻, 等. 河流氧化亚氮产生和排放研究综述[J]. 地球与环境, 2015, 43(1): 123-132. TAN Y J, WANG D Q, ZHOU L M, et al. Review on the production and emission of nitrous oxide from rivers[J]. Earth and Environment, 2015, 43(1): 123-132. |
| [25] |
杨平, 金宝石, 谭立山, 等. 九龙江河口区养虾塘沉积物-水界面营养盐交换通量特征[J]. 生态学报, 2017, 37(1): 192-203. YANG P, JIN B S, TAN L S, et al. Temporal variation of nutrients fluxes across the sediment-water interface of shrimp ponds and influencing factors in the Jiulong River estuary[J]. Acta Ecologica Sinica, 2017, 37(1): 192-203. |
| [26] |
谭立山, 杨平, 徐康, 等. 闽江河口短叶茳芏湿地及围垦后的养虾塘N2O通量比较[J]. 中国环境科学, 2017, 37(10): 3929-3939. TAN L S, YANG P, XU K, et al. Comparison of N2O flux following brackish Cyperus malaccensis marsh conversion to shrimp pond in the Min River estuary[J]. China Environmental Science, 2017, 37(10): 3929-3939. |
| [27] |
孙志高, 牟晓杰, 王玲玲. 滨海湿地生态系统N2O排放研究进展[J]. 海洋环境科学, 2010, 29(1): 159-164. SUN Z G, MOU X J, WANG L L. Research advance on nitrous oxide(N2O)emission from coastal wetland ecosystem[J]. Marine Environmental Science, 2010, 29(1): 159-164. |
| [28] |
孙文广, 孙志高, 甘卓亭, 等. 黄河口不同恢复阶段湿地土壤N2O产生的不同过程及贡献[J]. 环境科学, 2014, 35(8): 3110-3119. SUN W G, SUN Z G, GAN Z T, et al. Contribution of different processes in wetland soil N2O production in different rstoration phases of the Yellow River estuary, China[J]. Environmental Science, 2014, 35(8): 3110-3119. |
| [29] |
朱永官, 王晓辉, 杨小茹, 等. 农田土壤N2O产生的关键微生物过程及减排措施[J]. 环境科学, 2014, 35(2): 792-800. ZHU Y G, WANG X H, YANG X R, et al. Key microbial processes in nitrous oxide emissions of agricultural soil and mitigation strategies[J]. Environmental Science, 2014, 35(2): 792-800. |
| [30] |
BIANCHI M, FELIATRA F, LEFEVRE D. Regulation of mitrification in the land-ocean contact area of the Rhone River plume(NW Mediterranean)[J]. Aquatic Microbial Ecology, 1999, 18(3): 301-312. |
| [31] |
YANG L B, TAN W J, MA P, et al. Seasonal and diurnal variations in N2O concentrations and fluxes from three eutrophic rivers in southeast China[J]. Journal of Geographical Sciences, 2011, 21(5): 54-66. |
| [32] |
蔡延江, 丁维新. 农田土壤N2O和NO排放的影响因素及其作用机制[J]. 土壤, 2012, 44(6): 881-887. CAI Y J, DING W X. Factors controlling N2O and NO emissions from agricultural soils and their influencing mechanisms: A review[J]. Soils, 2012, 44(6): 881-887. |
| [33] |
刘运通, 李玉娥, 万运帆, 等. 不同氮磷肥施用对春玉米农田N2O排放的影响[J]. 农业环境科学学报, 2011, 30(7): 1468-1475. LIU Y T, LI Y E, WAN Y F, et al. Nitrous oxide emissions from springmaize field under the application of different nitrogen and phosphorus fertilizers[J]. Journal of Agro - Environment Science, 2011, 30(7): 1468-1475. |
| [34] |
AN S, JOYE S B. Enhancement of coupled nitrification-denitrification by benthic photosynthesis in shallow estuarine sediments[J]. Limnology and Oceanography, 2001, 46(1): 62-74. |
| [35] |
ABE D S, MATSUMURA-TUNDISI T, ROCHA O, et al. Denitrification and bacterial community structure in the cascade of six reservoirs on a tropical river in Brazil[J]. Hydrobiologia, 2003, 504(1/2/3): 67-76. |
 2021, Vol. 40
2021, Vol. 40