植物对阳光的依赖性导致它们不可避免地暴露于紫外线(UV)中,其中包括波长范围在280~320 nm的UV-B[1]。该波长范围可能会对DNA、RNA和蛋白质造成破坏,还会导致自由基产生[2]。通常UV-B辐射在植物分子、细胞、器官、个体甚至生态系统水平上都会对其产生影响,干预植物生理生化代谢过程及相关基因表达与调控[3]。然而,植物被损伤的迹象却很少,这是因为植物进化出了有效的保护手段来抵御UV-B辐射,如积累在植物外层组织中的酚类化合物的作用。
酚类化合物是一种具有生物活性的苯基丙烷类化合物,类黄酮、酚酸、原花青素等酚类化合物遍及整个植物界,酚类化合物具有吸收UV-B辐射和清除活性氧自由基的双重功能[4]。目前,在UV-B辐射增强对水稻叶片及其他植物酚类化合物含量的影响方面的研究较多[5-6],但关于UV-B辐射增强对水稻籽粒体内的酚类含量及其清除自由基能力的研究较少。大量研究表明酚类物质有极强的清除自由基的能力[7-8],是一类天然的抗氧化剂[9],所以其在食品、化妆品、药品和保健品等领域被广泛使用,是极具市场开发价值和经济价值的天然产物,也是国内外研究的热门物质。
水稻(Oryza sativa L.)是世界上产量和消费量最大的谷物之一,在健康与饮食的关系中起着重要的作用[10]。有研究在水稻中发现了几种具有抗氧化活性的化合物,包括酚类化合物、生育酚和谷维素[11]。稻米中的酚类化合物能有效抑制活性氧(ROS)的产生并使其失活,具有延缓衰老、增强抗应激反应及免疫调节机能等生理功能,还可以降低癌症、肝纤维化、高胆固醇和心血管疾病的发生率[12-13]。我国目前在水稻种植资源中有色稻占10% 左右,红米水稻占有色稻首位,有8 963份[14],而红米中黄酮类等酚类化合物含量显著高于白米[15]。为了明确UV-B辐射增强对水稻籽粒形成和酚类化合物含量及其抗氧化能力的影响,本研究以元阳梯田传统稻种“白脚老粳”为材料,白脚老粳是元阳哈尼梯田地方红米水稻品种,栽培历史悠久,是种质资源有效保护、可持续发展研究的极佳材料。通过大棚盆栽模式,增加不同强度的UV-B辐射,研究不同UV-B辐射强度对红米生长和籽粒中酚类化合物含量的变化特征,并通过1,1-二苯基-2-三硝基苯肼(DPPH)自由基、2,2 ′ -联氮-双- 3-6-磺酸(ABTS)自由基和羟基自由基3项指标对红米籽粒中酚类化合物的抗氧化活性进行评估,测定其抗氧化能力,以期为红米中天然抗氧化剂——酚类化合物的研究及产业开发提供科学依据。
1 材料与方法 1.1 试验设计盆栽水稻,供试水稻为元阳哈尼梯田的农家红米水稻品种——白脚老粳(OryzamIaponicamantiquam cum pedibusalbis)。每盆插水稻9穴,每穴2~3株,4个处理,3个重复,共12盆。盆的大小为40 cm×35 cm× 25 cm,每盆装土35 kg。所用土为云南农业大学后山土(25°14 ′ 30 ″ N,102°56 ′ 27 ″ E),红壤,有机质含量为29.59 g·kg-1、全氮含量为2.49 g·kg-1、碱解氮含量为54.73 mg·kg-1、全磷含量为13.21 g·kg-1、速效磷含量为82.56 mg·kg-1、全钾含量为16.06 g·kg-1、速效钾含量为519.53 mg·kg-1。
UV-B辐射处理:每个UV-B辐射处理架设两盏紫外灯管在水稻植株上方(紫外灯管为40 W,波长280~320 nm,上海顾村仪器厂生产),水稻植株顶端辐射强度测定使用UV-B辐射测定仪(北京师范大学光电仪器厂生产)。在自然条件下设自然光(0 kJ·m-2)和UV-B辐射(2.5、5.0、7.5 kJ·m-2·d-1,分别记为UV- B-1、UV-B-2、UV-B-3。即将灯管分别距离水稻60、40、20 cm)4组处理,紫外灯辐射时间为每日7 h(10:00—17:00),阴天和雨天关闭紫外灯,不进行UV-B辐射处理。观察水稻的生长状态并随着水稻生长手动调节灯管高度,以保持辐射强度不变。盆内水高出土2 cm左右,使水稻长期处于淹水状态。2019年8月15日水稻进入孕穗期开始照灯,10月9日收获水稻后停止试验,其中13 d是阴天或雨天,没有进行紫外线照射。试验期间分别进行籽粒乳熟期、蜡熟期和完熟期的采样保存,以备各指标测定使用。
1.2 指标测定 1.2.1 生长指标10月9日水稻收获后,每个处理随机取10株水稻测定其粒长粒宽、千粒质量、生物量等生长指标,测量方式为常规测量。
每株籽粒生物量的测定:籽粒收获后,将水稻籽粒用水轻轻冲洗干净,然后在通风且无阳光直射的室内自然风干。装入牛皮纸袋内,放入80 ℃烘箱烘至质量恒定,期间每隔24 h测定一次质量直到质量恒定,然后迅速称量烘干后的籽粒质量。
1.2.2 酚类化合物的提取准确称取水稻籽粒0.5 g,加入10 mL 70% 甲醇提取液,用匀浆机均质,超声45 min后在10 000 r·min-1下冷冻离心,过滤,取上清液1 mL用70% 甲醇稀释至50 mL,得待测样品溶液,备用。
1.2.3 总酚含量的测定参照ASSUMPCAO等[16]的方法,并稍加修改。采用福林酚法测定总酚含量。准确移取样品液1 mL于25 mL容量瓶中,加2 mL福林酚试剂混合反应6 min,再加入3 mL 7.5% 的Na2CO3溶液反应1 h,然后在765 nm波长下测定吸光度值。以没食子酸为对照品,测定100 g水稻籽粒中总酚的含量。
1.2.4 总黄酮含量的测定参照GHASEMZADEH等[17]的方法,并稍加修改。采用三氯化铝分光光度法。准确移取1 mL样品于25 mL容量瓶中,加1 mL 5% 的NaNO3溶液静置6 min后再加入1 mL 10% 的Al(NO3)3溶液,再静置6 min,最后加入10 mL 4% 的NaOH溶液,用30% 的乙醇定容至25 mL后静置15 min,在510 nm波长下测定吸光度。以芦丁为对照品,测定100 g水稻籽粒中总黄酮的含量。
1.2.5 总酚酸含量的测定取1 mL待测样品置于50 mL容量瓶,加无水乙醇至5 mL,加0.3% 十二烷基苯硫酸钠2 mL及0.6% 三氯化铁-0.9% 铁氰化钾(1∶1)混合溶液1 mL,混匀,暗处放置5 min。加0.1 mol·L-1的盐酸溶液至50 mL,摇匀,在暗处放置20 min。以显色剂为空白,在750 nm波长处测定吸光度。
1.2.6 清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基活性的测定参照陈克克等[18]的方法,并稍加修改。在4 mL 2×10-4 mol·L-1的DPPH溶液中加入1 mL样品提取液,静置0.5 h后在517 nm下测定吸光值Ai。同时在4 mL 2×10-4 mol·L-1的DPPH溶液中加入1 mL乙醇溶液,测定吸光值Ac。

|
式中:Ai代表加样品的吸光值;Ac代表未加样品的吸光值。
1.2.7 清除2,2 ′ -联氮-双-3-6-磺酸[2,2 ′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS] 自由基活性的测定参照CHEN等[19]的方法,并稍加修改。移取0.1 mL样品稀释液和0.1 mL抗坏血酸标准溶液于10 mL离心管,加入3.9 mL ABTS标准溶液,混匀,在室温下反应6 min,734 nm下测定吸光度AE。移取0.1 mL 70% 的乙醇,加入3.9 mL ABTS标准溶液,测定吸光度AB。

|
参照涂云飞等[20]的方法,并稍加修改。采用水杨酸捕捉羟自由基法测定。依次加入1 mL 9 mmol·L-1水杨酸-乙醇溶液和1 mL的提取液于试管,再加入1 mL 9 mmol·L-1Fe2+溶液和7 mL蒸馏水于试管,最后加入10 mL 88 mmol·L-1 H2O2,以此启动Fenton反应,摇匀后在紫外分光光度计510 nm处测定吸光度A1;另外取1 mL的蒸馏水代替9 mmol·L-1 Fe2+溶液,测得吸光度为A2;最后取1 mL蒸馏水代替样品提取液所测得的吸光度为A3。

|
利用Microsoft Excel进行数据处理,计算平均值和方差。利用统计软件SPSS 20进行单因素差异分析,采用Duncan检验法进行处理间的差异性分析。用Origin 9.1做图。
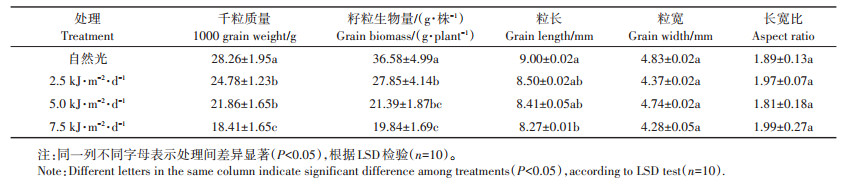
2 结果与分析 2.1 不同UV-B强度对白脚老粳籽粒形态的影响不同强度的UV-B辐射对水稻籽粒形态的影响不同(表 1)。水稻籽粒的千粒质量、生物量随着UV-B辐射的增强呈降低趋势。在UV-B辐射增加到UV-B-1时,已显著降低,伴随着UV-B辐射强度继续增加,UV-B辐射的抑制效应更加明显,当UV- B辐射强度增加到UV-B-3时,相较于自然光每株籽粒生物量下降了45.8%,千粒质量降低了34.9%。水稻籽粒粒宽和长宽比随着UV-B辐射增强无显著变化,但粒长在UV - B - 3时显著降低,降幅达到8.1%。
|
|
表 1 不同UV-B辐射强度对籽粒形态的影响 Table 1 Effects of different UV-B radiation intensities on grain morphology |
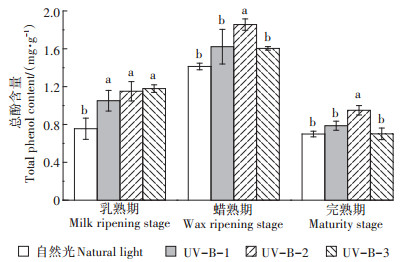
如图 1所示,乳熟期、蜡熟期和完熟期,UV-B-2辐射处理下白脚老粳水稻籽粒的总酚含量均较自然光处理显著增加。在乳熟期,相较于自然光处理,UV-B-1、UV-B-2和UV-B-3辐射处理的总酚含量显著增加,增幅分别为39.3%、52.5% 和56.2%;而当水稻长至蜡熟期,UV-B-1辐射处理下水稻籽粒总酚含量与自然光处理无显著差异,UV-B-2辐射处理总酚含量仍显著增高,相较于自然光和UV-B-1处理增幅分别为31.4% 和14.4%,UV-B-3辐射处理下水稻籽粒总酚含量较UV-B-2处理显著降低,但仍高于自然光处理;当水稻长至完熟期时,UV-B-2辐射处理总酚含量相较于自然光和UV-B-1辐射处理显著增加,增幅分别为35.8% 和20.6%,UV-B-3辐射处理相较于UV-B-2辐射处理水稻籽粒总酚含量显著降低。
|
不同小写字母表示处理间差异显著(P < 0.05)。下同 Different lowercase letters indicate significant differences among treatments(P < 0.05). The same below 图 1 UV-B辐射增强对水稻籽粒总酚含量的影响 Figure 1 Effects of enhanced UV-B radiation on total phenol content in rice grains |
综上可知,一定的UV-B辐射促进了3个时期水稻籽粒总酚含量的增加,在蜡熟期和完熟期,5.0 kJ·m-2·d-1的UV-B辐射处理下总酚含量增幅最大,当UV-B辐射超过5.0 kJ·m-2·d-1时总酚含量会显著下降。
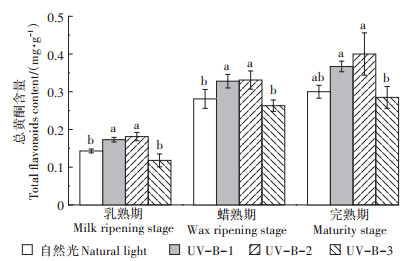
2.2.2 UV-B辐射对总黄酮含量的影响如图 2所示,UV-B-1和UV-B-2辐射处理下白脚老粳水稻籽粒体内总黄酮含量在乳熟期和蜡熟期均显著增加,乳熟期总黄酮含量增幅分别为21.5% 和25.6%,蜡熟期增幅分别为16.7% 和17.6%;而在完熟期,UV-B-1和UV-B-2辐射处理总黄酮含量相较自然光无显著差异。UV-B-3辐射处理下的总黄酮含量相较于其他两个辐射强度均显著下降。
|
图 2 UV-B辐射增强对水稻籽粒总黄酮含量的影响 Figure 2 Effects of enhanced UV-B radiation on total flavonoids content in rice grains |
以上结果表明,在一定的UV-B辐射下总黄酮含量会显著增加,其中5.0 kJ·m-2·d-1的UV-B辐射处理增幅最大,超过这个适宜的辐射强度后总黄酮含量就会显著下降。
2.2.3 UV-B辐射对总酚酸含量的影响如图 3所示,在乳熟期和蜡熟期,UV-B-1和UV- B-2辐射处理总酚酸含量显著上升,乳熟期总酚酸含量分别增加了20.3% 和22.4%,蜡熟期分别增加了20.4% 和24.3%;完熟期UV-B-1辐射处理总酚酸含量虽然有所上升,但与自然光相比无显著差异,UV- B-2辐射处理含量显著升高,增幅为28.7%,UV-B-3辐射处理导致3个时期的总酚酸含量较其他两个UV-B处理均显著降低。

|
图 3 UV-B辐射增强对水稻籽粒总酚酸含量的影响 Figure 3 Effects of enhanced UV-B radiation on total phenolic acid content in rice grains |
由以上结果可知,UV-B辐射处理可以显著诱导水稻籽粒产生酚酸,但辐射强度过高会显著抑制酚酸的产生。
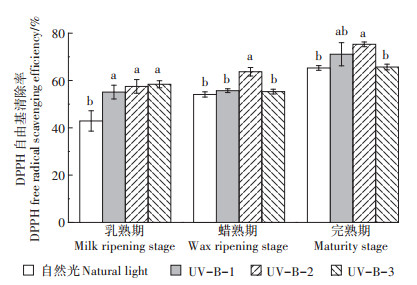
2.3 UV-B辐射增强对酚类清除自由基的影响 2.3.1 UV-B辐射对DPPH自由基清除率的影响如图 4所示,UV-B-2辐射处理下酚类化合物对DPPH自由基的清除率在3个时期中均最高,均与自然光处理有显著差异。在乳熟期,UV-B-1、UV-B-2和UV-B-3辐射处理与自然光相比去除率均有显著上升,分别增加了13、15个和16个百分点;当水稻进入蜡熟期,UV-B-2辐射处理下酚类化合物对DPPH自由基的清除率相较于自然光和UV-B-1辐射处理均显著上升,但UV-B-3辐射处理时酚类化合物对DPPH自由基的清除率在UV-B-2辐射处理基础上显著下降;在水稻完熟期,UV-B-1辐射处理时酚类化合物对DPPH自由基的清除率相较于自然光有所上升,但无显著差异,UV-B-2和UV-B-3辐射处理效果与蜡熟期一致。
|
图 4 UV-B辐射增强对DPPH自由基清除率的影响 Figure 4 Effects of enhanced UV-B radiation on free radical scavenging rate of DPPH |
由以上结果可知,5.0 kJ·m-2·d-1的UV-B辐射处理下酚类化合物对DPPH自由基的清除效果最为显著,高于该辐射强度后酚类化合物对DPPH自由基的清除率会显著下降。
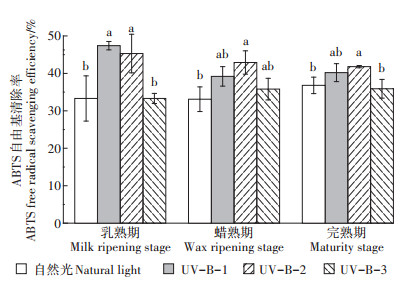
2.3.2 UV-B辐射对ABTS自由基清除率的影响如图 5所示,水稻乳熟期时UV-B-1和UV-B-2辐射处理下酚类化合物对ABTS自由基的清除率与自然光处理相比显著上升,UV-B-3辐射处理较UV-B-2处理又显著下降;水稻蜡熟期UV-B-1、UV-B-2和UV-B-3辐射处理酚类化合物对ABTS自由基的清除率相互之间无显著差异,UV-B-1和UV-B-3辐射处理相较于自然光处理有所上升,但无显著差异,仅有UV-B-2辐射处理时酚类化合物对ABTS自由基的清除率显著高于自然光处理;当水稻进入完熟期,UV-B-1和UV-B-2辐射处理时酚类化合物对ABTS自由基的清除率与蜡熟期无异,即UV-B-2辐射处理时清除率最高,UV-B-3辐射处理后清除率又较UV-B-2处理显著下降。
|
图 5 UV-B辐射增强对ABTS自由基清除率的影响 Figure 5 Effects of enhanced UV-B radiation on free radical scavenging rate of ABTS |
以上结果表明,一定的UV-B辐射强度有助于增强酚类化合物对ABTS自由基的清除能力,但超过这个适宜的强度后清除率便会显著下降。
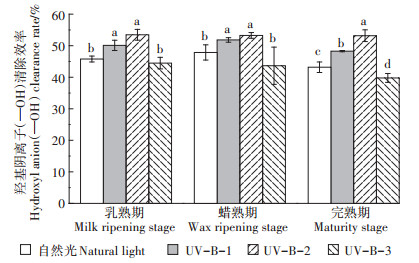
2.3.3 UV-B辐射对—OH自由基清除率的影响如图 6所示,在乳熟期、蜡熟期和完熟期UV-B辐射增强显著提高了酚类化合物对—OH自由基的清除率,3个时期的UV-B-1和UV-B-2辐射处理都有助于清除—OH自由基,且相较于自然光均有显著差异。另外,3个时期的UV-B-3辐射处理下酚类化合物对—OH自由基的清除率均较其他两个UV-B辐射处理显著下降,尤其是在完熟期。
|
图 6 UV-B辐射增强对羟基自由基(—OH)清除率的影响 Figure 6 Effects of enhanced UV-B radiation on the scavenging rate of hydroxyl radica(l —OH) |
以上结果表明,UV-B辐射增强有助于酚类化合物清除—OH自由基,但在7.5 kJ·m-2·d-1的UV-B辐射处理下酚类对—OH自由基的清除能力会显著降低。
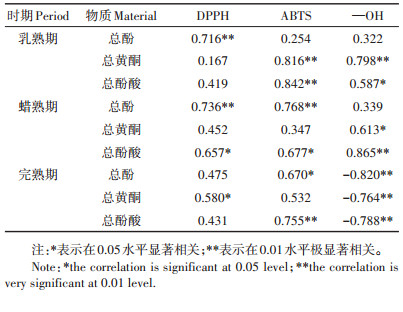
2.4 酚类含量与自由基的相关性由表 2可知,在乳熟期,UV-B辐射增强对DPPH自由基的清除率有极显著作用;总黄酮对ABTS、—OH自由基具有极显著清除作用;总酚酸含量与ABTS自由基清除率呈极显著正相关,与—OH自由基清除率呈显著正相关。在蜡熟期,UV-B辐射增强总酚对DPPH、ABTS自由基有极显著的清除作用;总黄酮对—OH自由基有显著的清除作用;总酚酸对DPPH、ABTS自由基有显著的清除作用,对—OH自由基有极显著清除作用。在完熟期,总酚含量与ABTS自由基清除率呈显著正相关关系,总黄酮与DPPH自由基清除率呈显著正相关关系,总酚酸对ABTS自由基具有极显著的清除作用,但是3个物质含量与—OH自由基清除率呈极显著负相关。
|
|
表 2 酚类含量与自由基的相关性 Table 2 Correlation between phenolic content and free radicals |
UV-B辐射会影响红米籽粒形态,且随着UV-B辐射地增强,水稻籽粒的千粒质量、生物量都不同程度地降低,这可能是因为水稻进入生殖生长期后,特别是抽穗后,UV-B辐射抑制了上部叶片的光合作用,从而使输送给籽粒的光合产物变少,导致灌浆不充分、籽粒厚度下降,大粒米比例也变少,最终导致籽粒生物量等下降[21]。但水稻籽粒形态是受多基因、多途径调控的复杂性状[22]。此外,当水稻籽粒持续暴露于较高强度UV-B辐射下,会使叶绿素含量下降,水稻叶片和籽粒出现褪绿斑,最终导致坏死(图 7)。

|
图 7 自然光处理与UV-B辐射处理下水稻籽粒形态对比图 Figure 7 Comparison of rice grain morphology under natural light treatment and UV-B radiation treatments b |
低强度的UV-B辐射可以起到调节信号的作用,植物对此有特殊的感知,以适应在阳光下生存,植物的保护作用基于多种基因的表达,包括在表皮组织中酚类化合物的合成[23]。有学者以青蒿为实验模型,研究了UV-B辐射对类黄酮生物合成的表观遗传调控。离体繁殖和驯化的植株在低强度UV-B辐射处理后采用高效液相色谱仪测定11个类黄酮化合物的含量,又检测了8个基因,结果发现在UV-B辐射下,黄酮生物合成途径上游PAL、C4H等基因和下游CHS、DFR、F3H等基因的表达上调,其中苯丙氨酸解氨酶的转录及蛋白表达上调最为显著[24]。在UV-B辐射下,植物通过积累花青素、类黄酮等酚类化合物实现自我保护[25]。有报道显示,UV-B辐射能诱导药用植物和采后果实中花青素的积累,同时其也刺激了吸收UV-B的黄酮类化合物的产生和抗氧化活性酶的合成[26]。研究表明UV-B处理使低海拔地区采集的野生马铃薯叶片中的酚类化合物含量增加[27]。而且,萝卜植株经增强UV-B辐射处理后,地下器官的类黄酮含量增加[28]。本研究中,3个时期5.0 kJ·m-2·d-1的UV-B辐射处理下,水稻体内的酚类化合物含量都显著增加,这是因为UV-B能诱导植物体内CHS、DFR、F3H等基因过表达,从而激活合成酚类化合物的酶,使酚类积累[29],这与大田试验结果相同[30-31]。
但当UV-B辐射增加到7.5 kJ·m-2·d-1时,水稻体内的类黄酮等酚类含量都显著下降,这可能是UV-B辐射强度过大,超过了水稻耐性范围,导致还原糖含量降低,合成酚类前体物质减少,最后直接影响酚类化合物的积累[32]。在长时间的UV-B暴露下,类黄酮与羟基肉桂酸的比例急剧增加[33],而后者在低剂量UV-B辐射过的植物中更为普遍[34]。UV-B辐射属于逆境,植物在逆境中会促进酚类合成,但超过耐性范围后,酚类合成途径被破坏,酚类化合物含量开始下降[35]。研究发现,荒漠植物红砂在增强的UV-B辐射胁迫下,其类黄酮代谢途径的关键酶F3H的活性先显著升高后显著降低,类黄酮含量也相应先显著升高后显著降低[36]。这与本研究UV-B辐射对红米籽粒酚类化合物的影响相同。这些结果说明酚类化合物的积累不仅与植物基因型有关,还与辐射强度有关,且UV-B辐射强度与酚类化合物含量的关系可以用二次多项式来描述[37]。
UV-B辐射在植物细胞中会产生不同的效应,这些效应随辐射剂量的变化而变化。UV-B对H2O2的直接作用会引发自由基的产生,如羟基和碳中心(甲基样)自由基。这可能会通过膜脂和蛋白质的过氧化而对光合作用造成损害[38]。此外,在保护酶系统中,超氧化物歧化酶(SOD)将超氧阴离子(O2-·)歧化为H2O2和O2-·,H2O2和O2-·可以产生毒性更强的—OH[39]。酚类物质能清除自由基,位于类黄酮物质结构的3位点处的一个羟基基团,能有效抑制自由基积累[40-41]。本实验中,从酚类含量与自由基清除率的相关性可知,5.0 kJ·m-2·d-1的UV-辐射处理下酚类化合物对DPPH、ABTS和—OH自由基的清除率都显著增强。
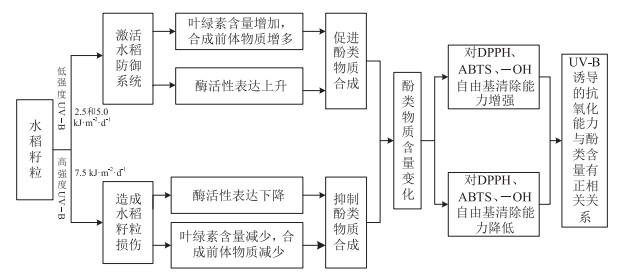
但增加UV-B辐射到7.5 kJ·m-2·d-1后酚类清除自由基的能力会显著降低,这可能是该辐射强度已经超过了红米籽粒中酚类的耐受程度,导致合成酚类的途径被破坏,以致含量下降,从而使清除自由基的能力下降,此结果与采用光谱法测定酚类化合物清除—OH自由基和DPPH自由基的结果相同:在一定的浓度范围内,酚类物质对这两种自由基都有较强的清除作用[42]。本试验中,完熟期的总酚、总黄酮含量与—OH自由基的清除率都呈极显著的负相关关系,这可能是因为水稻生长到完熟期,酚类化合物的结构与—OH自由基相互作用导致体内活性成分被破坏,使其失去清除—OH自由基的能力。有研究也得出相似的结果:植物合成酚类化合物的酶会被长时间高强度的UV-B辐射破坏,从而抑制酚类含量的积累,其清除活性氧自由基的能力也相应地被削弱[43]。本试验中水稻籽粒体内的类黄酮等酚类化合物的合成酶被长时间高强度的UV-B辐射破坏,使酚类含量降低,水稻籽粒防御能力下降,从而导致了活性氧自由基的积累(图 8)。
|
图 8 UV-B辐射增强对红米籽粒酚类化合物含量及其抗氧化能力的影响 Figure 8 Effects of enhanced UV-B radiation on phenolic compounds content and antioxidant capacity of red rice seeds |
UV-B辐射对酚类化合物的影响是一个热门的研究方向,但各酚类物质的提取及测定方法急需统一标准化。本试验为盆栽试验,局限于生长环境的限制。今后需将大田和室内盆栽试验相结合,开展长期系统的研究,更加深入地研究UV-B辐射对红米籽粒各酚类物质的影响,以期进一步为红米酚类物质及其抗氧化活性的研究提供理论依据。
4 结论(1)UV-B辐射增强会影响红米水稻的生理形态,降低红米水稻籽粒粒长、粒宽、千粒质量、生物量和产量。
(2)2.5 kJ·m-2·d-1和5.0 kJ·m-2·d-1 UV-B辐射处理使红米水稻酚类化合物含量显著上升,7.5 kJ·m-2·d-1 UV-B辐射处理下酚类化合物含量显著下降。UV-B辐射增强对红米水稻酚类化合物含量呈现低浓度促进高浓度抑制的作用。
(3)UV-B诱导的红米水稻籽粒的抗氧化能力与酚类化合物含量有显著的正相关关系,但完熟期酚类化合物含量与羟基自由基清除率呈极显著的负相关关系。
| [1] |
MATEJA G, INGRID S, ALENKA G. Morphological, biochemical and physiological responses of Indiancress(Tropaeolum majus)to elevated UV-B radiation[J]. PeriodicumBiologorum, 2015, 117(3): 357-364. |
| [2] |
RIES G, HELLER W, PUCHTA H, et al. Elevated UV-B radiation reduces genome stability in plants[J]. Nature: International Weekly Journal of Science, 2000, 406(6791): 98-101. |
| [3] |
GUPTA S, GUPTA V, SINGH V, et al. Extrapolation of significant genes and transcriptional regulatory networks involved in Zea mays in response in UV-B stress[J]. Genes Genom, 2018, 40(9): 973-990. DOI:10.1007/s13258-018-0705-1 |
| [4] |
DAVIES K M, ALBERT N W, ZHOU Y, et al. Functions of flavonoid and betalain pigments in abiotic stress tolerance in plants[J]. Annual Plant Reviews Online, 2018, 1(1): 1-41. |
| [5] |
齐艳, 邢燕霞, 郑禾, 等. UV-A和UV-B提高甘蓝幼苗花青素含量以及调控基因表达分析[J]. 中国农业大学学报, 2014, 19(2): 86-94. QI Y, XING Y X, ZHENG H., et al. UV-A and UV-B involved in induction and regulation of anthocyanin biosynthesis in cabbage[J]. Journal of China Agricultural University, 2014, 19(2): 86-94. |
| [6] |
何永美, 湛方栋, 祖艳群, 等. 大田条件下UV-B辐射对元阳梯田2个地方水稻品种硅、类黄酮和总酚含量的影响[J]. 农业环境科学学报, 2013, 32(8): 1500-1506. HE Y M, ZHAN F D, ZU Y Q, et al. Effects of UV-B radiation on the contents of silicon, flavonoids and total phenolic of two local rice varieties in Yuanyang terrace under field conditions[J]. Journal of Agro - Environment Science, 2013, 32(8): 1500-1506. |
| [7] |
陈子涵, 蒋继宏, 鞠秀云, 等. 各食用米中活性成分及其抗氧化活性[J]. 食品工业科技, 2018, 39(3): 71-75, 81. CHEN Z H, JIANG J H, JU X Y, et al. The bioactive compounds and their antioxidant activity of kinds of edible rice[J]. Science and Technology of Food Industry, 2018, 39(3): 71-75, 81. |
| [8] |
曹贵寿, 张倩茹, 尹蓉, 等. 不同草莓品种酚类物质含量及抗氧化能力研究[J]. 农学学报, 2018, 8(2): 35-41. CAO G S, ZHANG Q R, YIN R, et al. Content of phenlic compounds and antioxidant of different strawberry varieties[J]. Journal of Agriculture, 2018, 8(2): 35-41. |
| [9] |
范智义, 袁晓金, 贾本盼, 等. 天然酚类化合物对晚期糖基化末端产物抑制作用研究进展[J]. 中国食品学报, 2019, 19(3): 306-316. FAN Z Y, YUAN X J, JIA B P, et al. Research progress of inhibitory effect of natural-derived phenolic compounds on advanced glycation end products[J]. Journal of Chinese Institute of Food Science and Technology, 2019, 19(3): 306-316. |
| [10] |
LIU R H. Whole grain phytochemicals and health[J]. Journal of Cereal Science, 2007, 46(3): 207-219. DOI:10.1016/j.jcs.2007.06.010 |
| [11] |
IRAKLI M N, SAMANIDOU V F, BILIADERIs C G, et al. Simultaneous determination of phenolic acids and flavonoids in rice using solid- phase extraction and RP-HPLC with photodiode array detection[J]. Journal of Separation Science, 2015, 35(13): 1603-1611. |
| [12] |
YAWADIO R, TANIMORI S, MORITA N. Identification of phenolic compounds isolated from pigmented rices and their aldose reductase inhibitory activities[J]. Food Chemistry, 2007, 101(4): 1616-1625. DOI:10.1016/j.foodchem.2006.04.016 |
| [13] |
REDDY A M, REDDY V S, SCHEFFLER B E, et al. Novel transgenic rice overexpressing anthocyanidin synthase accumulates a mixture of flavonoids leading to an increased antioxidant potential[J]. Metabolic Engineering, 2007, 9(1): 95-111. DOI:10.1016/j.ymben.2006.09.003 |
| [14] |
全刚, 刘志. 有色稻研究现状[J]. 种子, 2017, 36(4): 51-53. QUAN G, LIU Z. Research status of colored rice[J]. Seed, 2017, 36(4): 51-53. DOI:10.3969/j.issn.1005-2690.2017.04.035 |
| [15] |
汤翠凤, 董超, 阿新祥, 等. 云南不同种皮色地方稻种的总黄酮含量及其对种子萌发的影响[J]. 植物遗传资源学报, 2016, 17(5): 883-888. TANG C F, DONG C, A X X, et al. Flavonoids content of rice landraces with different seed coat color in Yunnan and their effects on seed germination[J]. Journal of Plant Genetic Resources, 2016, 17(5): 883-888. |
| [16] |
ASSUMPCAO C F, HERMES V S, PAGNO C, et al. Phenolic enrichment in apple skin following post-harvest fruit UV-B treatment[J]. Postharvest Biology and Technology, 2018, 138: 37-45. DOI:10.1016/j.postharvbio.2017.12.010 |
| [17] |
GHASEMZADEH A, ASHKANI S, BAGHDADI A, et al. Improvement in flavonoids and phenolic acids production and pharmaceutical quality of sweet basil(Ocimum basilicum L.)by ultraviolet-B irradiation[J]. Molecule(s Basel, Switzerland), 2016, 21(9): 1203. DOI:10.3390/molecules21091203 |
| [18] |
陈克克, 强毅. 响应面法优化超声波辅助北苍术多酚提取工艺及其DPPH自由基清除能力研究[J]. 西北大学学报(自然科学版), 2018, 48(1): 78-84. CHEN K K, QIANG Y. Optimization of ultrasonic assisted extraction of polyphenols from Atracty lodes chinensis (DC.)Koidz. using response surface methodology and evaluation of its antioxidant activity[J]. Journal of Northwest University(Natural Science Edition), 2018, 48(1): 78-84. |
| [19] |
CHEN Y H, ZHANG X R, GUO Q S, et al. Effects of UV-B radiation on the content of bioactive components and the antioxidant activity of Prunella vulgaris L. Spica during development[J]. Molecules(Basel, Switzerland), 2018, 23(5): 989. DOI:10.3390/molecules23050989 |
| [20] |
涂云飞, 杨秀芳, 孔俊豪, 等. 儿茶素及茶黄素单体间清除羟自由基能力研究[J]. 天然产物研究与开发, 2012, 24(5): 653-659. TU Y F, YANG X F, KONG J H, et al. Antioxidant capability of epi-catechins and theaflavins in vitro by scavenging hydroxyl free radical[J]. Nat Prod Res Dev, 2012, 24(5): 653-659. DOI:10.3969/j.issn.1001-6880.2012.05.019 |
| [21] |
张文会, 孙传清, 佐藤雅志, 等. 紫外线(UV-B)照射对水稻产量及稻米蛋白质含量的影响[J]. 作物学报, 2003, 29(6): 908-912. ZHANG W H, SUN C Q, SATO T, et al. Effect of supplement ultraviolet-B radiation on yield and the content of protein in rice(Oryza sativa L.)[J]. Acta Agronomica Sinica, 2003, 29(6): 908-912. DOI:10.3321/j.issn:0496-3490.2003.06.019 |
| [22] |
周梦玉, 宋昕蔚, 徐静, 等. 籼稻C84和粳稻春江16B重组自交系遗传图谱构建及籽粒性状QTL定位与验证[J]. 中国水稻科学, 2018, 32(3): 207-218. ZHOU M Y, SONG X W, XU J, et al. Construction of genetic map and mapping and verification of grain traits QTLs using recombinant inbred lines derived from a cross between indica C84 and japonica CJ16B[J]. Chinese Journal of Rice Science, 2018, 32(3): 207-218. |
| [23] |
Fraikin G Y. Signaling mechanisms regulating diverse plant cell responses to UVB radiation[J]. Biochemistry(Moscow), 2018, 83(7): 972-980. |
| [24] |
PANDEY N, GOSWAMI N, TRIPATHI D, et al. Epigenetic control of UV-B-induced flavonoid accumulation in Artemisia annua L.[J]. Planta, 2019, 249: 497-514. DOI:10.1007/s00425-018-3022-7 |
| [25] |
TAKSHAK S, AGRAWAL S B. Defence strategies adopted by the medicinal plant Coleus forskohlii against supplemental ultraviolet-B radiation: Augmentation of secondary metabolites and antioxidants[J]. Plant Physiol Biochem, 2015, 97: 124-138. DOI:10.1016/j.plaphy.2015.09.018 |
| [26] |
NGUYEN C T, LIM S, LEE J G, et al. VcBBX, VcMYB21, and VcR2R3 MYB transcription factors are involved in UV-B-induced anthocyanin biosynthesis in the peel of harvested blueberry fruit[J]. J Agric Food Chem, 2017, 65: 2066-2073. DOI:10.1021/acs.jafc.6b05253 |
| [27] |
RUIZ V E, INTERDONATO R, CERIONI L, et al. Short-term UV-B exposure induces metabolic and anatomical changes in peel of harvested lemons contributing in fruit protection against green mold[J]. Journal of Photochemistry and Photobiology B: Biology, 2016, 159: 59-65. DOI:10.1016/j.jphotobiol.2016.03.016 |
| [28] |
NITHIA S M J, SHANTHI N, KULANDAIVELU G. Different responses to UV-B enhanced solar radiation in radish and carrot[J]. Photosynthetica, 2005, 43(2): 307-311. DOI:10.1007/s11099-005-0051-9 |
| [29] |
李想, 谢春梅, 何永梅, 等. UV-B辐射与稻瘟病菌复合胁迫对元阳梯田水稻生长和光合特性的影响[J]. 农业环境科学学报, 2018, 37(4): 613-620. LI X, XIE C M, HE Y M, et al. Effects of complex UV-B radiation and Magnaporthe oryzae stresses on the growth and photosynthetic characteristics of rice in Yuanyang Terrace, China[J]. Journal of Agro-Environment Science, 2018, 37(4): 613-620. |
| [30] |
ALBERT N W, THRIMAWITHANA A H, MCGHIE T K, et al. Genetic analysis of the liverwort Marchantia polymorpha reveals that R2R3 MYB activation of flavonoid production in response to abiotic stress is an ancient character in land plants[J]. New Phytol, 2018, 218(2): 554-566. DOI:10.1111/nph.15002 |
| [31] |
盛建军, 李想, 张彦雪, 等. UV-B辐射对元阳红米籽粒形态和原花青素含量分布的影响[J]. 农业环境科学学报, 2019, 38(12): 2689-2696. SHENG J J, LI X, ZHANG Y X, et al. Effects of UV-B radiation on grain morphology and proanthocyanidins content and distribution of Yuanyang red rice[J]. Journal of Agro - Environment Science, 2019, 38(12): 2689-2696. DOI:10.11654/jaes.2019-1064 |
| [32] |
ÁLVAREZ-GÓMEZ F, KORBEE N, FIGUEROA F L. Effects of UV radiation on photosynthesis, antioxidant capacity and the accumulation of bioactive compounds in Gracilariopsis longissima, Hydropuntia cornea and Halopithys incurva(Rhodophyta)[J]. Journal of Phycology, 2019, 55(6): 1258-1273. |
| [33] |
KOTILAINEN T, TEGELBERG R, JULKUNEN-TⅡTTO R, et al. Metabolic specific effects of solar UV-A and UV-B on alder and birch leaf phenolics[J]. Global Change Biology, 2008, 14(6): 1294-1304. DOI:10.1111/j.1365-2486.2008.01569.x |
| [34] |
TATTINIM, GALARDIC, PINELLIP, et al. Differential accumulation of flavonoids and hydroxycinnamates in leaves of Ligustrum vulgare under excess light and drought stress[J]. New Phytol, 2004, 163(3): 547-561. DOI:10.1111/j.1469-8137.2004.01126.x |
| [35] |
刘翔. 新疆不同产地黑果枸杞原花青素与花青素含量的比较研究[D]. 石河子: 石河子大学, 2017. LIU X. The comparative research on the content of procyanidins and anthocyanin of wild Lycium ruthenicum in Xinjiang different regions[D]. Shihezi: Shihezi University, 2017. |
| [36] |
SI C, YAO X Q, HE X L, Chu J Z, et al. Effects of enhanced UV-B radiation on biochemical traits in postharvest flowers of medicinal chrysanthemum[J]. Photochemistry and Photobiology, 2019, 91(4): 845-850. |
| [37] |
刘美玲, 曹波, 刘玉冰, 等. 红砂(Reaumuria soongorica)黄酮类物质代谢及其抗氧化活性对UV-B辐射的响应[J]. 中国沙漠, 2014, 32(2): 426-432. LIU M L, CAO B, LIU Y B, et al. Responses of the flavonoid pathway and antioxidant ability to UV-B radiation stress in Reaumuria soongorica[J]. Journal of Desert Research, 2014, 32(2): 426-432. |
| [38] |
SHARMA P K, ANAND P, SANKHALKAR S, et al. Photochemical and biochemical changes in wheat seedlings exposed to supplementary ultraviolet-B radiation[J]. Plant Science, 1998, 132(1): 21-30. DOI:10.1016/S0168-9452(97)00266-5 |
| [39] |
SEKOWSKI S, TEREBKA M, VEIKO A, et al. Epigallocatechin gallate(EGCG) activity against UV light-induced photo damages in erythrocytes and serum albumin: Theoretical and experimental studies[J]. J Photoch Photobio A: Chemistry, 2018, 356: 379-388. DOI:10.1016/j.jphotochem.2018.01.018 |
| [40] |
王红, 杨成坤, 岳堃, 等. 不同UV-B辐射对杧果树果实品质及其抗氧化的影响[J]. 热带作物学报, 2020, 41(2): 275-283. WANG H, YANG C K, YUE K, et al. Effects of mango tree fruit quality and antioxidant under treatments[J]. Acta Tropical Crops, 2020, 41(2): 275-283. DOI:10.3969/j.issn.1000-2561.2020.02.010 |
| [41] |
吴业飞, 吴鲁阳, 张振文. 紫外线-B辐射增强对葡萄叶片抗氧化系统的影响[J]. 西北农林科技大学学报: 自然科学版, 2008, 36(12): 161-166. WU Y F, WU L Y, ZHANG Z W. Effects of enhanced ultraviolet-B radiation on antioxidant systems in grapevine seedling leaves[J]. Journal of Northwest A & F University: Natural Science Edition, 2008, 36(12): 161-166. DOI:10.3321/j.issn:1671-9387.2008.12.027 |
| [42] |
蒲晓宏, 岳修乐, 安黎哲. 植物对UV-B辐射的响应与调控机制[J]. 中国科学: 生命科学, 2017, 47(8): 818-828. PU X H, YUE X L, AN L Z. The response of plant to UV-B radiation[J]. Scientia Sinica: Vitae, 2017, 47(8): 818-828. |
| [43] |
REYES T H, SCARTAZZA A, CASTAGNA A, et al. Physiological effects of short acute UV-B treatments in Chenopodium quinoa Willd[J]. Scientific Reports, 2018, 8(1): 371. DOI:10.1038/s41598-017-18710-2 |
 2022, Vol. 41
2022, Vol. 41