2. 上海市环境科学研究院, 上海 200233
2. Shanghai Academy of Environmental Sciences, Shanghai 200233, China
天然雌激素以自由态或结合态两种形式存在,自由态包括雌酮(Estrone,E1)、雌二醇(17β-Estradiol,E2)和雌三醇(Estriol,E3),结合态包括硫酸盐结合态和葡糖苷酸盐结合态两类,结合态雌激素主要由动物体产生[1]。英国的一项研究表明,人类排放雌激素达到365 kg·a-1,主要为雌酮和雌二醇,动物排放雌激素达到1520 kg·a-1,其中奶牛场为1058 kg·a-1[2]。动物为排出体内多余的雌激素,在体内磺基转移酶(Sulfotransferases)或葡萄糖苷酸基转移酶(Glucuronosyltransferase)的作用下,将硫酸根或者葡糖苷酸根结合到自由态雌激素分子上,增加了其水溶性,更利于通过尿液或粪便排出[3-5]。调查发现,猪、鸡和牛所排泄的雌激素中分别有96%、69%和42%是以结合态形式存在的[6-8]。虽然结合态雌激素的雌激素活性很低,但环境中的微生物能够将其重新转化为自由态从而激活其雌激素活性[4, 9]。重新转化为自由态的雌激素会对环境生物造成一定危害,产生各种不利的生态影响[6, 10-13]。相关研究发现,雌激素在水生环境中以ng·L-1级别的低浓度存在就足以造成雄鱼雌性化[5],且环境中90%的天然雌激素来自于畜禽养殖[3, 14-15],因此研究畜禽粪便中雌激素的降解和转化具有重要意义。
除天然雌激素外,还有一些物质,如己烯雌酚(Diethylstilbestrol,DES)和乙炔雌二醇(17a-Ethinylestradiol,EE2),尽管在2002年就被列于“禁止在饲料、动物饮用水和畜禽水产养殖过程中使用的药物和物质清单”,但目前仍能够从畜禽废弃物中检出。辛基酚(Octylphenol,OP)、壬基酚(Nonylphenol,NP)和双酚A(Bisphenol A,BPA)也可以通过食用含有该物质的饲料或饮用污染水体等方式被动物摄入体内。畜禽养殖场排放至环境中的雌激素,通过畜禽粪便堆肥还田等方式进入到土壤中,并可能流失到水体中,对环境及生物体构成潜在威胁[6, 16]。
由于结合态雌激素在畜禽粪便的保存过程中具有较高的稳定性,畜禽粪便堆肥中大约1/3的雌激素是以结合态的形式存在的[14]。而目前对畜禽粪便引起的污染研究和控制仍主要集中在N、P、重金属和农药等常规污染物和大量的微生物、病原菌等项目上[17-20]。雌激素等内分泌干扰物尚未得到足够的重视。目前研究中天然雌激素在堆肥处理过程中的降解主要以自由态雌激素(包括E1、E2和E3)为主[20-23],对结合态雌激素、自由态雌激素以及其他具有雌激素效应的物质的研究仍不足,对堆肥过程中结合态与自由态之间的降解转化行为等缺乏足够的认识。目前研究中堆肥处理多是在实验室完成[22],对试验条件的控制理想化,无法模拟实际堆肥过程中温度、湿度等因素的变化,使试验数据与现实堆肥中的情况有一定偏差。
因此,本研究选取15种雌激素类物质作为目标化合物,包括结合态雌激素[雌酮3-硫酸钠(Estrone 3-Sulfate Sodium Salt,E1-3S)、雌酮3-(β-D-葡糖苷酸)钠盐(Estrone β-D-Glucuronide Sodium Salt,E1-3G)、17β-雌二醇3-硫酸钠盐(17β-Estradiol 3-OSulfate Sodium Salt,E2-3S)、17β-雌二醇17-硫酸钾盐(17β-Estradiol 17-Sulfate Potassium Salt,E2-17S)、17β-雌二醇3-(β-D-葡糖苷酸)钠盐(17β-Estradiol 3-β-D-Glucuronide,E2-3G)、17β-雌二醇-17-β-D葡糖苷酸(17β-Estradiol 17β -D Glucuronide,E2- 17G)和雌三醇-3-O-β-D葡糖苷酸钠盐(Estriol 3- O-β-D-Glucuronide Sodium Salt,E3-3G)]、自由态雌激素(E1、E2和E3)和其他类雌激素(OP、NP、BPA、DES和EE2)。评价堆肥过程对目标雌激素的降解效果,并对比葡糖苷酸盐和硫酸盐结合态的降解速率,研究在实际堆肥过程中结合态雌激素与自由态雌激素的降解转化规律,确定最终可能通过粪肥还田方式进入到环境中的雌激素含量。
1 材料与方法 1.1 试验材料试验所用牛粪为上海市某奶牛场提供的新鲜混合牛粪。固相萃取柱选用美国Waters公司的Oasis HLB小柱(500 mg,6 mL)和Sep Pak Aminopropyl NH2小柱(500 mg,6 mL)。
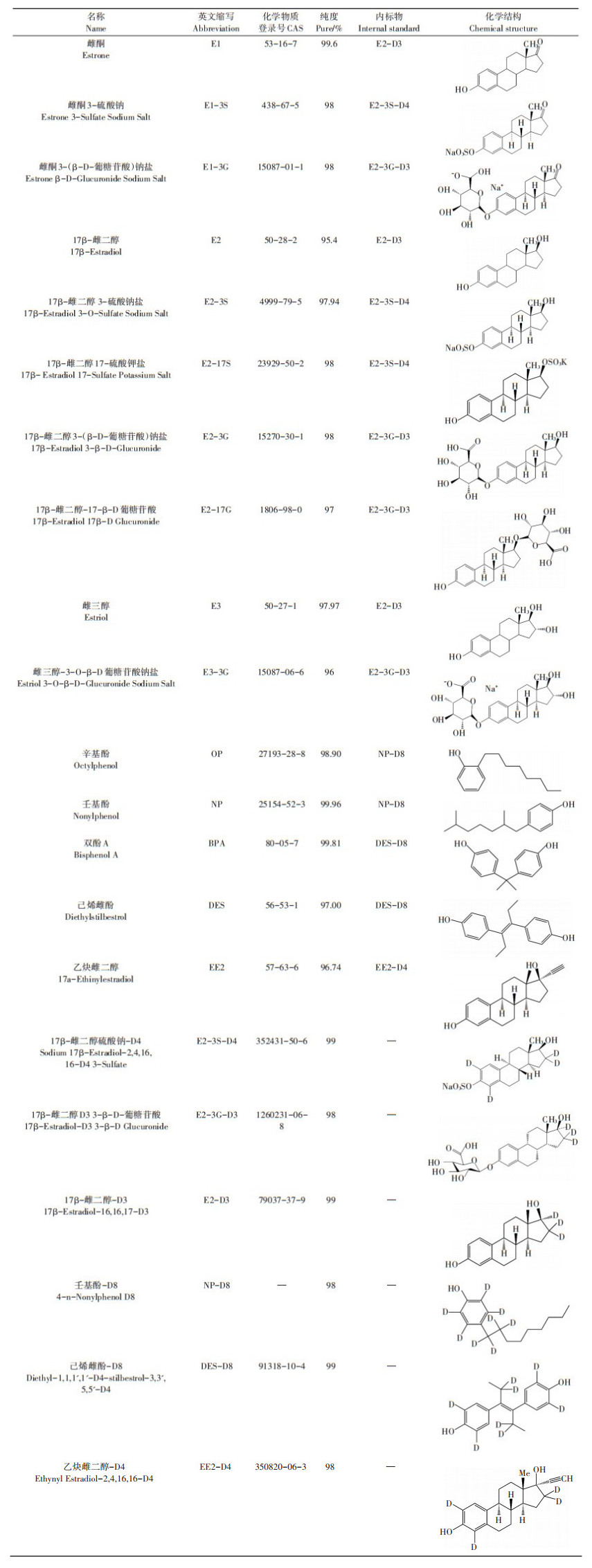
试剂:试验所用甲醇、乙腈、丙酮和正己烷均为HPLC级,购自德国Merck公司。甲基叔丁基醚(HPLC级)、柠檬酸钠(98%),购自沃凯。柠檬酸为优级纯,购自上海凌峰化学试剂有限公司。试验用水均为Milli-Q超纯水。试验所用标准品信息见表 1,上述标准品均用甲醇配成标准溶液,并配制浓度为10 mg·L-1的混合标准溶液,于-20 ℃冰箱中保存。
|
|
表 1 目标雌激素和内标物的标准品信息 Table 1 Information of target compounds |
缓冲溶液:分别配制0.1 mol·L-1的柠檬酸和柠檬酸钠溶液,以体积比41:59混合得到pH=5的柠檬酸缓冲溶液。
仪器:岛津30A-AB5500Q-trap高效液相色谱串联质谱仪(美国AB公司),CEM MARS CLASSIC型微波萃取仪(美国CEM公司),6通道全自动固相萃取仪(厦门睿科仪器有限公司),全自动氮吹浓缩仪(厦门睿科仪器有限公司),S220型pH计(梅特勒-托多仪器有限公司),Milli-Q超纯水器(美国Millipore公司),TW223L电子天平(日本岛津公司),LDG-0.3C低温真空冷冻干燥机(上海昊博低温真空设备有限公司),2300TH型数控超声波清洗器(上海安谱实验科技股份有限公司),DW130A氮气发生器(上海登晨生物医疗科技有限公司),LY280型翻抛机。
1.2 堆肥试验为研究实际农业堆肥过程中结合态雌激素的降解过程,确保研究过程中结合态雌激素降解行为能够反映生产中的实际情况,堆肥处理在上海市某奶牛场堆肥现场完成,堆肥周期为70 d。
所用牛粪为新鲜混合粪便,堆肥辅料为菌渣。将牛粪和堆肥辅料(菌渣)按照适当的比例(1:2)混合均匀后,含水率控制在51.07%±10%。
利用翻抛机将物料充分混合,并在设有顶棚的水泥地面上堆制成窄长条垛,断面为三角形,条垛的宽度为3.0~4.0 m、高度为1.5~2.0 m,并采用翻抛机对物料进行定期(7 d)翻堆,使内外层分解程度不同的物质重新混合均匀。
1.3 样品的采集与提取采集堆肥第0、4、10、15、21、36、47 d和70 d样品。采集深度为10~30 cm,所采集样品均为堆体6个随机点(每点间隔至少2 m)的等比例混合样。由于不同性别、生长阶段、生长条件的牛所排放的雌激素含量不同[2, 15, 23-25],本试验在两个月内采集7次牛粪样品,所采集牛粪为上海市某奶牛场新鲜混合粪便。样品经冷冻干燥、研磨、过筛后,保存在-20 ℃冰箱中,并于7 d内测定新鲜牛粪中雌激素含量。
结合态雌激素的提取:准确称取2.000 g堆肥样品,加入50 mL甲醇-缓冲溶液(V:V=1:1),于95 ℃微波萃取40 min提取结合态雌激素;收集提取液,经0.7 μm玻璃纤维滤膜过滤去除颗粒悬浮物后稀释至500 mL,用4 mol·L-1盐酸调节pH至3±0.1;依次用甲基叔丁基醚、甲醇和水活化固相萃取柱,将水样通过预活化的Oasis HLB小柱富集目标雌激素,利用体积浓度10%的甲醇-水溶液、pH=3的超纯水、体积浓度比为2:10:88的氨水-甲醇-水溶液淋洗,经甲醇洗脱HLB小柱,并收集洗脱液,再通过经甲醇活化的NH2小柱净化。
自由态和其他类雌激素的提取:准确称取2.000 g堆肥样品,加入50 mL甲醇-丙酮(V:V=1:3),于100 ℃微波萃取60 min提取目标雌激素。收集提取液,水浴加热40 ℃条件下氮吹浓缩至近干,用10 mL乙腈重新溶解,然后用10 mL正己烷进行液-液萃取,并移除正己烷层,该操作重复两次;所得乙腈层溶液稀释至250 mL后经0.7 μm玻璃纤维滤膜过滤去除颗粒悬浮物,用4 mol·L-1盐酸调节pH至3±0.1;依次用甲醇和水活化固相萃取柱,将水样通过预活化的Oasis HLB小柱富集目标雌激素,利用超纯水和体积浓度5%的甲醇-水溶液淋洗,经甲醇洗脱HLB小柱,并收集洗脱液。
在微波萃取前加入指示回收率的内标物。洗脱液在水浴加热40 ℃条件下氮吹浓缩至近干,用体积浓度为70%的甲醇-水溶液定容至1 mL,并通过孔径为0.22 μm的有机相滤膜,最后利用高效液相色谱串联质谱仪定量目标雌激素。
1.4 仪器检测方法利用美国AB公司的AB5500Q-trap三重四极杆质谱仪,配岛津30A液相色谱,对15种雌激素进行检测。色谱柱选用Shim-Pack XR-ODSII C18柱(75 mm×2 mm,1.0 μm),流动相A为体积浓度为0.1%氨水-超纯水溶液,流动相B为HPLC级甲醇。色谱柱温40 ℃,流动相流速为0.3 mL·min-1。质谱为三重四极杆质量分析器,在电喷雾离子源负离子模式ESI-下,选用多反应监测模式MRM扫描方式进行检测。离子源温度为550 ℃,喷雾电压为-4500 V,气帘气压力(CUR)为241.32 kPa,雾化器压力(GS1)为344.74 kPa,辅助气压力(GS2)为344.74 kPa,碰撞气CAD为Medium,碰撞气为高纯氮气。
结合态雌激素(E1-3S、E1-3G、E2-3S、E2-17S、E2-3G、E2-17G和E3-3G)梯度洗脱程序:0~2 min,10%B;2.0~2.2 min,10%B~50%B;2.2~3.5 min,50%B;3.5~3.8 min,50%B~97%B;3.8~5.5 min,97%B;5.5~ 5.6 min,97%B~10%B;10 min,10%B。
自由态和其他类雌激素(E1、E2、E3、OP、NP、BPA、DES和EE2)梯度洗脱程序:0~3.0 min,30%B;3.0~4.0 min,30%B~93%B;4.0~7.0 min,93%B;7.0~ 8.0 min,93%B~30%B;8.0~10.0 min,30%B。
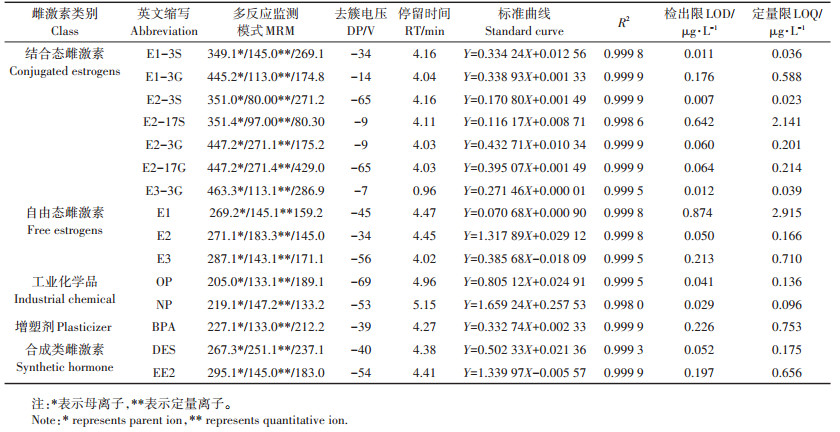
采用内标法,以牛粪作为样品进行加标检测,得到15种雌激素的加标回收率在70%~110%。目标雌激素的母离子、子离子、定量限、检测限和标准曲线等如表 2所示,R2均大于0.998,高分辨率、低检出限可用来定量环境中痕量存在的目标雌激素。
|
|
表 2 15种目标雌激素的母离子、子离子、检测限、定量限和标准曲线 Table 2 Parent ion, daughter ion, detection limits, quantitative limits and standard curve equation of 15 target estrogens |
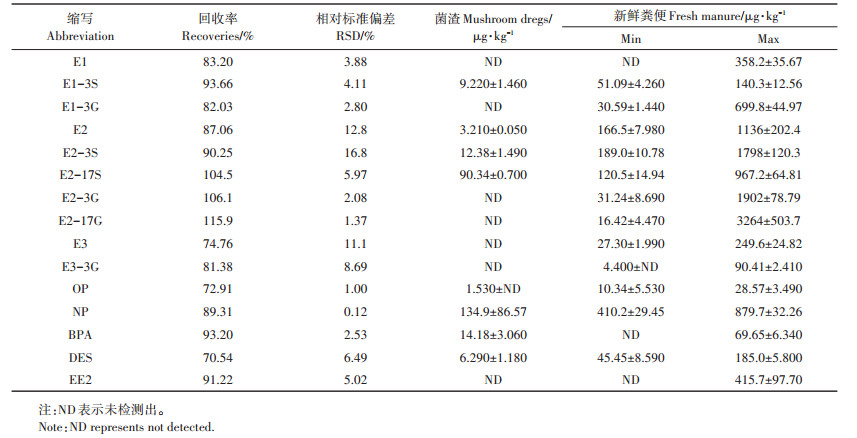
本试验分7次采集检测确定新鲜粪便中雌激素的含量范围,所述的15种雌激素在新鲜粪便中均有检出。15种雌激素的加标回收率及其在新鲜粪便和菌渣中的含量见表 3。
|
|
表 3 15种雌激素的加标回收率及其在新鲜粪便和菌渣中的含量 Table 3 Recovery rate of 15 target estrogens and their concentration in fresh manure and mushroom dregs |
堆肥0 d样品中15种雌激素含量如图 1所示,同新鲜粪便中雌激素含量比例相似,主要以结合态雌激素为主,其中E2-17G高达636.40 μg·kg-1;自由态雌激素中,E2雌激素活性最大[26-28],浓度最高,为281.98 μg·kg-1;除天然雌激素外,其他5种雌激素,包括人工合成雌激素、增塑剂和工业化学品均有检出,其中工业化学品NP含量最高,浓度为477.91 μg·kg-1。
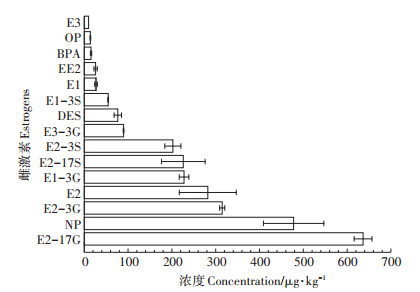
|
图 1 堆肥0 d的雌激素含量 Figure 1 Concentration of estrogens at 0 d |
结合态雌激素与其他6种雌激素(OP、NP、DES、EE2、BPA和E2)浓度随着堆肥的进行呈持续下降趋势,降解率如图 2所示。其中BPA和DES在堆肥第4 d已经低于检测限;E1-3S、E2-3S、E2-17S、E3-3G和OP的降解主要发生于堆肥0~4 d,堆肥至第4 d降解率均≥43%,在4 d之后降解速率明显降低;而E1-3G、E2-3G、E2-17G、E2和EE2的降解主要发生于堆肥4~15 d;图 2所示13种雌激素浓度均在堆肥36 d之后趋于平稳,在堆肥70 d降解率(除NP外)均≥95.75%;NP在堆肥过程中降解缓慢,第4 d降解20.5%,4~21 d仅降解16.3%,堆肥70 d降解51.16%。Bartelt-Hunt等[23]研究证实堆肥能有效降解79%~87%的激素。Derby等[20]在堆肥期间发现E1和E2总浓度降低了74%(静态堆肥)和79%(好氧堆肥)。与本研究结果相似,证明堆肥能去除大部分雌激素类物质,但不能将其完全降解。
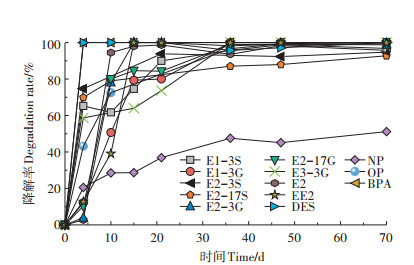
|
图 2 目标雌激素的降解率 Figure 2 Degradation rate of target estrogens |
堆肥处理70 d能有效降解粪便中的E1-3G、E3- 3G、OP、BPA、DES和EE2,但70 d后仍检测到E1-3S、E2-3S、E2-17S、E2-3G、E2-17G、NP、E1和E2 8种雌激素,浓度分别为1.75、9.5、16.4、3.89、4.44、233.4、69.28 μg·kg-1和11.98 μg·kg-1,这些雌激素会随有机肥还田进入土壤环境,可能对农田生态产生不利影响。同时,这些雌激素若随降雨等地表径流进入水生环境,会对水生生物造成内分泌干扰,造成一定的生态风险。因此,需对土壤中雌激素做进一步评价分析。
2.3 不同结合态雌激素的降解特征如图 1所示,天然雌激素在堆肥0 d主要以葡糖苷酸盐结合态形式存在。研究发现,结合态雌激素在环境中首先被微生物水解为自由态雌激素[6],再进一步发生降解。葡糖苷酸盐结合态雌激素的降解主要发生在堆肥4~15 d(除E3-3G以外),降解率均≥ 98.76%,高于硫酸盐结合态;而硫酸盐结合态主要在0~4 d降解,3种硫酸盐结合态在堆肥70 d后均有检出,降解率在92.74%~96.79%。
对各雌激素的降解进行模拟发现:在堆肥期间,E1-3S(0~47 d)、E1-3G(0~21 d)、E2-17S(0~70 d)、E2-3G(0~47 d)、E2-17G(0~47 d)和E3-3G(0~21 d)的降解符合一级动力学方程,如图 3所示,其中E1- 3G和E3-3G在21 d已经低于检测限。由方程得到6种结合态雌激素在堆肥处理中的降解速率常数,分别为0.086 38、0.041 48、0.088 03、0.104 66、0.106 86和0.065 57,计算得到半衰期分别为8.02、7.87、16.71、6.62、6.49 d和10.57 d。结果显示,在堆肥0~47 d,结合态雌激素的降解速率大小依次为:E2-17G>E2- 3G>E1-3G>E1-3S>E3-3G>E2-17S,表明葡糖苷酸盐结合态降解速率普遍高于硫酸盐结合态,这也与堆肥70 d后的检测结果相一致,即硫酸盐结合态在堆肥完成后仍有检出,葡糖苷酸盐结合态则无检出。Ben等[29]研究结合态雌激素在污水处理中的转化时发现,污水中硫酸盐结合态比葡糖苷酸盐结合态水解速率低。Ma等[30]研究结合态雌激素在土壤中的降解发现,硫酸盐结合态比葡糖苷酸盐结合态存在更持久。在堆肥降解中也发现类似现象,即葡糖苷酸盐结合态比硫酸盐结合态降解更彻底,硫酸盐结合态相对更加稳定。
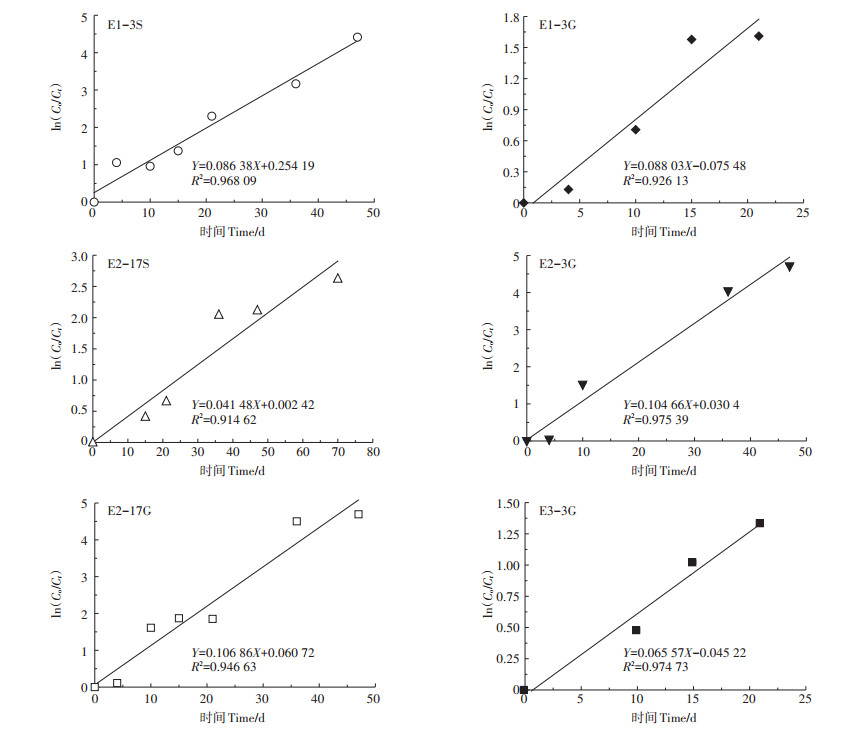
|
图 3 不同结合态雌激素在堆肥期间的降解动力学曲线 Figure 3 Biodegradation kinetics curves of conjugated estrogens during composting |
本研究中自由态雌激素E2在堆肥过程中持续降解,而E1、E3浓度先升高后降低(图 4)。堆肥过程中存在的自由态雌激素主要为E1,同Derby等[20]研究结果一致,尽管E2初始浓度(0~4 d)高于E1,但随着堆肥处理的进程E1含量始终高于E2(4~70 d)。如图 4所示,E1、E3浓度在0~10 d持续增高,在堆肥10 d达到最大浓度(192.15、56.82 μg·kg-1),增加了5~7倍,主要原因是结合态雌激素在堆肥过程中水解为自由态[9, 12]。Hammett等[31]在堆肥处理中发现E1在第7 d由17.4 ng·L-1逐渐增加至50.0 ng·L-1,第10 d显著增加至137.8 ng·L-1,在各种家禽粪便混合物中自由态雌激素(E1和E2)检测中发现,堆肥10 d雌激素含量(E1+E2)增加至3~10倍,这与本研究结果一致。而本试验中E1在36 d达到另一个峰值(212.5 μg·kg-1)。
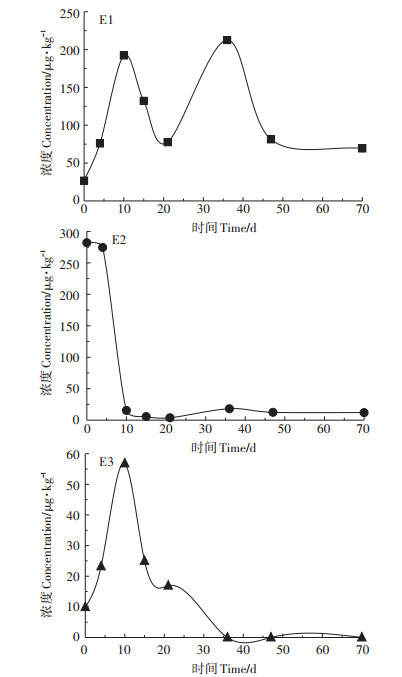
|
图 4 自由态雌激素浓度变化曲线 Figure 4 Concentration of free estrogens during composting |
对结合态雌激素降解率曲线(图 2)和自由态雌激素浓度变化曲线(图 4)进行分析发现:堆肥初期(0~10 d),E1和E3浓度升高,主要发生结合态雌激素的水解反应;堆肥10~21 d,E1和E3浓度降低,自由态降解速率明显大于结合态水解速率,E1、E3分别降解峰值浓度(10 d)的59.65%、70.22%;堆肥21~36 d,E1含量持续增大,而E3持续降解,但速率下降,表明结合态水解为E1的速率>E3降解速率>结合态水解为E3的速率;36 d之后,E3已经低于检出限。E1在47 d之后降解速率明显下降。在堆肥过程中,初期主要发生结合态的水解反应,36 d之后水解反应缓慢,至47 d雌激素浓度趋于稳定。
试验结果表明,堆肥过程中结合态雌激素的水解产物主要为E1、E3。Zheng等[25]研究发现,在牛粪堆积过程中E2会转变为E1。在Khanal等[3]研究中,E2在污水中首先被生物转化为E1,再进一步发生降解。也就是说,尽管部分结合态雌激素水解反应只脱去葡糖苷酸盐基团或硫酸盐基团从而转化为其自由态形式(如E2-3G脱去葡糖苷酸盐基团水解为E2),也会最终转化为E1,从而进一步降解。在本试验中,由于E2浓度波动不大,因此将E1作为结合态雌激素主要的水解产物。Ma等[30]研究土壤中结合态雌激素的降解过程,发现结合态雌激素在土壤环境中首先被微生物水解,而主要代谢产物为E1。与本研究中E1浓度变化趋势一致,表明结合态雌激素和E2在环境中主要被微生物转化为E1。
堆肥70 d能有效降解E3,却不能完全降解E1。堆肥70 d后E1降解了峰值浓度(36 d)的67.39%,最终经还田进入到土壤环境的浓度高于堆肥初始浓度,约为堆肥0 d的3倍。
2.5 堆肥过程中雌激素活性变化雌激素活性取决于其化学结构[32],天然雌激素中自由态比结合态活性高[14, 27],而自由态雌激素中E2的雌激素活性为E1和E3的5~1000倍[27-28]。本文采用雌二醇当量EEQ(17β-estradiol equivalents)表征雌激素活性,计算公式[33]如下:
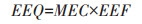
|
式中:MEC为雌激素实测浓度,μg·kg-1;EEF为雌二醇当量因子。
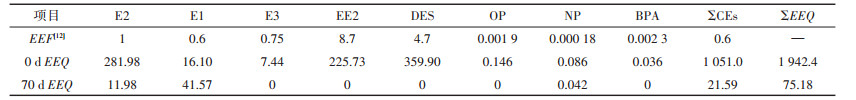
以雌激素同细胞内雌激素受体ER(Estrogen receptor)的最大结合能力[12]作为EEF进行计算。虽然结合态雌激素的生物活性比自由态雌激素低几个数量级[34],但是考虑到结合态雌激素首先转化为自由态雌激素从而激活其雌激素活性[3, 7, 31],且试验结果表明结合态水解产物主要为E1,因此结合态雌激素的EEF以E1计算。堆肥前后的雌二醇当量(μg·kg-1)计算结果和雌激素对应的雌二醇当量因子如表 4所示。
|
|
表 4 雌激素对应的雌二醇当量因子和堆肥前后的雌二醇当量 (μg·kg-1) Table 4 The estradiol equivalent factor, and the calculated estradiol equivalent at 0 d and 70 d (μg·kg-1) |
堆肥0 d的EEQ为1942 μg·kg-1,雌激素活性主要由结合态雌激素、DES、E2和EE2贡献,其中结合态雌激素占54.11%;至堆肥结束70 d的EEQ为75.18 μg ·kg-1,其中E1贡献55.29%,结合态雌激素为28.71%;以雌二醇活性(EEQ)变化评价堆肥过程对雌激素的降解效果,雌激素去除率约96.13%。
3 结论(1)牛粪中雌激素以结合态雌激素为主,其中主要为葡糖苷酸盐结合态。
(2)结合态雌激素在堆肥初期(0~10 d)首先被微生物转化为以E1为主的自由态雌激素,再进一步降解。其中,硫酸盐结合态相较于葡糖苷酸盐结合态在环境中更加稳定。
(3)目标雌激素(除NP外)在堆肥过程中能有效降解,NP的残留率为48.84%。但堆肥70 d后仍有8种雌激素被检出,EEQ为75.18 μg·kg-1,最终可能经粪肥还田过程将雌激素排放至土壤环境,并进一步经地表径流污染水生环境,造成生态风险。
| [1] |
Lange I G, Daxenberger A, Schiffer B, et al. Sex hormones originating from different livestock production systems: Fate and potential disrupting activity in the environment[J]. Analytica Chimica Acta, 2002, 473(1/2): 27-37. |
| [2] |
Johnson A C, Williams R J, Matthiessen P. The potential steroid hormone contribution of farm animals to freshwaters:The United Kingdom as a case study[J]. Science of the Total Environment, 2006, 362(1/2/3): 166-178. |
| [3] |
Khanal S K, Xie B, Thompson M L, et al. Fate, transport, and biodegradation of natural estrogens in the environment and engineered systems[J]. Environmental Science & Technology, 2006, 40(21): 6537-6546. |
| [4] |
朱栟, 贲伟伟, 袁向娟, 等. 结合态雌激素的检测方法及污染现状[J]. 环境化学, 2013, 32(8): 1425-1434. ZHU Bing, BEN Wei-wei, YUAN Xiang-juan, et al. The pollution status and detection method of conjugated estrogens[J]. Environmental Chemistry, 2013, 32(8): 1425-1434. |
| [5] |
Hanselman T A, Graetz D A, Wilkie A C, et al. Determination of steroidal estrogens in flushed dairy manure wastewater by Gas Chromatography-Mass Spectrometry[J]. Journal of Environment Quality, 2006, 35(3): 695. DOI:10.2134/jeq2005.0282 |
| [6] |
Hanselman T A, Graetz D A, Wilkie A C. Manure-borne estrogens as potential environmental contaminants: A review[J]. Environmental Science & Technology, 2003, 37(24): 5471-5478. |
| [7] |
D'Ascenzo G, Di Corcia A, Gentili A, et al. Fate of natural estrogen conjugates in municipal sewage transport and treatment facilities[J]. Science of the Total Environment, 2003, 302(1): 199-209. |
| [8] |
Adlercreutz H, Järvenpää P. Assay of estrogens in human feces[J]. Journal of Steroid Biochemistry, 1982, 17(6): 639. DOI:10.1016/0022-4731(82)90565-9 |
| [9] |
Zuo Y, Zhang K, Deng Y. Occurrence and photochemical degradation of 17α - ethinylestradiol in Acushnet River Estuary[J]. Chemosphere, 2006, 63(9): 1583-1590. DOI:10.1016/j.chemosphere.2005.08.063 |
| [10] |
Katsu Y, Lange A, Urushitani H, et al. Functional associations between two estrogen receptors, environmental estrogens, and sexual disruption in the roach(Rutilus rutilus)[J]. Environmental Science & Technology, 2007, 41(9): 3368-3374. |
| [11] |
李艳霞, 韩伟, 林春野, 等. 畜禽养殖过程中雌激素的排放及其环境行为[J]. 生态学报, 2010, 30(4): 1058-1065. LI Yan-xia, HAN Wei, LIN Chun-ye, et al. Excretion of estrogens in the livestock and poultry production and their environmental behaviors[J]. Acta Ecologica Sinica, 2010, 30(4): 1058-1065. |
| [12] |
Gadd J B. Steroid estrogens and estrogenic activity in farm dairy shed effluents[D]. New Zealand: University of Canterbury, 2009.
|
| [13] |
Orlando E F, Kolok A S, Binzcik G A, et al. Endocrine-disrupting effects of cattle feedlot effluent on an aquatic sentinel species, the fathead minnow[J]. Environmental Health Perspectives, 2004, 112(3): 353-358. DOI:10.1289/ehp.6591 |
| [14] |
Hutchins S R, White M V, Hudson F M, et al. Analysis of lagoon samples from different concentrated animal feeding operations for estrogens and estrogen conjugates[J]. Environmental Science & Technology, 2007, 41(3): 738-744. |
| [15] |
Lorenzen A, Hendel J G, Conn K L, et al. Survey of hormone activities in municipal biosolids and animal manures[J]. Environmental Toxicology, 2004, 19(3): 216-225. DOI:10.1002/tox.20014 |
| [16] |
Tashiro Y, Takemura A, Fujii H, et al. Livestock wastes as a source of estrogens and their effects on wildlife of Manko tidal flat, Okinawa[J]. Marine Pollution Bulletin, 2003, 47(1-6): 143-147. DOI:10.1016/S0025-326X(03)00053-5 |
| [17] |
许文志, 欧阳平, 罗付香, 等. 中国畜禽粪污处理利用现状及对策探讨[J]. 中国农学通报, 2017, 33(23): 106-112. XU Wen-zhi, OUYANG Ping, LUO Fu-xiang, et al. Livestock manure treatment in China: Utilization status and countermeasures[J]. Chinese Agricultural Science Bulletin, 2017, 33(23): 106-112. |
| [18] |
Liao Q, Guangpo W, Zepu J. Research progress on resource utilization of livestock and poultry manure[J]. Agricultural Science & Technology, 2014, 15(1): 105-110. |
| [19] |
Qian X, Shen G, Yao Z, et al. Town-based spatial heterogeneity of nutrient balance and potential pollution risk of land application of animal manure and fertilizer in Shanghai, China[J]. Nutrient Cycling in Agroecosystems, 2012, 92(1): 67-77. DOI:10.1007/s10705-011-9472-y |
| [20] |
Derby N E, Hakk H, Casey F X M, et al. Effects of composting swine manure on nutrients and estrogens[J]. Soil Science, 2011, 176(2): 91-98. |
| [21] |
郑溪.奶牛粪便中甾体雌素污染特征调查及在堆肥过程中的降解行为研究[D].合肥: 合肥工业大学, 2013. ZHENG Xi. Occurrence of steriod estrogens in dairy feces and their fate during aerobic composting process[D]. Hefei: Hefei University of Technology, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10359-1013377979.htm |
| [22] |
佟韶洋. 雌激素在不同畜禽粪便堆肥过程中的降解研究[J]. 吉林农业, 2016, 28(23): 72-73. TONG Shao-yang. Study on the degradation of estrogen in the composting process of different livestock and poultry manure[J]. Agriculture of Jilin, 2016, 28(23): 72-73. |
| [23] |
Bartelt-Hunt S L, DeVivo S, Johnson L, et al. Effect of composting on the fate of steroids in beef cattle manure[J]. Journal of Environment Quality, 2013, 42(4): 1159. DOI:10.2134/jeq2013.01.0024 |
| [24] |
Raman D R, Williams E L, Layton A C, et al. Estrogen content of dairy and swine wastes[J]. Environmental Science & Technology, 2004, 38(13): 3567-3573. |
| [25] |
Zheng W, Yates S R, Bradford S A. Analysis of steroid hormones in a typical dairy waste disposal system[J]. Environmental Science & Technology, 2008, 42(2): 530-535. |
| [26] |
隋倩, 黄俊, 余刚. 中国城市污水处理厂内分泌干扰物控制优先性分析[J]. 环境科学, 2009, 30(2): 384-390. SUI Qian, HUANG Jun, YU Gang. Priority analysis for controlling endocrine disrupting chemicals in municipal wastewater treatment plants of China[J]. Environmental Science, 2009, 30(2): 384-390. DOI:10.3321/j.issn:0250-3301.2009.02.011 |
| [27] |
Lee L S, Strock T J, Sarmah A K, et al. Sorption and dissipation of testosterone, estrogens, and their primary transformation products in soils and sediment[J]. Environmental Science & Technology, 2003, 37(18): 4098-4105. |
| [28] |
Legler J, Jonas A, Lahr J, et al. Biological measurement of estrogenic activity in urine and bile conjugates with the in vitro ER-CALUX reporter gene assay[J]. Environmental Toxicology and Chemistry, 2002, 21(3): 473-479. DOI:10.1002/etc.5620210301 |
| [29] |
Ben W, Zhu B, Yuan X, et al. Transformation and fate of natural estrogens and their conjugates in wastewater treatment plants: Influence of operational parameters and removal pathways[J]. Water Research, 2017, 124: 244-250. DOI:10.1016/j.watres.2017.07.065 |
| [30] |
Ma L, Yates S R. Degradation and metabolite formation of estrogen conjugates in an agricultural soil[J]. Journal of Pharmaceutical and Biomedical Analysis, 2017, 145: 634-640. DOI:10.1016/j.jpba.2017.07.058 |
| [31] |
Hammett K M, Mullin E J, Aga D S, et al. In vitro and in vivo assessment of aqueously extractable estrogens in poultry manure after pilotscale composting[J]. Journal of Environment Quality, 2017, 46(3): 614-622. DOI:10.2134/jeq2017.01.0012 |
| [32] |
Dutta S K, Inamdar S P, Tso J, et al. Concentrations of free and conjugated estrogens at different landscape positions in an agricultural watershed receiving poultry litter[J]. Water Air Soil Pollut, 2012, 223(5): 2821-2836. DOI:10.1007/s11270-011-1069-1 |
| [33] |
Korner W, Spengler P, Bolz U, et al. Substances with estrogenic activity in effluents of sewage treatment plants in southwestern Germany. 2. Biological analysis[J]. Environmental Toxicology and Chemistry, 2001, 20(10): 2142-2151. DOI:10.1002/etc.5620201002 |
| [34] |
Yost E E, Meyer M T, Dietze J E, et al. Comprehensive assessment of hormones, phytoestrogens, and estrogenic activity in an anaerobic swine waste lagoon[J]. Environmental Science & Technology, 2013, 47(23): 13781-13790. |
 2019, Vol. 38
2019, Vol. 38