2. 农业部长江中游平原农业环境重点实验室, 长沙 410125;
3. 中南大学, 长沙 410083
2. Key Laboratory of Agro-Environment in Midstream of Yangtze Plain, Ministry of Agriculture, Changsha 410125, China;
3. Central South University, Changsha 410083, China
农业面源污染是指在农业生产和生活活动中,溶解或固体污染物(如氮、磷、农药以及其他有机或无机污染物质),从非特定的地点通过地表径流、农田排水和地下渗漏等过程进入受纳水体引起水质污染的过程。农业面源污染的主要来源包括化肥农药的流失、畜禽和水产养殖以及农村生活径流和分散式生活污水的排放等;由于其涉及范围广、随机性大、隐蔽性强、不易溯源、难以监管等,治理难度大,已经成为我国现代农业和社会可持续发展的瓶颈。根据2010年第一次全国污染源普查公报,我国农业面源污染引起的总氮(TN)和总磷(TP)的排放量分别达到270.46万t·a-1和28.47万t·a-1,分别占全国污染排放总量的57.19%和67.27%,已经超过工业和生活污染源成为地表水污染的第一大污染源[1]。当今世界约三至五成的地表都不同程度受到面源污染的影响,约1.5亿hm2耕地因农业面源污染出现不同层次的退化,中国受农业面源污染影响的耕地近2000万hm2[2]。因此,控制农业面源污染是实现水环境、土壤环境和农村生态环境质量改善的核心。
氮(N)、磷(P)的大量排放导致水体富营养化是农业面源污染最主要的危害之一,而N、P也是生物生长所必需的营养物质,如何将其合理利用变为有用资源,产生良好的经济和生态效益,是值得探索的可持续农业发展道路。藻类对水体中营养盐浓度的变化十分敏感:通过光合作用和生长作用,藻类可以迅速地吸收水体中N、P等养分,将其转化为自身生物量;藻类水华的发生,就是水体富营养化的直接结果,但是通过定时清除藻类生物量即可达到永久去除水体中营养盐的目的[3-4]。此外,藻类与其他微生物如细菌、真菌等的相互作用还能进一步促进水体中污染物的转化和去除,尤其是有机污染物[4]。许多研究已表明藻类在降低稻田N、P养分流失、净化富营养废水、甚至富集吸附重金属等方面都具有巨大的应用潜力[3, 5-8]。更为重要的是,藻类生物量通常富含高脂质化合物,可用于生物肥料、动物饲料和燃料等的生产[9]。因此,通过加以合理利用和开发,藻类可以变废为宝,在农业面源污染防治上起重要作用。
目前,我国农业面源污染治理技术主要基于源头减量(Reduce)、过程拦截(Retain)、养分再利用(Reuse)和生态修复(Restore)的基本思路(“4R”理论)[10],通过不同生态技术措施的实施,如减量施肥、有机肥替代、沟渠系统、生化塘及人工湿地系统等[11],在消减控制农业面源污染的同时,将农业有机和无机废弃物进行循环再利用,从而实现绿色可持续发展。而藻类是水生生态系统的重要组成成分,几乎能在水体任何群落生境中繁殖生长,它们不仅可以悬浮生长于水体真光层(浮游藻类,Phytoplankton),还可以固着生长于水体所有固体表面,包括水生植物和底泥表层等(固着藻类,Periphytic/attached algae)[12],因此,也是生态沟渠系统、生化塘及人工湿地系统等面源污染治理系统的重要组成部分。本文基于藻类生长特性及农业面源污染产排规律和过程,系统探讨了藻类在农业面源污染(本文主要指引起水体富营养化的基本营养元素:N和P)防控中的主要治理技术与模式,并深入分析了其应用的关键限制因素及优缺点,以期为农业面源污染治理技术提供理论基础。
1 主要治理技术与模式 1.1 稻田藻类固氮减磷藻类广泛存在于稻田生态系统中,其对稻田氮素迁移和转化的重要性已被广泛认可[13],固氮蓝藻所具有的固氮特性使其在农业栽培方面具有巨大的应用潜力。早在1939年就有研究发现,蓝藻才是稻田中的主要固氮微生物,来自细菌的固氮量可以忽略不计;而且通过蓝藻的固氮作用可使稻田在不施肥的情况下连续保持较高的产量[14]。中科院水生生物所通过多年实验和田间研究,解决了如何获得大量固氮藻种和使藻种快速繁殖的两大瓶颈问题,并通过晚稻田大面积放养固氮蓝藻试验,发现可使水稻增产15%~20%[15-17],进一步证明利用固氮蓝藻作为稻田的氮肥肥源是完全可行的。因此,通过稻田接种固氮蓝藻可有效减少氮肥施用量,实现农业面源污染发生的源头控制。
另一方面,农业面源污染的本质就是污染物质由土相向水相迁移的过程,因此,在农业面源污染治理中,应充分利用固着藻类,建立起土壤相-生物相(土水界面固着藻类群落)-水相三相结合的农业面源污染防控技术,如筛选固氮磷活化藻、菌种等,可有效降低污染排放[18]。稻田中的固着藻类在稻田土壤和上覆田面水的养分交换中也起重要作用。研究表明,固着藻类的存在降低了稻田水体中的磷,而增加了稻田土壤中的磷;而且固着藻类本身也吸收了大量磷储存于体内,在细胞死亡分解后可重新释放到土壤中被利用[6];因此,合理利用固着藻类可有效调节稻田养分平衡,提高稻田肥料利用率[19]。Li等[20]通过钙、铁离子的添加显著促进了稻田固着藻类对无机磷的吸附积累,从而降低了土壤对磷的固定以及稻田磷流失。因此,在稻田生态系统中,合理引入固着藻类,不仅可进一步提高稻田N、P利用率,减少养分流失,还可同时提高农作物产量。
1.2 多营养级综合养殖系统多营养级综合养殖系统(Integrated multi-trophic aquaculture,IMTA),是指通过藻类及其他滤食性双壳贝类或沉积食性动物的加入,实现水产养殖面源污染控制和效益增值双赢的养殖理念[21]。水产养殖污染是农业面源污染的重要来源之一,由于常规养殖的养殖品种单一,而且为保证高产量,养殖过程中必须投入大量高蛋白饲料[22],未被消化和分解的饵料以及粪便残留在养殖水体中,导致养殖水体水环境不断恶化,生态系统失衡,水体自净能力低,因此必须采取有效措施控制水产养殖污染。而IMTA养殖系统通过藻类的引入,利用不同营养级生物的生活习性,实现把高营养级养殖物种排放的废弃物质(残饵、排泄物等)转化成低营养级养殖物种产品(图 1),净化环境的同时提高了经济生产力,实现了水产养殖环境友好的可持续发展。IMTA不同于传统的混养,其所包含的多个养殖品种是在一个系统中处于不同的营养级,而混养则不一定,它是根据经济效益来选择的品种,有可能是相同营养级上的多个品种的混养。因此,IMTA能显著提高水产养殖的可持续性,具有潜在的生态、社会和环境效益,其优点是各个营养级的不同养殖品种组成了一个基础食物链,通过水环境将营养和能量相互转化并充分利用。

|
图 1 多营养级综合养殖系统概念图 Figure 1 Concept map of the integrated multi-trophic aquaculture system |
在IMTA系统中,藻类不仅可以吸收同化养殖水体中多余的N、P等营养物质;而且还能产生高价值的藻类生物量,或直接被其他食草性鱼类、虾和软体动物等捕食。因此,利用藻类吸收养殖水体中的营养元素,不仅可以净化养殖水体,减少排放污染,简化养殖废水处理步骤,还可同时产生可利用的藻类生物量或其他低营养级水产副产品,实现水产养殖效益的增值。但是,目前IMTA在海水养殖中的应用更为普遍,而且主要基于大型藻类,如石莼和江蓠等[23],而微藻的应用被忽略了。微藻同大型藻类一样,不仅可以作为生物过滤器,吸收养分,产生氧气,而且还可以用作饵料,因此,高浓度微藻在IMTA系统中也有巨大的应用潜力[24]。此外,微藻不仅可以直接投放于水产养殖单元,与饲养品种和滤食性动物构成IMTA系统,净化水质,减少污染排放;而且,还可以单独构成废水处理系统单元,净化水产养殖排水。
1.3 固着藻类净水系统田间生态沟渠技术是最常用的农业面源污染物拦截技术之一,常规生态沟渠主要依靠水生植物的吸收作用,对污染物的去除效率相对较低。而主要基于藻类作用的固着藻类净水系统,相对于常规生态沟渠,对污染物具有更好的拦截效果;它们对养分的去除率主要取决于藻类生长速率及其细胞养分含量,进水N、P浓度越高,藻类生长速率越快,细胞内N、P含量越高。此外,固着藻类通常以绝对优势与细菌、真菌、附着动物以及无机和有机碎屑一起构成固着生物群落,它们之间复杂的相互作用可进一步促进对污染物质的去除效率[25]。
藻坪净水系统(Algal turf scrubber,ATS)是目前最常用的一种藻类生态沟渠净水系统[26],已在美国应用30多年,并已申请专利;其商业化应用以及对所获得藻类生物量的科学利用仍正在不断发展和完善之中[27]。ATS系统主要通过在水渠底部加装供藻类固着形成藻坪的聚乙烯网构成,结构简单;固着藻类群落可通过吸收、吸附、截留等方式净化水中过剩的营养物质及其他有机和无机污染物;ATS系统运行的关键在于利用人工抽水或安装于具有一定坡度的沟渠上以制造水流涌动刺激藻坪上的群落,模拟珊瑚礁群落,获得极高的生产力,因此,其对水利系统的依赖性强[28],水泵电力消耗是其运行成本的重要支出部分,结合太阳能发电可极大降低其运行成本[29]。ATS系统中的固着藻类通过水利系统自然形成,主要由纤维绿藻组成,包括Spirogyra sp.、Microspora sp.、Ulothrix sp.、Rhizoclonium sp.和Oedogonium sp.等;除此之外,还有部分蓝藻和底栖硅藻,蓝藻主要为席藻(Phormidium sp.)和颤藻(Oscillatoria sp.)。这些固着藻类组成的藻坪结构组成异质性强,而且生长速率高,具有极强的再生性,其对N和P的最大吸收率分别可达到1.58 g·m-2·d-1和0.73 g·m-2·d-1[30-32]。
ATS系统中的固着藻类群落并没有人为主动的筛选过程,通过人为筛选或驯化之后获得工程固着藻类,也称藻类生物膜,对污染物具有更强的针对性和更高的去除率[33]。许多研究已表明,藻类生物膜养分去除率高,应用潜力巨大。Shi等[34]应用Hallochlorellarubescens CCAC 0126在尼龙薄膜上形成藻类生物膜处理污水,循环流动2 d后其对PO4-P的吸收率在0.8~1.5 mg·L-1·d-1,P去除率达到78.9%~85%;而主要由Chlorella pyrenoidosa、Scenedesmus obliquus、Anabaena flos-aquae、Synechococcuselongatus和Microcystis aeruginosa等构成的藻类生物膜在循环处理污水4 d后对N、P的去除率分别约为95%和84%[35];Posadas等[36]以聚苯乙烯泡沫为载体对比研究了藻类生物膜和细菌生物膜对N、P和有机物的去除率,发现藻类生物膜对N、P的去除率更好,并且两者对有机物的去除率相同。目前,在废水处理中应用频率最高的藻种主要为小球藻(Chlorella)、栅藻(Scenedesmus)以及纤维蓝藻(如Phormidium和Pseudanabaena等)[35, 37],纤维蓝藻形成的网状结构可捕获单细胞绿藻[38]。但是,由于自然环境中土著微生物的竞争、环境条件的多变性等,目前大部分有关藻类生物膜的研究都主要基于室内实验,野外实际应用较少;因此,相对于自然形成的ATS系统,藻类生物膜的大范围实际应用还很少,相关技术仍需要进一步的提升[39-40]。Sukačová等[33]研究了由纤维蓝藻和球形绿藻组成的藻类生物膜对P的吸收,并进行了野外小试实验,藻类生物膜附着在微倾斜的混凝土板材上,总面积8 m2,污水在系统停留24 h后,系统对P的吸收率为0.16 g·m-2·d-1,去除率达到97%。
此外,藻类还可与其他农业面源防控技术结合使用,进一步提高防控效率,Liu等[41]通过藻类生物膜的应用,设计了一种复合生态浮床,提高了生态浮床在寒冷季节的处理效率,有效解决了由于浮床冬季植物凋落引起的处理效果降低的问题。
在建设基于固着藻类的生态沟渠净水系统时,首先应夯实基座,上垫不透膜材料(如聚乙烯)以防止土壤和固着藻类的互渗。固着基质的设计和选择是固着藻类净水系统成功应用的关键,固着基质的表面积越大,可供固着藻类繁殖生长的空间越多,其多样性越高;而且在去除藻类生物量后,残留在固着基质上的部分纤维藻类还能促进固着藻类群落的再生。目前已报到的固着基质材料有尼龙薄膜、PVC塑料、聚碳酸酯以及聚苯乙烯泡沫等[34-35, 37, 42]。此外,固着藻类净水系统的有效运行还受到水力条件、营养、光照、温度、pH、后生动物的捕食作用及暴雨冲刷等影响[34],在设计建设和运行基于固着藻类的生态沟渠净水系统时,应予以充分考虑。
(1)N/P
固着藻类对N、P的去除率受上覆水中的N/P影响重大。理论上,为获得更高的营养盐去除率,上覆水中的N/P应接近于藻类生长的最适N/P比[43]。根据Redfield比例,浮游生物对营养盐吸收的最适N/P值约为16:1[44];而最新研究发现,大多数藻类生长的最适N/P一般都高于16:1[43],而且随着藻类群落结构的变化,其最适N/P可由8变化到45[45]。大多数的畜禽养殖废水的N/P都在此范围内,但为防止氨浓度过高对藻类产生毒性,一般建议对畜禽养殖废水进行稀释后再利用藻类进行处理[43, 46]。值得注意的是,一些微藻具有高效富P能力,可从水体中吸收同化大量的P并以多聚磷酸盐颗粒的形式储存于细胞中[47-48],因此去P效率高;尽管如此,P浓度常常仍是污水处理中限制藻类生长的关键因子。
(2)光照条件
光照条件是藻类生长最重要的限制因素之一[12],而固着藻类的光合作用可利用光强主要受水深、水柱光衰减系数及固着藻类生物量厚度等因素影响。由于颗粒物散色和吸收作用,光照强度随着水深增加呈指数降低;而且随着固着藻类生物量厚度增加,底层藻类可获得光照越来越少;由于光照限制,会引起藻类呼吸大于生产的负增长情况出现[49]。因此,为保持良好的光照条件,田间固着藻类生态沟渠净水系统中水深不宜过深,一般不超过10 cm;对于高浊度污水,还应进行预沉降等前处理。
(3)温度
温度也是影响藻类生长的重要因素,许多研究已表明固着藻类净水系统中的藻类生物量在冬季显著低于夏季[30-31];其运行效率还与当地气候有关,亚热带地区比温带地区养分去除率普遍更高[50]。因此固着藻类对养分吸收的速率可能随季节变化波动明显,可通过降低水力负荷、减少藻类去除频率、再循环处理出水或筛选低温藻种等方法弥补低温条件处理效率低下的问题[25]。有研究指出,利用ATS系统处理单位体积废水所需要的沟渠面积在秋冬季是春夏季的两倍[50]。此外,昼夜温差变化也会对藻类产生重要影响,尤其在夏季,白天太阳辐射作用会显著提高水体(尤其是局部水体)温度,甚至抑制藻类生长。而太阳辐射时间受水体流速或水力停留时间影响,水体停留时间越长,则辐射时间越长。因此,通过提高流速,可减少太阳辐射时间,以防止温度过高。Sindelar等[51]通过加倍水体流速使水温下降了3 ℃。
(4)水力条件
水力停留时间决定了水体中污染物与固着藻类群落接触反应的时间,是影响固着藻类净水系统养分去除率的重要因素。目前已报道的中试实验或大生产应用中,固着藻类净水系统的水力停留时间通常较短,以分钟计,最小为6~12 min[31],最高为43 min[52]。水力停留时间主要取决于系统水力条件,如流速、沟渠坡度、长度、宽度及水深等。流速过高会使废水在沟渠中的停留时间过短,不利于污染物的沉淀转化。研究发现,通过将流速由1.36 m·d-1降低到0.44 m· d-1,系统出水中的P浓度、总悬浮颗粒物及生化需氧量浓度均显著减低[31]。Kangas等[29]发现固着藻类净水系统对氮素的去除率与流速之间存在非线性关系,当每单位沟渠宽度的流速低于125 L·min-1时,固着藻类净水系统对氮素的去除率与流速呈线性关系;而超过125 L·min-1时,系统对氮素的去除率趋近稳定不变。另一方面,通过增加沟渠长度,降低流速,可以刺激藻类光合作用,促进水体pH和溶解氧等升高,增加磷沉降。但当沟渠过长时,会显著影响沟渠末端的藻类生产力及养分去除率;D′Aiuto等[52]发现,当沟渠长度超过243 m时,超过部分沟渠的藻类生物量及养分去除率均显著降低。
(5)捕食作用
后生动物对固着藻类的捕食作用不仅会显著降低其养分去除率,而且还能改变固着藻类的群落结构,使其向低矮紧密固着型藻类群落转变[26],从而增加固着藻类生物量的去除难度。因此,实际应用中必须采取有效措施控制捕食者数量。研究发现,通过定期去除藻类生物量即可有效控制蜗牛、摇蚊幼虫等对固着藻类的捕食作用[30-31];但当捕食者生物量爆发,通过去除藻类生物量仍然无法控制时,只能采取放干沟渠的办法,彻底清理捕食动物[31];但这种方法也会导致固着藻类沟渠的间歇性失效,因为需要时间重新构建固着藻类群落以恢复其养分去除率。
(6)暴雨影响
暴雨的冲刷会引起固着藻类生物量的流失,进而降低其养分吸收能力;通过再循环暴雨冲刷后富含脱落固着藻类生物量的出水可加速系统内固着藻类群落的重建。但是,由于暴雨影响,还会带入大量泥沙进入沟渠,降低水体透明度,影响藻类光合作用,从而降低其养分吸收效率;而且大量泥沙的流入甚至会掩埋固着藻类,产生不利影响。因此,如何改进工艺,有效削减暴雨或强降雨事件对固着藻类净水系统的影响也是未来研究的关键[25]。
1.4 高效藻类塘高效藻类塘(High rate algal ponds,HRAP),是农村比较常用的生活污水处理方式[53-54],技术成熟度最高;它是一种利用浆轮搅拌混合的浅水氧化池塘,在传统稳定塘的基础上,通过强化手段促进藻类和细菌的生长,形成更紧密的藻菌共生体系;因此,具有更高的藻类生物量产率和养分去除率[5]。高效藻类塘中的藻类生物量的生产浓度通常在8~35 g·m-2·d-1之间,一般没有特定的藻类专门用于高效藻类塘接种,而是使用池塘自然生长的藻类聚集体,其中比较常见的有绿藻(如Chlorella、Ankistrodesmus、Scenedesmus、Chlamydomonas、Micractinium、Pediastrum、Dictyosphaeria、Euglena等)和蓝藻(如Oscillatoria等)[38, 54-55]。在适当的停留时间后,高效藻类塘的养分去除率通常可达到70%以上。孙伟丽等[53]研究发现,当停留时间7 d时,藻类塘对COD、氨氮和TP的去除率最高可分别达到87.77%、97.2%和64.8%,出水水质能达到《城镇污水处理厂污染物排放标准》(GB 18918—2002)中的一级A标准。
影响HRAP中营养盐去除效率和藻类生物量产率的关键影响因素主要有温度、光周期、透光度、水力停留时间、营养负荷、池塘深度及搅拌力度(或混合条件)等[56-57]。池塘深度和光照条件都会影响藻类的光合作用效率,通过延长浮游藻类的光照周期可以弥补深度增加和水力停留时间减少引起的养分去除速率的降低[58]。而污水中营养负荷的增加虽然对藻类产量和养分去除率无明显影响,但会降低出水水质[59]。最近研究还发现,通过藻种的再循环利用可以调控高效藻类塘中藻类的群落结构,并使池塘中藻群粒径更均匀[54]。
此外,通过工程筛选后的藻类甚至可直接用于农业面源污染废水的处理。Wang等[7]利用紫外诱变(UV-mutagenesis)和驯化联合培养法获得了工程藻种用于厌氧发酵后的生猪养殖废水处理,发现通过驯化后的浮游微藻可以直接用于处理未稀释的高浓度生猪养殖废水,其对TN、TP的去除率达到90%,通过室外原位扩大培养后,对TN、TP的去除率也分别能达到89.5%和85.3%,效果显著,充分证明了微藻在农业废水处理中的巨大应用潜力。
1.5 藻类养分循环再利用虽然固着藻类净水系统及高效藻类塘等可有效吸收去除农业面源污染废水中的N、P养分,但同时也产生了大量藻类废弃物,对这些藻类废弃物进行资源化利用,尤其是对N、P等养分进行循环再利用是未来发展的需要。藻类生物量通常富含高脂质化合物,应用广泛,可用于生产生物肥料、生物燃料、土壤改良剂甚至饲料等[9, 60]。而且,利用藻类生物肥替代化肥施用,从而减少化肥氮磷流失,也是重要的农业面源污染源头防控的措施。
研究已表明,藻类生物肥料可促进作物增产增效,许多微藻都可以产生生物活性化合物[61-62],利用小球藻、栅藻等绿藻制成的藻类生物肥料可促进农作物的营养吸收率、提高作物产量;还有研究表明利用藻类提取液浸润种子可加速种子萌发和植株生长[63-65]。藻类生物肥料在国内也逐渐受到研究者的关注,孙世中等[66]利用蓝藻泥和废弃烟叶混合物通过发酵等制作的有机肥料各项指标都已达到国家标准。将蓝藻作为原料生产的有机无机复合肥进行田间试验发现,专用藻类有机无机复合肥比普通复合肥对烟草、韭菜和康乃馨等的增产效果更为明显,还能改良施肥土壤[67]。Mulbry等[68]将ATS系统产生的固着藻类生物量用作缓释肥料,与常规商业肥料相比,它们对植株籽苗生长的影响无显著差异;Roberts等[69]将含有纤维藻类Oedogonium的固着藻类生物量制成生物炭用作土壤改良剂,并施于土壤中提高了肥料中营养元素的停留时间,使萝卜产量增加了35%~40%。因此,有研究者认为,也可以将富含磷素的藻类生物量转化成生物炭以提高土壤的磷含量[38]。此外,利用藻类进行厌氧发酵不仅可产沼气,而且沼液、沼渣用作肥料也得到非常好的试验效果[67]。
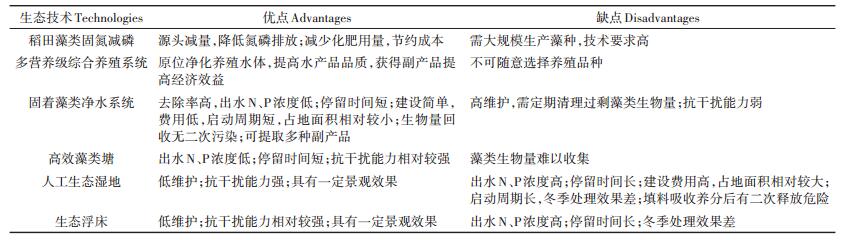
2 不同藻类治理技术及与其他面源污染治理措施的对比研究藻类在农业面源污染治理过程中发挥着重要作用。稻田藻类固氮减磷(表 1)是一项源头控制措施,通过稻田接种固氮蓝藻,可有效减少化肥用量,节本增效。但大规模应用时,需要大量藻种用于稻田放养,虽然可通过“滚雪球”的方式,利用闲置茬口田大面积生产藻种[16],但仍存在一系列的技术问题,包括适宜的接种时期、接种量、接种方法及田间管理等[70],因此技术要求高,而农民接受度有限,应用受到限制。
|
|
表 1 不同农业面源污染治理生态技术措施优缺点比较 Table 1 Advantages and disadvantages of different nutrient removal technologies for agricultural non-point source pollution control |
水产养殖是农业面源污染的主要来源之一,常规养殖模式投肥又投料,未被消化和分解的饵料以及粪便残留在养殖水体中,导致养殖水体水环境不断恶化,还会降低水产品品质。而IMTA是一种新兴的生态养殖理念,通过基础食物网的建立,利用不同营养级生物的生活习性,实现废弃物的循环再利用,不仅提高了养殖水体的自净能力,净化养殖水体的同时提高水产品品质,还可获得副产品提高经济效益。正因如此,IMTA不可根据经济效益随意选择养殖品种(表 1)。
固着藻类净水系统和高效藻类塘是藻类应用于农业面源污染治理最重要的两种生态治理技术;而目前农业面源污染治理常用的生态技术措施主要包括生态沟渠系统、生态浮岛及人工湿地系统等,这些常规的技术措施主要依靠水生植物(草类)的吸收作用;因此,本文在不同藻类治理技术特点的研究基础之上,还对基于藻类和草类植物吸收作用的不同农业面源污染治理生态技术措施进行了对比研究(表 1)。
首先,常规的沟渠系统、生态浮岛及人工湿地等主要依靠植物吸收作用,对污染物的去除效率相对较低,一般不超过60%[11]。相比之下,基于藻类的污水处理系统通常具有更高的养分去除率(表 1)。目前已报道的ATS系统对TN和TP的去除率平均分别为88 g·m-2·a-1和12 g·m-2·a-1,分别是农业面源污染人工湿地处理系统(40 g·m-2·a-1和3 g·m-2·a-1)的2倍多和4倍[25]。
更为重要的是,由于农业面源污染来源和排放的不确定性,形成了规模大且浓度低(TN < 10 mg·L-1,TP < 1 mg·L-1)的江河湖泊污染,而为了防止水体富营养化,必须将TN和TP浓度降低到更低水平,因此,这种规模大且浓度低的特性进一步增加了农业面源污染的治理难度[71]。常规生态沟渠、生态浮岛及人工湿地系统等出水的N、P浓度通常仍较高,很难满足地表水环境质量标准(如地表水四类水中TN、TP分别为1.5 mg·L-1和0.1 mg·L-1的标准)。而藻类相对于植物具有更快的生长和养分吸收率,研究表明,利用藻类的同化吸收作用,可使TN和TP浓度直接降低到0.5 mg·L-1和0.03 mg·L-1以下[4];因此,基于藻类吸收作用的生态沟渠净水系统和高效藻类塘,在处理低浓度污染废水或对出水水质要求更高时,优势显著,甚至可用于人工生态湿地出水的深度净化[72]。
此外,藻类主要通过自生同化吸收作用去除水体中的N、P养分,对于固着藻类,其本身还可吸附截留大量的P和颗粒污染物等[73-75],因此,通过藻类生物量的去除即可永久去除水体中的N、P等污染物;获得的藻类生物量还可用于生产生物燃料、饲料和肥料等增加经济效益,不仅不会产生二次污染,还可实现N、P等养分的循环再利用。相比之下,人工湿地等系统中,除植物吸收外,填料吸附和微生物作用也是其脱氮除磷的主要方式[76-77];氮素可被转化成氮气释放到大气中彻底去除;但吸附的磷累积在系统中,当吸附达到饱和后可能会重新释放,产生二次污染。更为重要的是,藻类不仅可以去除多种营养元素,还可吸附去除重金属,因为其细胞表面一般带负电荷,具有大量可以与金属离子相结合的官能团,如-NH2、-COOH、-OH、-CHO、-SH、-CO-、-PO3H2等,而且比表面积大,吸附能力强[5, 8]。
最后,由于藻类生长速率快,世代周期短,因此,固着生态沟渠系统和高效藻类塘等相对于人工湿地等具有更高的水力负荷和养分去除效率,处理同等污水时占地面积更小。而且,固着藻类净水系统和高效藻类塘等的建设过程相对简单,例如,对于固着藻类生态沟渠净水系统,只需在具有一定坡度的沟渠上夯实土地并覆盖不透膜供固着藻类繁殖生长即可;而生态湿地的建设需要开挖土地、填充基质、栽种植被等,更加复杂,且费用更高。此外,藻类生长周期短,繁殖迅速,在建成后几周内即可开始运营,而人工湿地中植物的生长至少需要几个月;因此,相对于人工湿地等植物处理系统,固着生态沟渠系统和高效藻类塘等不仅占地面积相对更小,而且建设费用低,启动运营快。
尽管如此,利用藻类处理农业面源污染废水也存在一些明显的缺陷。首先,藻类生物量必须及时清理和去除,因此,需要频繁的人工维护,且高效藻类塘还存在藻类生物量难以收集去除的问题;而人工湿地和生态浮岛等在建成投入运营之后基本无需维护。其次,固着藻类净水系统和高效藻类塘等都极易受到捕食者的影响,导致藻类生物量锐减,从而降低处理效率;而且,暴雨冲刷也会导致固着藻类的流失,而人工湿地等几乎不受捕食和暴雨作用影响,因此具有较强的抗干扰能力。最后,由于固着藻类处理系统一般停留时间较短,易受流速和污染负荷的影响,而人工湿地等由于具有更高的水力停留时间,因此,对环境变化具有更高的耐受性。
3 结论与展望综上所述,藻类在农业面源污染防控过程中可发挥重要作用。通过稻田接种固氮蓝藻可有效减少氮肥施用量,同时稻田中的固着藻类还能促进营养盐的迁移和转化,进一步减少农田排水的氮磷排放;通过IMTA水产养殖模式的构建,藻类在净化养殖水体的同时还能产生可利用的藻类生物量或其他低营养级水产副产品,实现水产养殖的增值;此外,通过固着藻类净水系统及高效藻类塘的应用,利用藻类自生同化吸收作用及与其他细菌、真菌等微生物的相互作用,不仅可高效拦截净化农业生产生活污水或地表径流中过剩的N、P营养物及其他污染物;而且获得的藻类生物量通常富含高脂质化合物,可用于生物肥料、动物饲料和燃料的生产,实现物质循环利用。
但是,由于藻类特殊的结构和生理代谢作用,虽具有良好的生物净化功能,但也极易受其他生物及外部复杂环境的影响,抗干扰能力较弱。未来研究中应提高技术水平,通过强耐受性藻种的筛选和培养、新装置新设备的研发等提高藻类应用广度,同时扩大实验规模或进行野外试验验证藻类实际应用效果。
此外,尽管藻类生物量应用广泛,但仍然存在副产品提取难、产量低的问题;而且利用污水培养获得的藻类生物量,还可能含有重金属、微污染物或致病菌等,会降低其循环利用的可能性。如何进一步提高产量,同时规避有害物质作用,实现废弃物的安全高效利用,仍需要深入研究和相关技术支持。
| [1] |
石嫣, 程存旺, 朱艺, 等. 中国农业源污染防治的制度创新与组织创新:兼析《第一次全国污染源普查公报》[J]. 农业经济与管理, 2011, 12(2): 27-37. SHI Yan, CHENG Cun-wang, ZHU Yi, et al. Institutional and organizational innovation on China agricultural non-point pollution prevention: Analysis on the 1st National Survey of Pollution Sources Bulletin[J]. Agricultural Economics and Management, 2011, 12(2): 27-37. DOI:10.3969/j.issn.1674-9189.2011.02.004 |
| [2] |
赵欣. 浅析中国农业面源污染防治研究现状与对策[J]. 中国农学通报, 2017, 33(33): 80-84. ZHAO Xin. Brief analysis of present situation and countermeasures of agricultural non-point source pollution control in China[J]. Chinese Agriculture Science Bulletin, 2017, 33(33): 80-84. |
| [3] |
Gonçalves A L, Pires J C M, Simões M. A review on the use of microalgal consortia for wastewater treatment[J]. Algal Research, 2017, 24(Part B): 403-415. |
| [4] |
Liu J, Wu Y, Wu C, et al. Advanced nutrient removal from surface water by a consortium of attached microalgae and bacteria: A review[J]. Bioresource Technology, 2017, 241(241): 1127-1137. |
| [5] |
Cuellar-Bermudez S P, Aleman-Nava G S, Chandra R, et al. Nutrients utilization and contaminants removal: A review of two approaches of algae and cyanobacteria in wastewater[J]. Algal Research, 2017, 24(Part B): 438-449. |
| [6] |
Wu Y, Liu J, Lu H, et al. Periphyton: An important regulator in optimizing soil phosphorus bioavailability in paddy fields[J]. Environmental Science & Pollution Research, 2016, 23(21): 1-8. |
| [7] |
Wang M, Yang Y, Chen Z, et al. Removal of nutrients from undiluted anaerobically treated piggery wastewater by improved microalgae[J]. Bioresource Technology, 2016, 222: 130-138. DOI:10.1016/j.biortech.2016.09.128 |
| [8] |
李攀荣, 邹长伟, 万金保, 等. 微藻在废水处理中的应用研究[J]. 工业水处理, 2016, 36(5): 5-9. LI Pan-rong, ZOU Chang-wei, WAN Jin-bao, et al. Research of micro algae processing wastewater[J]. Industrial Water Treatment, 2016, 36(5): 5-9. |
| [9] |
Unc A, Camargo-Valero M A, Smith S R. Algal research, special issue editorial: Wastewater and algae; risk, biofuels and long-term sustainability[J]. Algal Research, 2017, 24(Part B): A1. |
| [10] |
杨林章, 施卫明, 薛利红, 等. 农村面源污染治理的"4R"理论与工程实践:总体思路与"4R"治理技术[J]. 农业环境科学学报, 2013, 32(1): 1-8. YANG Lin-zhang, SHI Wei-ming, XUE Li-hong, et al. Reduce-retain-reuse-restore technology for the controlling the agricultural nonpoint source pollution in countryside in China: General countermeasures and technologies[J]. Journal of Agro-Environment Science, 2013, 32(1): 1-8. |
| [11] |
施卫明, 薛利红, 王建国, 等. 农村面源污染治理的"4R"理论与工程实践:生态拦截技术[J]. 农业环境科学学报, 2013, 32(9): 1697-1704. SHI Wei-ming, XUE Li-hong, WANG Jian-guo, et al. A reduce-retain-reuse-restore technology for controlling rural non-point pollution in China: Eco-retain technology[J]. Journal of Agro-Environment Science, 2013, 32(9): 1697-1704. |
| [12] |
宋玉芝, 张亚冬, 郑建伟, 等. 淡水湖泊附着藻类生态学研究进展[J]. 生态学杂志, 2016, 35(2): 534-541. SONG Yu-zhi, ZHANG Ya-dong, ZHENG Jian-wei, et al. Periphytic algae ecology in freshwater lake: A review[J]. Chinese Journal of Ecology, 2016, 35(2): 534-541. |
| [13] |
张启明, 铁文霞, 尹斌, 等. 藻类在稻田生态系统中的作用及其对氨挥发损失的影响[J]. 土壤, 2006, 38(6): 814-819. ZHANG Qi-ming, TIE Wen-xia, YIN Bin, et al. Algae function in paddy field ecosystem and its effect on reducing ammonia volatilization from paddy fields[J]. Soils, 2006, 38(6): 814-819. DOI:10.3321/j.issn:0253-9829.2006.06.026 |
| [14] |
De P K. The role of blue-green algae in nitrogen fixation in rice-fields[J]. Proceedings of the Royal Society of London, 1939, 127(846): 121-139. |
| [15] |
黎尚豪. 固氮蓝藻作为晚稻肥源的研究[J]. 水生生物学报, 1981, 7(3): 417-423. LI Shang-hao. Study of nitrogen-faxing blue-green algae for a fertilizer in late rice[J]. Acta Hydrobiology Sinica, 1981, 7(3): 417-423. |
| [16] |
中国科学院水生生物研究所第五室藻类实验生态学组. 双季晚稻田大面积放养固氮蓝藻的试验[J]. 水生生物学报, 1978, 6(3): 299-310. Group of Algae Ecology Research (Fifth Division), Institute of Hydrobiology, Chinese Academy of Sciences. Experiment on large-scale planting of nitrogen-fixing Cyanobacteria in late rice of double-cropping paddy field[J]. Acta Hydrobiology Sinica, 1978, 6(3): 299-310. |
| [17] |
黎尚豪, 叶清泉, 刘富瑞, 等. 固氮蓝藻对水稻肥效的初步研究[J]. 水生生物学报, 1959(4): 440-444. LI Shang-hao, YE Qing-quan, LIY Fu-rui, et al. Study of using nitrogen-fixing Cyanobacteria as a fertilizer in rice[J]. Acta Hydrobiology Sinica, 1959(4): 440-444. |
| [18] |
Wu Y, Liu J, Shen R, et al. Mitigation of nonpoint source pollution in rural areas: From control to synergies of multi ecosystem services[J]. Science of the Total Environment, 2017(607/608): 1376-1380. |
| [19] |
Wu Y, Liu J, Rene E R. Periphytic biofilms: A promising nutrient utilization regulator in wetlands[J]. Bioresource Technology, 2018, 248(Part B): 44-48. |
| [20] |
Li J Y, Deng K Y, Hesterberg D, et al. Mechanisms of enhanced inorganic phosphorus accumulation by periphyton in paddy fields as affected by calcium and ferrous ions[J]. Science of the Total Environment, 2017, 609: 466. DOI:10.1016/j.scitotenv.2017.07.117 |
| [21] |
Milhazes-Cunha H, Otero A. Valorisation of aquaculture effluents with microalgae: The integrated multi-trophic aquaculture concept[J]. Algal Research, 2017, 24(Part B): 416-424. |
| [22] |
Hecht T. Handbook on ingredients for aquaculture feeds[M]. Netherlands: Springer, 2000: 359-360.
|
| [23] |
Neori A, Chopin T, Troell M, et al. Integrated aquaculture: Rationale, evolution and state of the art emphasizing seaweed biofiltration in modern mariculture[J]. Aquaculture, 2004, 231(1): 361-391. |
| [24] |
Krom M D, Neori A. A total nutrient budget for an experimental intensive fishpond with circularly moving seawater[J]. Aquaculture, 1989, 83(3): 345-358. |
| [25] |
Sutherland D L, Craggs R J. Utilising periphytic algae as nutrient removal systems for the treatment of diffuse nutrient pollution in waterways[J]. Algal Research, 2017, 25: 496-506. DOI:10.1016/j.algal.2017.05.023 |
| [26] |
Adey W, Luckett C, Jensen K. Phosphorus removal from natural waters using controlled algal production[J]. Restoration Ecology, 1993, 1(1): 29-39. DOI:10.1111/rec.1993.1.issue-1 |
| [27] |
Valeta J, Verdegem M. Removal of nitrogen by algal turf scrubber Technology in recirculating aquaculture system[J]. Aquaculture Research, 2015, 46(4): 945-951. DOI:10.1111/are.12255 |
| [28] |
Adey W H, Kangas P C, Mulbry W. Algal turf scrubbing: Cleaning surface waters with solar energy while producing a biofuel[J]. Bioscience, 2011, 61(6): 434-441. DOI:10.1525/bio.2011.61.6.5 |
| [29] |
Kangas P, Mulbry W. Nutrient removal from agricultural drainage water using algal turf scrubbers and solar power[J]. Bioresour Technol, 2014, 152(1): 484-489. |
| [30] |
Sandefur H N, Matlock M D, Costello T A. Seasonal productivity of a periphytic algal community for biofuel feedstock generation and nutrient treatment[J]. Ecological Engineering, 2011, 37(10): 1476-1480. DOI:10.1016/j.ecoleng.2011.04.002 |
| [31] |
Craggs R J, Adey W H, Jessup B K, et al. A controlled stream mesocosm for tertiary treatment of sewage[J]. Ecological Engineering, 1996, 6(1/2/3): 149-169. |
| [32] |
Mulbry W, Kondrad S, Pizarro C, et al. Treatment of dairy manure effluent using freshwater algae: Algal productivity and recovery of manure nutrients using pilot-scale algal turf scrubbers[J]. Bioresour Technol, 2008, 99(17): 8137-8142. DOI:10.1016/j.biortech.2008.03.073 |
| [33] |
Sukačová K, Trtílek M, Rataj T. Phosphorus removal using a microalgal biofilm in a new biofilm photobioreactor for tertiary wastewater treatment[J]. Water Research, 2015, 71: 55-63. DOI:10.1016/j.watres.2014.12.049 |
| [34] |
Shi J, Podola B, Melkonian M. Application of a prototype-scale twinlayer photobioreactor for effective N and P removal from different process stages of municipal wastewater by immobilized microalgae[J]. Bioresource Technology, 2014, 154(2): 260-266. |
| [35] |
Boelee N C, Temmink H, Janssen M, et al. Nitrogen and phosphorus removal from municipal wastewater effluent using microalgal biofilms[J]. Water Research, 2011, 45(18): 5925-5933. DOI:10.1016/j.watres.2011.08.044 |
| [36] |
Posadas E, García-Encina P A, Soltau A, et al. Carbon and nutrient removal from centrates and domestic wastewater using algal-bacterial biofilm bioreactors[J]. Bioresource Technology, 2013, 139(13): 50-58. |
| [37] |
Johnson M B, Wen Z. Development of an attached microalgal growth system for biofuel production[J]. Applied Microbiology & Biotechnology, 2010, 85(3): 525-534. |
| [38] |
Sukačová K, Červený J. Can algal biotechnology bring effective solution for closing the phosphorus cycle? Use of algae for nutrient removal: Review of past trends and future perspectives in the context of nutrient recovery[J]. European Journal of Environmental Sciences, 2017, 7(1): 63-72. DOI:10.14712/23361964.2017.6 |
| [39] |
Kesaano M, Sims R C. Algal biofilm based technology for wastewater treatment[J]. Algal Research, 2014, 5(1): 231-240. |
| [40] |
Whitton R, Ometto F, Pidou M, et al. Microalgae for municipal wastewater nutrient remediation: Mechanisms, reactors and outlook for tertiary treatment[J]. Environmental Technology Reviews, 2015, 4(1): 133-148. DOI:10.1080/21622515.2015.1105308 |
| [41] |
Liu J, Wang F, Liu W, et al. Nutrient removal by up-scaling a hybrid floating treatment bed (HFTB) using plant and periphyton: From laboratory tank to polluted river[J]. Bioresource Technology, 2016, 207: 142-149. DOI:10.1016/j.biortech.2016.02.011 |
| [42] |
Guzzon A, Bohn A, Diociaiuti M, et al. Cultured phototrophic biofilms for phosphorus removal in wastewater treatment[J]. Water Research, 2008, 42(16): 4357-4367. DOI:10.1016/j.watres.2008.07.029 |
| [43] |
Monfet E, Unc A. Defining wastewaters used for cultivation of algae[J]. Algal Research, 2017, 24(Part B): 520-526. |
| [44] |
Loladze I, Elser J J. The origins of the redfield nitrogen-to-phosphorus ratio are in a homoeostatic protein-to-rRNA ratio[J]. Ecology Letters, 2011, 14(3): 244-250. DOI:10.1111/ele.2011.14.issue-3 |
| [45] |
Beuckels A, Depraetere O, Vandamme D, et al. Influence of organic matter on flocculation of Chlorella vulgaris by calcium phosphate precipitation[J]. Biomass & Bioenergy, 2013, 54(4): 107-114. |
| [46] |
Azov Y, Goldman J C. Free ammonia inhibition of algal photosynthesis in intensive cultures[J]. Applied & Environmental Microbiology, 1982, 43(4): 735-739. |
| [47] |
Solovchenko A, Verschoor A M, Jablonowski N D, et al. Phosphorus from wastewater to crops: An alternative path involving microalgae[J]. Biotechnology Advances, 2016, 34(5): 550-564. DOI:10.1016/j.biotechadv.2016.01.002 |
| [48] |
Schmidt J J, Gagnon G A, Jamieson R C. Microalgae growth and phosphorus uptake in wastewater under simulated cold region conditions[J]. Ecological Engineering, 2016, 95: 588-593. DOI:10.1016/j.ecoleng.2016.06.114 |
| [49] |
Krause-Jensen D, Mcglathery K, Rysgaard S, et al. Production within dense mats of the filamentous macroalga Chaetomorpha linum in relation to light and nutrient availability[J]. Marine Ecology Progress, 1996, 134(1/2/3): 207-216. |
| [50] |
Chen N, Li J, Wu Y, et al. Nutrient removal at a drinking water reservoir in China with an algal floway[J]. Ecological Engineering, 2015, 84: 506-514. DOI:10.1016/j.ecoleng.2015.09.049 |
| [51] |
Sindelar H R, Yap J N, Boyer T H, et al. Algae scrubbers for phosphorus removal in impaired waters[J]. Ecological Engineering, 2015, 85: 144-158. DOI:10.1016/j.ecoleng.2015.09.002 |
| [52] |
D′Aiuto P E, Patt J M, Albano J P, et al. Algal turf scrubbers: Periphyton production and nutrient recovery on a South Florida citrus farm[J]. Ecological Engineering, 2015, 75(4): 404-412. |
| [53] |
孙伟丽, 刘绍俨, 高宇, 等. 高效藻类塘处理北方农村模拟生活污水试验研究[J]. 科学技术与工程, 2015, 15(28): 217-220. SUN Wei-li, LIU Shao-yan, GAO Yu, et al. Study on the treatment of northern rural simulated domestic wastewater with high rate algal pond[J]. Science Technology and Engineering, 2015, 15(28): 217-220. DOI:10.3969/j.issn.1671-1815.2015.28.041 |
| [54] |
Park J B, Craggs R J, Shilton A N. Enhancing biomass energy yield from pilot-scale high rate algal ponds with recycling[J]. Water Research, 2013, 47(13): 4422-4432. DOI:10.1016/j.watres.2013.04.001 |
| [55] |
Sim T S, Goh A. Ecology of microalgae in a high rate pond for piggery effluent purification in Singapore[J]. Mircen Journal of Applied Microbiology & Biotechnology, 1988, 4(3): 285-297. |
| [56] |
Craggs R, Sutherland D, Campbell H. Hectare-scale demonstration of high rate algal ponds for enhanced wastewater treatment and biofuel production[J]. Journal of Applied Phycology, 2012, 24(3): 329-337. DOI:10.1007/s10811-012-9810-8 |
| [57] |
Mehrabadi A, Craggs R, Farid M M. Wastewater treatment high rate algal ponds (WWT HRAP) for low-cost biofuel production[J]. Bioresource Technology, 2015, 184: 202-214. DOI:10.1016/j.biortech.2014.11.004 |
| [58] |
Sutherland D L, Montemezzani V, Howard-Williams C, et al. Modifying the high rate algal pond light environment and its effects on light absorption and photosynthesis[J]. Water Research, 2015, 70: 86-95. DOI:10.1016/j.watres.2014.11.050 |
| [59] |
Sutherland D L, Turnbull M H, Broady P A, et al. Effects of two different nutrient loads on microalgal production, nutrient removal and photosynthetic efficiency in pilot-scale wastewater high rate algal ponds[J]. Water Research, 2014, 66(66): 53-62. |
| [60] |
Unc A, Monfet E, Potter A, et al. Note to editor: Microalgae cultivation for wastewater treatment and biofuel production: A bibliographic overview of past and current trends[J]. Algal Research, 2017, 24(Part B): A2-A7. |
| [61] |
Foley P M, Beach E S, Zimmerman J B. Algae as a source of renewable chemicals: Opportunities and challenges[J]. Cheminform, 2011, 42(37): 1399-1405. |
| [62] |
Pulz O, Gross W. Valuable products from biotechnology of microalgae[J]. Appl Microbiol Biotechnol, 2004, 65(6): 635-648. DOI:10.1007/s00253-004-1647-x |
| [63] |
Garcia-Gonzalez J. Evaluation of potential agricultural applications of the microalga scenedesmus dimorphus[D]. Phoenix: Arizona State University, 2014. https://search.proquest.com/docview/1640765368
|
| [64] |
Faheed F A, Fattah Z A. Effect of Chlorella vulgaris as bio-fertilizer on growth parameters and metabolic aspects of lettuce plant[J]. Journal of Agriculture & Social Sciences, 2008, 4: 165-169. |
| [65] |
Shaaban M M. Nutritional status and growth of maize plants as affected by green microalgae as soil additives[J]. Journal of Biological Sciences, 2001, 1(6): 475-479. DOI:10.3923/jbs.2001.475.479 |
| [66] |
孙世中, 高天荣, 徐锐, 等. 蓝藻泥和废弃烟叶混合制作有机肥料工艺优化[J]. 云南师范大学学报:自然科学版, 2008, 28(5): 35-38. SUN Shi-zhong, GAO Tian-rong, XU Rui, et al. Technological process improment of organic fertilizer made of blue green algae mixed with tobacco residue[J]. Journal of Yunnan Normal University, 2008, 28(5): 35-38. |
| [67] |
韩士群, 严少华, 王震宇, 等. 太湖蓝藻无害化处理资源化利用[J]. 自然资源学报, 2009, 24(3): 431-438. HAN Shi-qun, YAN Shao-hua, WANG Zhen-yu, et al. Harmless disposal and resources utilizations of Taihu Lake blue algae[J]. Journal of Natural Resources, 2009, 24(3): 431-438. DOI:10.3321/j.issn:1000-3037.2009.03.007 |
| [68] |
Mulbry W, Westhead E K, Pizarro C, et al. Recycling of manure nutrients: Use of algal biomass from dairy manure treatment as a slow release fertilizer[J]. Bioresource Technology, 2005, 96(4): 451-458. DOI:10.1016/j.biortech.2004.05.026 |
| [69] |
Roberts D A, Paul N A, Cole A J, et al. From waste water treatment to land management: Conversion of aquatic biomass to biochar for soil amelioration and the fortification of crops with essential trace elements[J]. Journal of Environmental Management, 2015, 157: 60-68. |
| [70] |
贾醉公. 稻田固氮蓝藻养殖技术与肥效[J]. 土壤, 1962(3): 23-30. JIA Zui-gong. Nitrogen-fixing cyanobacteria culture technology and fertilizer efficiency in paddy fields[J]. Soils, 1962(3): 23-30. |
| [71] |
杨林章, 吴永红. 农业面源污染防控与水环境保护[J]. 中国科学院院刊, 2018, 33(2): 168-176. YANG Lin-zhang, WU Yong-hong. Prevention and control of agricultural non-point source pollution and aquatic environmental protection[J]. Bulletin of Chinese Acadamy of Sciences, 2018, 33(2): 168-176. |
| [72] |
陶玲, 李谷, 李晓莉, 等. 基于固着藻类反应器的生态沟渠构建[J]. 农业工程学报, 2011, 27(1): 297-302. TAO Ling, LI Gu, LI Xiao-li, et al. Construction of an ecological ditch based on periphyton reactor[J]. Transactions of the CSAE, 2011, 27(1): 297-302. DOI:10.3969/j.issn.1002-6819.2011.01.048 |
| [73] |
Flemming H C, Leis A. Sorption properties of biofilms[M]. John Wiley & Sons, Inc., 2003.
|
| [74] |
Li S S, Li J H, Xia M S, et al. Adsorption of nitrogen and phosphorus by intact cells and cell wall polysaccharides of microcystis[J]. Journal of Applied Phycology, 2013, 25(5): 1539-1544. DOI:10.1007/s10811-013-9992-8 |
| [75] |
Dodds W K. The role of periphyton in phosphorus retention in shallow freshwater aquatic systems[J]. Journal of Phycology, 2003, 39(5): 840-849. DOI:10.1046/j.1529-8817.2003.02081.x |
| [76] |
周金娥, 唐立峰. 人工湿地系统的除污机理及影响因素探讨[J]. 土壤, 2009, 41(4): 520-524. ZHOU Jin-e, TANG Li-feng. On purification mechanism and influential factors of constructed wetland system[J]. Soils, 2009, 41(4): 520-524. DOI:10.3321/j.issn:0253-9829.2009.04.003 |
| [77] |
丁怡, 王玮, 王宇晖, 等. 水平潜流人工湿地的脱氮机理及其影响因素研究[J]. 工业水处理, 2015, 35(6): 6-10. DING Yi, WANG Wei, WANG Yu-hui, et al. Research on the mechanism of nitrogen removal and its main influencing factors in horizontal subsurface flow constructed wetlands[J]. Industrial Water Treatment, 2015, 35(6): 6-10. |
 2019, Vol. 38
2019, Vol. 38