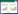文章信息
- 姚影, 何静, 张一, 李钰飞, 伍玉鹏
- YAO Ying, HE Jing, ZHANG Yi, LI Yu-fei, WU Yu-peng
- 赤子爱胜蚓(Eisenia fetida)对秸秆施入后土壤有机碳和微生物的影响
- Effects of Eisenia fetida Inoculation on Soil Organic Carbon and Soil Microorganisms Under Rice Straw Application
- 农业环境科学学报, 2015, 34(1): 110-117
- Journal of Agro-Environment Science, 2015, 34(1): 110-117
- http://dx.doi.org/10.11654/jaes.2015.01.016
-
文章历史
- 收稿日期:2014-07-12
2. 中国农业大学资源与环境学院, 北京 100193;
3. 北京市农林科学院植物营养与资源研究所, 北京 100097
2. College of Resources and Environment Sciences, China Agricultural University, Beijing 100193, China;
3. Institute of Plant Nutrition and Resources, Beijing Academy of Agriculture and Forestry Sciences, Beijing 100097, China
农田土壤有机碳的含量和组成不仅反映土壤有机质含量水平,还在土壤肥力、环境保护、农业可持续发展方面起着极其重要的作用,是影响土壤肥力和作物产量的决定性因子[1]。农作物秸秆是世界上数量最多的一种农业生产副产品,中国是农业大国,也是秸秆资源最丰富的国家之一。秸秆还田既可解决秸秆的去路,又能够显著增加耕层土壤有机碳含量[2,3,4,5],获得了广泛的应用。但农田施用秸秆也带来了一系列问题,如秸秆难腐解而引起耕作困难、与作物争肥等,因此加速秸秆转化是另外一项需要关注的重要问题。
秸秆碎片被认为是蚯蚓最好的食物源[6],在秸秆还田时辅以蚯蚓处理,可加快秸秆向土壤有机碳的转化。于建光等[7]通过连续4年稻麦轮作的小区试验,发现秸秆施用且接种蚯蚓有助于土壤有机碳活性的提高。袁新田等[8]通过室内培养试验,发现不同秸秆施用方式下接种蚯蚓能显著降低黏砂粒有机碳在全碳中的含量,增加团聚体有机碳含量。李辉信等[9]的研究则表明,秸秆还田时接种蚯蚓对土壤有机碳和全氮含量无显著影响,蚯蚓活动未造成土壤碳库的衰减,土壤碳、氮基本维持平衡[10]。也有报道显示蚯蚓对不同活性有机碳的影响不同[11],例如袁新田等[12]发现在混施秸秆的土壤中接种蚯蚓后只有水提取碳含量增加,而土壤微生物量碳含量和碳水化合物含量则有所下降。由此可见,蚯蚓对土壤有机碳的作用十分重要,但也十分复杂。
秸秆向土壤有机碳的转化开始于秸秆的腐解过程,而蚯蚓能够通过粉碎、消化、呼吸、排泄等一系列活动对秸秆的分解做出直接贡献;另一方面,蚯蚓也能够通过捕食或者改变土壤环境从而影响其他土著土壤生物的种群动态而对秸秆分解做出间接贡献[13,14,15]。很少有研究将这两种作用区分开来并分别进行研究,这是由于二者通常是相伴发生的。因此,本研究通过对土壤进行灭菌处理,排除土著土壤生物的干扰,研究接种蚯蚓对秸秆还田下土壤有机碳含量的影响,并与未灭菌土壤下的相同处理进行比较,结合不同处理下土壤微生物群落结构的变化,探索蚯蚓影响土壤有机碳变化的机理。 1 材料与方法 1.1 供试材料
土壤:供试土壤样品采集自华中农业大学蔬菜试验田(30°28.65′N,114°21.59′E) 0~30 cm深度的红壤。土样采集后挑选出大的石块、植物根茬等杂物,过5 mm筛,混匀并加入灭菌去离子水调节含水率为30%,置于25 ℃下预培养7 d,以消除在后续试验中因土壤湿度改变对土壤微生物造成的影响。在完成预培养后取出一部分土壤采用湿热灭菌法在121 ℃灭菌1 h,重复2次后获得灭菌土壤。土壤基本理化性质如表 1所示。
秸秆:供试秸秆为水稻秸秆,采集自华中农业大学水稻实验田。秸秆收集后于60 ℃烘干至恒重,粉碎过2 mm筛。秸秆全碳(TC)含量为376.8 g·kg-1,全氮(TN)含量为7.9 g·kg-1,C/N为48。
蚯蚓:供试蚯蚓为赤子爱胜蚓(Eisenia fetide),选择大小一致、性成熟的蚯蚓置于供试土壤与供试秸秆的混合物中,在25 ℃下驯化1周。实验开始前挑选活性较高的蚯蚓于湿润的滤纸上进行24 h避光吐泥,以排除蚯蚓肠道内容物,并用无菌水冲洗蚯蚓体表。 1.2 实验设计
本实验采用微宇宙系统进行培养,在2 L的玻璃瓶中分别加入灭菌或未灭菌的鲜土1.5 kg(30%含水率),混入15 g秸秆,接种5条蚯蚓,同时设置不接种蚯蚓的对照。按照玻璃瓶的底面积来计算,本实验秸秆还田量大约为6000 kg·hm-2,这是根据前作产量,按照谷草比1∶1计算获得的全量秸秆还田量。蚯蚓接种密度为200 条·m-2,该密度对于耕地土壤来说偏高,但接种较高密度的蚯蚓能够通过加快对土壤和秸秆的作用过程而在一定程度上抵消短期培养实验带来的影响,同时也有研究报道在红壤中蚯蚓密度可高达277 条·m-2 [16]。因此,本实验共设置4个处理,分别为灭菌土壤接种蚯蚓(S1E1)、灭菌土壤不接种蚯蚓(S1E0)、未灭菌土壤接种蚯蚓(S0E1)和未灭菌土壤不接种蚯蚓(S0E0),每个处理设置3个重复。
每个玻璃瓶均用黑色塑料袋进行遮光处理,同时利用橡皮筋将瓶口用带有小孔的塑料薄膜封住,在防止蚯蚓逃逸的同时也保证微宇宙系统和外界能够有良好的气体交换。整个培养装置放于(25±2)℃的恒温培养箱中进行30 d的培养。在培养过程中利用称重法对装置中的土壤含水率进行调节,使其始终保持在30%。 1.3 样品采集与测定
利用气相色谱法,于培养开始的前10 d每天测定一次土壤呼吸,接下来隔一天测定一次。测定土壤呼吸时,先利用风扇对玻璃瓶通风30 min,带三通阀的注射器采集瓶口附近的气体用于计算背景值,而后用带橡胶管的胶塞塞紧玻璃瓶口,夹紧橡胶管,密闭状态下培养2 h后,利用注射器连接橡胶管,打开夹子,抽取瓶中气体。气体采集后在当天用气相色谱仪(GC-7890A,USA)进行CO2浓度分析。CO2排放通量参照李成芳等[17]的方法进行计算,CO2累积排放量参照Kool等[18]的方法进行计算。
30 d的培养结束后对土壤进行破坏性采样。总有机碳(TOC)采用重铬酸钾氧化外加热法测定[19]。可溶性有机碳(DOC)利用蒸馏水对土壤浸提,离心,取上清液过0.45 μm滤膜后用TOC仪(Elementer Vario TOC,Germany)测定[20]。活性有机碳(LOC)采用0.2 mol·L-1(1/6 K2Cr2O7-1∶3H2SO4)氧化法测定[21,22]。微生物量碳(MBC)采用氯仿熏蒸法进行测定[23]。
土壤微生物群落结构及多样性采用末端限制性片段长度多样性(T-RFLP)法进行分析,参考Wu等[24]的方法,利用土壤DNA提取试剂盒提取土壤微生物总DNA,用带FAM荧光标记的细菌通用引物扩增16S rDNA片段,纯化后的PCR产物用限制性内切酶Msp I进行酶切,酶切产物由生工生物工程股份有限公司于ABI 373自动测序分析仪上进行毛细管电泳,以ROX-500-LIS作为内标,用Peak Scanner Software V1.0(Applied Biosystems,Inc.)对毛细管电泳结果进行分析。 1.4 数据分析及统计
使用BIO-DAP(Gordon Thomas,Canada)软件计算细菌的Shannon多样性指数、Simpson多样性指数和均一度指数。使用CANOCO 4.0(Microcomputer Power,USA)中的冗余分析(RDA)来研究土壤微生物与土壤有机碳的相关关系。文中数据结果以均值表示,用SPSS 17.0(IBM,USA)统计软件进行相关的统计分析、差异检验等(显著水平α为0.05)。 2 结果与分析 2.1 蚯蚓存活率
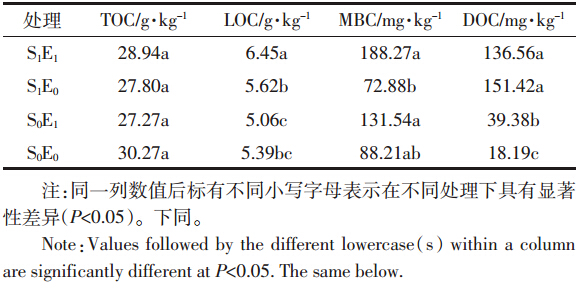
在30 d的培养结束后,接种蚯蚓的处理中所有蚯蚓均存活,并且还在未灭菌土壤处理的两个玻璃瓶中各发现1条幼蚓(表 2)。虽然未在灭菌土壤中发现幼蚓,但不同处理的土壤接种蚯蚓30 d后均发现存在大量的蚓茧。该现象说明本研究中设置的环境条件能够保证蚯蚓的正常生命活动。
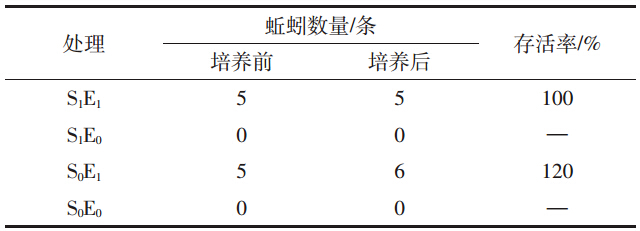 |
土壤呼吸作用是土壤碳库变化的主要途径之一,图 1A显示培养期内不同处理的土壤呼吸均呈波动状。值得注意的是灭菌土壤在培养前期(1~3 d)产生了一个显著的CO2排放峰值,而这一值在随后的培养中又忽然快速下降。总体看来,无论是在灭菌土壤还是非灭菌土壤中,接种蚯蚓均增强了土壤呼吸。于30 d的培养结束后计算整个培养过程中的CO2-C累积排放量,结果显示接种蚯蚓的处理获得了高于未接种蚯蚓处理的CO2-C累积排放量,然而仅在灭菌土壤中发现存在显著性差异,接种蚯蚓与未接种蚯蚓分别为517.02、244.17 mg CO2-C·kg-1干土(图 1B)。
|
|
图B中不同小写字母表示不同处理下30 d的CO2-C累积排放量具有显著性差异(P<0.05);图B中垂直条表示标准误 Values of cumulative CO2-C followed by the different lowercase(s) in Figure B are significantly different at P<0.05. The vertical bars in Figure B represent standard errors 图 1 接种蚯蚓对土壤呼吸(A)和累积CO2-C排放量(B)的影响 Figure 1 Effects of earthworm inoculation on soil respiration(A) and cumulative CO2 emissions(B) |
表 3显示,接种蚯蚓对不同土壤TOC含量的影响因土壤处理方式不同而异。接种蚯蚓增加了灭菌土壤中TOC含量,减少了未灭菌土壤中TOC含量,然而不同处理之间均无显著差异。在灭菌土壤中,蚯蚓的接种显著增加了LOC含量,接种蚯蚓与不接种蚯蚓分别为6.45、5.62 g·kg-1,但在未灭菌土壤中却减少了LOC含量。通过计算LOC与TOC比值[25]发现,接种蚯蚓均提高了LOC的分配比例,在灭菌和未灭菌土壤中较不接种蚯蚓的处理分别提高了2.08%和0.74%。不论在灭菌土壤还是未灭菌土壤中,接种蚯蚓均增加了MBC值,但仅在灭菌土壤中观察到差异显著性。接种蚯蚓对土壤DOC含量的影响也因土壤是否灭菌而异,在灭菌土壤中接种蚯蚓降低了DOC含量,但在未灭菌土壤中蚯蚓的存在则显著增加了DOC含量。
经过Peak Scanner Software V1.0软件分析,共得到58个不同的T-RFLP片段,大部分T-RFLP片段大小均在55~536 bp范围内。土壤灭菌处理后大幅减少了TRFs(末端限制性片段)数量,在灭菌土壤中共发现30个TRFs,而在未灭菌土壤中发现48个TRFs(图 3)。蚯蚓接种对TRFs数量的影响因土壤是否灭菌而异,在灭菌土壤中,蚯蚓接种获得了26个TRFs,明显高于未接种蚯蚓的处理(共14个TRFs)。另外,接种蚯蚓的处理包含16个独有的TRFs,为未接种蚯蚓独有TRFs数量的4倍。相比之下,在未灭菌土壤中,蚯蚓的存在并未明显改变TRFs的数目(接种与不接种蚯蚓分别为29个和32个),且接种与不接种蚯蚓的处理共享了近50%的TRFs。
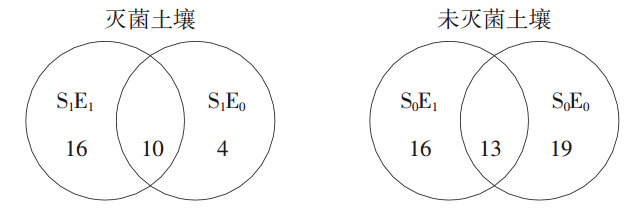
|
| 图 3 蚯蚓接种对培养结束后灭菌与未灭菌 土壤中细菌丰度的影响 Figure 3 Venn diagrams of species richness of bacteria in differently treated soils at the end of incubation |
表 4显示,在灭菌土壤中,蚯蚓的接种增加了细菌的Shannon多样性指数和Simpson多样性指数,但在未灭菌土壤中,蚯蚓的接种则降低了土壤中细菌的Shannon多样性指数和Simpson多样性指数。对于均一度指数来说,在两种不同处理的土壤中,蚯蚓的接种均表现为降低作用。
 |
RDA图显示(图 4),不同处理之间细菌群落结构并无明显的聚集现象,说明不同处理间细菌的群落结构存在一定差异。图 4还显示,土壤MBC含量和CO2累积排放量与S1E1和S0E1呈现较为明显的正相关关系,而土壤DOC含量和LOC含量则与S1E1和S1E0呈现较为明显的正相关关系。

|
| 图 4 土壤细菌群落与土壤有机碳的关系 Figure 4 Relationship between soil organic carbon and soil bacterial population |
土壤中DOC的来源主要包括凋落物、腐殖质、微生物和根际分泌物等;LOC可模拟微生物对土壤有机质的降解;MBC用于直接表征土壤中微生物的生物量或数量;土壤呼吸则表明了微生物矿化土壤有机碳的速率,反映固有微生物库总的活性或能量消耗[26]。在本研究中,土壤灭菌后测定其MBC值几乎为零(表 1),说明两次1 h的121 ℃灭菌达到了去除土壤土著微生物的目的,而土壤微生物死亡后细胞内容物的渗出则是引起DOC含量显著增高的主要原因。虽然对土壤进行了灭菌处理,但仍然在随后的培养过程中观察到CO2的排放(图 1),可能是由于该实验的培养过程中并未在严格的无菌环境下进行,而且未灭菌秸秆的施入也导致了外来微生物在土壤中的繁殖。在培养的初期,灭菌土壤反而出现了较为明显的CO2排放峰,类似的现象已有报道,如Biederbeck等[27]发现连续焚烧秸秆可能会杀死土表微生物,但单次焚烧秸秆后土壤呼吸反而得到了提高。这是由于秸秆焚烧时产生的高温导致了土壤表面局部灭菌,死亡细胞渗出的营养物质被存活下来的或是重新入侵的微生物所利用,从而促进了分解并提高了土壤呼吸。在随后的培养过程中,灭菌土壤呼吸速率迅速下降则可能归结于土壤中可利用速效养分的快速消耗。
研究结果显示,蚯蚓的接种提高了土壤MBC,但差异仅出现在灭菌土壤中(表 3),而主要来源于土壤微生物异养呼吸的CO2-C累积排放量也有类似的趋势(图 1),这些结果均与前人的研究一致[28,29]。这可能源于蚓穴内部及蚓粪的微生物量均高于对照土壤[30],且过腹的土壤及有机物料更利于微生物侵染和繁殖[14],同时蚯蚓能够加速土壤养分转化[31],也能够为微生物提供更好的生存环境。虽然也有报道认为蚯蚓可能由于取食作用降低微生物量[32],但当生存环境对微生物生长有利的时候,例如在灭菌土壤中,充足的食物和无竞争的环境可能导致活性微生物的增加幅度远远超过部分微生物的减少量,从而造成MBC含量的增大。
在未灭菌土壤中接种蚯蚓并未显著影响土壤TOC和LOC的含量,该结果与于建光等[7,11]的研究结果一致,于建光等将这归结于蚯蚓作用不明显或作用时间太短。秸秆腐解通常需要较长的时间,特别是对于高C/N等较为难分解的秸秆更是如此,本研究仅30 d的培养时间可能是导致土壤TOC和LOC的含量差异不显著的原因之一。另外,在本研究中,秸秆均被粉碎过2 mm筛,并人为的混入土壤之中,该操作间接降低了蚯蚓破碎和混合作用对有机物分解的影响,而蚯蚓对秸秆与土壤颗粒的吞咽及包被等物理性保护作用则可能相对突出。虽然于建光等[11]指出,这一物理保护可减缓秸秆的分解和转化及土壤有机碳的矿化,进而减缓土壤有机碳的更新,使土壤有机碳活性下降,但值得注意的是,在灭菌、未灭菌土壤中接种蚯蚓均增加了LOC的分配比例,说明蚯蚓的存在增加了土壤的有机碳活性强度,此时土壤有机碳被分解矿化的潜力更大。
在灭菌土壤中,接种蚯蚓的处理获得了更高的细菌丰度,以及4倍于未接种蚯蚓的独有TRFs数。由于培养试验严格控制了不同处理之间的环境条件,且蚯蚓在接种前经过了无菌水的冲洗,这些独有的TRFs极有可能来源于蚯蚓肠道微生物。已有的研究表明,细菌在通过蚯蚓肠道后其数量明显增加,群落结构也发生了变化[33,34],而这些肠道源微生物也会随着蚓粪的排泄进入土壤,蚯蚓的穿插移动则为这些移动性较小的微生物提供了便利的传播方式[35]。尤其是没有竞争且食物充足的灭菌土壤,更为来自蚯蚓肠道的微生物繁殖提供了极好的环境和条件,使其成为土壤中的优势种群。灭菌土壤在接种蚯蚓后细菌多样性指数增加,但均一度指数下降也可以部分证明这一推论。相比之下,在未灭菌土壤中,土壤土著微生物的竞争作用可能极大地抑制了来自蚯蚓肠道微生物的繁殖,因此并未观察到蚯蚓接种对未灭菌土壤的TRFs数目产生较为明显的影响,且接种与不接种蚯蚓的处理共享了近50%的TRFs。
RDA图显示,在30 d的培养之后,蚯蚓接种改变了土壤细菌群落结构,但接种蚯蚓的处理只与土壤MBC含量和CO2累积排放量呈正相关关系,而土壤DOC和LOC含量则更多的正相关于土壤灭菌处理。值得注意的是,S1E1处理与MBC、DOC、LOC含量和CO2累积排放量均呈正相关关系,说明在该处理下细菌群落更有利于土壤活性有机碳含量的提高。前文提到,在S1E1处理中来源于蚯蚓肠道的微生物可能是土壤微生物群落中的主要类群。蚯蚓肠道微生物虽来源于蚯蚓的生活环境,但在群落结构上又有很大差别[36],Drake等[37]指出,当食物通过蚯蚓肠道时,蚯蚓肠道特殊的微环境会极大地刺激取食食物中某些类群微生物的繁殖,而这些微生物大多能够促进土壤碳、氮的循环。Bernard等[38]则发现,稻草等新鲜有机质的加入普遍提高微生物的活性,但没有显著改变微生物的群体结构,而蚯蚓的存在可以通过促进一小部分的细菌功能群成为优势种来加快有机质的矿化。因此,可以推断,来源于蚯蚓肠道的微生物可能是导致灭菌土壤LOC含量增加的主要因素之一,而在未灭菌土壤中这一作用可能由于土著微生物的竞争而削弱。然而,这一推论需要更进一步的研究予以证实,例如利用高通量测序技术分别对土壤、蚯蚓粪的微生物进行对比分析、对S1E1中独有的TRFs进行鉴定和分析以确定其功能,或将蚯蚓肠道微生物单独分离出来并加入到灭菌土壤中以观察其对土壤LOC的影响等。 4 结论
不论在灭菌还是未灭菌土壤中接种蚯蚓均增加了土壤微生物量碳和土壤呼吸,但接种蚯蚓对土壤总有机碳、活性有机碳和可溶性有机碳的影响则因土壤是否灭菌而存在差异。蚯蚓的存在并未显著影响未灭菌土壤中的活性有机碳含量,却显著增加了灭菌土壤中的活性有机碳含量。虽然在不同处理的土壤中接种蚯蚓均改变了土壤细菌群落结构,但仅在灭菌土壤中发现接种蚯蚓后获得了更多的TRFs。
| [1] | 南雄雄, 游东海, 田霄鸿, 等. 关中平原农田作物秸秆还田对土壤有机碳和作物产量的影响[J]. 华北农学报, 2011, 26(5):222-229. NAN Xiong-xiong, YOU Dong-hai, TIAN Xiao-hong, et al. Effect of returning of cropland straw to field on soil organic carbon and grain yield in Guanzhong plain[J]. Acta Agriculturae Boreali-Sinica, 2011, 26(5):222-229. |
| [2] | 张 鹏, 李 涵, 贾志宽, 等. 秸秆还田对宁南旱区土壤有机碳含量及土壤碳矿化的影响[J]. 农业环境科学学报, 2011, 30(12):2518-2525. ZHANG Peng, LI Han, JIA Zhi-kuan, et al. Effects of straw returning on soil organic carbon and carbon mineralization in semi-arid areas of southern Ningxia, China[J]. Journal of Agro-Environment Science, 2011, 30(12):2518-2525. |
| [3] | 李小刚, 崔志军, 王玲英. 施用秸秆对土壤有机碳组成和结构稳定性的影响[J]. 土壤学报, 2002, 39(3):421-428. LI Xiao-gang, GUI Zhi-jun, WANG Ling-ying. Effect of straw on soil organic carbon constitution and structural stability[J]. Acta Pedologica Sinica, 2002, 39(3):421-428. |
| [4] | 路文涛, 贾志宽, 张 鹏, 等. 秸秆还田对宁南旱作农田土壤活性有机碳及酶活性的影响[J]. 农业环境科学学报, 2011, 30(3):522-528. LU Wen-tao, JIA Zhi-kuan, ZHANG Peng, et al. Effects of straw returning on soil labile organic carbon and enzyme activity in semi-arid areas of southern Ningxia, China[J]. Journal of Agro-Environment Science, 2011, 30(3):522-528. |
| [5] | 郝翔翔, 杨春葆, 苑亚茹, 等. 连续秸秆还田对黑土团聚体中有机碳含量及土壤肥力的影响[J]. 中国农学通报, 2013, 29(35):263-269. HAO Xiang-xiang, YANG Chun-bao, YUAN Ya-ru, et al. Effects of continuous straw returning on organic carbon content in aggregates and fertility of black soil[J]. Chinese Agricultural Science Bulletin, 2013, 29(35):263-269. |
| [6] | Lavelle P, Martin A. Small-scale and large-scale effects of endogeic earthworms on soil organic matter dynamics in soils of the humid tropics[J]. Soil Biology and Biochemistry, 1992, 24(12):1491-1498. |
| [7] | 于建光, 李辉信, 胡 锋, 等. 施用秸秆及接种蚯蚓对土壤颗粒有机碳及矿物结合有机碳的影响[J]. 生态环境, 2006, 15(3):606-610. YU Jian-guang, LI Hui-xin, HU Feng, et al. Effects of straw application and earthworm inoculation on soil particulate organic carbon and mineral-associated organic carbon[J]. Ecology and Environment, 2006, 15(3):606-610. |
| [8] | 袁新田, 焦加国, 朱 玲, 等. 不同秸秆施用方式下接种蚯蚓对土壤团聚体及其中碳分布的影响[J]. 土壤, 2011, 43(6):968-974. YUAN Xin-tian, JIAO Jia-guo, ZHU Ling, et al. Effects of earthworm activity on soil aggregates' stabillity and organic carbon distribution under different manipulations of corn straw[J]. Soils, 2011, 43(6):968-974. |
| [9] | 李辉信, 胡 锋, 沈其荣, 等. 接种蚯蚓对秸秆还田土壤碳、氮动态和作物产量的影响[J]. 应用生态学报, 2002, 13(12):1637-1641. LI Hui-xin, HU Feng, SHEN Qi-rong, et al. Effect of earthworm inouclation on soil carbon and nitrogen gynamics and on crop yield with application of corn residues[J]. Chinese Journal of Applied Ecology, 2002, 13(12):1637-1641. |
| [10] | Cortez J, Hameed R, Bouché M B. C and N transfer in soil with or without earthworms fed with 14C- and 15N-labelled wheat straw[J]. Soil Biology and Biochemistry, 1989, 21(4):491-497. |
| [11] | 于建光, 李辉信, 陈小云, 等. 秸秆施用及蚯蚓活动对土壤活性有机碳的影响[J]. 应用生态学报, 2007, 18(4):818-824. YU Jian-guang, LI Hui-xin, CHEN Xiao-yun, et al. Effects of straw application and earthworm inoculation on soil labile organic carbon[J]. Chinese Journal of Applied Ecology, 2007, 18(4):818-824. |
| [12] | 袁新田, 朱 玲, 焦加国, 等. 施用玉米秸秆和接种蚯蚓后几种土壤活性有机碳的动态变化[J]. 生态学报, 2010, 30(19):5264- 5271. YUAN Xin-tian, ZHU Ling, JIAO Jia-guo, et al. Effects of earthworm and maize stalk application on the dynamic variation of soil active organic carbon[J]. Acta Ecologica Sinica, 2010, 30(19):5264- 5271. |
| [13] | Whalen J K, Costa C. Linking spatio-temporal dynamics of earthworm populations to nutrient cycling in temperate agricultural and forest ecosystems[J]. Pedobiologia, 2003, 47(5):801-806. |
| [14] | Brown G G, Barois I, Lavelle P. Regulation of soil organic matter dynamics and microbial activityin the drilosphere and the role of interactions with other edaphic functional domains[J]. European Journal of Soil Biology, 2000, 36(3):177-198. |
| [15] | 庞军柱, 乔玉辉, 孙振钧, 等. 蚯蚓对麦秸分解速率的影响及其对氮矿化的贡献[J]. 生态学报, 2009, 29(2):1017-1023. PANG Jun-zhu, QIAO Yu-hui, SUN Zhen-jun, et al. Effects of earthworm(Eisenia foetida) on wheat straw decomposition and its contribution to nitrogen mineralization[J]. Acta Ecologica Sinica, 2009, 29(2):1017-1023. |
| [16] | 胡 锋, 吴珊眉. 不同利用方式红壤生态系统蚯蚓种群特征[J]. 南京农业大学学报, 1993, 16(1):65-71. HU Feng, WU Shan-mei. Population characteristic of earthworm in red soil ecosystems under different utilization[J]. Journal of Nanjing Agricultural University, 1993, 16(1):65-71. |
| [17] | 李成芳, 寇志奎, 张枝盛, 等. 秸秆还田对免耕稻田温室气体排放及土壤有机碳固定的影响[J]. 农业环境科学学报, 2011, 30(11):2362-2367. LI Cheng-fang, KOU Zhi-kui, ZHANG Zhi-sheng, et al. Effects of rape residue mulch on greenhouse gas emissions and carbon sequestration from no-tillage rice fields[J]. Journal of Agro-Environment Science, 2011, 30(11):2362-2367. |
| [18] | Kool D M, Hoffland E, Hummelink E W, et al. Increased hippuric acid content of urine can reduce soil N2O fluxes[J]. Soil Biology and Biochemistry, 2006, 38(5):1021-1027. |
| [19] | 鲍士旦. 土壤农化分析[M]. 北京:中国农业出版社, 2000. BAO Shi-dan. Soil and agricultural chemistry analysis[M]. Beijing:China Agriculture Press, 2000. |
| [20] | Liang B C, Wang X L, Ma B L. Maize root-induced change in soil organic carbon pools[J]. Soil Science Society of America Journal, 2002, 66(3):845-847. |
| [21] | Hu S J, van Bruggen A H C, Grünwald N J. Dynamics of bacterial populations in relation to carbon availability in a residue-amended soil[J]. Applied Soil Ecology, 1999, 13(1):21-30. |
| [22] | 刘合明, 杨志新, 刘树庆. 不同粒径土壤活性有机碳测定方法的探讨[J]. 生态环境, 2008, 17(5):2046-2049. LIU He-ming, YANG Zhi-xin, LIU Shu-qing. Methods for determining labile orange matter in different sized soil particles of different soils[J]. Ecology and Environment, 2008, 17(5):2046-2049. |
| [23] | Vance E D, Brookes P C, Jenkinson D S. An extraction method for measuring soil microbial biomass C[J]. Soil Biology and Biochemistry, 1987, 19(6):703-707. |
| [24] | Wu Y P, Li Y F, Zheng C Y, et al. Organic amendment application influence soil organism abundance in saline alkali soil[J]. European Journal of Soil Biology, 2013, 54: 32-40. |
| [25] | 吴建国, 张小全, 徐德应. 六盘山林区几种土地利用方式对土壤有机碳矿化影响的比较[J]. 植物生态学报, 2004, 28(4):530-538. WU Jian-guo, ZHANG Xiao-quan, XU De-ying. The mineralization of soil organic carbon under different land uses in the Liupan mountain forest zone[J]. Acta Phytoecologica Sinica, 2004, 28(4):530-538. |
| [26] | 于建光, 李辉信, 胡 锋. 秸秆施用及蚯蚓活动下土壤有机碳变化表征指标的筛选[J]. 土壤学报, 2007, 44(5):878-884. YU Jian-guang, LI Hui-xin, HU feng. Indices for changes in organic carbon in soils subject to straw applcaiotn and earthworm activity[J]. Acta Pedologica Sinica, 2007, 44(5):878-884. |
| [27] | Biederbeck V O, Campbell C A, Bowren K E, et al. Effect of burning cereal straw on soil properties and grain yields in Saskatchewan[J]. Soil Science Society of America Journal, 1980, 44(1):103-111. |
| [28] | 胡 锋, 王 霞, 李辉信, 等. 蚯蚓活动对稻麦轮作系统中土壤微生物量碳的影响[J]. 土壤学报, 2005, 42(6):965-969. HU Feng, WANG Xia, LI Hui-xin, et al. Effects of earthworms on soil microbial biomass carbon in rice-wheat ratation agro-ecosystem[J]. Acta Pedologica Sinica, 2005, 42(6):965-969. |
| [29] | Speratti A B, Whalen J K, Rochette P. Earthworm influence on carbon dioxide and nitrous oxide fluxes from an unfertilized corn agroecosystem[J]. Biology and Fertility of Soils, 2007, 44(2):405-409. |
| [30] | Gorres J H, Savin M C, Amador J A. Soil micropore structure and carbon mineralization in burrows and casts of an anecic earthworm(Lumbricus terrestris)[J]. Soil Biology and Biochemistry, 2001, 33(14):1881-1887. |
| [31] | Cortez J, Billes G, Bouché M B. Effect of climate, soil type and earthworm activity on nitrogen transfer from a nitrogen-15-labelled decomposing material under field conditions[J]. Biology and Fertility of Soils, 2000, 30(4):318-327. |
| [32] | Fraser P M, Beare M H, Butler R C, et al. Interactions between earthworms(Aporrectodea caliginosa), plants and crop residues for restoring properties of a degraded arable soil[J]. Pedobiologia, 2003, 47(5-6):870-876. |
| [33] | Furlong M A, Singleton D R, Coleman D C, et al. Molecular and culture-based analyses of prokaryotic communities from an agricultural soil and the burrows and casts of the earthworm Lumbricus rubellus[J]. Applied and Environmental Microbiology, 2002, 68(3):1265-1279. |
| [34] | Curry J P, Schmidt O. The feeding ecology of earthworms:A review[J]. Pedobiologia, 2007, 50(6):463-477. |
| [35] | Mackay A D, Kladivko E J. Earthworms and rate of breakdown of soybean and maize residues in soil[J]. Soil Biology and Biochemistry, 1985, 17(6):851-857. |
| [36] | 张宝贵. 蚯蚓与微生物的相互作用[J]. 生态学报, 1997, 17(5):556-560. ZHANG Bao-gui. Interaction between earthworms and microorganisms[J]. Acta Ecologica Sinica, 1997, 17(5):556-560. |
| [37] | Drake H L, Horn M A. As the worm turns:The earthworm gut as a transient habitat for soil microbial biomes[J]. Annual Review of Microbiology, 2007, 61: 169-189. |
| [38] | Bernard L, Chapuis-Lardy L, Razafimbelo T, et al. Endogeic earthworms shape bacterial functional communities and affect organic matter mineralization in a tropical soil[J]. The ISME Journal, 2011, 6(1):213-222. |
 2015, Vol. 34
2015, Vol. 34