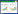文章信息
- 王争妍, 雷紫烟, 叶志雄, 伍玉鹏
- WANG Zheng-yan, LEI Zi-yan, YE Zhi-xiong, WU Yu-peng
- 蚯蚓作用下不同C/N秸秆还田对土壤CO2及N2O排放的影响
- Influence of earthworm activity on soil CO2 and N2O emissions by incorporating different C/N residues
- 农业环境科学学报, 2017, 36(9): 1908-1915
- Journal of Agro-Environment Science, 2017, 36(9): 1908-1915
- http://dx.doi.org/10.11654/jaes.2017-0187
文章历史
- 收稿日期: 2017-02-19
2. 农业部长江中下游耕地保育重点实验室, 武汉 430070
2. Key Laboratory of Arable Land Conservation(Middle and Lower Reaches of Yangtze River), Ministry of Agriculture, Wuhan 430070, China
秸秆是农作物的主要副产品,含有丰富的碳、氮、磷、钾等营养元素,还田后能够在土壤微生物的作用下腐解并形成腐殖质,从而提高土壤有机质含量,增强土壤肥力,改善土壤结构及土壤生物学特性[1-2]。因此,秸秆还田在我国农业生产中得到了广泛应用。
虽然秸秆还田有利于农田土壤改良,但也极易导致土壤CO2和N2O等温室气体排放的增加[3-4]。已有的研究指出,秸秆还田主要通过增强土壤呼吸作用来促进CO2的排放,特别是对于低C/N的秸秆来说,其腐解速度更快,进入土壤后能够刺激微生物迅速繁殖并排放出更多的CO2[5-6]。秸秆还田在促进土壤呼吸的同时加速了土壤中氧气的消耗,并形成一个适宜于反硝化作用的厌氧环境,进而导致土壤N2O排放的增加[3]。但一般来说,高C/N秸秆还田导致的N2O排放要少于低C/N的秸秆[3]。这是因为秸秆C/N较高时,表现为碳源相对过剩、氮源相对缺少,从而刺激土壤微生物去吸收另外的氮源以满足其生物体的合成需要,加剧了土壤异养微生物和自养硝化细菌对土壤中NH4+的竞争[3, 5, 7]。
蚯蚓是陆地生态系统中最典型的大型土壤动物之一,能够通过破碎、取食、消化、掘穴等一系列生命活动加速秸秆的腐解过程,促进新鲜秸秆残体向土壤腐殖质的转化[8-9]。尤其是蚯蚓肠道内较高的酶活(如纤维素酶),能够将一些难分解物质转化为易利用的有机物,并随蚓粪排除体外,便于微生物更好地利用[10-11],进而明显提高低质量秸秆(高C/N、高木质素和多酚含量)的腐解速度[12-13]。此外,蚯蚓在吞食-排泄过程中充分混合有机质与土壤,促进了表层秸秆碳向土壤深层的转移,并最终通过增强土壤养分循环和周转速率来提高土壤肥力[14-16]。因此,在秸秆还田时辅以蚯蚓处理,可显著加快秸秆(尤其是高C/N秸秆)的腐解过程,促进表层秸秆残体向深层土壤腐殖质的转化,强化秸秆还田下的土壤培肥作用。
综上所述,辅以蚯蚓处理能够加快还田秸秆的腐解过程,强化秸秆还田对土壤的培肥作用。秸秆C/N是影响不同秸秆还田后土壤产生CO2、N2O的主要因素之一,但蚯蚓作用下不同C/N秸秆还田对土壤CO2及N2O排放的影响却并不清楚。因此,本研究通过室内培养实验,选取不同C/N的四种秸秆(油菜饼、玉米叶、水稻秸、玉米秆)为材料,比较有、无蚯蚓存在下不同秸秆混入土壤后的CO2、N2O排放变化,并结合土壤无机氮和可溶性碳含量的变化探讨其作用机理。研究结果将有助于进一步揭示还田秸秆在土壤生物作用下对土壤温室气体排放的影响,亦能够为不同类型秸秆还田过程中土壤生物的管理与利用提供参考依据。
1 材料与方法 1.1 实验材料供试土壤采集自华中农业大学蔬菜试验田(114°21′34″E,30°28′47″N)0~30 cm土层。土壤采集后挑出大石块、植物根茬等杂物,过5 mm筛,混匀并加入去离子水,调节含水率使其与土壤采集时的含水率(52% WFPS)一致,置于25 ℃下预培养7 d,以消除在后续试验中因土壤湿度改变对土壤微生物造成的影响。在实验开始前土壤总有机碳(TOC)含量为13.95 g·kg-1,全氮(TN)含量为1.25 g·kg-1,可溶性有机碳(DOC)含量为35.89 mg·kg-1,无机氮(NH4+-N与NO3--N之和)含量为27.49 mg·kg-1。
蚯蚓与土壤采自同一片蔬菜田,挖掘手捡法挑选性成熟且大小一致的优势种Metaphire guillelmi带回实验室进行驯化培养。在实验开始前利用滤纸法排空蚯蚓肠道,并用蒸馏水对蚯蚓体表进行冲洗。
油菜、玉米和水稻均是当地常见作物类型,因此本研究选择油菜饼、玉米叶、水稻秸和玉米秆为供试作物秸秆,其C/N为7.3~52.1不等。选择油菜饼作为实验材料是因为其较低的C/N,油菜饼虽然并非严格意义上的秸秆,但其是来源于农作物的副产物,且在部分地区确有农户用油菜饼还田,因此本研究也将其归为作物秸秆。作物秸秆采集后60 ℃烘干,并粉碎过筛,其总碳(TC)、总氮(TN)、木质素、多酚含量及C/N见表 1。
|
采用玻璃瓶在室内进行恒温培养实验。在800 mL的玻璃瓶中放入482 g鲜土(折合400 g风干土),并分别混入4 g(土壤干重的1%)不同的秸秆,随后按照实验设计在相应的玻璃瓶中接种3条蚯蚓(约0.99 g·条-1、180条·m-2)。本实验共计8个处理,分别为油菜饼+蚯蚓(ERC)、油菜饼(RC)、玉米叶+蚯蚓(ECL)、玉米叶(CL)、水稻秸+蚯蚓(ERS)、水稻秸(RS)、玉米秆+蚯蚓(ECS)、玉米秆(CS)。同时设置不施用任何秸秆的处理作为对照(有蚯蚓ECK及无蚯蚓CK),每个处理设置3个重复。本研究中接种的蚯蚓密度对于耕地土壤来说偏高,但接种较高密度的蚯蚓能够通过加快对土壤和秸秆的作用过程而在一定程度上抵消短期培养实验带来的影响,同时也有研究报道, 土壤中蚯蚓密度可高达277条·m-2 [17]。
每个玻璃瓶均用黑色塑料袋进行遮光处理,同时利用橡皮筋将瓶口用带有小孔(1.5 mm)的塑料薄膜封住,在防止蚯蚓逃逸的同时也保证瓶内与外界有良好的气体交换。整个培养装置放于(25±2)℃的恒温培养箱中培养60 d。在培养过程中利用数据采集器(Em50G+ECH2O土壤水分传感器,Decagon,美国)对土壤含水量进行持续监测,并通过称重法对土壤含水率进行调节以保持稳定。
1.3 取样及测定 1.3.1 气体培养开始的前10 d每天采集一次气体,接下来的第11~25 d每两天采集一次气体,之后每周采集一次气体直到培养结束。采集气体时,先利用风扇给玻璃瓶通风30 min,用带三通阀的注射器采集瓶口附近的气体用于计算背景值,而后用带橡胶管的胶塞塞紧玻璃瓶口,夹紧橡胶管,密闭状态下培养1 h后,利用注射器连接橡胶管,打开夹子,抽取瓶中气体。气体采集后在当天用气相色谱仪(GC-7890A,Agilent,美国)进行CO2和N2O的浓度分析。
1.3.2 土壤在培养开始后的第6、12、18、30、60 d分别采集土样。土壤取样均在气体采样完成后进行,利用土钻(直径1 cm)从土壤表面向瓶底垂直取样,尽量避免土壤扰动而影响气体排放。每次土壤取样量均为10 g,并在后续计算中对土壤总量变化后的气体排放通量进行矫正。在培养结束后对土壤进行破坏性取样并对其中的蚯蚓数量和生物量进行统计。土壤DOC含量采用蒸馏水浸提后离心,上清液过0.45 μm滤膜后用TOC仪(Vario TOC,Elementer,德国)测定[18]。土壤NH4+-N和NO3--N含量用KCl溶液浸提后采用靛酚蓝比色法和紫外分光光度法测定[19]。
1.4 统计与分析气体通量按照以下公式[20]计算:
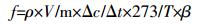
式中:f为气体排放通量,μg·kg-1·h-1(N2O-N)或mg·kg-1·h-1(CO2-C);ρ是标准状况下的气体密度,kg·m-3;V是培养瓶中气体所占的有效体积,m3;Δc/Δt为特定时间内气体浓度变化速率,10-6 h-1;m是培养瓶中土样干质量,kg;T是培养时的绝对温度,K;β是由气体转换为元素C或N时的转换系数,CO2和N2O分别为12/44和28/44。
气体累积排放量通过内插累加法[21]获得。
N2O和CO2排放系数(EFs-N和EFs-C)指投入单位秸秆N或单位秸秆C量时对N2O-N或CO2-C累积排放量的影响,按照以下公式[7]计算:
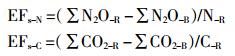
式中:∑N2O-R(∑CO2-R)指混入秸秆土壤的N2O(CO2)累积排放量,μg·kg-1(N2O)或mg·kg-1(CO2);∑N2O-B(∑CO2-B)指相应无秸秆土壤的N2O(CO2)累积排放量,μg·kg-1(N2O)或mg·kg-1(CO2);N-R(C-R)指混入土壤的秸秆N(C)量,μg·kg-1(N)或mg·kg-1(C)。
实验结果以均值表示,但因不同秸秆处理投入的总秸秆C及秸秆N量并不一致,故仅对同种秸秆处理下有、无蚯蚓接种处理之间的均值进行了方差分析。统计分析采用SPSS 17.0软件完成。
2 结果与分析 2.1 蚯蚓存活率为期60 d的培养结束后,所有接种的蚯蚓均存活下来,但不同处理蚯蚓的生物量变化趋势不同(表 2)。相对于培养开始前,C/N最低的油菜饼处理中蚯蚓生物量显著增加,其他秸秆处理则无显著变化。

|
整体来看,N2O的排放均集中在培养前期(图 1A)。最低C/N的油菜饼混入土壤后导致N2O排放通量迅速上升,在培养的第6 d达到峰值(20.8 μg·kg-1·h-1),随后缓慢下降。其他秸秆混入土壤后仅在培养最初的几天产生一个较小的N2O排放峰,并在随后的培养过程中迅速下降,接近于CK处理的排放量。不同秸秆混入后60 d的N2O累积排放量从大到小的顺序为RC>CL>CS>RS>CK(表 3)。不论混入何种秸秆,蚯蚓的接种均促进了N2O的排放,一方面表现为更高的N2O排放峰,另一方面表现为N2O排放峰更为缓慢的下降过程(图 1A)。培养结束后,相比无蚯蚓的处理,蚯蚓接种均显著增加了N2O的累积排放量,相对RC、CL、RS、CS和CK分别增加了1.4、1.7、1.7、1.4、9.5倍(表 3)。
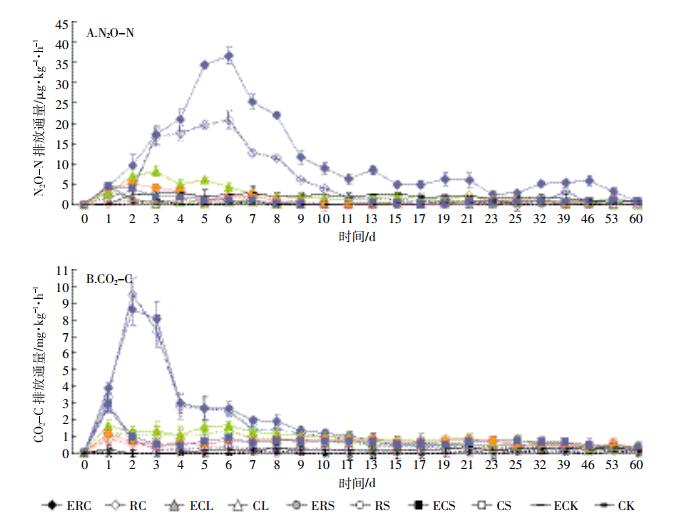
|
| 图 1 不同处理下N2O-N和CO2-C的排放通量 Figure 1 Emission flux of N2O-N and CO2-C from different treatments |
|
与N2O类似,CO2的排放同样主要集中在培养前期(图 1B)。最低C/N的油菜饼混入土壤后导致CO2排放通量迅速上升,在培养的第2 d达到峰值(9.5 mg·kg-1·h-1),随后缓慢下降。除玉米秆处理在培养初期有个CO2排放峰值外,其余秸秆处理的CO2排放通量在整个培养期内并无大的波动。不同秸秆混入后CO2累积排放量从大到小的顺序为RC>CL>CS>RS>CK(表 3)。总体来看,接种蚯蚓增加了CO2的排放,在RC和CS中,主要表现为对培养后期CO2排放的促进作用,但在CL和RS中,则同时促进了CO2的排放峰值和后期的排放通量(图 1B)。培养结束后,与无蚯蚓的处理相比,接种蚯蚓均显著增加了CO2的累积排放量,相对RC、CL、RS、CS和CK处理分别增加了0.3、0.5、0.9、1.0、1.8倍(表 3)。
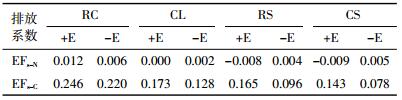
表 4显示,在单独混入秸秆的处理中,N2O排放系数(EFs-N)与秸秆C/N并无明显的线性关系,但当接种蚯蚓后,N2O排放系数与秸秆C/N呈显著的负相关关系(R2=0.881 3)。值得注意的是,在低C/N秸秆油菜饼的处理中,蚯蚓的存在增大了N2O排放系数,但在其他处理中蚯蚓的存在却减小了N2O排放系数,尤其是在高C/N的水稻秸和玉米秆处理中,接种蚯蚓后的N2O排放系数均为负值。不论是否接种蚯蚓,CO2排放系数(EFs-C)与秸秆C/N均呈显著的负相关关系(有、无蚯蚓时R2分别为0.753 4和0.827 3),且接种蚯蚓均增加了CO2排放系数。
|
低C/N油菜饼混入土壤后导致DOC含量快速上升,并在整个培养期内均明显高于其他秸秆处理,而高C/N的秸秆混入土壤后并未引起土壤DOC含量的剧烈波动(图 2A)。接种蚯蚓降低了油菜饼处理的DOC含量,特别是在第6 d和第18 d时差异显著,但对其余秸秆处理并无显著作用。
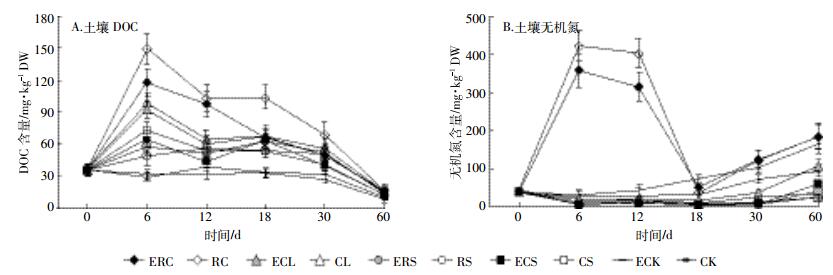
|
| 图 2 不同处理下土壤DOC和无机氮含量变化 Figure 2 Dynamics of DOC and inorganic N content during the incubation between different treatment |
油菜饼的混入同样导致了土壤无机氮含量的快速上升,并在第6 d和第12 d时显著高于其他秸秆处理(图 2B),虽然无机氮含量在第18~30 d快速下降,但随后又缓慢上升。尽管玉米叶、水稻秸和玉米秆处理的无机氮含量从第18 d开始缓慢上升,但在整个培养期内均低于无秸秆的对照。蚯蚓的接种降低了油菜饼处理土壤的无机氮含量,却增加了其余秸秆处理和对照处理的无机氮含量。在高C/N秸秆的处理中,蚯蚓对无机氮的增加作用明显滞后,例如自培养的第18 d即可观察到接种蚯蚓显著增加了CK土壤无机氮含量,自培养的第30 d观察到接种蚯蚓增加了CL处理土壤无机氮含量,但在培养的第60 d才观察到接种蚯蚓增加了RS和CS处理土壤无机氮含量。总体看来,土壤DOC及土壤无机氮含量的变化趋势与N2O、CO2的排放趋势相似,即峰值均集中在培养前期。
3 讨论 3.1 添加不同C/N秸秆对CO2和N2O排放的影响与对照土壤较为稳定的气体排放速率相比,无论添加何种秸秆,均促使CO2和N2O的排放通量增加(图 1),与已有的研究结果[6-7, 22]一致。作物秸秆施用到土壤后在土壤微生物作用下开始腐解,其有机碳被降解为各种含碳小分子,而这些含碳小分子又可以供土壤微生物利用,为其提供物质和能源,促进微生物的繁殖和生长代谢,在好氧条件下即表现为土壤呼吸作用加强,CO2排放增多[5]。此外,秸秆还能够作为基质直接影响土壤硝化与反硝化作用,或通过改变土壤理化及生物学性状间接影响土壤硝化与反硝化过程,进而影响土壤N2O的排放[23]。已有的研究指出,土壤中的DOC及无机氮含量作为土壤硝化与反硝化过程的基质,将直接影响土壤N2O排放的高低[7]。这一结论亦在本研究中得到了证实,即土壤DOC及土壤无机氮含量的变化趋势与N2O、CO2的排放趋势相似,其峰值均集中在培养前期(图 2)。
不论是CO2还是N2O,本研究中秸秆还田后的气体排放速率整体上均呈现“前高后低”特征(图 1),这与秸秆的物质组成有关。秸秆还田后,在分解前期微生物会优先利用秸秆残体中的可溶性有机化合物等易利用物质,而在分解后期则以利用前期未分解的木质素、蜡质等难分解物质为主[24]。对于油菜饼来说,其木质素、多酚等难分解物质含量较低、全氮含量较高而C/N较低(表 1),能够在培养前期释放大量的易利用无机氮和可溶性碳(图 2),因此在培养前期产生了显著高于其他秸秆处理的CO2和N2O排放峰值(图 1)。
已有的研究指出,低C/N秸秆还田后比高C/N秸秆更容易导致土壤CO2和N2O等温室气体排放的增加[3-6]。这一观点在本研究中亦得到了证实,即CO2的排放系数与秸秆C/N呈现明显的负相关关系(R2=0.827 3)。一般认为,环境条件中C/N在25~30时符合土壤微生物的物质构成。因此,当秸秆C/N较大时,表现为碳源相对过剩、氮源相对缺少,刺激土壤微生物去吸收另外的氮源以满足其生物体的合成需要,加强了对土壤中可利用氮源的吸收,减少了硝化与反硝化作用的基质,从而降低土壤N2O排放[3, 5, 7]。但本研究并未发现N2O排放系数与秸秆C/N较为明显的线性关系(表 4),可能归结于本研究中秸秆是按照等质量混入土壤的,这导致实际进入土壤的秸秆N含量并不一致。但无论何种秸秆混入土壤,结果显示其N2O累计排放量均高于对照处理。这与Chen等[3]的观点一致,即不论多高C/N的秸秆还田,一般来说都不会导致土壤N2O排放的减少,即便是秸秆C/N高于30并导致土壤氮的固定时也是如此。
3.2 蚯蚓作用下不同C/N秸秆添加对CO2和N2O排放的影响本研究显示,不论混入何种秸秆或是在无秸秆的对照土壤中,接种蚯蚓均显著增加了CO2和N2O的累计排放量(图 1)。Lubbers等[25]指出蚯蚓的生命活动增加了土壤33%的CO2排放和42%的N2O排放;卢明珠等[26]进一步指出,在农田土壤中接种蚯蚓和施加秸秆均可导致CO2排放量的增加,当在施加秸秆的基础上接种蚯蚓时能使土壤CO2排放量再增加41%。这一方面来源于蚯蚓自身的CO2排放,另一方面则来源于对土壤微生物活性的刺激作用[26]。蚯蚓自身很少产生N2O,但蚯蚓肠道独特的环境(厌氧及丰富可利用有机物)极有利于反硝化细菌的繁殖和活性的提高[25]。来源于土壤的反硝化微生物经过蚯蚓肠道后随蚓粪再次回到土壤,成为N2O排放的热点[27-28]。此外,蚯蚓活动改善土壤通气性为自养硝化菌提供有利的生存条件,蚯蚓体表黏液、蚯蚓粪等释放更多的可利用碳源、氮源,也为土壤硝化、反硝化细菌提供了能量来源[25]。
虽然接种蚯蚓显著提高了土壤的N2O累积排放量,但进一步分析发现,除低C/N油菜饼处理外,蚯蚓的接种降低了秸秆还田处理下的N2O排放系数,尤其是在高C/N的水稻秸和玉米秆处理中,蚯蚓接种后的N2O排放系数均为负值(表 4)。这说明高C/N秸秆的施用降低了蚯蚓自身活动下的土壤N2O排放。这一现象可归结于土壤中有限氮的固定作用。这从图 2可以得到证实,即ERS和ECS的无机氮含量明显低ECK,并从第18 d开始差异显著。前文讨论中已提到,高C/N秸秆混入土壤后会刺激土壤微生物对土壤中可利用氮源的固定,从而降低土壤N2O排放[3, 5, 7]。蚯蚓对微生物活性的刺激作用(可由图 1证实,ERS和ECS的CO2排放通量从第3 d起均明显高于RS和CS)则可能通过强化微生物对土壤中可利用氮源的固定,进一步减少可用于硝化、反硝化作用的氮源基质,并导致更低的N2O累积排放量(ERS和ECS的N2O累积排放量均低于ECK处理)。虽然蚯蚓对微生物活性的刺激作用同样存在于油菜饼处理中,但油菜饼在培养前期所释放的大量无机氮(图 2)并不会成为硝化、反硝化作用的限制因素;反之,来源于蚯蚓肠道的微生物成为促进油菜饼处理N2O排放的“热点”[27-28]。秸秆分解是一个缓慢的过程,尤其是水稻秸、玉米秆这类较难分解的秸秆残体,完全分解需要的时间更长[29]。而蚯蚓通过分解作用释放秸秆C、N的过程和蚯蚓通过体表黏液等方式提高土壤有效氮含量的过程则需要随着时间的推移而逐步体现(图 2B,从第18 d起才观察到ECL无机氮含量逐渐高于CL;从第30 d起才观察到ECS和ERS无机氮含量逐渐高于CS和RS)。因此,本研究较短的培养时间或许并不能反映自然界中高C/N秸秆和蚯蚓互作下分解过程对土壤N2O排放的影响。未来周期更长的培养实验或大田实验将有助于解决这个问题。
4 结论(1)无论添加何种秸秆,均促进了土壤CO2和N2O的排放,且CO2排放系数与秸秆C/N呈显著的负相关关系。
(2)无论添加秸秆与否,接种蚯蚓处理的CO2和N2O累积排放量均显著高于无蚯蚓的处理。进一步的分析显示,蚯蚓接种提高了低C/N油菜饼处理的N2O排放系数,却降低了高C/N水稻秸和玉米秆处理的N2O排放系数。
| [1] |
李涛, 何春娥, 葛晓颖, 等. 秸秆还田施氮调节碳氮比对土壤无机氮、酶活性及作物产量的影响[J]. 中国生态农业学报, 2016, 24(12): 1633-1642. LI Tao, HE Chun-e, GE Xiao-ying, et al. Responses of soil mineral N contents, enzyme activities and crop yield to different C/N ratio mediated by straw retention and N fertilization[J]. Chinese Journal of Eco-Agriculture, 2016, 24(12): 1633-1642. |
| [2] |
许明敏, 冯金侠, 陈卫平, 等. 秸秆集中沟埋还田对土壤氮素分布及微生物群落的影响[J]. 农业环境科学学报, 2016, 35(10): 1960-1967. XU Ming-min, FENG Jin-xia, CHEN Wei-ping, et al. Effects of ditch-buried straw return on nitrogen distribution and microbial community in the straw-soil interface[J]. Journal of Agro-Environment Science, 2016, 35(10): 1960-1967. DOI:10.11654/jaes.2016-0533 |
| [3] |
Chen H H, Li X C, Hu F, et al. Soil nitrous oxide emissions following crop residue addition:A meta-analysis[J]. Global Change Biol, 2013, 19(10): 2956-2964. DOI:10.1111/gcb.2013.19.issue-10 |
| [4] |
曹佳, 王冲, 皇彦, 等. 蚯蚓对土壤微生物及生物肥力的影响研究进展[J]. 应用生态学报, 2015, 26(5): 1579-1586. CAO Jia, WANG Chong, HUANG Yan, et al. Effects of earthworm on soil microbes and biological fertility:A review[J]. Chinese Journal of Applied Ecology, 2015, 26(5): 1579-1586. |
| [5] |
伍玉鹏, 刘田, 彭其安, 等. 氮肥配施下不同C/N作物残渣还田对红壤温室气体排放的影响[J]. 农业环境科学学报, 2014, 33(10): 2053-2062. WU Yu-peng, LIU Tian, PENG Qi-an, et al. Greenhouse gas emissions in red soil as influenced by different C/N residues under nitrogen applications[J]. Journal of Agro-Environment Science, 2014, 33(10): 2053-2062. DOI:10.11654/jaes.2014.10.025 |
| [6] |
刘四义, 张晓平, 梁爱珍, 等. 玉米和大豆秸秆还田初期对黑土CO2排放的影响[J]. 应用生态学报, 2015, 26(8): 2421-2427. LIU Si-yi, ZHANG Xiao-ping, LIANG Ai-zhen, et al. Effects of corn and soybean straws returning on CO2 efflux at initial stage in black soil[J]. Chinese Journal of Applied Ecology, 2015, 26(8): 2421-2427. |
| [7] |
Wu Y, Lin S, Liu T, et al. Effect of crop residue returns on N2O emissions from red soil in China[J]. Soil Use and Management, 2016, 32(1): 80-88. DOI:10.1111/sum.2016.32.issue-1 |
| [8] |
Lubbers I M, Pulleman M M, Groenigen J W V. Can earthworms simultaneously enhance decomposition and stabilization of plant residue carbon?[J]. Soil Biology and Biochemistry, 2017, 105: 12-24. DOI:10.1016/j.soilbio.2016.11.008 |
| [9] |
Ernst G, Henseler I, Felten D, et al. Decomposition and mineralization of energy crop residues governed by earthworms[J]. Soil Biology and Biochemistry, 2009, 41(7): 1548-1554. DOI:10.1016/j.soilbio.2009.04.015 |
| [10] |
Ravindran B, Contreras-Ramos S M, Sekaran G. Changes in earthworm gut associated enzymes and microbial diversity on the treatment of fermented tannery waste using epigeic earthworm Eudrilus eugeniae[J]. Ecological Engineering, 2015, 74: 394-401. DOI:10.1016/j.ecoleng.2014.10.014 |
| [11] |
Procházková P, Šustr V, Dvořák J, et al. Correlation between the activity of digestive enzymes and nonself recognition in the gut of Eisenia andrei earthworms[J]. Journal of Invertebrate Pathology, 2013, 114(3): 217-221. DOI:10.1016/j.jip.2013.08.003 |
| [12] |
Gómezbrandón M, Lazcano C, Lores M, et al. Detritivorous earthworms modify microbial community structure and accelerate plant residue decomposition[J]. Applied Soil Ecology, 2010, 44(3): 237-244. DOI:10.1016/j.apsoil.2009.12.010 |
| [13] |
Chen Y X, Zhang Y F, Zhang Q G, et al. Earthworms modify microbial community structure and accelerate maize stover decomposition during vermicomposting[J]. Environmental Science and Pollution Research, 2015, 22(21): 17161-17170. DOI:10.1007/s11356-015-4955-z |
| [14] |
Schon N L, Mackay A D, Gray R A, et al. The action of an anecic earthworm(Aporrectodea longa) on vertical soil carbon distribution in New Zealand pastures several decades after their introduction[J]. European Journal of Soil Biology, 2014, 62(5): 101-104. |
| [15] |
Massey P A, Creamer R E, Schulte R P O, et al. The effects of earthworms, botanical diversity and fertiliser type on the vertical distribution of soil nutrients and plant nutrient acquisition[J]. Biology and fertility of soils, 2013, 49(8): 1189-1201. DOI:10.1007/s00374-013-0817-3 |
| [16] |
Blouin M, Hodson M E, Delgado E A, et al. A review of earthworm impact on soil function and ecosystem services[J]. European Journal of Soil Science, 2013, 64(2): 161-182. DOI:10.1111/ejss.12025 |
| [17] |
胡锋, 吴珊眉. 不同利用方式红壤生态系统蚯蚓种群特征[J]. 南京农业大学学报, 1993, 16(1): 65-71. HU Feng, WU Shan-mei. Population characteristics of earthworm in red soil ecosystems under different utilization[J]. Journal of Nanjing Agricultural University, 1993, 16(1): 65-71. |
| [18] |
Liang B C, Wang X L, Ma B L. Maize root-induced change in soil organic carbon pools[J]. Soil Science Society of America Journal, 2002, 66(3): 845-847. DOI:10.2136/sssaj2002.8450 |
| [19] |
鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000. BAO Shi-dan. Soil and agricultural chemistry analysis[M]. Beijing: China Agriculture Press, 2000. |
| [20] |
李成芳, 寇志奎, 张枝盛, 等. 秸秆还田对免耕稻田温室气体排放及土壤有机碳固定的影响[J]. 农业环境科学学报, 2011, 30(11): 2362-2367. LI Cheng-fang, KOU Zhi-kui, ZHANG Zhi-sheng, et al. Effects of rape residue mulch on greenhouse gas emissions and carbon sequestration from no-tillage rice fields[J]. Journal of Agro-Environment Science, 2011, 30(11): 2362-2367. |
| [21] |
Kool D M, Hoffland E, Hummelink E W, et al. Increased hippuric acid content of urine can reduce soil N2O fluxes[J]. Soil Biology and Biochemistry, 2006, 38(5): 1021-1027. DOI:10.1016/j.soilbio.2005.08.017 |
| [22] |
Wu Y P, Liu T, Peng Q, et al. Effect of straw returning in winter fallow in Chinese rice fields on greenhouse gas emissions:Evidence from an incubation study[J]. Soil Research, 2015, 53(3): 298-305. DOI:10.1071/SR14261 |
| [23] |
张冉, 赵鑫, 濮超, 等. 中国农田秸秆还田土壤N2O排放及其影响因素的Meta分析[J]. 农业工程学报, 2015, 31(22): 1-6. ZHANG Ran, ZHAO Xin, PU Chao, et al. Meta-analysis on effects of residue retention on soil N2O emissions and influence factors in China[J]. Transactions of the Chinese Society of Agricultural Engineering, 2015, 31(22): 1-6. DOI:10.11975/j.issn.1002-6819.2015.22.001 |
| [24] |
王晓玥, 孙波. 植物残体分解过程中微生物群落变化影响因素研究进展[J]. 土壤, 2012, 44(3): 353-359. WANG Xiao-yue, SUN Bo. Factors affecting change of microbial community during plant residue decomposition:A review[J]. Soils, 2012, 44(3): 353-359. |
| [25] |
Lubbers I M, van Groenigen K J, Fonte S J, et al. Greenhouse-gas emissions from soils increased by earthworms[J]. Nature Climate Change, 2013, 3(3): 187-194. DOI:10.1038/nclimate1692 |
| [26] |
卢明珠, 吕宪国, 管强, 等. 蚯蚓对土壤温室气体排放的影响及机制研究进展[J]. 土壤学报, 2015, 52(6): 1209-1225. LU Ming-zhu, LÜ Xian-guo, GUAN Qiang, et al. Advancement in study on effect of earthworm on greenhouse gas emission in soil and its mechanism[J]. Acta Pedologica Sinica, 2015, 52(6): 1209-1225. |
| [27] |
Wang Z Y, Peng S X, Sun Y, et al. How gut-stimulated denitrifiers influence soil N2O emission without earthworm activity[J]. European Journal of Soil Biology, 2016, 76: 70-73. DOI:10.1016/j.ejsobi.2016.08.001 |
| [28] |
Wu Y P, Shaaban M, Zhao J S, et al. Effect of the earthworm gut-stimulated denitrifiers on soil nitrous oxide emissions[J]. European Journal of Soil Biology, 2015, 70: 104-110. DOI:10.1016/j.ejsobi.2015.08.001 |
| [29] |
Parton W, Silver W L, Burke I C, et al. Global-scale similarities in nitrogen release patterns during long-term decomposition[J]. Science, 2007, 315(5810): 361-364. DOI:10.1126/science.1134853 |
 2017, Vol. 36
2017, Vol. 36