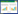文章信息
- 杜小平, 康靖全, 吕金印
- DU Xiao-ping, KANG Jing-quan, LÜ Jin-yin
- 镉低积累青菜品种筛选及硫对镉胁迫下青菜镉含量和品质影响
- Selection for low-Cd-accumulating cultivars of pakchoi(Brassica chinensis L.), effects of sulfur on Cd content, and quality characters under Cd stress
- 农业环境科学学报, 2018, 37(8): 1592-1601
- Journal of Agro-Environment Science, 2018, 37(8): 1592-1601
- http://dx.doi.org/10.11654/jaes.2017-1661
文章历史
- 收稿日期: 2017-12-03
- 录用日期: 2018-03-06
近年来,随着我国工业化、城镇化快速发展,以及对化肥、污水灌溉和采矿活动的过度依赖,农业土壤重金属污染日趋严重[1]。据统计,人类活动每年向土壤排放镉(Cd)9.9~45.0万t[2]。我国受重金属污染的耕地面积近2000万hm2,约占耕地面积的1/5,其中Cd污染耕地占1.33万hm2,涉及11个省25个地区[3]。重金属可以在土壤中和作物体内积累,通过食物链进入人体,对人体健康造成潜在的威胁[4]。减少Cd进入食物链的可能途径:一是调节土壤中Cd的生物有效性;二是利用或培育吸Cd量少或Cd优先吸附在非可食部分的植物品种。Cd低积累作物品种[Low Cd accumulating cultivars(LCACs)]要求生长在Cd污染土壤中作物可食部分Cd积累量低于食品安全国家标准(GB 2762—2012),而选育Cd低积累作物品种是建立在同一物种不同品系对Cd吸收和迁移的遗传稳定差异上。研究表明,已根据一些主要农作物可食部分Cd积累量筛选出Cd低积累品种,如水稻(Oryza sativa L.)[5-8]、小麦(Triticum aestivum L.)[9-10]、玉米(Zea mays L.)[11]和白菜(Brassica perkinensis L.)[12]等,尤其是杜兰小麦,作为第一种成功选育的商业化Cd低积累农作物,已在加拿大种植很多年[13]。目前更多的研究主要集中在农作物上,但对蔬菜的研究报道较少,尤其是特别容易遭受土壤Cd污染的叶类蔬菜[14]。
硫是植物生长仅次于氮、磷、钾的第四要素,并在逆境应答中起着重要作用[15-16]。大量研究证实,硫在植物抵抗Cd毒害的过程中起着重要的作用。衣纯真等[17]研究表明,施用K2SO4能显著减少水稻对Cd的吸收,降低水稻叶、茎、谷壳以及糙米中的Cd含量。梁泰帅等[15]研究发现外施Na2SO4能明显促进小白菜生长和光合作用,减少Cd从根部向地上部转运,从而降低小白菜地上部Cd含量。由此可见,外施硫能够增强植物对Cd胁迫的抗性或耐受性。
青菜(Brassica chinensis L.)又称小白菜,是十字花科芸薹属植物,作为我国一种重要的叶类蔬菜,在南北方广泛栽培和食用[15, 18]。Arthur等[19]根据作物体内Cd的积累量认为:十字花科是Cd高积累作物。李博文等[20]和张晓晴等[21]研究认为菜花、莴苣和小白菜等为重金属中度积累性。故筛选、种植重金属低积累青菜品种有助于降低长期食用青菜所带来的健康风险。本研究通过人工模拟土壤污染采用盆栽和大田小区试验,以36个不同基因型青菜品种为试验材料,根据可食部分生物量变化和Cd积累量差异,筛选出Cd高积累和Cd低积累青菜品种,并通过外施硫在大田小区进一步降低可食部分Cd含量,以期为确保食物安全及提高蔬菜营养品质提供科学依据。
1 材料与方法 1.1 盆栽试验 1.1.1 供试青菜品种青菜(Brassica chinensis L.)品种共36种,均购自相关作物种业研究所。供试青菜名称及其提供商见表 1。
供试土壤取自陕西关中地区大田耕作层土(0~20 cm),土壤类型为土垫旱耕人为土(关中塿土),基本理化性质为:pH 8.02,有机质12.57 g·kg-1,速效氮、速效磷、速效钾分别为64.29、19.58、78.62 mg·kg-1,全硫138.42 mg·kg-1,有效硫7.24 mg·kg-1,总Cd 0.13 mg·kg-1。
1.1.3 试验设计盆栽试验在西北农林科技大学试验基地进行。将供试土壤均匀摊开,风干后过5 mm筛,装入聚乙烯塑料盆(18 cm×15 cm)中,每盆装土2.5 kg。Cd试剂为CdCl2·2.5H2O。以溶液形式均匀喷洒施入Cd溶液。共设3个Cd处理水平(0、1、5 mg·kg-1)模拟Cd污染土壤,分别编号为CK、Cd1、Cd5。每个处理水平设置3次重复。装盆前每千克干土施尿素0.324 g,磷酸二氢钾1.25 g,氯化钾0.158 g。搅拌均匀,平衡60 d。挑选籽粒饱满的青菜种子播种,每盆播种10粒,待植株生长至3片真叶间苗至5株。生长35 d后收集全部植株,测定各项生理指标。
1.2 小区试验 1.2.1 供试青菜品种供试品种为盆栽筛选获得2个Cd低积累品种紫罗兰(ZLL)和矮脚黄(AJH),及2个Cd高积累品种壶瓶长梗白(HPCGB)和抗热605(KR605)。
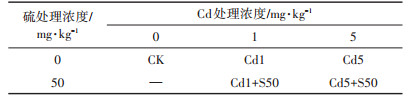
1.2.2 小区试验设计试验地点及供试土壤同1.1.2。在大田模拟Cd污染土壤,设置5个处理水平(试验因素与水平见表 2),每个处理水平为一个小区(长×宽×深,1.2 m×1.0 m×0.25 m),利用泡沫板和塑料布对每个小区做防渗漏处理,每个小区装土150 kg,以溶液形式均匀喷洒施入CdCl2·2.5H2O和Na2SO4,与土壤搅拌均匀,平衡60 d。每个小区播种4个品种,生长35 d后收集全部植株,测定各项生理指标。
取植株样,用自来水反复冲洗,最后用去离子水洗净,滤纸吸干多余水分。105 ℃杀青15 min,于80 ℃烘干至恒重,测定干物质量。
1.3.2 重金属Cd含量测定将青菜样品研磨并过100目筛,称取0.5 g青菜样品可食部分,加入10 mL混合酸HNO3-HClO4(4:1,V/V),220 ℃沙浴消解至透明色,采用火焰原子吸收分光光度计(Z-2000赛曼,日立公司)测定Cd含量。土壤风干后机械粉碎,过100目筛,称取2.0 g土壤样品于锥形瓶中,加入少许去离子水湿润,然后加入15 mL HNO3,于电热板上缓慢加热分解,并加以回流,蒸至近干;稍冷后加入HNO3-HClO4(4:1,V/V)10 mL,220 ℃沙浴消解,蒸至近干;稍冷却后反复加入10 mL HNO3,待样品蒸至近灰白色,定容至25 mL,上清液用火焰原子吸收分光光度计测定土壤Cd含量。
1.3.3 品质指标测定选取青菜植株从第1片展开叶向下数的第4片成熟功能叶作为材料,进行品质指标测定:可溶性蛋白含量测定采用考马斯亮蓝法[22];可溶性糖含量测定采用蒽酮比色法[22];硝酸盐含量采用GB 5009.33— 2016《食品安全国家标准食品中亚硝酸盐与硝酸盐的测定》 [23]第三法紫外分光光度法测定;维生素C含量采用2,6-二氯靛酚比色法[24]。
1.4 Cd低积累品种(LCACs)筛选标准研究Cd在不同品种间积累差异,综合考虑农产品产量和质量。根据以往的文献和前期的研究结果[18, 25-26],本试验中Cd低积累品种筛选标准应符合以下两个指标。一是Cd低积累品种可食部分的Cd含量不应超过食品安全国家标准最大限量值(GB 2762—2012),即青菜可食部分Cd含量最大限度为0.2 mg·kg-1。中国蔬菜地土壤Cd污染实地调查数据和土壤环境质量标准(GB 15618—1995)表明,“低等Cd污染土壤” Cd浓度范围为0.3~0.6 mg·kg-1,“中等Cd污染土壤” Cd浓度范围为0.6~1 mg·kg-1,“高Cd污染土壤” Cd浓度超过1 mg·kg-1。二是在污染土壤条件下,Cd低积累品种具有一定耐受性,其地上部分生物量不会呈现明显下降。
1.5 分析指标选用Cd胁迫下青菜生物量响应(Biomass response to stress,BRS)作为评价指标[18, 25, 27],青菜的耐性特征:
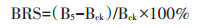
式中:B5和Bck分别代表5 mg·kg-1 Cd和对照条件下青菜可食部分生物量。
1.6 数据处理与分析采用OriginPro 2016软件进行图形处理,SPSS 20.0进行方差分析,通过最小显著法(LSD)检验差异显著性水平(P < 0.05)。
2 结果与分析 2.1 Cd胁迫下青菜生物量变化Cd处理下不同基因型青菜可食部分生物量存在显著差异(P < 0.01)(表 3)。在CK、Cd1、Cd5处理下,36个青菜品种可食部分生物量分别为0.385~1.984、0.549~1.420、0.392~1.277 g·株-1 DW,每株可食部分生物量均值分别为1.005±0.296、0.916±0.215、0.782± 0.233 g DW。根据双因素方差分析,青菜可食部分生物量受青菜品种(P < 0.01)、土壤Cd浓度(P < 0.01)及两者交互作用(P < 0.01)的显著影响(表 3)。

|
以Cd胁迫下青菜生物量的响应(BRS)作为评价指标(图 1)。36个青菜品种的BRS指标数值在-62.5%~96.4%,与对照CK相比,Cd5处理下,22个青菜品种(59.5%)可食部分生物量呈现显著下降,对Cd胁迫表现敏感,5个青菜品种地上部分生物量呈现显著性增加,9个品种(25%)生物量差异不显著,包括WYM、LX、TCSH、SZQ、DYHDT、ZLL、LZX、SHQ和AJH(图 1)。表明36个青菜品种对Cd的耐受性差异明显,Cd胁迫抑制绝大部分青菜品种的生长。

|
| ns、*和**分别代表CK和Cd5处理下可食部分生物量差异性不显著、显著(P < 0.05)和极显著(P < 0.01) ns, * and ** indicate the differences of the biomass of edible parts between CK and Cd5 treatments are not significant, significant at the P < 0.05 level, and significant at the P < 0.01 level, respectively 图 1 Cd胁迫下36种青菜品种可食部分生物量响应 Figure 1 Edible parts biomass response to stress(BRS)of 36 pakchoi cultivars |
在CK、Cd1和Cd5处理下,不同青菜品种可食部分Cd含量差异显著(P < 0.05)。36个青菜品种CK、Cd1、Cd5处理下可食部分Cd含量分别为0.011~ 0.125、0.144~0.559 mg·kg-1 FW和0.337~1.242 mg·kg-1 FW,均值分别为0.044 ± 0.032、0.292 ± 0.107、0.741±0.251 mg·kg-1 FW(表 3)。
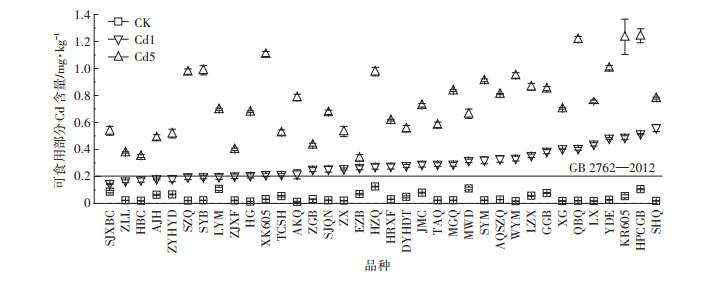
由图 2可知,对照组36个青菜品种可食部分Cd含量均低于食品安全国家标准GB 2762—2012(Cd < 0.2 mg·kg-1 FW)。1 mg·kg-1 Cd处理时,有8个青菜品种可食部分Cd含量低于0.2 mg·kg-1,包括:SJXBC、ZLL、HBC、AJH、ZYHYD、SZQ、SYB和LYM。然而,当Cd浓度为5 mg·kg-1时,36个青菜品种可食部分Cd含量均超过食品安全国家标准,在该污染条件下,36个待测品种均不符合Cd低积累品种(LCACs)。表明Cd低积累品种虽然在低Cd污染土壤中可食部分Cd含量低于食品安全国家标准,但在高Cd污染土壤条件下却超过食品安全国家标准。
|
| 食品安全国家标准食品中污染物限量(GB 2762—2012)(Cd≤0.2 mg·kg-1 FW) National food safety standard maximum levels of contaminants in foods(GB 2762—2012)(Cd≤0.2 mg·kg-1 FW) 图 2 不同浓度Cd胁迫对36个青菜品种可食部分Cd含量的影响 Figure 2 The Cd contents of 36 pakchoi cultivars in edible parts under different Cd treatments |
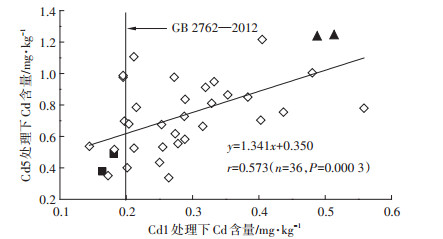
在Cd1和Cd5处理下,不同青菜品种可食部分Cd含量呈现显著正相关(P=0.000 3)(图 3)。根据生物量响应胁迫指数和Cd含量综合评测,在Cd1胁迫下,36个待测青菜品种中8个品种可食部分Cd含量低于食品安全国家标准,表明这8个品种符合Cd低积累品种(LCACs)第一条筛选标准。但在Cd5处理下,5个青菜品种SYB、HBC、SJXBC、ZYHYD和LYM呈现较强敏感性,其可食部分生物量显著下降,分别降低36.53%、22.45%、43.04%、48.70%和35.66%,表明仅有3个青菜品种ZLL、AJH和SZQ符合两条筛选指标。在Cd5胁迫下,ZLL、AJH和SZQ可食部分Cd含量分别为食品安全国家标准(0.2 mg·kg-1)的1.89、2.45倍和4.9倍,因此,选择ZLL和AJH为Cd低积累青菜品种。
|
| 筛选镉高积累品种(▲):HPCGB和KR605,筛选镉低积累品种(■):ZLL和AJH Selected HCACs(▲): HPCGB and KR605, Selected LCACs(■): ZLL和AJH 图 3 Cd1和Cd5处理下36种青菜品种可食部分Cd含量相关性 Figure 3 Correlation of Cd contents in edible parts of 36 pakchoi cultivars between Cd1 and Cd5 treatments |
在所有待测36个青菜品种中,壶瓶长梗白(HPCGB)和抗热605(KR605)具有较高的可食部分Cd积累量,将其作为典型Cd高积累青菜品种,与2个筛选的Cd低积累品种紫罗兰(ZLL)和矮脚黄(AJH)在大田小区条件下,探究外施硫对青菜可食部分Cd含量和蔬菜品质的影响。
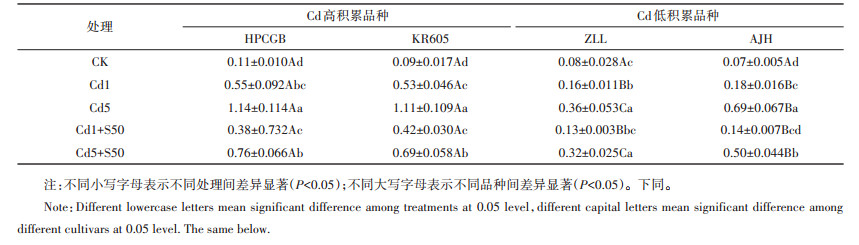
2.4 硫对Cd污染土壤中青菜可食部分Cd含量的影响表 4结果表明,两组不同积累型青菜品种可食部分Cd含量随着Cd处理水平的增加呈现显著升高趋势。2个Cd低积累品种紫罗兰(ZLL)和矮脚黄(AJH)可食部分Cd含量在Cd1、Cd5、Cd1+S50和Cd5+S50处理下均显著低于2个Cd高积累品种壶瓶长梗白(HPCGB)和抗热605(KR605),且随着Cd处理浓度增加两组不同积累型青菜品种间差异显著增加。与单一Cd处理相比,外施硫降低了可食部分Cd含量。Cd5处理下,外施硫对青菜品种壶瓶长梗白(HPCGB)、抗热605(KR605)和矮脚黄(AJH)可食部分Cd含量分别显著降低33.33%、37.84%和27.54%,而其他处理下对可食部分Cd含量降低幅度均不显著。Cd1处理下,仅有Cd低积累品种紫罗兰(ZLL)和矮脚黄(AJH)可食部分Cd含量低于食品安全国家标准GB 2762—2012(Cd < 0.2 mg·kg-1),说明在一定污染条件下,Cd低积累品种种植符合食品安全。
|
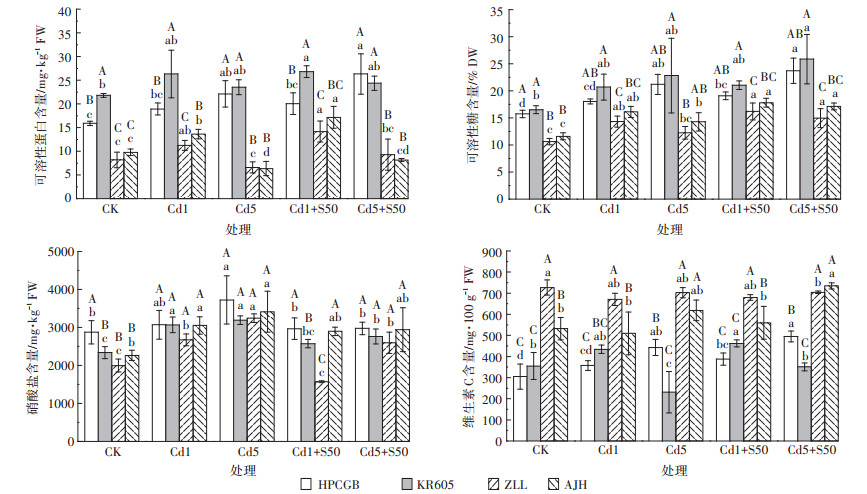
由图 4可知,随着Cd处理水平的增加,Cd高积累品种壶瓶长梗白(HPCGB)和抗热605(KR605)可食部分可溶性蛋白和可溶性糖含量均呈增加趋势,Cd低积累品种紫罗兰(ZLL)和矮脚黄(AJH)呈先升后降趋势。与CK相比,Cd5处理下,壶瓶长梗白(HPCGB)可食部分可溶性蛋白和可溶性糖含量分别显著增加39.23%和34.64%,抗热605(KR605)可食部分可溶性糖含量增加了38.22%,而紫罗兰(ZLL)和矮脚黄(AJH)可食部分在Cd1处理水平下,可溶性蛋白含量分别显著增加37.65%和39.47%,可溶性糖含量分别显著增加34.71%和38.88%,而其他处理水平下含量变化不明显。外施硫不同程度提高Cd胁迫下青菜可食部分可溶性蛋白和可溶性糖含量,在Cd5处理水平下,外施硫将紫罗兰(ZLL)和矮脚黄(AJH)可溶性糖含量分别提高21.76%和19.99%,差异显著。而其余处理水平下,外施硫对4种青菜可食部分可溶性蛋白和可溶性糖的影响差异均不显著。
|
| 图 4 外施硫对Cd胁迫下青菜可食部分可溶性蛋白、可溶性糖、硝酸盐和维生素C含量的影响 Figure 4 Effects of exogenous sulfur on the contents of soluble protein, soluble sugar, nitrate and vitamin in edible parts of pakchoi under Cd stress |
对照CK条件下,青菜可食部分硝酸盐含量均低于国家标准叶菜类硝酸盐含量≤3000 mg·kg-1 FW(GB 18406.1—2001)。与CK相比,Cd胁迫显著增加了4个青菜品种可食部分硝酸盐含量(图 4),Cd5处理下,壶瓶长梗白(HPCGB)和抗热605(KR605)可食部分硝酸盐含量显著增加了29.55%和36.54%,紫罗兰(ZLL)和矮脚黄(AJH)可食部分硝酸盐含量显著增加了62.41%和50.72%,均超过食品安全国家标准叶菜类硝酸盐限量标准;Cd1处理浓度下,抗热605(KR605)和矮脚黄(AJH)可食部分硝酸盐含量显著增加了31.19%和11.81%,超过国家标准叶菜类硝酸盐限量标准,而紫罗兰(ZLL)可食部分硝酸盐含量显著增加了21.27%,但未超标。与单一Cd处理相比,外施硫降低青菜可食部分硝酸盐含量,且均低于食品安全国家标准叶菜类硝酸盐含量。在Cd1处理条件下,ZLL可食部分硝酸盐含量降幅最高,达到41.30%。
与CK相比,Cd胁迫显著增加了壶瓶长梗白(HPCGB)和矮脚黄(AJH)可食部分维生素C含量,而抗热605(KR605)和紫罗兰(ZLL)可食部分维生素C含量呈现降低趋势。Cd5处理水平下,壶瓶长梗白(HPCGB)可食部分维生素C含量增加了38.61%,抗热605(KR605)可食部分维生素C含量降低了34.94%,差异显著。外施硫增加了可食部分维生素C含量,Cd5处理水平下,抗热605(KR605)可食部分维生素C含量显著提高了51.92%,Cd1处理下,外施硫对青菜可食部分维生素C含量影响不明显。
3 讨论Cd可以通过根系进入植物体内,过量积累对植物生长和食品安全造成不利影响,严重威胁人类健康[28-29]。筛选和培育重金属低积累作物品种被认为是一种应对土壤重金属污染的有效和合理的途径。Liu等[30]和Wang等[31]对Cd低积累大白菜品种筛选时提出,Cd胁迫生物量耐受性应该作为Cd低积累品种鉴定指标之一;Wang等[32]指出植物对Cd污染具有一定抗性,产量降低和植物毒害症状不能及时和有效反映叶类蔬菜Cd污染,易于造成食品安全风险。本研究表明,不同Cd处理水平下36个青菜品种间可食部分生物量达到极显著差异。与CK处理相比,Cd5处理水平下,59.5%的青菜品种可食部分生物量降低趋势显著,25%的青菜品种生物量对Cd胁迫表现不敏感。青菜品种易受到重金属Cd污染,可食部分Cd含量不应超过食品安全国家标准GB 2766—2012(Cd < 0.2 mg·kg-1)。在Cd1处理水平下,77.78%的青菜品种可食部分Cd含量超过食品安全国家标准,Cd5处理下,所有青菜品种可食部分Cd含量均超过0.2 mg·kg-1。本研究筛选出来的2个Cd低积累品种紫罗兰(ZLL)和矮脚黄(AJH),与对照CK相比,可食部分生物量在Cd1和Cd5处理水平下差异均不显著,可食部分Cd含量在Cd1处理下低于0.2 mg·kg-1,Cd5处理水平下分别超过国家标准1.89倍和2.45倍。表明Cd胁迫对大多数青菜品种生长具有抑制作用,随着Cd处理水平的增加,青菜品种可食部分Cd含量急剧增加,Cd低积累品种在Cd中低污染(Cd < 1 mg·kg-1)条件下种植符合食品安全国家标准。
城郊作为无公害蔬菜生产基地,由于工业“三废”和农用化学物质排放,土壤极易受到各种污染,造成蔬菜重金属含量超标和品质降低。硫是植物必需的6种大量元素之一,在植物体内的含量为3%~5%,是含硫氨基酸Met(甲硫氨酸)和Cys(半胱氨酸)、GSH(谷胱甘肽)和PCs(植物络合素)等重要组成成分,广泛参与植物体内各种代谢酶促反应,缓解重金属对植物的毒害作用,提高蔬菜品质[33]。潘瑶等[34]研究发现施硫能显著降低水稻根系中Cd向地上部分转移,地上部分Cd积累量更容易受到施硫水平影响。梁泰帅等[15]研究发现外施50 mg·kg-1硫能显著降低小白菜地上部Cd含量,同时显著增加小白菜叶片可溶性蛋白、可溶性糖和抗坏血酸含量。本研究中,外施硫降低了青菜可食部分的Cd含量,Cd5处理下,壶瓶长梗白(HPCGB)、抗热605(KR605)和矮脚黄(AJH)可食部分Cd含量分别显著降低了33.33%、37.84%和27.54%,可能原因,一是土壤中硫通过改变自身形态与重金属发生反应,影响土壤重金属的生物有效性[35-36];二是植物体中的硫代谢产物GSH在谷胱甘肽巯基转移酶(GST)的作用下与进入细胞内的Cd2+形成复合物,维持细胞内离子平衡[37]。同时GSH作为植物螯合肽PCs的合成底物,参与PCs合成,低分子量的PCs与Cd2+形成复合物Cd-PCs,可通过液泡膜转运体进入液泡,与液泡中的硫化物形成高分子状态的Cd-PC-S复合物,固定更多的Cd在液泡中[38];三是硫对Cd根部向地上部运输具有拮抗作用[15]。外施硫能改善Cd胁迫下青菜品质,提高青菜产品中可溶性蛋白、可溶性糖和维生素C含量,降低硝酸盐含量。这与前人在大蒜[39-40]、玉米[41]和大豆[42]上的研究结果一致。本研究中,Cd5处理浓度下,外施硫提高青菜可食部分可溶性蛋白、可溶性糖和维生素C含量,其中2个Cd低积累品种紫罗兰(ZLL)和矮脚黄(AJH)可食部分可溶性糖含量分别显著增加21.76%和19.99%,Cd高积累品种抗热605(KR605)可食部分维生素C含量显著提高了51.92%。可能是镉硫交互处理增加了青菜体内非蛋白巯基、谷胱甘肽和络合素以及抗坏血酸-谷胱甘肽循环关键酶的活性,从而增强青菜对Cd胁迫的耐受性,提高了青菜营养品质[43-44]。另外,外施硫能在一定程度上降低青菜可食部分硝酸盐含量。可能是植物的氮硫代谢具有相互偶联的关系[45-46],适量的外施硫能提高植株氮代谢限速关键酶NR(硝酸还原酶)活性和氮素同化效率,促进NO3-→NO2-代谢过程,降低硝酸盐的积累[47],同时外施硫能够提高PSⅡ电子传递能力和羧化反应速率,从而促进光合碳同化,在碳骨架和能量供应上间接拉动了氮代谢的还原同化[48];另一方面蔬菜是喜硝植物,虽然能吸收NH4+形态,但以NO3-形态为多,硫元素进入土壤后,在微生物的作用下,硫与氧发生反应产生SO42-,根据植物根部吸收养分离子交换原理,可能由于SO42-具有与NO3-竞争置换,缓解蔬菜根部嗜好性过量吸收NO3-的作用,并加速蔬菜体内的生理生化过程,促进体内NO3-的转化,减少滞留时间和累积[49]。
4 结论(1)不同青菜品种可食部分对Cd的积累差异明显,本研究中筛选的Cd低积累品种紫罗兰(ZLL)和矮脚黄(AJH)在Cd中、低污染(Cd < 1 mg·kg-1)条件下,其可食部分Cd含量低于食品安全国家标准限量(0.2 mg·kg-1),可作为Cd安全青菜品种。
(2)与对照相比,Cd中、低污染(Cd < 1 mg·kg-1)提高了青菜可食部分可溶性蛋白、可溶性糖和硝酸盐含量,而Cd高污染(Cd > 1 mg·kg-1)条件下2个Cd低积累青菜品种可食部分可溶性蛋白和可溶性糖含量低于对照。
(3)外施50 mg·kg-1硫可不同程度降低Cd胁迫下青菜可食部分Cd含量和硝酸盐含量,提高可食部分可溶性蛋白、可溶性糖和维生素C含量,改善青菜营养品种。
| [1] |
张晗芝, 郭庆军, 杨俊兴, 等. 镉胁迫下蓖麻对镉及矿质元素的富集特征[J]. 生态环境学报, 2015(2): 323-328. ZHANG Han-zhi, GUO Qing-jun, YANG Jun-xing, et al. Cadmium and mineral nutrients accumulation in various genotypes of castor under cadmium stress[J]. Ecology and Environment Sciences, 2015(2): 323-328. |
| [2] |
Kamnev A A, Van d L D. Chemical and biological parameters as tools to evaluate and improve heavy metal phytoremediation[J]. Bioscience Reports, 2000, 20(4): 239-258. DOI:10.1023/A:1026436806319 |
| [3] |
包丹丹, 李恋卿, 潘根兴, 等. 苏南某冶炼厂周边农田土壤重金属分布及风险评价[J]. 农业环境科学学报, 2011, 30(8): 1546-1552. BAO Dan-dan, LI Lian-qing, PAN Gen-xing, et al. Distribution and risk assessment of soil heavy metals around a smelter in south Jiangsu Province, China[J]. Journal of Agro-Environment Science, 2011, 30(8): 1546-1552. |
| [4] |
涂杰峰, 刘兰英, 罗钦, 等. 福建省稻米镉含量及其健康风险[J]. 农业环境科学学报, 2015, 34(4): 695-701. TU Jie-feng, LIU Lan-ying, LUO Qin, et al. Contents and health risk assessment of cadmium in milled rice in Fujian Province[J]. Journal of Agro-Environment Science, 2015, 34(4): 695-701. DOI:10.11654/jaes.2015.04.013 |
| [5] |
Liu J, Li K, Xu J, et al. Interaction of Cd and five mineral nutrients for uptake and accumulation in different rice cultivars and genotypes[J]. Field Crops Research, 2003, 83(3): 271-281. DOI:10.1016/S0378-4290(03)00077-7 |
| [6] |
Liu J, Zhu Q, Zhang Z, et al. Variations in cadmium accumulation among rice cultivars and types and the selection of cultivars for reducing cadmium in the diet[J]. Journal of the Science of Food & Agriculture, 2005, 85(1): 147-153. |
| [7] |
Arao T, Ae N. Genotypic variations in cadmium levels of rice grain[J]. Soil Science & Plant Nutrition, 2003, 49(4): 473-479. |
| [8] |
Yu H, Wang J, Fang W, et al. Cadmium accumulation in different rice cultivars and screening for pollution-safe cultivars of rice[J]. Science of the Total Environment, 2006, 370(2/3): 302-309. |
| [9] |
Grant C A, Clarke J M, Duguid S, et al. Selection and breeding of plant cultivars to minimize cadmium accumulation[J]. Science of the Total Environment, 2008, 390(2/3): 301-310. |
| [10] |
Greger R M, Lofstedt M. Comparison of uptake and distribution of cadmium in different cultivars of bread and durum wheat[J]. Crop Science, 2004, 44(2): 111-113. |
| [11] |
Kurz H, Schulz R, Römheid V. Selection of cultivars to reduce the concentration of cadmium and thallium in food and fodder plants[J]. Journal of Plant Nutrition and Soil Science, 2015, 162(3): 323-328. |
| [12] |
Liu W, Zhou Q, An J, et al. Variations in cadmium accumulation among Chinese cabbage cultivars and screening for Cd-safe cultivars[J]. Journal of Hazardous Materials, 2010, 173(1/2/3): 737-743. |
| [13] |
Clarke J M, Mccaig T N, Depauw R M, et al. Registration of 'Strongfield' durum wheat[J]. Crop Science, 2006, 46(5): 253-262. |
| [14] |
Liu H, Probst A, Liao B. Metal contamination of soils and crops affected by the Chenzhou lead/zinc mine spill(Hunan, China)[J]. Science of the Total Environment, 2005, 339(1/2/3): 153-166. |
| [15] |
梁泰帅, 刘昌欣, 康靖全, 等. 硫对镉胁迫下小白菜镉富集、光合速率等生理特性的影响[J]. 农业环境科学学报, 2015, 34(8): 1455-1463. LIANG Tai-shuai, LIU Chang-xin, KANG Jing-quan, et al. Effects of sulfur on cadmium accumulation, photosynthesis and some other physiological characteristics of pakchoi(Brassica chinensis L.)under cadmium stresses[J]. Journal of Agro-Environment Science, 2015, 34(8): 1455-1463. DOI:10.11654/jaes.2015.08.004 |
| [16] |
王云, 张海军, 唐为忠, 等. 硫对镉胁迫下小麦幼苗生长和一些生理特性的影响[J]. 农业环境科学学报, 2008, 27(3): 1029-1032. WANG Yun, ZHANG Hai-jun, TANG Wei-zhong, et al. Effect of sulfur on plant growth and some physiological characteristics of wheat seedlings under cadmium stress[J]. Journal of Agro-Environment Science, 2008, 27(3): 1029-1032. |
| [17] |
衣纯真, 傅桂平, 张福锁. 不同钾肥对水稻镉吸收和运移的影响[J]. 中国农业大学学报, 1996(3): 65-70. YI Chun-zhen, FU Gui-ping, ZHANG Fu-suo. Effect of different potash fertilizers on Cd uptake and translocation in rice[J]. Journal of China Agricultural University, 1996(3): 65-70. |
| [18] |
Wang L, Xu Y, Sun Y, et al. Identification of pakchoi cultivars with low cadmium accumulation and soil factors that affect their cadmium uptake and translocation[J]. Frontiers of Environmental Science & Engineering, 2014, 8(6): 877-887. |
| [19] |
Arthur E E, Crews E H, Morgan E C. Optimizing plant genetic strategies for minimizing environmental contamination in the food chain[J]. International Journal of Phytoremediation, 2000, 2(1): 1-21. DOI:10.1080/15226510008500027 |
| [20] |
李博文, 谢建治, 郝晋珉. 不同蔬菜对潮褐土镉铅锌复合污染的吸收效应研究[J]. 农业环境科学学报, 2003, 22(3): 286-288. LI Bo-wen, XIE Jian-zhi, HAO Jin-min. Effects of complex contamination of cadmium, lead and zinc on vegetables grown in meadow cinnamon soil[J]. Journal of Agro-Environment Science, 2003, 22(3): 286-288. |
| [21] |
张晓晴, 韦东普, 李波, 等. 土壤水溶态铜对小白菜的毒害效应及其预测模型[J]. 生态毒理学报, 2014, 9(4): 729-736. ZHANG Xiao-qing, WEI Dong-pu, LI Bo, et al. The toxicity effect of soil soluble copper on bok choy and its prediction model[J]. Asian Journal of Ecotoxicology, 2014, 9(4): 729-736. |
| [22] |
高俊凤. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2006. GAO Jun-feng. Guide for plant physiology experiments[M]. Beijing: Higher Education Press, 2006. |
| [23] |
中华人民共和国卫生部. 食品安全国家标准食品中亚硝酸盐与硝酸盐的测定: GB 5009. 33-2016[S]. 北京: 中国标准出版社, 2016. Ministry of Health of PRC National food safety standard-determination of nitrite and nitrate in foods: GB 5009. 33-2016[S]. Beijing: China Standards Press, 2016. |
| [24] |
王学奎. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2006, 268-270. WANG Xue-kui. Principles and techniques of plant physiological bio-chemical experiments[M]. Beijing: Higher Education Press, 2006, 268-270. |
| [25] |
Zhang K, Wang J, Yang Z, et al. Genotype variations in accumulation of cadmium and lead in celery(Apium graveolens L.)and screening for low Cd and Pb accumulative cultivars[J]. Frontiers of Environmental Science & Engineering, 2012, 7(1): 85-96. |
| [26] |
Zhu Y, Yu H, Wang J, et al. Heavy metal accumulations of 24 asparagus bean cultivars grown in soil contaminated with Cd alone and with multiple metals(Cd, Pb, and Zn)[J]. Journal of Agricultural & Food Chemistry, 2007, 55(3): 1045-1052. |
| [27] |
Zhou Y, Xue M, Yang Z, et al. High cadmium pollution risk on vegetable amaranth and a selection for pollution-safe cultivars to lower the risk[J]. Frontiers of Environmental Science & Engineering, 2012, 7(2): 219-230. |
| [28] |
Wu Z, Zhao X, Sun X, et al. Xylem transport and gene expression play decisive roles in cadmium accumulation in shoots of two oilseed rape cultivars(Brassica napus)[J]. Chemosphere, 2015, 119(119C): 1217-1223. |
| [29] |
Mclaughlin M J, Parker D R, Clarke J M. Metals and micronutrientsfood safety issues[J]. Field Crops Research, 1999, 60(1/2): 143-163. |
| [30] |
Liu W, Zhou Q, Sun Y, et al. Identification of Chinese cabbage genotypes with low cadmium accumulation for food safety[J]. Environmental Pollution, 2009, 157(6): 1961-1967. DOI:10.1016/j.envpol.2009.01.005 |
| [31] |
Wang J, Fang W, Yang Z, et al. Inter-and intraspecific variations of cadmium accumulation of 13 leafy vegetable species in a greenhouse experiment[J]. Journal of Agricultural & Food Chemistry, 2007, 55(22): 9118-9123. |
| [32] |
Wang J, Yuan J, Yang Z, et al. Variation in cadmium accumulation among 30 cultivars and cadmium subcellular distribution in 2 selected cultivars of water spinach(Ipomoea aquatica Forsk.)[J]. Journal of Agricultural and Food Chemistry, 2009, 57(19): 8942-8949. DOI:10.1021/jf900812s |
| [33] |
张基茂, 黄运湘. 硫对水稻镉吸收的影响机理[J]. 作物研究, 2017, 31(1): 82-87. ZHANG Ji-mao, HUANG Yun-xiang. Effect of sulfur on cadmium absorption of rice[J]. Crop Research, 2017, 31(1): 82-87. |
| [34] |
潘瑶, 尹洁, 高子平, 等. 硫对水稻幼苗镉积累特性及亚细胞分布特征的影响[J]. 农业资源与环境学报, 2015, 32(3): 275-281. PAN Yao, YIN Jie, GAO Zi-ping, et al. Effects of sulfur on the accumulation and subcellular distribution of cadmium in rice seedlings[J]. Journal of Agricultural Resources & Environment, 2015, 32(3): 275-281. |
| [35] |
孙丽娟, 段德超, 彭程, 等. 硫对土壤重金属形态转化及植物有效性的影响研究进展[J]. 应用生态学报, 2014, 25(7): 2141-2148. SUN LI-juan, DUAN De-chao, PENG Cheng, et al. Influence of sulfur on the speciation transformation and phyto-availability of heavy metals in soil:A review[J]. Chinese Journal of Applied Ecology, 2014, 25(7): 2141-2148. |
| [36] |
Moreau J W, Weber P K, Martin M C, et al. Extracellular proteins limit the dispersal of biogenic nanoparticles[J]. Science, 2007, 316(5831): 1600-1603. DOI:10.1126/science.1141064 |
| [37] |
Xiang C, Oliver D J. Glutathione metabolic genes coordinately respond to heavy metals and jasmonic acid in Arabidopsis[J]. The Plant Cell, 1998, 10(9): 1539-1550. DOI:10.1105/tpc.10.9.1539 |
| [38] |
Clemens S. Molecular mechanisms of plant metal tolerance and homeostasis[J]. Planta, 2001, 212(4): 475-486. DOI:10.1007/s004250000458 |
| [39] |
杨凤娟, 刘世琦, 王秀峰, 等. 硫对大蒜生理生化指标及营养品质的影响[J]. 应用生态学报, 2004, 15(11): 2095-2098. YANG Feng-juan, LIU Shi-qi, WANG Xiu-feng, et al. Effects of sulfur on physiological and biochemical indices and nutrition quality of gralic[J]. Chinese Journal of Applied Ecology, 2004, 15(11): 2095-2098. DOI:10.3321/j.issn:1001-9332.2004.11.021 |
| [40] |
刘中良, 刘世琦, 张自坤. 硫对青蒜生长及品质的影响[J]. 植物营养与肥料学报, 2011, 17(5): 1288-1292. LIU Zhong-liang, LIU Shi-qi, ZHANG Zi-kun. Effects of sulfur contents on growth and quality of garlic sprout[J]. Plant Nutrition & Fertilizer Science, 2011, 17(5): 1288-1292. DOI:10.11674/zwyf.2011.0320 |
| [41] |
谢瑞芝, 董树亭, 胡昌浩, 等. 氮硫互作对玉米籽粒营养品质的影响[J]. 中国农业科学, 2003, 36(3): 263-268. XIE Rui-zhi, DONG Shu-ting, HU Chang-hao, et al. Influence of nitrogen and sulfur interaction on grain quality of maize[J]. Scientia Agricultura Sinica, 2003, 36(3): 263-268. |
| [42] |
孙羽, 刘丽君, 祖伟, 等. 硫素营养对大豆氮素积累及品质的影响[J]. 东北农业大学学报, 2004, 35(4): 389-394. SUN Yu, LIU Li-jun, ZU Wei, et al. Effects of sulfur on nitrogen accumulation and quality of soybean[J]. Journal of Northeast Agricultural University, 2004, 35(4): 389-394. |
| [43] |
孙惠莉, 吕金印, 贾少磊. 硫对镉胁迫下小白菜叶片AsA-GSH循环和植物络合素含量的影响[J]. 农业环境科学学报, 2013, 32(7): 1294-1301. SUN Hui-li, LÜ Jin-yin, JIA Shao-lei. Effects of sulfur on ascorbateglutathione cycle and the content of phytochelatins in the leaves of pakchoi(brassica chinensis L.) under cadmium stress[J]. Journal of Agro-Environment Science, 2013, 32(7): 1294-1301. |
| [44] |
Zhang W, Lin K, Zhou J, et al. Spatial distribution and toxicity of cadmium in the joint presence of sulfur in rice seedling[J]. Environ Toxicol Pharmacol, 2013, 36(3): 1235-1241. DOI:10.1016/j.etap.2013.10.007 |
| [45] |
Wirtz M, Droux M, Hell R. O-acetylserine(thiol)lyase:An enigmatic enzyme of plant cysteine biosynthesis revisited in Arabidopsis thaliana[J]. Journal of Experimental Botany, 2004, 55(404): 1785-1798. DOI:10.1093/jxb/erh201 |
| [46] |
Tabe L, Hagan N, Higgins T J. Plasticity of seed protein composition in response to nitrogen and sulfur availability[J]. Current Opinion in Plant Biology, 2002, 5(3): 212-217. DOI:10.1016/S1369-5266(02)00252-2 |
| [47] |
朱云集, 李国强, 郭天财, 等. 硫对不同氮水平下小麦旗叶氮硫同化关键酶活性及产量的影响[J]. 作物学报, 2007, 33(7): 1116-1121. ZHU Yun-ji, LI Guo-qiang, GUO Tian-cai, et al. Effects of sulfur on key enzyme activities involved in nitrogen and sulphur assimilation in flag leaves and grain yield under different nitrogen levels in winter wheat, Triticum aestivum L[J]. Acta Agronomica Sinica, 2007, 33(7): 1116-1121. |
| [48] |
霍捷, 王俊玲, 薛占军, 等. 亚硫酸氢钠对白菜叶片硝酸盐还原及光合能力的影响[J]. 园艺学报, 2012, 39(4): 669-676. HUO Jie, WANG Jun-ling, XUE Zhan-jun, et al. Effects of sodium bisulfite on nitrate reduction and photosynthetic capacity in the leaves of non-heading Chinese cabbage[J]. Acta Horticulturae Sinica, 2012, 39(4): 669-676. |
| [49] |
彭嘉桂, 杨杰, 林琼, 等. 硫对蔬菜的增产及降低NO3-累积效应研究[J]. 福建农业学报, 2004, 19(3): 160-163. PENG Jia-gui, YANG Jie, LIN Qiong. Effect of sulfur fertilizer on increasing vegetable yield and decreasing accumulation of NO3-[J]. Fujian Journal of Agricultural Sciences, 2004, 19(3): 160-163. |
 2018, Vol. 37
2018, Vol. 37