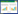文章信息
- 关川, 童蕾, 秦丽婷, 刘慧
- GUAN Chuan, TONG Lei, QIN Li-ting, LIU Hui
- 洪湖养殖区水环境中微生物的耐药性及其群落功能多样性研究
- The antibiotic resistance of microorganisms and the functional diversity of microbial communities in the aquaculture environments of Honghu Lake, China
- 农业环境科学学报, 2018, 37(8): 1748-1757
- Journal of Agro-Environment Science, 2018, 37(8): 1748-1757
- http://dx.doi.org/10.11654/jaes.2017-1460
文章历史
- 收稿日期: 2017-10-27
- 录用日期: 2018-02-13
近年来,抗生素在医疗业和养殖领域中得到广泛使用,水环境中抗生素的存在已是普遍现象。磺胺类抗生素(Sulfonamides,SAs)是一类具有广谱抗菌效果的人工合成药物,进入体内1~2 d后会以母体或代谢产物的形式排出,进入到自然环境[1]。研究发现,磺胺类抗生素在水环境中有着较高的检出率[2]。微生物是水环境中重要且活跃的组分[3-4],其群落结构和数量影响着水体的生态环境、营养水平及污染状况[5]。每年大量的抗生素通过生活污水和养殖废水进入到水环境中,影响水环境中微生物的种群结构和数量,引发次级效应,破坏生态平衡[6]。环境中长期残留的抗生素还会导致耐药微生物的产生[7],耐药微生物在环境中传播扩散,最终通过直接或间接(如食物链)途径进入人体,给人类健康带来威胁[8]。随着养殖业中抗生素的大量使用,环境中耐药微生物的分布已引起广泛关注,有研究证明养殖区及周边环境(土壤、水体)中均存在耐磺胺类抗生素的多种微生物[9-11]。因此,研究耐药微生物数量与抗生素的浓度关系可为微生物的耐药机理提供理论基础。
洪湖是湖北省最大的淡水湖,水生动植物资源十分丰富,兼具灌溉、渔业、水质净化、航运等多种功能[12]。20世纪80年代洪湖开始围网养殖,2002年到2004年达到高峰,养殖面积迅速扩大,造成的污染远远超过湖泊的自净能力。养殖业的迅猛发展使得洪湖水质明显恶化[12],从Ⅱ类水体降为Ⅳ类水体[13]。由于水产养殖投放的饲料中含有抗生素,未利用的抗生素在环境水体和底泥中不断积累,经过地表水和地下水的相互作用[14],进而污染地下水,引发一系列环境问题。所以,研究洪湖养殖区地表水和地下水中抗生素对环境微生物的影响具有重要意义。本文选取洪湖养殖区的地下水、湖水和鱼塘水为研究对象,分别调查水体中细菌、真菌和放线菌对SAs耐药菌数的分布规律,并分析耐药微生物数量及占比与SAs的关系,同时采用Biolog法研究微生物总体活性与代谢功能的差异,以期通过微生物指标了解洪湖养殖区水环境的污染特征,为抗生素的生态环境影响评价提供理论参考。
1 材料与方法 1.1 采样点概况本文以洪湖养殖区为研究对象,根据地下水、鱼塘水和湖水三种不同环境水体,共设置26个采样点,其中GW1~GW15为地下水,LW1~LW8为湖水,FW1~FW3为鱼塘水。
1.2 水样的采集与保存水样采集时间为2015年12月,通过地下水井阀(手压井或机井)采集4 L地下水,利用水样采集器采集1 L湖水和0.5 L鱼塘水。将水样置于无菌玻璃瓶中,微生物样品经真空抽滤于0.22 μm滤膜上,并置于灭菌离心管中,密封放于冷冻箱,带回实验室放入-20 ℃冰箱保存待用。
1.3 水样理化性质及磺胺抗生素测定利用便携式水质分析仪器(SX751型,上海三信)现场测水样pH值、电导率、氧化还原电位(ORP)和溶解氧(DO),用采水器温度计测水温,水样中TOC使用总有机碳(TOC)分析仪(Vario TOC,德国元素)测定。
水样通过固相萃取小柱[oasis® HLB6cc(200mg)Extraction Cartridges,OASIS,Ireland]分离富集和纯化,并采用液相色谱质谱联用法(Access Max,Thermo Fisher)测定磺胺抗生素浓度[15]。
1.4 培养基制备及微生物计数细菌培养基(LB培养基)[16]、真菌培养基(改良马丁培养基)[17]及放线菌培养基(高氏一号琼脂培养基)[18]。
1.5 微生物计数在无菌操作条件下,将膜用灭菌剪刀剪碎,加入25 mL无菌水,150 r·min-1条件下振荡0.5 h,用移液枪反复冲洗使膜上细胞完全进入溶液中,将膜取出,制成菌悬液,依次用无菌蒸馏水稀释3个梯度,每个稀释度设3个平行。取100 μL稀释样品分别涂于不加和添加50 mg·L-1磺胺甲恶唑(Dr.Ehrenstorfer)的细菌、真菌、放线菌培养基平板上,于28 ℃恒温保湿培养箱(HPX-250B5H-Ⅲ,上海新苗)中倒置培养。细菌、真菌、放线菌分别培养2、2、5 d后计数,实验结果取3次试验的平均值。
1.6 微生物群落功能多样性分析分别吸取1.5中微生物悬液150 μL加入Biolog板各孔中,将接种的Biolog板放置于25 ℃恒温保湿培养箱,每隔12 h用酶标仪(Infinite® 200 Pro Nano Quant,Tecan,瑞士)测定吸光度值(OD),本文采用培养120 h数据进行地下水和地表水微生物群落多样性评价。Biolog板中多底物酶联(ELISA)反应的单孔颜色平均吸光值(average well color development,AWCD)、微生物群落底物利用碳源数(S)、Shannon指数、Simpson指数、McIntosh指数及6大碳源利用根据文献[19-21]来计算。
所有数据经Excel 2007进行处理,采用SPSS 17.0进行耐药微生物数量及其占比与磺胺抗生素的相关性分析、样品间的差异显著性分析。
2 结果与分析 2.1 水样理化性质分析从表 1可以看出洪湖养殖区水体呈弱碱性,其中湖水pH最高可达8.75。主要原因是受洪湖居民生活污水的排放及冬季水生植物菹草的大量生长,水生植物白天因光合作用大量吸收水中CO2,导致湖水pH值升高[22]。
由于采样时间为冬季,洪湖地表水温度低于地下水水温。地下水与地表水在ORP和DO等指标上有明显差异,地下水具有显著的还原和缺氧环境。湖水和鱼塘水的DO值最高分别可达12.01 mg · L-1和13.01 mg·L-1,这与王学雷等监测的冬季洪湖水中DO最大值为13.32 mg·L-1相似[22]。洪湖水体中HCO3-浓度普遍较高,且地下水的HCO3-比湖水和鱼塘水高出2~3倍,与电导率呈正相关性,这与含碳矿物溶解和土壤中CO2气体的溶解等有关[23],此结果与杜耘等研究结果相符[12]。

|
洪湖不同水体中TOC含量分布差异较大,地下水中TOC平均值为6.25 mg·L-1,其中GW3和GW15中TOC分别高达20.03 mg·L-1和14.29 mg·L-1。鱼塘水中TOC含量远高于湖水,平均值是湖水中TOC的1.62倍,说明鱼塘养殖增加了有机质含量。
2.2 微生物和耐药微生物数量及其耐药占比分布微生物和耐药微生物数量及其耐药占比分布见图 2。研究表明,影响水体中微生物生长的环境因素较多,如pH、DO、温度、TOC等对微生物生长均有重要影响[24]。由表 1可以看出,地下水与地表水的电导率、氧化还原电位、溶解氧及TOC相差较大,而鱼塘水与湖水的TOC也具有明显差异。这些理化性质很可能是影响三种水体中微生物数量差别的重要因素。
|
| 图 1 研究区域及采样点布设 Figure 1 Map of sampling sites in Honghu Lake |
|
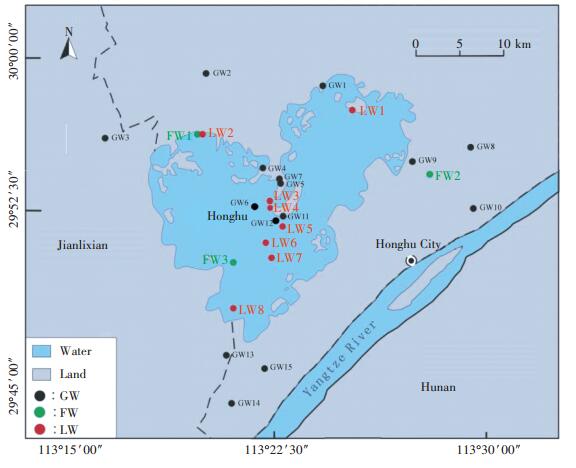
| 图 2 洪湖养殖区水环境中微生物和耐药微生物数量及其耐药占比的分布 Figure 2 Numbers of microorganisms and antibiotic resistant microorganisms and proportion in aquaculture environment of Honghu Lake |
洪湖地下水中有不同程度的微生物分布,细菌、真菌、放线菌数量范围分别为(0.01~1.69)×103、(0.01~ 1.26)×103、(0.01~0.26)×103 cfu · mL-1。样品GW1、GW5、GW8、GW13中真菌数量相对其他样品较高,最高可达1.26×103 cfu·mL-1。地下水中放线菌主要来自土壤和空气,20%样品中放线菌数量高于102 cfu·mL-1。近年来,由于地表水质的恶化,受地表水补给的影响,地下水污染已日趋严重。由于农村打井条件简陋,加上缺乏有效的环境治理措施,农村的地下水源已受到不同程度的污染[25]。洪湖水环境中微生物的数量分布表明该研究区已受到一定程度的污染,存在饮水安全问题,这与我国其他地区出现的污染状况类似[26]。
地下水中耐药细菌、真菌、放线菌数量范围分别为(0~0.2)×103、(0~0.5)×103、(0~0.02)×103 cfu·mL-1,检出样品数分别为11、8、3个,检出率分别为73.33%、53.33%和20%,说明地下水中有一定比例的耐药菌存在,其中4个样品中耐药细菌数在102 cfu·mL-1以上,最高达2×102 cfu·mL-1,耐药真菌数和放线菌数最高分别可达5×102 cfu·mL-1和24 cfu·mL-1。地下水中耐药细菌的占比较低,绝大多数占比都在10%左右,只有GW7、GW10和GW12的耐药细菌占比较高,分别达到了50%、94%和78%。其中GW10紧挨鱼塘,受鱼类养殖影响较大。而GW7和GW12均是居民居住聚集地区,地下水受到人为影响大。地下水中耐药真菌占比较高,接近一半的采样点的耐药真菌占比都高于45%,最高可达88%。而放线菌的耐药占比则普遍不高。已有研究表明,地表水中的抗性菌株可经多种途径进入到地下水中[27]。
地表水中细菌、真菌、放线菌的数量总体高于地下水,而鱼塘水中数量又高于洪湖湖水(除LW4外),不同样品间微生物数量差异显著。除LW6、LW7、LW8样品中微生物数量较少外,其他均较高,湖水微生物数量与居民生活、渔业和畜禽养殖等活动密切相关。如LW3、LW4湖水中有小面积的围栏养鱼;LW2、LW5湖水位于村民住宅旁;LW1湖水周围正在修路,说明人类活动对湖水造成一定程度的污染。而LW6、LW7、LW8是离居民地较远湖心水域,人为影响较小。人类活动排放的生活污水和养殖废水能增加水环境中有机质的含量,且污染水体中的微生物数量与有机物含量有显著的相关性[28]。从表 1中可看出湖水和鱼塘水中TOC的含量均高于地下水,鱼塘水体的TOC达到了地下水的2.3倍。因此,受人类活动影响的地表水微生物数量较高。特别是养殖池塘属于相对封闭型,在养殖过程中池塘水体基本上不与外界发生水体交换,因而池塘中积累了丰富的营养盐[29],使微生物生长迅速,造成池塘中微生物数量增加。
湖水中耐药细菌、真菌、放线菌数量范围分别为(0.018~3.75)×103、(0.05~1.45)×103、(0~0.079)×103 cfu·mL-1,其中LW4耐药细菌和真菌数量最高,远离居民区的LW6、LW7、LW8中耐药菌数量相对较少,说明耐药菌数量与人类活动有一定关联,这与北江流域中的耐药细菌分布规律相似[30]。另外,8个湖水采样点中,只有LW7的耐药细菌占比是19%,其他7个采样点占比均在30%~70%间,其中LW4的耐药细菌占比最高,为62%。说明湖水中的耐药细菌占比很高。洪湖鱼塘水中耐药细菌和真菌远高于湖水,由于人工养鱼过程中投入抗生素,未被吸收的抗生素通过粪便排入水体,使得耐药菌数量增加。3个鱼塘水中,只有FW2的耐药细菌占比为11%,其他两个采样点的耐药细菌占比分别为57%和42%。鱼塘作为抗生素耐药菌和耐药基因的源,其污染状况备受关注,不同地区的养殖场水体中检出不同程度耐药的菌株[31-34]。
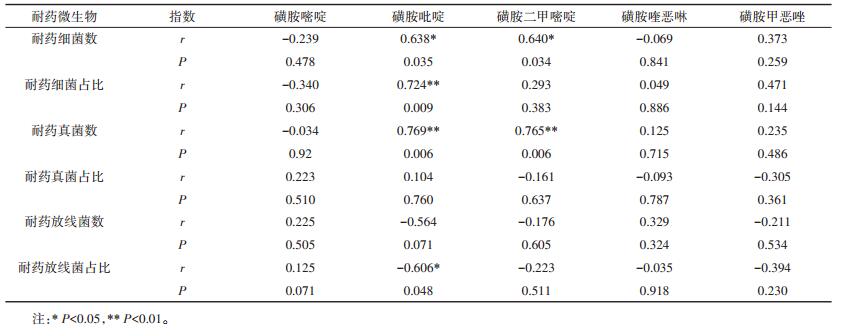
2.3 耐药微生物数量及耐药占比与SAs浓度相关性分析环境抗生素污染促进耐药微生物生存和繁衍,进而对生态环境造成潜在危害[35-36],因此分析环境中抗生素浓度和耐药菌的关系有助于了解耐药菌在环境的产生及传播规律。本文测得地下水中磺胺嘧啶、磺胺吡啶、磺胺二甲基嘧啶、磺胺喹恶啉和磺胺甲恶唑浓度平均值分别为0.15、3.07、0.72、4.41、7.60 ng·L-1。经SPSS相关性分析得出,地下水中耐药微生物数量和SAs浓度的相关性并不显著。据报道,不同类型抗生素在水体中的存在将对微生物耐药性产生影响[37],即不同抗生素对细菌耐药性具有共选择作用,导致单一类型抗生素与相应耐药菌的相关性减弱[38]。
湖水和鱼塘水均属于受人为活动影响较大的地表水,本文将地表水中耐药微生物及其占比与磺胺抗生素进行相关性分析(表 2),地表水(湖水和鱼塘水)中五种磺胺抗生素浓度分别为0.43、24.75、5.44、138.9、288.39 ng·L-1,SPSS相关性分析表明耐药细菌数与耐药真菌数均与磺胺吡啶和磺胺二甲嘧啶的浓度具有一定程度的相关性,同时耐药细菌占比也与磺胺吡啶的浓度具有相关性。耐药放线菌和SAs相关性不显著,但是其占比却和磺胺吡啶浓度呈负相关。有研究表明,北京温榆河中四环素类、氟喹诺酮类耐药大肠杆菌与相应抗生素浓度也存在相关关系,推测抗生素是其抗药菌发生的决定因素[39]。
|
微生物群落平均活性AWCD(Average well color development)是用颜色平均变化率来评判微生物群落的碳源利用能力,指示微生物的代谢活性[40]。微生物群落AWCD随培养时间的变化趋势如图 3所示,由于地下水微生物较少,整个培养过程中微生物活性较低,受污染的地下水GW7和未受污染的地下水GW14在96 h前AWCD变化基本一致,在96 h后GW7活性略高于GW14,整个培养过程两个样品中AWCD差异不大。地表水LW4和FW3的微生物生长在0~40 h变化较小,40 h后开始急剧上升,说明碳源的利用主要在40 h后,在96 h基本达到平稳,LW4在平稳期的AWCD值远大于FW3,说明LW4中微生物对碳源利用能力和代谢活性更强,这与两个样品中微生物数量和整体活性有关。

|
| 图 3 不同水样中AWCD随培养时间的变化 Figure 3 The change of AWCD in different water samples with incubation time |
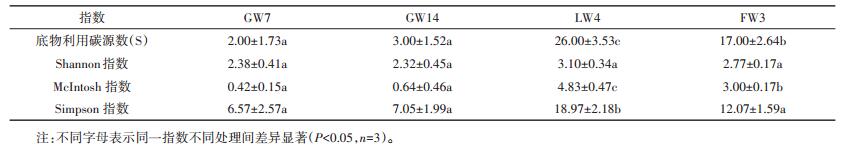
微生物群落代谢功能多样性评价中底物利用碳源数是表征微生物群落对底物利用的广泛性和差异性的指标,Shannon指数是研究群落物种数量及其个体数量和分布均匀程度的综合指标,受群落物种丰富度影响较大;McIntosh指数是群落物种均一性的度量指标;Simpson指数是反映群落中最常见物种的衡量指标。
由表 3知,GW7和GW14地下水样品中微生物群落底物利用碳源数、Shannon、McIntosh和Simpson指数差异不大,说明微生物群落对碳源利用性、丰富度、均一性及物种数相似。地下水与地表水相比,微生物数量少,活性低,所以对碳源的利用数和利用能力都很低。地下水的理化性质和地表水有显著差异,如地下水ORP值很低,水体还原性越强,微生物的多样性越低[41]。另外,地下水中微生物群落均一性很低,且不存在优势菌种。
|
FW3与LW4相比,鱼塘水相对封闭,营养物质大量累积,某些有机物相对容易降解,水体中微生物对这些碳源利用有选择偏好[42],因此,鱼塘水中微生物的碳源利用数更少。同时,由于长期投加养殖饲料,鱼塘水环境中抗生素含量较高。抗生素会使得非耐药菌生长受限,耐药优势菌菌群生长良好,严重破坏水体生态平衡,降低微生物群落的多样性[43],所以鱼塘水微生物丰富度要低于湖水。表 3结果显示,湖水中存在着某类优势菌种,且微生物的均匀性更高。
由图 4可知,地下水GW7和GW14对6大类碳源利用情况相似,对碳水化合物类利用程度最高,湖水LW4微生物除对胺类利用度较低外,对其他5种碳源均有较高利用。鱼塘水FW3对碳水化合物类、聚合物类、复合类有较高利用,说明洪湖湖水和鱼塘水整体利用不同碳源的微生物物种较丰富。这将为我们了解洪湖水体微生物营养需求提供数据支持,并为以后养殖水体异养微生物定向强化提供可靠依据[44]。

|
| 图 4 不同水体中微生物对 6大碳源利用 Figure 4 Situation utilized for six types of carbon sources by microbial community in different water samples |
(1)洪湖地下水、湖水、鱼塘水中微生物数量(细菌、真菌、放线菌)分布差异较大。湖水中微生物数量受人为活动影响较大,池塘水由于养殖活动,其微生物数量整体高于湖水。
(2)不同水体中耐药细菌、真菌、放线菌均有不同程度检出。地下水中耐药微生物数量及耐药占比与磺胺抗生素无显著相关性。湖水和鱼塘水中耐药微生物数量较高,与磺胺吡啶和磺胺二甲基嘧啶呈显著正相关,同时耐药细菌占比和耐药放线菌占比也与磺胺吡啶的浓度具有相关性。
(3)地下水中微生物群落多样性低于地表水,且对碳源的利用数更少;湖水微生物相比于鱼塘水微生物,其群落更为丰富,均一性更高,且存在某种优势菌种。
(4)洪湖受污染与未受污染的地下水中微生物群落代谢的平均活性、对碳源利用性、丰富度、均一性及物种数相似,对碳水化合物类碳源利用程度较高;湖水和鱼塘水中整体利用不同碳源的微生物较丰富,对碳水化合物类、聚合物类、复合类碳源均有较高利用。
| [1] |
刘锋, 廖德润, 李可, 等. 畜禽养殖基地磺胺类喹诺酮类和大环内酯类抗生素污染特征[J]. 农业环境科学学报, 2013, 32(4): 847-853. LIU Feng, LIAO De-run, LI Ke, et al. Pollution characteristics of the sulfonamides, quinolones and macrolides in the samples collected from livestock and poultry feedlots[J]. Journal of Agro-Environment Science, 2013, 32(4): 847-853. |
| [2] |
Campagnolo E R, Johnson K R, Karpati A, et al. Antimicrobial residues in animal waste and water resources proximal to large-scale swine and poultry feeding operations[J]. Science of the Total Environment, 2002, 299(1/2/3): 89-95. |
| [3] |
Bethke C M, Ding D, Jin Q S, et al. Origin of microbiological zoning in groundwater flows[J]. Geology, 2008, 36(9): 739-742. DOI:10.1130/G24859A.1 |
| [4] |
Watanabe K, Watanabe K, Kodama Y, et al. Molecular characterization of bacterial populations in petroleum-contaminated groundwater discharged from underground crude oil storage cavities[J]. Applied and Environmental Microbiology, 2000, 66(11): 4803-4809. DOI:10.1128/AEM.66.11.4803-4809.2000 |
| [5] |
万欢, 吴根福. 京杭大运河杭州段水体中微生物生理群生态分布研究[J]. 农业环境科学学报, 2006, 25(6): 1581-1587. WAN Huan, WU Gen-fu. Physiological group distribution of microorganisms in the water body of the Hangzhou section of the grand canal[J]. Journal of Agro-Environment Science, 2006, 25(6): 1581-1587. |
| [6] |
李嘉, 张瑞杰, 王润梅, 等. 小清河流域抗生素污染分布特征与生态风险评估[J]. 农业环境科学学报, 2016, 35(7): 1384-1391. LI Jia, ZHANG Rui-jie, WANG Run-mei, et al. Distribution characteristics and ecological risk assessment of antibiotic pollution in Xiaoqing River watershed[J]. Journal of Agro-Environment Science, 2016, 35(7): 1384-1391. DOI:10.11654/jaes.2016.07.022 |
| [7] |
Diarra M S, Silversides F G, Diarrassouba F, et al. Impact of feed supplementation with antimicrobial agents on growth performance of broiler chickens, clostridium perfringens and enterococcus counts, and antibiotic resistance phenotypes and distribution of antimicrobial resistance determinants in escherich[J]. Applied & Environmental Microbiology, 2007, 73(20): 65-66. |
| [8] |
吴楠, 乔敏. 土壤环境中四环素类抗生素残留及抗性基因污染的研究进展[J]. 生态毒理学报, 2010, 5(5): 618-627. WU Nan, QIAO Min. Tetracycline residues and tetracycline resistance gene pollution in soil:A review[J]. Asian Journal of Ecotoxicology, 2010, 5(5): 618-627. |
| [9] |
Sharma R, Munns K, Alexander T, et al. Diversity and distribution of commensal fecal Escherichia coli bacteria in beef cattle administered selected subtherapeutic antimicrobials in a feedlot setting[J]. Applied and Environmental Microbiology, 2008, 74(20): 6178-6186. DOI:10.1128/AEM.00704-08 |
| [10] |
Byrne-Bailey K G, Gaze W H, Kay P, et al. Prevalence of sulfonamide resistance genes in bacterial isolates from manured agricultural soils and pig slurry in the united kingdom[J]. Antimicrobial Agents and Chemotherapy, 2009, 53(2): 696-702. DOI:10.1128/AAC.00652-07 |
| [11] |
李宛蔓, 杨琛, 郭楚玲, 等. 底泥中红霉素耐受菌群的多样性分析[J]. 环境科学学报, 2016, 36(1): 100-105. LI Wan-man, YANG Chen, GUO Chu-ling, et al. The microbial diversity of erythromycin resistant bacterial community in the sediment[J]. Acta Scientiae Circumstantiae, 2016, 36(1): 100-105. |
| [12] |
杜耘, 陈萍, Kieko, 等. 洪湖水环境现状及主导因子分析[J]. 长江流域资源与环境, 2005, 14(4): 481-485. DU Yun, CHEN Ping, K SATO, et al. Present situation of water environment and analysis of dominant factors in Honghu[J]. Resources and Environment in the Yang tze Basin, 2005, 14(4): 481-485. |
| [13] |
黄应生, 陈世俭, 吴后建, 等. 洪湖演变的驱动力及其生态保护对策分析[J]. 长江流域资源与环境, 2007, 16(4): 504-508. HUANG Ying-sheng, CHENG Shi-jian, WU Hou-jian, et al. Analysis on the driving force of Honghu evolution and the countermeasures of ecological protection[J]. Resources and Environment in the Yangtze Basin, 2007, 16(4): 504-508. |
| [14] |
Gan Y, Wang Y, Duan Y, et al. Dynamic changes of groundwater arsenic concentration in the monitoring field site, Jianghan Plain[J]. Earth Science Frontiers, 2014(21): 37-49. |
| [15] |
Tong L, Liu H, Xie C, et al. Quantitative analysis of antibiotics in aquifer sediments by liquid chromatography coupled to high resolution mass spectrometry[J]. Journal of Chromatography A, 2016, 1452: 58-66. DOI:10.1016/j.chroma.2016.05.027 |
| [16] |
蔡妙英, 东秀珠. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001. CAI Miao-ying, DONG Xiu-zhu. Common bacterial system identification manual[M]. Beijing: The Science Publishing Company, 2001. |
| [17] |
国家药典委员会. 中华人民共和国药典[M]. 2010年版.二部. , 中国医药科技出版社.
|
| [18] |
刘国生. 微生物学实验技术[M]. 北京: 科学出版社, 2007. LIU Guo-sheng. Experimental technique in microbiology[M]. Beijing: The Science Publishing Company, 2007. |
| [19] |
Ma T, Pan X, Chen L K, et al. Effects of different concentrations and application frequencies of oxytetracycline on soil enzyme activities and microbial community diversity[J]. European Journal of Soil Biology, 2016, 76: 53-60. DOI:10.1016/j.ejsobi.2016.07.004 |
| [20] |
Kong W D, Zhu Y G, Fu B J, et al. The veterinary antibiotic oxytetracycline and Cu influence functional diversity of the soil microbial community[J]. Environmental Pollution, 2006, 143(1): 129-137. DOI:10.1016/j.envpol.2005.11.003 |
| [21] |
Liu B, Li Y, Zhang X, et al. Combined effects of chlortetracycline and dissolved organic matter extracted from pig manure on the functional diversity of soil microbial community[J]. Soil Biology & Biochemistry, 2014, 74: 148-155. |
| [22] |
王学雷, 刘兴土, 吴宜进. 洪湖水环境特征与湖泊湿地净化能力研究[J]. 武汉大学学报(理学版), 2003, 49(2): 217-220. WANG Xue-lei, LIU Xin-tu, WU Yi-jin. Characteristics of water environment and purification capacity of wetland in Honghu[J]. J Wuhan Univ (Nat Sci Ed), 2003, 49(2): 217-220. |
| [23] |
Choi B Y, Yun S T, Yu S Y, et al. Hydrochemistry of urban groundwater in Seoul, South Korea:Effects of land-use and pollutant recharge[J]. Environmental Geology, 2005, 48(8): 979-990. DOI:10.1007/s00254-004-1205-y |
| [24] |
刘乐. 西北某市地下水源中真菌污染特征及灭活研究[D]. 西安: 西安建筑科技大学, 2015. LIU Le. The polluted characteristics of fungi in the groundwater of northwest city and the inactivation efficiency[D]. Xi'an: Xi'an University of Architecture and Technology, 2015. |
| [25] |
陈建耀, 周世宁, 谢丽纯, 等. 城镇化过程中地下水微生物的时空分异与演化:以珠海为例[J]. 自然资源学报, 2011, 26(3): 504-512. CHEN Jian-yao, ZHOU Shi-ning, XIE Li-chun, et al. Spatio temporal differentiation and evolution of microorganisms in groundwater during Urbanization:Take Zhuhai as an example[J]. Journal of Natural Resources, 2011, 26(3): 504-512. DOI:10.11849/zrzyxb.2011.03.017 |
| [26] |
李俐. 洛阳市地下水微生物污染状况浅析[J]. 地下水, 2012, 34(3): 102-103. LI Li. Analysis of microbial contamination of groundwater in Luoyang[J]. Ground Water, 2012, 34(3): 102-103. |
| [27] |
Dolliver H, Gupta S. Antibiotic losses in leaching and surface runoff from manure-amended agricultural land[J]. Journal of Environmental Quality, 2008, 37(3): 1227-1237. DOI:10.2134/jeq2007.0392 |
| [28] |
谢文斐, 杨开勋, 黄耀坚, 等. 沙溪水污染对微生物群落变化的影响[J]. 厦门大学学报(自然版), 2005, 44(2): 250-254. XIE Wen -fei, YANG Kai-xun, HUANG Yao-jian, et al. The influence of polluted water on changes in the microorganic community of the Shaxi River[J]. Journal of Xiamen University(Natural Science), 2005, 44(2): 250-254. |
| [29] |
唐凌, 邝声耀, 刘兴国, 等. 不同养殖年份鱼塘底泥细菌群落多样性及演替分析[J]. 水产科学, 2014, 33(11): 680-684. TANG Ling, KUANG Sheng-yao, LIU Xing-guo, et al. Diversity and succession of bacterial community in sediment of fish ponds in different breeding years[J]. Fisheries Science, 2014, 33(11): 680-684. DOI:10.3969/j.issn.1003-1111.2014.11.004 |
| [30] |
杨颖. 北江水环境中抗生素抗性基因污染分析[D]. 广州: 中山大学, 2010. YANG Ying. Characterizing the pollution by the representative antibiotic resistance genes(ARGs)in the Beijiang River, South China[D]. Guangzhou: Sun Yat-sen University, 2010. |
| [31] |
Akinbowale O LPengH, Barton M D. Antimicrobial resistance in bacteria isolated from aquaculture sources in Australia[J]. J Appl Microbiol, 2006, 100(5): 1103-1113. DOI:10.1111/jam.2006.100.issue-5 |
| [32] |
Miranda C D, Zemelman R. Antibiotic resistant bacteria in fish from the Concepción Bay, Chile[J]. Marine Pollution Bulletin, 2001, 42(11): 1096-1102. DOI:10.1016/S0025-326X(01)00093-5 |
| [33] |
Miranda C D, Zemelman R. Antimicrobial multiresistance in bacteria isolated from freshwater Chilean salmon farms[J]. Science of the Total Environment, 2002, 293(1/2/3): 207. |
| [34] |
Broughton E I, Walker D G. Prevalence of antibiotic-resistant salmonella in fish in Guangdong, China[J]. Foodborne Pathogens and Disease, 2009, 6(4): 519. DOI:10.1089/fpd.2008.0196 |
| [35] |
Kobayashi T, Suehiro F, Tuyen B C, et al. Distribution and diversity of tetracycline resistance genes encoding ribosomal protection proteins in Mekong River sediments in Vietnam[J]. Fems Microbiology Ecology, 2007, 59(3): 729-737. DOI:10.1111/fem.2007.59.issue-3 |
| [36] |
Volkmann H, Schwartz T, Bischoff P, et al. Detection of clinically relevant antibiotic-resistance genes in municipal wastewater using realtime PCR(TaqMan)[J]. Journal of Microbiological Methods, 2004, 56(2): 277-286. DOI:10.1016/j.mimet.2003.10.014 |
| [37] |
Wollenberger L, Halling-Sorensen B, Kusk K O. Acute and chronic toxicity of veterinary antibiotics to Daphnia magna[J]. Chemosphere, 2000, 40(7): 723-730. DOI:10.1016/S0045-6535(99)00443-9 |
| [38] |
何良英. 典型蓄禽养殖环境中抗生素耐药基因的污染特征与扩散机理研究[D]. 广州: 中国科学院研究生院(广州地球化学研究所), 2016. HE Liang-ying. Pollution characteristics and diffusion mechanism of antibiotic resistance genes in typical poultry breeding environment[D]. Guangzhou: Guangzhou Institute of Geochemistry, Chinese Academy of Science, 2016. |
| [39] |
章琴琴. 北京温榆河流域抗生素污染分布特征及源解析研究[D]. 重庆大学, 2012. ZHANG Qin-qin. Determination and source apportionment of three classes of antibiotics in Beijing Wenyu Rivers[D]. Chongqing: Chongqin University, 2012. |
| [40] |
JL G, AL M. Classification and characterization of heterotrophic microbial communities on the basis of patterns of community-level solecarbon-source utilization[J]. Applied and Environmental Microbiology, 1991, 57(8): 23-51. |
| [41] |
李媛. 内蒙古河套盆地高砷含水系统的微生物特征及生物地球化学效应[D]. 北京: 中国地质大学(北京), 2016. LI Yuan. Characterization and biogeochemical functions of indigeneous microbes in the Hetao aquifersystems, Inner Mongolia[D]. Beijing: China University of Geosciences(Beijing), 2016. |
| [42] |
邓欢欢, 葛利云, 蒋愉林, 等. 水平潜流人工湿地微生物群落的碳源代谢特性和功能多样性研究[J]. 农业环境科学学报, 2007, 26(6): 2144-2149. DENG Huan-huan, GE Li-yun, JIANG Yu-lin, et al. Analysis of the carbon metabolic properties and functional diversity of the microbial community in horizontal sub-surface flow constructed wetlands[J]. Journal of Agro-Environment Science, 2007, 26(6): 2144-2149. |
| [43] |
曾冠军, 柳娴, 马满英. 水体中抗生素污染研究进展[J]. 安徽农业科学, 2017, 45(3): 72-74. ZENG Guan-jun, LIU Xian, MA Man-ying. Research progress of antibiotic pollution in water[J]. Journal of Anhui Agri Sci, 2017, 45(3): 72-74. |
| [44] |
李志斐, 谢骏, 郁二蒙, 等. 基于Biolog-ECO技术分析杂交鳢和大口黑鲈高产池塘水体微生物碳代谢特征[J]. 农业环境科学学报, 2014, 33(1): 185-192. LI Zhi-fei, XIE Jun, YU Er-meng, et al. Carbon metabolic diversity of microbial communities in intensive ponds for hybrid snakehead and large-mouth bass based on Biolog-ECO plates[J]. Journal of Agro-Environment Science, 2014, 33(1): 185-192. DOI:10.11654/jaes.2014.01.024 |
 2018, Vol. 37
2018, Vol. 37