微塑料(Microplastic)是一类新型的全球性环境污染物,近十几年来已引起了国内外环境学者的高度关注[1-2]。微塑料的概念最早由英国学者Thompson等[3]在2004年提出,目前学术界对微塑料定义中粒径大小仍存在一定争议,但通常将微塑料分类为粒径小于5 mm的塑料[3-5]。根据其来源分类,环境中微塑料又可分为初生微塑料和次生微塑料[6]。初生微塑料是现实中为多种用途而制造的塑料微粒,它们均可以被直接排放进入环境中,例如工业磨料或者化妆品中的塑料微珠[7-8]。而次生微塑料则是由大尺寸的塑料在环境中风化(如水解、紫外光降解、机械磨损、生物降解)降解形成,如洗涤过程中产生的二次塑料纤维[9-10]。环境中的微塑料粒径小、数量大、分布广且可作为污染物载体,易被生物所摄食并且能在食物链中积累,从而可能会对人体健康和生态系统产生潜在的不利影响[6, 8, 11]。
目前,微塑料的研究主要集中在海洋、河流和湖泊等水域环境[3, 9, 12-14],有关微塑料对陆地生态系统尤其是农业生态系统影响的研究相对缺乏[1]。据报道,由于含微塑料有机废物的循环利用及塑料薄膜的大量使用,农业土壤中积累的微塑料含量实际上比海洋更多[2, 15]。Ng等[16]利用现有的法规估算了欧洲、北美和澳大利亚农业生态系统中微塑料的最大负荷,发现仅来自有机废物循环利用的微塑料负荷就高达2.8~ 63 t·hm-2。Zhang等[17]调查我国西南地区土壤团聚体中微塑料分布发现土壤中微塑料的平均丰度为18 760个·kg-1,其中<1 mm的微塑料丰度最高;蔬菜土壤中的微塑料含量比缓冲区土壤高,可能是由于土壤添加剂的长期使用和污水灌溉所导致。已有研究表明,农业生态系统中的微塑料不仅能降低土壤微生物量、微生物活性和功能多样性,还会影响土壤中植物营养元素的循环过程[2, 18],从而可能会间接影响植物种子发芽及幼苗的生长。
值得关注的是,农作物作为农业生态系统中的重要组成部分,农作物的生长不可避免地会受到土壤环境中诸多因素(包括微塑料)的影响,而有关微塑料对农作物种子发芽和幼苗生长等的研究迄今尚未见报道。因此,本文采用粮食作物小麦(Triticum aestivum L.)作为供试植物,以3种农业环境中常见乙烯-乙酸乙烯酯共聚合物(EVA)、线性低密度聚乙烯(LLDPE)和聚甲基丙烯酸甲酯(PMMA)微塑料为研究对象,研究了这3种微塑料在不同浓度下对小麦种子发芽和幼苗生长的影响,旨在探讨微塑料对农作物的生态效应,为后期评估微塑料对作物的生态毒理效应提供理论依据。
1 材料与方法 1.1 供试材料供试小麦种子为西北农林科技大学选育的小偃22号(国审麦2003034,实测发芽率为97.5%)。供试试剂为:吐温20(Tween 20),过氧化氢(H2O2 30%)分析纯。微塑料粉末(产品均标注为50 nm)分别购自广州大韩油化(型号KP3755)和上海悦晨塑料有限公司。
1.1.1 微塑料表征微塑料的成分和形貌的鉴定采用傅立叶红外光谱仪(FT-IR,Thermo-Nicolet iS50)和场发射扫描电镜(SEM,JSM-7800)。傅立叶红外光谱仪:将微塑料粉末与提前烘干的溴化钾混合后充分研磨,然后装入样品池,对其在650~4000 cm-1范围内进行傅立叶红外光谱测定并与数据库(HR Nicolet Sample Library)信息进行样品分析比对。场发射扫描电镜:取少量微塑料粉末样品放在粘上双面胶带载物盘圆心位置,然后用橡胶球朝载物盘径外方向轻吹使其均匀分布,再在胶带边缘涂上导电银浆以连接样品和载物盘,待其干燥后直接进行喷金处理,在不同分辨率下拍摄清晰的扫描电镜照片。
1.1.2 微塑料浓度设置和悬浮液的制备参考Zhu等[19]和Murphy等[20]实验中微塑料浓度设置,本实验选0、0.001%、0.01%、0.05%和0.1%(m/m)5个浓度水平。具体步骤为称取0、2、20、100 mg和200 mg微塑料粉末加入200 mL高纯水中,再加入0.1%吐温20(Tween 20),经超声波粉碎机(新芝JY98-ⅢN)在水浴条件下超声30 min(400 W、20.5 kHz)使其均匀分散形成0、10、100、500、1000 mg·L-1的微塑料悬浮液,并测定悬浮液中微塑料的粒径分布及Zeta电位(Zetasizer Nano ZS 90)。
1.2 种子发芽实验在玻璃培养皿中垫放两张定性滤纸,并用去离子水润湿,赶走滤纸下方遗留的气泡。将籽粒均匀饱满的小麦种子用3%(V/V)H2O2消毒30 min,再用去离子水反复冲洗后,整齐摆放在提前准备好的培养皿中,每皿10粒并设4个重复,然后加入10 mL浓度为0、10、100、500、1000 mg·L-1的微塑料悬浮液。对照组用只含0.1% Tween 20去离子水培养。将处理好的培养皿置于恒温培养箱(SPX-330I-C型)中在黑暗条件下进行发芽实验,温度控制在25±1 ℃,培养7 d。培养过程中每天记录小麦种子萌发情况,从第3 d开始打开培养皿并补充1~2 mL去离子水以补偿蒸发水分。
1.3 测定方法待第7 d收获后,用游标卡尺测定芽长、根长,并将小麦幼苗置于103 ℃烘箱中烘干24 h至恒质量,用天平称量记录。发芽率、发芽势、发芽指数、活力指数、平均发芽时间和抑制率等指标的计算公式如下:

|
式中:Gt为t天内的发芽数;Dt为对应的发芽天数。
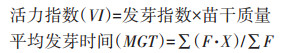
|
式中:F是种子在第X天的新发芽数;是发芽天数。

|
实验结果均以平均值±标准偏差(Mean±SD)表示,采用Excel 2003对数据进行处理,采用SPSS 17.0软件对数据进行统计分析,并由Origin 2017和ImageJ软件进行绘图和图片信息处理。
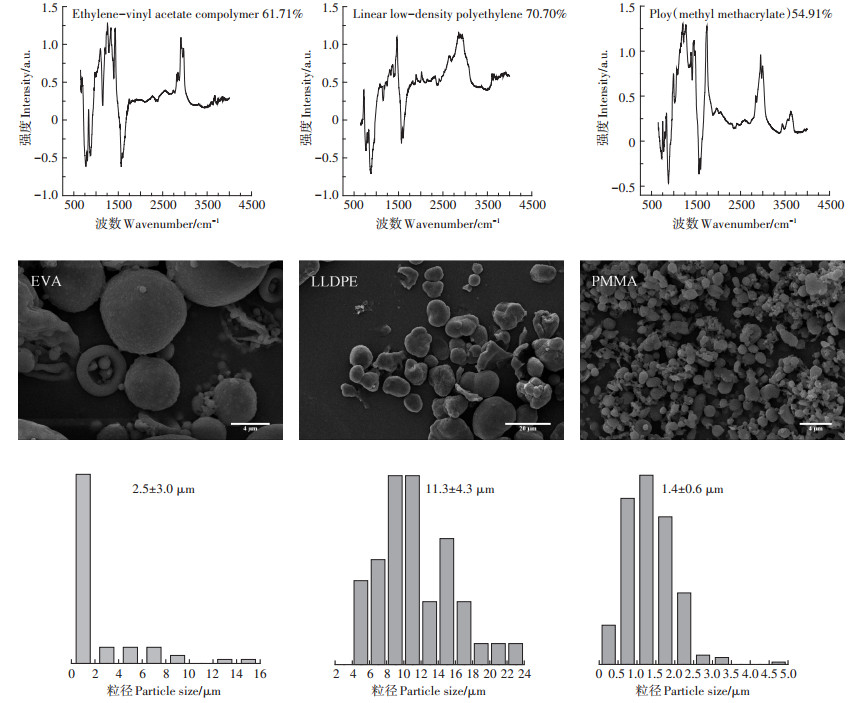
2 结果与分析 2.1 微塑料的组成与形貌本实验所用的微塑料的成分与形貌鉴定结果见图 1。经过傅立叶红外光谱分析(图 1上),3种微塑料对比度分别是EVA 61.71%、LLDPE 70.70%和PMMA 54.91%。塑料中的添加剂或者加入其他塑料来改性以达到实际需要性能都是导致其对比度下降的原因。其中,EVA膜被广泛应用于农业大棚膜,为具有良好的透明性和保温耐寒防老化性能,常在EVA膜中添加流滴剂、消雾剂和耐老化剂等添加剂。LLDPE是聚乙烯(PE)中的一种,具有防潮性、透湿性小,常作为农业地面覆盖薄膜以提高土壤温度,保持土壤水分,促进植物生长。PMMA透光率高、隔热性好、耐候性好,利于作物的发育,被广泛用作农林温室材料。
|
图 1 微塑料的红外吸收光谱图(上)、扫描电镜图(中)和粒径分布图(下) Figure 1 Infrared absorption spectrum (top), scanning electron micrograph (middle) and particle size distribution of three microplastics (bottom) |
从扫描电镜图可以看出,3种微塑料均为不规则的球形颗粒(图 1中)。与EVA和PMMA相比,LLDPE中含有少量的不规则的块状或者杆状的微塑料碎片。通过对3种微塑料粒径分布测定发现,LLDPE和PMMA粒径分布大致符合正态分布,其平均粒径分别为11.3 μm和1.4 μm;而EVA粒径分布集中在1.5 μm内(占74.6%),其表观平均粒径为2.5 μm。
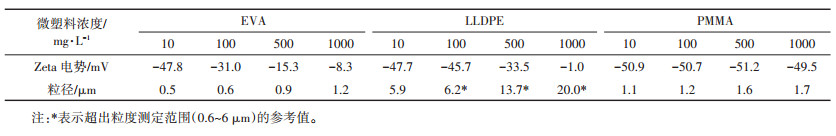
2.2 悬浮液中微塑料的粒径及Zeta电位微塑料在悬浮液中的粒径分布及Zeta电位测定结果如表 1所示。微塑料在悬浮液中带负电荷。当EVA浓度高于100 mg·L-1和LLDPE浓度为1000 mg·L-1时,Zeta电位绝对值均低于30 mV,表明这两种悬浮液随浓度的升高而稳定性降低,在高浓度容易发生颗粒的团聚。值得注意的是,PMMA的Zeta电位绝对值一直高于40 mV,反映此悬浮液具有良好的稳定性。粒径测定结果表明,微塑料在溶液中的粒径均随着浓度升高而增加,均发生一定的团聚。另外,溶液中微塑料的粒径大小顺序为:d(EVA)<d(PMMA)<d(LLPDE)。
|
|
表 1 悬浮液中微塑料的粒度分布和Zeta电位 Table 1 Particle size distribution and Zeta potential of microplastics in suspension |
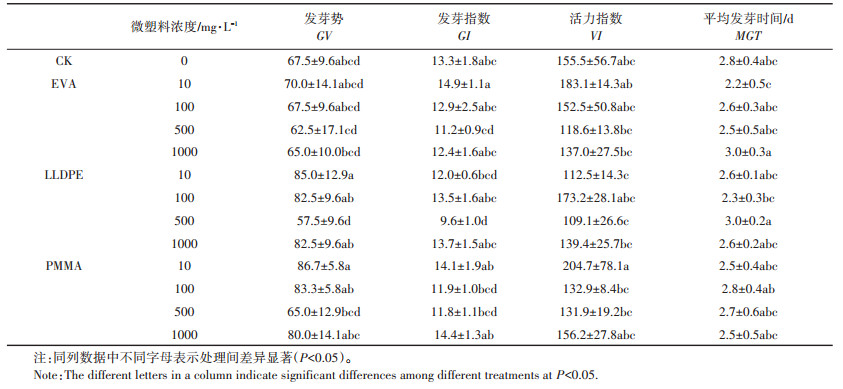
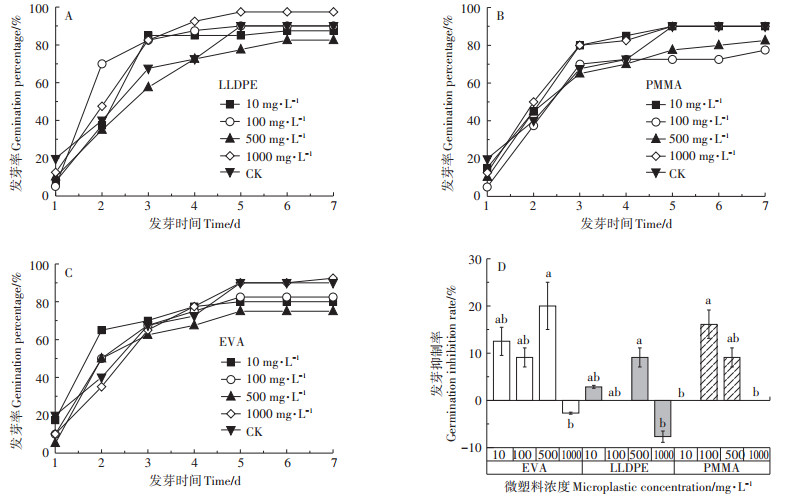
发芽率是衡量种子在微塑料暴露下萌发能力强弱的重要指标。小麦种子在微塑料暴露下的发芽率为69%~97.5%(图 2),表明在微塑料暴露胁迫下,大部分小麦种子能够萌发。值得注意的是,微塑料在低中浓度(<500 mg·L-1)时对小麦的发芽有抑制,抑制率在2.86%~20%;但在高浓度(1000 mg·L-1)时却表现出一定的促进作用(图 2D),表现出一定的“高促低抑”现象。其中,LLDPE和EVA浓度为500 mg·L-1时,小麦的发芽抑制作用最强;而PMMA在浓度为100 mg·L-1时,小麦发芽率最低(76.7%)(图 2),抑制率达到16.1%。
|
图中不同小写字母代表处理间的差异显著(P<0.05) The different lowercase letters indicate significant differences among different treatments (P < 0.05) 图 2 在微塑料暴露下小麦种子发芽率(A、B、C)和抑制率(D)随时间的变化 Figure 2 Changes in germination percentage (A, B, C) and germination inhibition rate (D) of wheat seed with time under microplastics exposure |
微塑料处理对小麦种子的发芽势、发芽指数和活力指数基本表现为“低促中抑高恢复”的规律,即低浓度(10 mg·L-1和100 mg·L-1)促进,中浓度(500 mg·L-1)抑制,高浓度(1000 mg·L-1)抑制有所恢复,与对照组(CK)相比差异不显著(P>0.05)(表 2)。具体表现为:在微塑料的暴露浓度为10 mg·L-1时,发芽势和发芽指数均为最高,而在暴露浓度为500 mg·L-1时发芽势和发芽指数最低,在高浓度(1000 mg·L-1)微塑料处理时,种子发芽势相对于中浓度(500 mg·L-1)有所升高,表现出一定的恢复现象。对于活力指数,3种微塑料的影响各不相同(表 2)。与对照组(CK)相比,EVA和PMMA对小麦种子活力指数无明显变化。但与EVA相比,PMMA对活力指数的促进更加显著;而LLDPE在10 mg·L-1和100 mg·L-1均对小麦种子活力指数有所抑制。综合分析,3种微塑料对小麦种子活力指数抑制程度为:LLDPE>EVA>PMMA。
|
|
表 2 微塑料对小麦种子生长特征的影响 Table 2 Influence of microplastics on growth features of wheat seedling |
种子平均发芽时间是发芽速度的量度,其数值越低表明发芽越快。表 2显示微塑料的种类和浓度对小麦种子平均发芽时间的影响存在差异。EVA对小麦种子平均发芽时间的影响与其浓度密切相关。当浓度为10 mg·L-1时,EVA能明显缩短种子平均发芽时间(P<0.05),但在1000 mg·L-1时能延长种子平均发芽时间,且此两个浓度达到极显著差异(P<0.01)。与对照组相比,PMMA对小麦种子平均发芽时间无明显影响,而LLDPE在100 mg·L-1时显著缩短小麦种子平均发芽时间(P<0.05)。
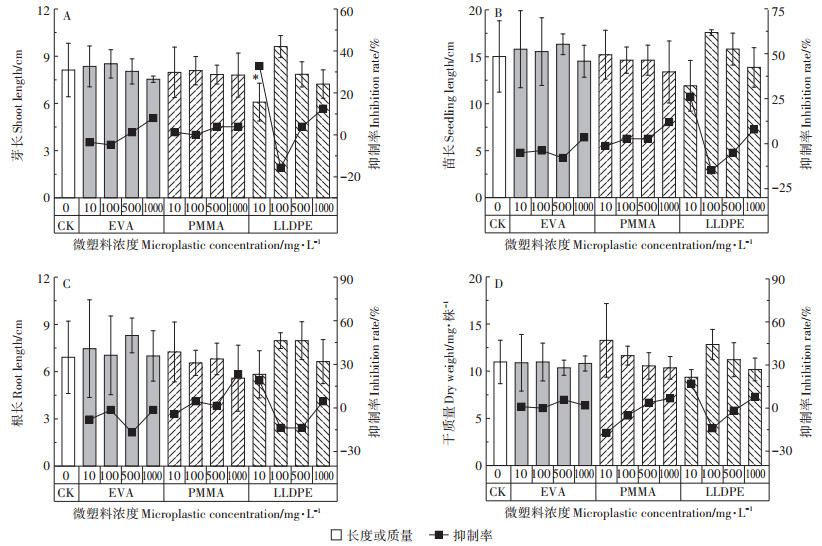
2.5 微塑料对小麦芽长、根长和幼苗生物量的影响小麦幼苗的芽长和苗长均呈现随EVA和LLDPE浓度先升高后下降的趋势(图 3和图 4)。在EVA和PMMA暴露下,小麦芽长和苗长与对照组相比并没有明显变化;而在LLDPE暴露时,10 mg·L-1处理下的芽长与对照组达到统计学差异(P<0.05),说明低浓度的LLDPE暴露能抑制小麦幼苗地上部的生长(图 3和图 4)。而在LLDPE 100 mg·L-1时,芽长和苗长虽然比对照组分别增加了18.5%和17.3%,但统计学差异并不明显。与EVA和LLDPE不同的是,PMMA处理后的小麦苗长与浓度呈显著负相关(r=-0.513,P<0.05),即小麦苗长与PMMA浓度梯度相关。

|
图 3 微塑料对小麦幼苗生长的影响 Figure 3 Effect of microplastics on growth of wheat seedlings |
|
*表示用Duncan检验分析不同处理间的差异显著(P<0.05) 图 4 微塑料对小麦芽长、根长和生物量的影响 Figure 4 Effect of microplastics on coleoptile length, root length and biomass of wheat seedlings |
微塑料暴露下的小麦幼苗根长均与对照组无显著差异(P>0.05)(图 4C),表明微塑料对小麦幼苗的根伸长影响较小。总的来看,微塑料浓度为500 mg·L-1时对小麦幼苗根伸长具有一定的促进作用,而浓度为1000 mg·L-1时则表现出抑制作用。其中,PMMA对小麦幼苗根长的抑制率比EVA和LLDPE更高(1.47%~23.21%),LLDPE仅在浓度为10 mg·L-1时对小麦根长表现出抑制作用。与微塑料对小麦根长的影响类似,相较于对照组,小麦生物量(干质量)在微塑料暴露下的变化也不显著(P>0.05)(图 4D),表明微塑料对小麦干质量影响不大。但值得注意的是,低浓度(10 mg·L-1)PMMA暴露下,小麦幼苗的干质量最大,其干质量随着PMMA浓度的增加而降低;EVA和LLDPE的浓度为100 mg·L-1时,小麦幼苗的干质量最大。
3 讨论目前有关微塑料的研究主要集中在海洋、河口和湖泊等水域生态系统中的污染现状[21-25],以及微塑料对藻类[26]、贻贝[27]、鱼类[28]和虾类[29]等水生生物的毒理学效应及其食物链传递[30],而有关微塑料对陆生植物毒性的研究未见报道,因此无法与本实验的研究结果进行对比。
农业生态系统中微塑料的来源已有研究,但尚缺乏更为详细和量化的数据。微塑料一旦进入农业生态系统[31],会持续存在、积累,并最终达到能够影响农业生态系统生物多样性和功能的水平,所以对应用于农业领域中的塑料进行系统的检测和量化显得极为重要[2, 32]。但目前有关微塑料检测和鉴定的方法仍需要进一步优化。目前对微塑料的鉴定分析普遍采用光谱分析[傅立叶(变换)红外光谱、拉曼光谱等][33],本实验所用的微塑料与数据库标准谱线对比度不高(54.91%~70.70%),则反映了应用于农业中微塑料的复杂性。实际应用的塑料绝大多数为追求优良性能而进行过改良,除了上述的添加剂(流滴剂、消雾剂和耐老化剂等)外,塑料之间的掺杂也是重要的因素。此外,环境介质样品中微塑料的分类和分离主要还是依靠人眼和显微镜的辅助,而生物样品中的微塑料的识别和鉴定具有一定的挑战性,特别是粒径小于1 mm的微塑料,因此仍需要微塑料分离检测技术的创新[34]。
目前有关农业生态系统中微塑料与作物相互作用的研究极为缺乏,微塑料对植物的作用机理并不清楚[2, 16]。本研究发现三种微塑料在中低浓度下对小麦种子发芽有抑制作用,但在高浓度时对小麦发芽具有一定的恢复或者促进作用,其原因可能是小麦种子对微塑料的吸附和吸收取决于微塑料本身所带的电荷和粒径[15, 35]。低中浓度下微塑料的粒径可能对小麦的影响占主导地位,虽然其Zeta电位更低(表 1),但更小的粒径可能更加利于小麦对微塑料的吸附和吸收。相反地,高浓度的微塑料对小麦发芽率的恢复或者促进是由微塑料的团聚而引起的[15, 29],团聚后的微塑料粒径成为吸附的重要阻碍因素,降低了小麦对微塑料的可接触性,从而减轻了其发芽胁迫。而相比对照组而言,3种微塑料对小麦苗长、根长和生物量并无显著影响,表明微塑料对小麦的生长发育毒性不大。而仅LLDPE在10 mg·L-1时对小麦活力指数和芽长有抑制,可能是在低浓度下,小麦芽长对粒径最小的LLDPE更加敏感。类似地,Kalčíková等[36]发现化妆品中的微塑料对浮萍的平均叶片生长速率和叶绿素含量均没有影响,但只有锐状微塑料能通过机械损伤显著降低其根长和根细胞活力。
微塑料中的增塑剂以及微塑料对环境污染物的吸附作用也是农业生态系统需要重点关注的问题。塑料合成中添加的增塑剂也会随着塑料的自然风化而释放到环境中,对农业生态系统和人体健康构成影响[15, 37-40]。其中研究和报道最多的增塑剂是邻苯二甲酸酯类(PAEs),其属于一种塑料软化剂,具有致癌性,能干扰内分泌系统。研究表明,PVC农膜中的邻苯二甲酸二(2-乙基)己酯(DEHP)能在弱酸性条件下大量析出[41],对植物产生潜在的毒理学效应。刘晓丹等[42]发现塑料中的增塑剂能够抑制小麦种子的萌发,甚至在高浓度下能引发小麦种子细胞的程序性死亡。此外,环境中风化成的微塑料表面粗糙,且具有较大的比表面积、带负电荷,能吸附重金属和有机污染物[43-45],从而成为污染物的环境载体,加剧微塑料对植物的毒害效应,因此农业系统中的微塑料与重金属或农药的联合效应还有待进一步研究。
综上所述,今后关于微塑料与农作物间的交互作用研究亟需深入开展:(1)微塑料在农田土壤中的污染现状及其来源;(2)适用于环境生物样品中微塑料的分离和检测技术;(3)微塑料与重金属、有机污染吸附后对植物的毒性效应。
4 结论(1)在微塑料暴露下,小麦种子的发芽率为69%~ 97.5%。微塑料对小麦种子发芽表现出一定的抑制作用,抑制率在2.86%~20%。
(2)微塑料处理对小麦种子的发芽势、发芽指数和活力指数的影响表现为低浓度(10 mg·L-1和100 mg·L-1)促进,中浓度(500 mg·L-1)抑制,高浓度(1000 mg·L-1)抑制作用有所降低,与对照组相比差异不显著(P>0.05)。
(3)与对照组相比,微塑料对小麦苗长、根长和干质量没有显著影响(P>0.05),仅在LLDPE为10 mg·L-1处理时对小麦芽长产生明显抑制作用。
| [1] |
任欣伟, 唐景春, 于宸, 等. 土壤微塑料污染及生态效应研究进展[J]. 农业环境科学学报, 2018, 37(6): 1045-1058. REN Xin-wei, TANG Jing -chun, YU Chen, et al. Advances in research on the ecological effects of microplastic pollution on soil ecosystems[J]. Journal of Agro-Environment Science, 2018, 37(6): 1045-1058. |
| [2] |
Machado A A, Kloas W, Zarfl C, et al. Microplastics as an emerging threat to terrestrial ecosystems[J]. Global Change Biology, 2018, 24(4): 1405-1416. DOI:10.1111/gcb.14020 |
| [3] |
Thompson R C, Olsen Y, Mitchell R P, et al. Lost at sea:Where is all the plastic?[J]. Science, 2004, 304(5672): 838. DOI:10.1126/science.1094559 |
| [4] |
Law K L, Thompson R C. Oceans. Microplastics in the seas[J]. Science, 2014, 345(6193): 144-145. DOI:10.1126/science.1254065 |
| [5] |
Isobe A, Uchiyama-Matsumoto K, Uchida K, et al. Microplastics in the Southern Ocean[J]. Marine Pollution Bulletin, 2017, 114(1): 623-626. DOI:10.1016/j.marpolbul.2016.09.037 |
| [6] |
Cole M, Lindeque P, Halsband C, et al. Microplastics as contaminants in the marine environment:A review[J]. Marine Pollution Bulletin, 2011, 62(12): 2588-2597. DOI:10.1016/j.marpolbul.2011.09.025 |
| [7] |
Fendall L S, Sewell M A. Contributing to marine pollution by washing your face:Microplastics in facial cleansers[J]. Marine Pollution Bulletin, 2009, 58(8): 1225-1228. DOI:10.1016/j.marpolbul.2009.04.025 |
| [8] |
Gregory M R. Plastic 'scrubbers' in hand cleansers:A further (and minor) source for marine pollution identified[J]. Marine Pollution Bulletin, 1996, 32(12): 867-871. DOI:10.1016/S0025-326X(96)00047-1 |
| [9] |
Andrady A L. Microplastics in the marine environment[J]. Marine Pollution Bulletin, 2011, 62(8): 1596-1605. DOI:10.1016/j.marpolbul.2011.05.030 |
| [10] |
Barnes D K A, Galgani F, Thompson R C, et al. Accumulation and fragmentation of plastic debris in global environments[J]. Philosophical Transactions Biological Sciences, 2009, 364(1526): 1985-1998. DOI:10.1098/rstb.2008.0205 |
| [11] |
Prata J C. Airborne microplastics:Consequences to human health?[J]. Environmental Pollution, 2018, 234: 115-126. DOI:10.1016/j.envpol.2017.11.043 |
| [12] |
Peng G, Xu P, Zhu B, et al. Microplastics in freshwater river sediments in Shanghai, China:A case study of risk assessment in megacities[J]. Environmental Pollution, 2018, 234: 448-456. DOI:10.1016/j.envpol.2017.11.034 |
| [13] |
Zhang W, Zhang S, Wang J, et al. Microplastic pollution in the surface waters of the Bohai Sea, China[J]. Environmental Pollution, 2017, 231: 541-548. DOI:10.1016/j.envpol.2017.08.058 |
| [14] |
Wang W, Ndungu A W, Li Z, et al. Microplastics pollution in inland freshwaters of China:A case study in urban surface waters of Wuhan, China[J]. Science of the Total Environment, 2017, 575: 1369-1374. DOI:10.1016/j.scitotenv.2016.09.213 |
| [15] |
Alimi O S, Farner Budarz J, Hernandez L M, et al. Microplastics and nanoplastics in aquatic environments:Aggregation, deposition, and enhanced contaminant transport[J]. Environmental Science & Technology, 2018, 52(4): 1704-1724. |
| [16] |
Ng E-L, Huerta Lwanga E, Eldridge S M, et al. An overview of microplastic and nanoplastic pollution in agroecosystems[J]. Science of the Total Environment, 2018, 627: 1377-1388. DOI:10.1016/j.scitotenv.2018.01.341 |
| [17] |
Zhang G S, Liu Y F. The distribution of microplastics in soil aggregate fractions in southwestern China[J]. Science of the Total Environment, 2018, 642: 12-20. DOI:10.1016/j.scitotenv.2018.06.004 |
| [18] |
Horton A A, Walton A, Spurgeon D J, et al. Microplastics in freshwater and terrestrial environments:Evaluating the current understanding to identify the knowledge gaps and future research priorities[J]. Science of the Total Environment, 2017, 586: 127-141. DOI:10.1016/j.scitotenv.2017.01.190 |
| [19] |
Zhu B K, Fang Y M, Zhu D, et al. Exposure to nanoplastics disturbs the gut microbiome in the soil oligochaete Enchytraeus crypticus[J]. Environmental Pollution, 2018, 239: 408-415. DOI:10.1016/j.envpol.2018.04.017 |
| [20] |
Murphy F, Quinn B. The effects of microplastic on freshwater Hydra attenuata feeding, morphology & reproduction[J]. Environmental Pollution, 2018, 234: 487-494. DOI:10.1016/j.envpol.2017.11.029 |
| [21] |
Zhang K, Shi H, Peng J, et al. Microplastic pollution in China's inland water systems:A review of findings, methods, characteristics, effects, and management[J]. Science of the Total Environment, 2018, 630: 1641-1653. DOI:10.1016/j.scitotenv.2018.02.300 |
| [22] |
Tang G, Liu M, Zhou Q, et al. Microplastics and polycyclic aromatic hydrocarbons (PAHs) in Xiamen coastal areas:Implications for anthropogenic impacts[J]. Science of the Total Environment, 2018, 634: 811-820. DOI:10.1016/j.scitotenv.2018.03.336 |
| [23] |
Yu Y, Zhou D, Li Z, et al. Advancement and challenges of microplastic pollution in the aquatic environment:A review[J]. Water, Air, & Soil Pollution, 2018, 229(5): 140. |
| [24] |
Barrows A P W, Cathey S E, Petersen C W. Marine environment microfiber contamination:Global patterns and the diversity of microparticle origins[J]. Environmental Pollution, 2018, 237: 275-284. DOI:10.1016/j.envpol.2018.02.062 |
| [25] |
Li H X, Ma L S, Lin L, et al. Microplastics in oysters Saccostrea cucullata along the Pearl River Estuary, China[J]. Environmental Pollution, 2018, 236: 619-625. DOI:10.1016/j.envpol.2018.01.083 |
| [26] |
Canniff P M, Hoang T C. Microplastic ingestion by Daphnia magna and its enhancement on algal growth[J]. Science of the Total Environment, 2018, 633: 500-507. DOI:10.1016/j.scitotenv.2018.03.176 |
| [27] |
Santana M F M, Moreira F T, Pereira C D S, et al. Continuous exposure to microplastics does not cause physiological effects in the cultivated mussel Perna perna[J]. Archives of Environmental Contamination and Toxicology, 2018, 74(4): 594-604. DOI:10.1007/s00244-018-0504-3 |
| [28] |
Ferreira G V B, Barletta M, Lima A R A, et al. High intake rates of microplastics in a Western Atlantic predatory fish, and insights of a direct fishery effect[J]. Environmental Pollution, 2018, 236: 706-717. DOI:10.1016/j.envpol.2018.01.095 |
| [29] |
Weber A, Scherer C, Brennholt N, et al. PET microplastics do not negatively affect the survival, development, metabolism and feeding activity of the freshwater invertebrate Gammarus pulex[J]. Environmental Pollution, 2018, 234: 181-189. DOI:10.1016/j.envpol.2017.11.014 |
| [30] |
Anbumani S, Kakkar P. Ecotoxicological effects of microplastics on biota:A review[J]. Environmental Science and Pollution Research, 2018, 25(15): 14373-14396. DOI:10.1007/s11356-018-1999-x |
| [31] |
Weithmann N, Möller J N, Löder M G J, et al. Organic fertilizer as a vehicle for the entry of microplastic into the environment[J]. Science Advances, 2018, 4(4): 1-7. |
| [32] |
Rillig M C. Microplastic in terrestrial ecosystems and the soil?[J]. Environmental Science & Technology, 2012, 46(12): 6453-6454. |
| [33] |
Schymanski D, Goldbeck C, Humpf H U, et al. Analysis of microplastics in water by micro-Raman spectroscopy:Release of plastic particles from different packaging into mineral water[J]. Water Research, 2018, 129: 154-162. DOI:10.1016/j.watres.2017.11.011 |
| [34] |
Hidalgo-Ruz V, Gutow L, Thompson R C, et al. Microplastics in the marine environment:A review of the methods used for identification and quantification[J]. Environmental Science & Technology, 2012, 46(6): 3060-3075. |
| [35] |
Ziajahromi S, Kumar A, Neale P A, et al. Environmentally relevant concentrations of polyethylene microplastics negatively impact the survival, growth and emergence of sediment-dwelling invertebrates[J]. Environmental Pollution, 2018, 236: 425-431. DOI:10.1016/j.envpol.2018.01.094 |
| [36] |
Kalčíková G, Žgajnar Gotvajn A, Kladnik A, et al. Impact of polyethylene microbeads on the floating freshwater plant duckweed Lemna minor[J]. Environmental Pollution, 2017, 230: 1108-1115. DOI:10.1016/j.envpol.2017.07.050 |
| [37] |
Kedzierski M, D'Almeida M, Magueresse A, et al. Threat of plastic ageing in marine environment. Adsorption/desorption of micropollutants[J]. Marine Pollution Bulletin, 2018, 127: 684-694. DOI:10.1016/j.marpolbul.2017.12.059 |
| [38] |
Cai L, Hu L, Shi H, et al. Effects of inorganic ions and natural organic matter on the aggregation of nanoplastics[J]. Chemosphere, 2018, 197: 142-151. DOI:10.1016/j.chemosphere.2018.01.052 |
| [39] |
León V M, García I, González E, et al. Potential transfer of organic pollutants from littoral plastics debris to the marine environment[J]. Environmental Pollution, 2018, 236: 442-453. DOI:10.1016/j.envpol.2018.01.114 |
| [40] |
Wang J, Luo Y, Teng Y, et al. Soil contamination by phthalate esters in Chinese intensive vegetable production systems with different modes of use of plastic film[J]. Environmental Pollution, 2013, 180: 265-273. DOI:10.1016/j.envpol.2013.05.036 |
| [41] |
徐刚, 李发生, 汪群慧. 模拟酸雨对聚氯乙烯农膜中增塑剂析出的影响[J]. 农业环境科学学报, 2006, 25(6): 1625-1630. XU Gang, LI Fa-sheng, WANG Qun-hui. Effect of simulated acid on release of plasticizer in PVC film[J]. Journal of Agro-Environment Science, 2006, 25(6): 1625-1630. DOI:10.3321/j.issn:1672-2043.2006.06.045 |
| [42] |
刘晓丹, 龚一富, 李军, 等. 增塑剂对小麦种子萌发过程中细胞程序性死亡指标的影响[J]. 麦类作物学报, 2013, 2: 350-356. LIU Xiao-dan, GONG Yi-fu, LI Jun, et al. Mechanism of programmed cell death triggerd by plasticizers in the germination process of wheat seeds[J]. Journal of Triticeae Crops, 2013, 2: 350-356. |
| [43] |
Pascall M A, Zabik M E, Zabik M J, et al. Uptake of polychlorinated biphenyls (PCBs) from an aqueous medium by polyethylene, polyvinyl chloride, and polystyrene films[J]. Journal of Agricultural and Food Chemistry, 2005, 53(1): 164-169. DOI:10.1021/jf048978t |
| [44] |
Massos A, Turner A. Cadmium, lead and bromine in beached microplastics[J]. Environmental Pollution, 2017, 227: 139-145. DOI:10.1016/j.envpol.2017.04.034 |
| [45] |
Li J, Zhang K, Zhang H. Adsorption of antibiotics on microplastics[J]. Environmental Pollution, 2018, 237: 460-467. DOI:10.1016/j.envpol.2018.02.050 |
 2019, Vol. 38
2019, Vol. 38