2. 农业农村部环境保护科研监测所农田有机污染生物消减创新团队, 农业农村部产地环境污染防控重点实验室/天津市农业环境与农产品安全重点实验室, 天津 300191;
3. 华南农业大学资源环境学院, 广州 510642
2. Innovation Team of Soil Organic Contaminant Control, Agro-Environmental Protection Institute, Ministry of Agriculture and Rural Affairs, Key Laboratory of Original AgroEnvironmental Pollution Prevention and Control, Ministry of Agriculture and Rural Affairs/Tianjin Key Laboratory of Original AgroEnvironment and Agro-Product Safety, Tianjin 300191, China;
3. College of Natural Resources and Environment, South China Agricultural University, Guangzhou 510642, China
抗生素在畜禽养殖业发展中起重要作用,广泛用于预防畜禽疾病、促进动物生长发育和提高畜禽产品质量等[1]。然而,进入到动物体内的抗生素只有少部分被吸收利用,大约90% 的抗生素以母体或代谢物的形式通过粪便和尿液进入到畜禽粪肥和自然环境中[2]。研究报道,中国每年大约有5.38万t的抗生素随动物粪肥等进入到水体和土壤环境中[3]。金霉素作为当前用量最大的四环素类抗生素之一,近年来在土壤中被广泛检出,研究表明施用畜禽粪肥的农用土壤中金霉素浓度高达33.10~5 325 μg·kg-1[4],其中部分地区检出浓度严重超出欧盟委员会设立的风险应激阈值(100 μg·kg-1),对生态环境造成潜在风险[5]。土壤中金霉素的半衰期为6.2~28.8 d不等,有的甚至长达157.5 d,这表明其可能会长期残留在土壤中[6]。残留的抗生素一方面直接抑制土壤微生物活性,导致一些微生物种群及其生态功能的消失;另一方面会诱导土壤中抗生素抗性细菌增殖扩散,从而以多种方式破坏土壤微生物群落结构和功能[7]。此外,进入土壤中的金霉素能诱导土壤中微生物扩增抗生素抗性基因,也可以在农产品内富集,并通过食物链进入人体,对人类生命健康造成潜在的不良影响[8-9]。因此,开展关于土壤中抗生素和抗性基因的去除、抗生素污染土壤微生物群落结构与功能的恢复和提升的研究十分必要。
蚯蚓作为土壤中生物量最大的无脊椎生物,其对土壤肥力和结构有重要的影响作用,可通过掘穴、蠕动、进食和排便等活动,改变土壤理化性质和微生物群落,为土壤中污染物的去除提供有利的环境条件[10]。大量研究表明,蚯蚓可以加速土壤中许多有机污染物的降解,如农药、多环芳烃和多氯联苯等[11-13]。目前,关于蚯蚓对抗生素污染土壤影响的研究主要集中在对其总量的去除和抗生素抗性基因丰度削减方面[14-15],而在此过程中,蚯蚓对土壤酶活性和微生物群落的影响研究十分稀少。土壤酶作为土壤的重要组分,参与了土壤中污染物的降解、有机质的矿化和养分元素循环等生物化学过程;同时,微生物是土壤酶的重要来源之一,土壤酶活性的变化一定程度上反映土壤微生物群落结构的变化[6]。仅有的一篇蚯蚓对抗生素污染土壤中酶活性和微生物群落影响的研究表明,蚯蚓是通过影响土壤pH和胡敏酸含量等促进四环素污染土壤酶活性的提升[16],然而针对蚯蚓对抗生素污染土壤微生物群落的影响无深入探究。此外,有研究表明,相对于四环素,土壤中金霉素的残留及生态风险更高[4]。因此,探讨蚯蚓对金霉素污染土壤酶活性以及微生物群落的影响具有重要意义。本研究选取了威廉环毛蚓和赤子爱胜蚓两种不同生态型的蚯蚓为实验生物,通过土壤酶试剂盒(微板法)和高通量测序等方法分析土壤酶活性和微生物多样性,揭示不同类型蚯蚓对金霉素污染土壤酶活性、微生物群落结构以及物种组成等方面的影响,以期为利用蚯蚓修复和改善抗生素污染土壤质量提供一定的理论支持。
1 材料与方法 1.1 实验材料实验土壤为潮土,采自天津市东丽区玉米田。土样在实验室自然风干后,过2 mm筛备用。土壤中未检测到金霉素。供试土壤基本理化性质:土壤pH为8.19,有机质含量为36.0 g·kg-1,碱解氮含量为73.6 mg·kg-1,速效磷含量为28.7 mg·kg-1,速效钾含量为148.0 mg·kg-1。供试蚯蚓威廉环毛蚓(内层蚓)和赤子爱胜蚓(表层蚓)均购买于蚯蚓养殖厂(江苏省句容市)。实验前两种蚯蚓在供试土壤中驯化30 d,实验时挑选健康、带有环带的蚯蚓,用无菌水清洗表面后放置于装有湿润滤纸的干净烧杯中24 h,使其排出体内粪便。
金霉素(纯度≥93%)购自Dr. Ehrenstorfer公司(德国),甲醇(色谱纯)购自Fisher公司(美国),其他试剂均为分析纯。
1.2 实验设计实验设置7个处理组:CK,空白土壤;L,土壤+ 0.50 mg·kg-1金霉素;ML,土壤+0.50 mg·kg-1金霉素+ 威廉环毛蚓;EL,土壤+0.50 mg·kg-1金霉素+赤子爱胜蚓;H,土壤+15 mg·kg-1金霉素;MH,土壤+15 mg·kg-1金霉素+威廉环毛蚓;EH,土壤+15 mg·kg-1金霉素+赤子爱胜蚓;每个处理3个平行。将5条威廉环毛蚓(总质量约10 g)和35条赤子爱胜蚓(总质量约10 g)放入到对应装有1 kg土壤的烧杯中,添加蚯蚓的数量参照Pu等[14]的研究。金霉素储备液的配制方法如下:取250 mg金霉素,溶解于甲醇中,并用甲醇定容至25 mL,配制成10 000 mg·L-1的金霉素溶液A;再吸取0.5 mL溶液A,用甲醇稀释至5 mL,配制成1 000 mg· L-1的金霉素溶液B。吸取1.5 mL溶液A和0.5 mL溶液B分别加入到对应的处理组土壤中,待溶剂充分挥发后,混合均匀。用去离子水调节土壤含水量为25%,烧杯口用带小孔的锡纸封住,室温环境下培养28 d。实验过程中每隔2 d加入去离子水保持土壤含水量稳定。在第1、7、14、28 d收集土壤样品,样品冻干研磨过筛后用于土壤脱氢酶、过氧化氢酶、蔗糖酶、脲酶和碱性磷酸酶的测定,同时测定第28 d土壤样品中的金霉素残留量和土壤理化指标(pH和有机质)。
1.3 土壤酶活性测定脱氢酶活性的测定:采用四氮唑盐还原法。用四氮唑盐作为脱氢酶的氢受体,反应生成黄色甲臜物质,该物质易溶于水,于460 nm处测定其吸光值,可得出土壤脱氢酶的活性,单位为μg·d-1·g-1。
过氧化氢酶活性的测定:土壤中过氧化氢酶可以催化一部分过氧化氢产生水和氧气,而另一部分过氧化氢与一种高灵敏显色探针反应生成紫色物质,其在510 nm处有最大吸收峰。通过计算过氧化氢的减少量得出土壤中过氧化氢酶的活性,单位为μmol·h-1·g-1。
蔗糖酶活性的测定:采用3,5-二硝基水杨酸(DNS)比色法。土壤蔗糖酶催化蔗糖降解生成还原糖,然后与DNS生成有色氨基化合物,该物质在540 nm处有特征光吸收。在一定范围内540 nm光吸收增加速率与土壤蔗糖酶活性成正比,进而得到土壤蔗糖酶活性,单位为mg·d-1·g-1。
脲酶活性的测定:采用靛酚蓝比色法。脲酶水解产物为铵态氮,其可在强碱介质中与苯酚和次氯酸盐反应生成水溶性染料靛酚蓝。在578 nm处,靛酚蓝有最大光吸收,其颜色深浅与溶液中的铵态氮含量成正比,进而计算出土壤脲酶活性大小,单位为μg·d-1·g-1。
碱性磷酸酶活性的测定:在碱性环境下,土壤碱性磷酸酶可以催化对硝基苯磷酸酯生成黄色的对硝基苯酚,其在405 nm处有最大吸收峰。通过计算405 nm下对硝基苯酚的增加速率,得出土壤碱性磷酸酶活性的大小,单位为nmol·h-1·g-1。
1.4 土壤中金霉素浓度测定土壤中金霉素浓度的测定参照孟明辉等[17]的研究,在此基础上做了一些改动。取2 g冻干土壤于50 mL离心管中,然后依次加入0.40 g乙二胺四乙酸二钠盐、10 mL乙腈和10 mL磷酸盐缓冲液,涡旋混匀8 min(2 500 r·min-1)后,10 000 r·min-1离心10 min,转移全部上清液于梨形瓶。重复上述过程1次,合并上清液。上清液于旋转蒸发仪(40 ℃)蒸发至15 mL左右,过0.45 μm尼龙滤膜,加入65 mL蒸馏水稀释,并用甲酸调节pH至4,所得提取液进一步用PEP-2固相萃取小柱(500 mg/6 mL,博纳艾杰尔科技有限公司,天津)净化。过柱前,PEP-2柱用6.0 mL甲醇和6.0 mL蒸馏水活化。过柱后,用10 mL甲醇洗脱PEP-2柱。最后,用高纯氮气将洗脱液吹至近干,1.0 mL甲醇水(1∶1,V/V)复溶,过0.22 μm尼龙滤膜于进样小瓶,上机检测。
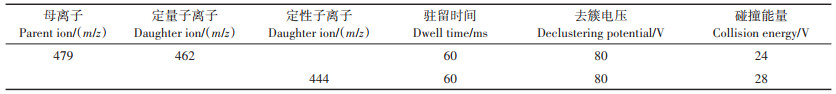
金霉素的测定采用液相色谱-串联质谱法(LCMS /MS,SCINEX QTRAPⓇ4500,美国)。色谱柱为Waters UPLC BEH C18(100 mm×2.1 mm,1.7 μm,美国),柱温40 ℃。流动相:A为超纯水+0.1%甲酸,B为甲醇+0.1% 甲酸,进样体积为5 μL,流速为0.4 mL· min-1。采用多反应监测模式(MRM)检测目标物。电喷雾离子源(ESI)条件如下:离子源1和2的气压均为50 psi(1 psi=6 895 Pa),气帘气压力为30 psi,离子源温度为550 ℃,离子喷雾电压为5 500 V,碰撞室入口和出口电压分别为10 V和14 V。金霉素的定性和定量离子对以及对应的去簇电压和碰撞能量见表 1。采用加标法测定3种不同浓度金霉素(10、50、100 μg·kg-1)的回收率,回收率为72.1%~85.4%,变异系数为3.83%~9.58%。
|
|
表 1 金霉素测定的质谱参数 Table 1 Mass spectrometric parameters of chlortetracycline determination |
土壤pH的测定:土壤pH采用电位法测定[16]。称取2 g干土放入15 mL离心管,加入5 mL蒸馏水,涡旋混匀8 min(2 500 r · min-1),10 000 r · min-1离心10 min,取上清液用校准过的pH计测定。
土壤有机质的测定:有机质的测定采用重铬酸钾容量法(外加热法)。在外加热条件下(油浴温度180 ℃,沸腾5 min),用一定浓度的重铬酸钾-硫酸溶液氧化土壤有机质,剩余的重铬酸钾用硫酸亚铁溶液滴定,利用所消耗的重铬酸钾量计算土壤中有机质含量。
1.6 土壤细菌高通量分析高通量测序步骤如下:(1)土壤DNA提取:第28 d的土壤样品用试剂盒Power Soil DNA kit(Mobio,美国)提取DNA,然后用琼脂糖凝胶电泳检测其纯度和浓度,最后将DNA提取物稀释至浓度为1 ng·μL-1。(2)扩增:对稀释后的DNA进行PCR扩增,引物为16S rRNA基因的V4区(515F和806R)。(3)混样和纯化:将扩增反应产物按其浓度等体积混合,然后用2% 琼脂糖凝胶电泳测定,最后用胶回收试剂盒(Qiagen,德国)进行纯化。(4)分析:纯化后的DNA文库构建和测序由诺禾致源公司(天津)完成。
1.7 数据分析采用SPSS(Version 23.0)统计软件对金霉素浓度、pH、土壤酶活性和理化性质在各处理组中的差异进行单因素方差分析(ANOVA,Duncan′s test,P < 0.05);作图软件选用Origin 9.0;RDA(Redundancy analysis)分析选用Canoco 5.0。
2 结果与分析 2.1 金霉素污染土壤中酶活性的变化在整个培养周期内,CK组中5种酶的活性波动较小(图 1)。L组在第7 d和14 d时脱氢酶活性显著低于CK组(P < 0.05),分别降低了32.5% 和14.6%;在第1 d和28 d与CK组无显著差异。在整个培养过程中,H组脱氢酶活性均低于CK组(P < 0.05),降低了15.2%~47.7%(图 1A)。与CK组相比,第1 d时,L和H组过氧化氢酶活性分别下降2.96% 和5.43%(P < 0.05);第14 d时,L组过氧化氢酶活性增加4.56%(P < 0.05);第28 d时,H组过氧化氢酶活性增加2.88%(P < 0.05)(图 1B)。在第7 d和14 d时,L组蔗糖酶活性显著低于CK组(P < 0.05),分别降低了10.1% 和18.1%;第28 d时,L组中蔗糖酶活性回升到接近CK组水平;在整个培养期内,H组蔗糖酶活性显著低于CK组(P < 0.05),降低17.1%~31.0%(图 1C)。在第1~ 14 d,L组中脲酶活性显著低于CK组(P < 0.05),降低23.2%~41.3%;在整个培养周期内,H组中脲酶活性显著低于CK组(P < 0.05),降低23.5%~55.0%(图 1D)。L组在第7 d和14 d时碱性磷酸酶活性显著低于CK(P < 0.05),分别降低6.06% 和11.3%,第28 d时活性与CK组无显著差异;在整个培养周期内,H组碱性磷酸酶活性均显著低于CK组,降低幅度为5.28%~ 26.3%(图 1E)。

|
不同小写字母表示不同处理间差异显著(邓肯检验,P < 0.05) Different lowercase letters represent significant difference among different treatments(Duncan′s test, P < 0.05) 图 1 不同处理组土壤酶活性的变化 Figure 1 Changes of soil enzyme activities in different treatments |
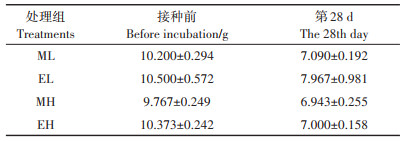
在本研究中,威廉环毛蚓和赤子爱胜蚓的存活率分别为100% 和89.2%。与接种前相比,28 d时蚯蚓的生物量下降了17.9%~36.2%(表 2)。与L组相比,在第7 d时,ML与EL组脱氢酶的活性提高最显著,分别增加了73.7% 和77.0%;与H组相比,在第7 d时MH组脱氢酶的活性提高最显著,增加了77.8%,第14 d时EH组脱氢酶的活性提高最显著,增加了88.5%(图 1A)。在第1~28 d,ML组中过氧化氢酶的活性均高于L组,其中第1 d时ML组过氧化氢酶活性提高最显著(P < 0.05),增加了4.00%;在第1 d和7 d,EL组的过氧化氢酶活性显著高于L组(P < 0.05),分别增加6.16% 和4.70%;在第1 d,MH组与EH组过氧化氢酶的活性都显著高于H组(P < 0.05),分别增加3.08%和4.02%;随着培养时间的延长,蚯蚓对过氧化氢酶活性的激活作用逐渐减弱,培养结束时,MH和EH组的过氧化氢酶活性与H组差异不显著(图 1B)。在第7~28 d,ML和EL组中蔗糖酶的活性显著高于L组(P < 0.05),分别增加了15.0%~72.6% 和15.8%~ 69.2%。在第7~28 d,MH组中蔗糖酶的活性显著高于H组(P < 0.05),增加30.0%~36.3%;在第7 d和14 d时,EH组蔗糖酶活性显著高于H组(P < 0.05),分别增加31.9% 和29.1%(图 1C)。在整个培养周期内,ML组脲酶活性都显著高于L组(P < 0.05),在第28 d时,ML组中脲酶活性最高,为2.13 μg·d-1·g-1;在第1、14 d和28 d时,EL组脲酶活性都显著高于L组(P < 0.05),增加30.9%~42.3%。在第1~28 d,MH组脲酶活性都显著高于H组(P < 0.05),增加27.8%~ 37.9%;在第1~14 d,EH组脲酶活性都显著高于H组(P < 0.05),增加了19.6%~48.8%(图 1D)。在第7 d和28 d,ML组碱性磷酸酶活性显著低于L组(P < 0.05),分别降低5.00% 和7.74%;在第14 d和28 d,EL组碱性磷酸酶活性都显著低于L组(P < 0.05),分别降低5.84%和8.31%;在第14 d和28 d,MH和EH组都显著低于H组(P < 0.05),分别降低10.9%~23.8% 和14.6%~25.0%(图 1E)。
|
|
表 2 蚯蚓在第28 d时的生物量 Table 2 The biomass of earthworms at the 28th day |
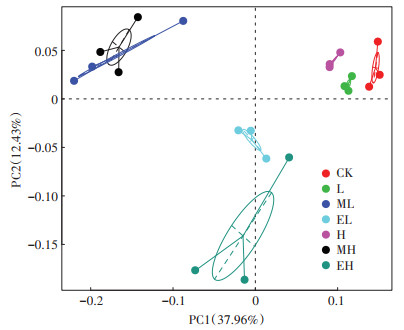
根据不同处理土壤中OTUs的组成,对所有处理组进行了PCoA分析(图 2)。由PCoA分析可看出,试验结束时,自然土(CK)与添加金霉素处理的2个处理组(L与H)明显分开;与L组相比,H组距CK的距离更远。这些结果表明金霉素可以改变土壤的细菌群落结构,且浓度越大,影响作用越显著。加入蚯蚓的4个处理组与金霉素的2个处理组明显分开;威廉环毛蚓处理组(ML和MH)与赤子爱胜蚓处理组(EL和EH)也明显分开,而EL和EH相聚较近,ML与MH聚在一起。这表明蚯蚓的加入显著改变了金霉素污染土壤中细菌群落的结构,且蚯蚓的种类不同影响结果也有差异。
|
图 2 第28 d时金霉素和蚯蚓对土壤细菌群落结构的影响 Figure 2 The impacts of chlortetracycline and earthworm on soil bacteria community structure at the 28th day |
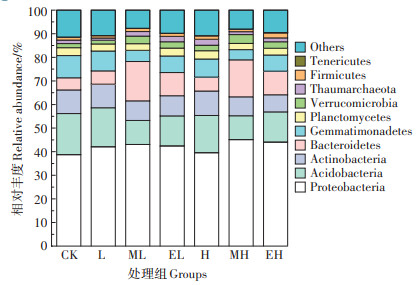
图 3为第28 d相对丰度排名前10的门水平细菌柱状图。各处理组土壤中的优势菌门为变形菌门(Proteobacteria)占比38.8%~45.1%、酸杆菌门(Acidobacteria)占比10.2%~17.4%、拟杆菌门(Bacteroidetes)占比5.13%~16.7%、放线菌门(Actinobacteria)占比7.25%~10.4%、芽单胞菌门(Gemmatimonadetes)占比4.30%~9.40%。金霉素的加入提高了土壤中Proteobacteria和Bacteroidetes的丰度。加入蚯蚓后,土壤中Proteobacteria和Bacteroidetes的相对丰度进一步提高。与L组相比,ML和EL组中Proteobacteria的相对丰度分别增加2.39%和0.83%,Bacteroidetes的相对丰度分别增加198%和75.8%;与H组相比,MH和EH组中Proteobacteria的相对丰度分别增加14.1% 和11.5%,Bacteroidetes的相对丰度分别增加165% 和69.0%。与Proteobacteria和Bacteroidetes的相对丰度变化不同,金霉素的加入降低了Acidobacteria和Gemmatimonadetes的相对丰度,且金霉素浓度越高下降幅度越大。加入蚯蚓后,Acidobacteria和Gemmatimonadetes的相对丰度进一步降低。与L组相比,ML与EL组中Acidobacteria的相对丰度分别下降38.5% 和23.1%,Gemmatimonadetes的相对丰度分别下降44.4% 和17.0%;与H组相比,MH与EH组中Acidobacteria的相对丰度分别降低35.8% 和19.0%,Gemmatimonadetes的相对丰度分别降低44.0% 和11.2%。低浓度金霉素对Actinobacteria的相对丰度无明显影响,高浓度金霉素使Actinobacteria的相对丰度增加了3.38%。加入蚯蚓后,Actinobacteria的相对丰度降低。与L组相比,ML与EL组中Actinobacteria的相对丰度分别下降17.2% 和14.6%;与H组相比,MH与EH组中Actinobacteria的相对丰度分别下降22.7% 和30.0%。以上结果表明,蚯蚓的加入未改变土壤中的优势菌门组成,但明显改变了其各自的丰度。
|
图 3 第28 d不同处理组土壤中细菌门水平的相对丰度 Figure 3 Relative abundances of bacterial communities at the phylum level determined in soils of different treatments at the 28th day |
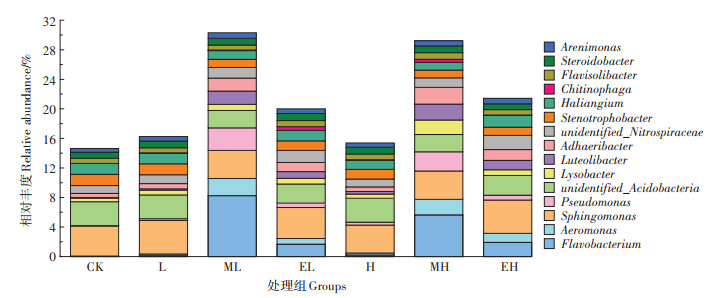
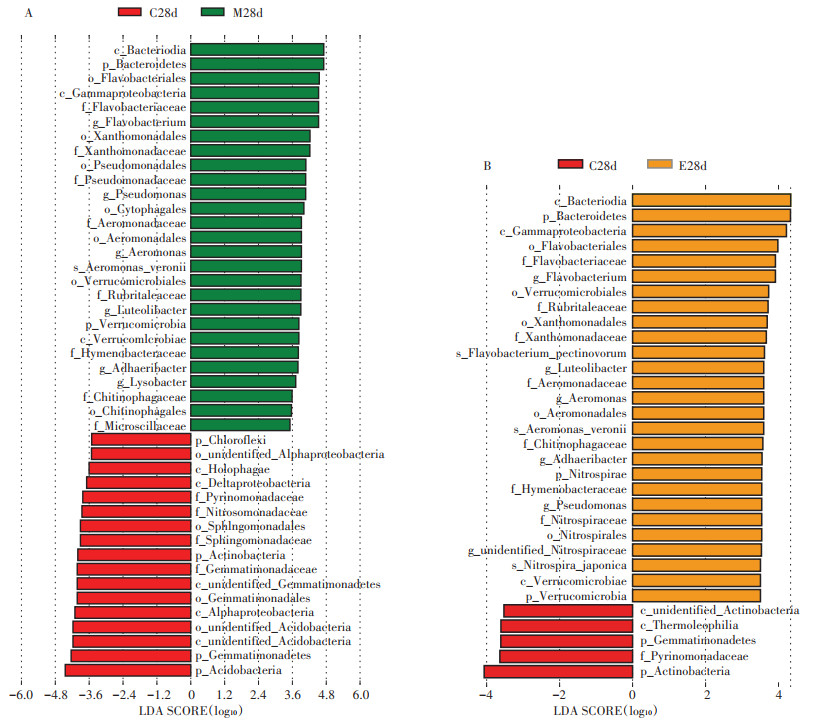
为了进一步分析金霉素和蚯蚓对土壤中微生物属水平的影响,列举了第28 d相对丰度排名前15的属(图 4)。结果显示,金霉素处理后土壤中的优势菌属组成未发生变化,但其相对丰度发生了变化。CK、L与H组中的优势菌属为Sphingomonas、unidentified_Acidobacteria、Stenotrophobacter、Haliangium和unidentified_Nitrospiraceae,占比9.58%~10.6%。与CK组相比,Sphingomonas的丰度在L组中增加了10.7%;Stenotrophobacter和Haliangium的丰度在H组分别降低了13.1%和15.1%。蚯蚓加入后土壤中优势菌属发生了明显的变化,同类型蚯蚓处理之间优势菌属相同。ML和MH组中,Flavobacterium、Sphingomonas、Pseudomonas和unidentified_Acidobacteria为优势菌属;EL和EH组中,Sphingomonas、unidentified_Acidobacteria、Flavobacterium和unidentified_Nitrospiraceae的丰度较高。LEfSe(LDA score>3.5)分析可用于找出不同处理组间差异显著的物种(图 5),相较于无蚯蚓的金霉素污染处理组,威廉环毛蚓处理组土壤中菌属丰度显著增加的是Flavobacterium、Pseudomonas、Aeromonas、Luteolibacter、Adhaeribacter和Lysobacter(P < 0.05);赤子爱胜蚓处理组中丰度显著升高的分别是Flavobacterium、Luteolibacter、Aeromonas、Adhaeribacter、Pseudomonas和unidentified_Nitrospiraceae(P < 0.05)。通过以上结果发现,Flavobacterium,Aeromonas、Luteolibacter、Adhaeribacter和Pseudomonas的丰度在所有蚯蚓处理组中都显著升高,在ML、EL、MH和EH中占比分别为17.2%、5.19%、14.8% 和6.14%。
|
图 4 第28 d不同处理组土壤中细菌属水平的相对丰度 Figure 4 Relative abundances of bacterial communities at the genera level determined in soils of different treatments at the 28th day |
|
C,金霉素污染土壤;M,金霉素污染土壤加入威廉环毛蚓;E,金霉素污染土壤加入赤子爱胜蚓 C, soils spiked with chlortetracycline; M, chlortetracycline-spiked soils with Metaphire guillelmi; E, chlortetracycline-spiked soils with Eisenia fetida 图 5 不同处理组土壤中物种的LEfSe分析 Figure 5 LEfSe analysis of species in different treatments |
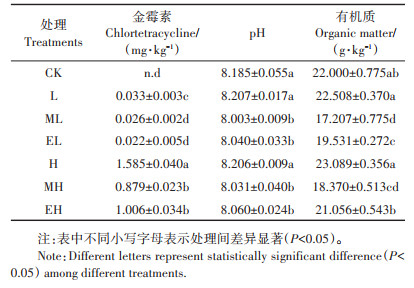
实验结束时,土壤中金霉素的浓度和理化性质如表 3所示。在第28 d时,ML组和EL组中的金霉素浓度分别为0.026 mg·kg-1和0.022 mg·kg-1,显著低于L组(0.033 mg·kg-1);MH组和EH组中的金霉素浓度分别为0.879 mg·kg-1和1.006 mg·kg-1,显著低于H组(1.585 mg·kg-1)。此外,低、高浓度金霉素的加入对土壤pH均无显著影响(P>0.05);两种生态型蚯蚓的加入均显著降低了土壤的pH(P < 0.05)。与CK相比,L和H组有机质含量略微增加。与L组相比,ML和EL组有机质含量分别降低23.5%和13.2%;与H组相比,MH和EH组有机质含量分别降低20.4% 和8.81%。
|
|
表 3 第28 d不同处理组土壤中pH、金霉素浓度和有机质含量 Table 3 pH, chlortetracycline concentration and organic matter content of soils in different treatments at the 28th day |
通过冗余分析探究土壤酶、细菌群落(被蚯蚓显著刺激的属)、金霉素和理化性质(pH和有机质)间的关系。图 6表明,轴1和轴2分别解释了62.8% 和7.43% 的变异度,合计解释了总变量的70.2%。脱氢酶、脲酶和蔗糖酶与pH、有机质和金霉素方向相反,呈负相关关系,与5种菌属呈正相关关系。过氧化氢酶与金霉素呈正相关,与pH、有机质呈负相关,与5种菌属呈正相关关系。碱性磷酸酶与pH、有机质呈正相关,与金霉素和5种菌属呈负相关关系。

|
图 6 土壤酶、细菌群落、金霉素和理化性质间的冗余分析 Figure 6 Redundancy analysis of the relationships among the soil enemies, bacterial genera, chlortetracycline and physicochemical properties |
土壤酶参与土壤中各种生物化学过程,是判断土壤生物化学过程强度及评价土壤肥力的重要指标之一[18]。金霉素的加入抑制了土壤中脱氢酶、蔗糖酶、脲酶和碱性磷酸酶的活性,且浓度越高抑制效果越明显,这与先前的研究结果一致[19-20]。造成这一结果的主要原因可能是金霉素作为细菌抑制剂,对土壤中的微生物有一定的毒害作用甚至使其失活,从而改变细菌的群落结构与功能[21]。PCoA分析结果也表明,金霉素污染土壤的细菌群落结构与无金霉素处理组明显不同,但并不是所有土壤酶的活性都被金霉素抑制。本研究结果表明,金霉素可以促进土壤中过氧化氢酶的活性,可能原因是进入到土壤中的金霉素可以被一些耐受性高的微生物利用而丰度升高,从而导致土壤酶活性的提高,这也与Yang等[22]的研究结果类似。
蚯蚓的加入提高了土壤中脱氢酶、过氧化氢酶、蔗糖酶和脲酶的活性。脱氢酶和过氧化氢酶是表征土壤微生物总体活性的指标,金霉素的毒害作用导致土壤微生物活性降低,而蚯蚓的加入促进了金霉素的降解和转化,从而削弱了毒害作用,促进了脱氢酶和过氧化氢酶的活性。蚯蚓还可以通过分泌体表黏液等方式对土壤酸碱性进行调节[23]。本研究选用的土壤为碱性土壤,蚯蚓的加入显著降低了土壤的pH,为微生物的生长提供了适宜的环境,有利于金霉素污染土壤中酶活性的升高。在两种浓度条件下,加入蚯蚓均使脱氢酶活性显著提高,但由于低、高浓度条件下土壤中可利用的金霉素含量不同,使得蚯蚓对脱氢酶活性的影响程度也有所差异。实验初期,因高浓度处理组整体微生物活性受到金霉素的抑制作用较大,脱氢酶的活性整体低于低浓度处理组,但由于蚯蚓的刺激作用,随着时间的延长,高浓度处理组中越来越多的金霉素被微生物消耗利用,微生物活性逐渐恢复并超过低浓度处理组,因此在实验后期(28 d时)高浓度蚯蚓处理组中脱氢酶的活性超过了低浓度蚯蚓处理组。加入蚯蚓对两种浓度条件下过氧化氢酶活性的影响与脱氢酶类似,实验初期高浓度处理组整体活性低于低浓度处理组,直至实验后期两种浓度条件下蚯蚓处理组中过氧化氢酶的活性基本相当。威廉环毛蚓和赤子爱胜蚓都以土壤中有机质为食,这与有机质的转化和降解关系密切[24]。表 3结果表明,两种生态型蚯蚓都加速了土壤有机质的消耗,从而促进了与土壤碳转化相关的蔗糖酶的活性。赤子爱胜蚓为表层蚓,体型小、吞土量少,主要以有机质为食;威廉环毛蚓属内层蚓,体型较大、吞土量多,以落叶和深层有机质为食,因而更能促进与土壤碳转化相关的蔗糖酶的活性。高浓度处理组金霉素可能对蚯蚓产生一定的毒性效应[25],蚯蚓活性降低,摄食有机质能力减弱,有机质的消耗量减少(表 3),因此对蔗糖酶活性的刺激作用与低浓度处理组相比较小。脲酶反映土壤氮素状况,与土壤有效态氮含量呈正相关,蚯蚓可通过摄食土壤和排泄蚓粪等方式增加土壤中有机氮的矿化速度,导致无机氮含量的增加[26]。此外,我们发现威廉环毛蚓处理组中脲酶活性要略高于赤子爱胜蚓处理组。之前的研究发现脲酶活性与土壤团聚体粒径关系密切,土壤团聚体粒径增大,脲酶活性升高[27]。与表层蚓相比,内层蚓具有极强的扰动能力和肠道消化作用,导致形成的土壤团聚体粒径较大和土壤透气性增加[28-29],这可以解释威廉环毛蚓处理组脲酶活性高于赤子爱胜蚓处理组。与蔗糖酶结果一致,低浓度处理组蚯蚓对脲酶活性的促进作用更强。与上述4种酶活性变化不同,蚯蚓抑制了土壤碱性磷酸酶的活性。冗余分析结果表明,碱性磷酸酶活性与土壤有机质呈正相关关系。耿玉清等[30]研究发现碱性磷酸酶活性与有机质密切相关,增加土壤有机质含量可促进碱性磷酸酶的产生,是提高土壤中有效磷含量的重要途径。因此,蚯蚓处理组土壤中有机质含量的降低,导致了碱性磷酸酶活性的下降。此外,有研究表明添加远盲蚓可以显著增加土壤中碱性磷酸酶的活性[31],这可能与蚯蚓的种类、土壤类型、培养时间和外源添加组分等有关。
3.2 蚯蚓对金霉素污染土壤细菌群落的影响与CK相比,金霉素的加入改变了土壤细菌群落结构,且浓度越高影响作用越大(图 2)。主要原因是金霉素作为一种广谱性抗菌剂,对大部分细菌都有毒副作用,其进入到土壤中,会对土壤微生物造成一定的选择性压力,进而导致群落结构的变化[32]。Proteobacteria、Acidobacteria、Bacteroidetes、Actinobacteria和Gemmatimonadetes是金霉素污染土壤中的优势菌门。其中Proteobacteria、Bacteroidetes和Actinobacteria受到金霉素刺激而活性增强,且金霉素浓度越高刺激作用越强;Acidobacteria和Gemmatimonadetes受到金霉素抑制而活性降低,低浓度组抑制作用略强。之前的研究表明在抗生素污染的土壤中Actinobacteria、Proteobacteria和Bacteroidetes的丰度较高,对抗生素具有一定的耐受性[33-35]。此外,Proteobacteria和Actinobacteria也被证实是抗生素抗性基因的宿主菌门[36]。
与无蚯蚓处理组相比,蚯蚓处理组土壤中的细菌群落结构发生了显著变化。低、高浓度金霉素污染土壤中Proteobacteria和Bacteroidetes的相对丰度经两种蚯蚓刺激作用后均升高。Proteobacteria是所有处理组土壤中丰度最高的菌门,蚯蚓对其丰度的影响必将导致土壤细菌群落结构的改变,本研究表明低金霉素浓度条件下Proteobacteria受蚯蚓刺激程度较弱,而高浓度条件下受蚯蚓刺激作用显著增强。有研究表明Proteobacteria对固定化微生物脱氮具有重要作用[37]。Bacteroidetes受两种蚯蚓的刺激作用相对丰度上升比例最高,且低浓度处理组刺激作用更强。Bacteroidetes是一类具有极强分解能力的菌门,可以分解土壤营养物质,为土壤中酶促反应提供能量[38]。蚯蚓的加入刺激了土壤中Proteobacteria和Bacteroidetes的生长,从而有助于土壤中酶活性的增加。不同生态型蚯蚓处理组土壤中的细菌群落结构也有显著差异,本实验选用的两种蚯蚓分别为表层蚓和内层蚓,不同的生存环境和食物偏好可能是导致这一现象的原因[39-40]。两种浓度条件下,威廉环毛蚓对Proteobacteria和Bacteroidetes的促进效果都优于赤子爱胜蚓,这一定程度上解释了威廉环毛蚓处理组土壤中酶活性高于赤子爱胜蚓处理组的原因。蚯蚓加入后,土壤中Acidobacteria、Actinobacteria和Gemmatimonadetes丰度降低,且威廉环毛蚓对此3种菌门的抑制程度高于赤子爱胜蚓。造成这种结果的原因可能是这些菌群以土壤有机质作为碳源来抵御环境压力[41],然而喜好取食土壤有机质的蚯蚓加入后,与这些进食土壤有机质的菌群产生竞争,导致其丰度下降。本文的研究结果也表明在低、高浓度金霉素处理组中,威廉环毛蚓和赤子爱胜蚓的加入均显著降低了土壤有机质含量(P < 0.05)。此外,高浓度金霉素处理组中蚯蚓对3种菌门的抑制作用相较于低浓度处理组有所减弱,可能是因为高浓度金霉素对蚯蚓活性产生一定的抑制作用,一定程度上减少了土壤有机质的消耗。
实验结束时,与无蚯蚓处理组相比,蚯蚓处理组土壤中优势菌属的组成也发生了明显的改变,Flavobacterium、Aeromonas、Pseudomonas、Luteolibacter和Adhaeribacter在4个蚯蚓处理组丰度都显著升高。此外,这5种菌属在金霉素处理组的相对丰度也高于CK组(图 4),表明其可能是金霉素的潜在降解菌。RDA结果表明,土壤脱氢酶、过氧化氢酶、蔗糖酶和脲酶与上述金霉素降解菌属呈正相关关系。脱氢酶是一种能催化土壤有机物质脱氢、使有机污染物降解的胞内酶,并与多种微生物的分泌活动相关[42-43]。金霉素降解菌的活性受蚯蚓刺激而增加,这可能导致了脱氢酶活性的增加,同时也会加速土壤中金霉素的降解。土壤中氮循环与有机污染物降解关系密切,含氮化合物作为微生物氮源与其生长繁殖直接相关,但微生物对土壤中不同形态氮的利用难易程度也不同。蚯蚓对氮循环的促进作用增加了土壤中易被微生物利用的氮素,促进了其活性[44]。Liang等[45]研究发现Pseudomonas可产生脲酶,图 5也显示蚯蚓处理中Pseudomonas丰度大幅度增加,从而导致土壤中脲酶活性升高。土壤碱性磷酸酶与Flavobacterium、Aeromonas、Pseudomonas、Luteolibacter和Adhaeribacter呈负相关关系,说明蚯蚓处理组中碱性磷酸酶活性下降可能与金霉素降解菌活性升高有关。此外,有研究表明Flavobacterium有降解环丙沙星的潜力[14];Aeromonas可以加速土壤中异丙甲草胺的降解[46];Pseudomonas是土壤中土霉素和莠去津的主要降解者[47]。杨浩等[48]研究表明Luteolibacter是窖水中污染物微生物降解的重要细菌。蚯蚓处理组中这些菌属丰度的升高,可能加速了土壤中金霉素的生物降解,减少了其对土壤中其他微生物的毒害作用,从而一定程度上导致了蚯蚓处理组中脱氢酶、过氧化氢酶、蔗糖酶和脲酶活性的升高。
土壤中蚯蚓种类众多,在未来的工作中,可以在蚯蚓类型方面开展细化研究,筛选出改善污染土壤质量的最优蚓种。另外,土壤酶与微生物的关系并非单一的、有规律的,而是多元多变的,因此还需借助宏基因组等技术手段,明确土壤微生物群落中差异物种的生态功能,进一步揭示蚯蚓对抗生素污染土壤酶活性和微生物群落的影响机制。
4 结论金霉素的加入,使土壤中脱氢酶、蔗糖酶、脲酶和碱性磷酸酶的活性受到抑制,浓度越高抑制作用越明显;过氧化氢酶活性被激活;土壤中的细菌群落发生演变。威廉环毛蚓和赤子爱胜蚓的加入均促进了金霉素污染土壤中脱氢酶、过氧化氢酶、蔗糖酶和脲酶的活性,其中威廉环毛蚓对脱氢酶、蔗糖酶和脲酶活性的促进作用优于赤子爱胜蚓;碱性磷酸酶的活性则受到抑制。土壤pH、有机质含量、金霉素浓度和细菌群落结构是影响土壤酶活性变化的重要因子。
两种蚯蚓均未改变金霉素污染土壤中的细菌优势菌门组成,但都改变了其丰度占比。在属水平上,Flavobacterium、Aeromonas、Luteolibacter、Adhaeribacter和Pseudomonas等潜在金霉素降解菌被两种蚯蚓刺激丰度显著增加,从而加速了土壤中金霉素的降解。此外,两种蚯蚓的加入均改变了金霉素污染土壤中的细菌群落结构,且蚯蚓种类不同影响作用也不同。
| [1] |
喻娇, 冯乃宪, 喻乐意, 等. 土壤环境中典型抗生素残留及其与微生物互作效应研究进展[J]. 微生物学杂志, 2017, 37(6): 105-113. YU Jiao, FENG Nai-xian, YU Le-yi, et al. Advances in typical antibiotics residues and their mutual effects with microorganisms in soil environment[J]. Journal of Microbiology, 2017, 37(6): 105-113. DOI:10.3969/j.issn.1005-7021.2017.06.016 |
| [2] |
Awad Y M, Kim S C, Azeem S E, et al. Veterinary antibiotics contamination in water, sediment, and soil near a swine manure composting facility[J]. Environmental Earth Sciences, 2013, 71: 1433-1440. DOI:10.1007/s12665-013-2548-z |
| [3] |
Zhang Q Q, Ying G G, Pan C G, et al. Comprehensive evaluation of antibiotics emission and fate in the river basins of China: Source analysis, multimedia modeling, and linkage to bacterial resistance[J]. Environmental Science and Technology, 2015, 49(11): 6772-6782. DOI:10.1021/acs.est.5b00729 |
| [4] |
曾巧云, 丁丹, 檀笑. 中国农业土壤中四环素类抗生素污染现状及来源研究进展[J]. 生态环境学报, 2018, 27(9): 1774-1782. ZENG Qiao-yun, DING Dan, TAN Xiao. Pollution status and sources of tetracycline antibiotics in agricultural soil in China: A review[J]. Ecology and Environmental Sciences, 2018, 27(9): 1774-1782. |
| [5] |
European Commission. Commission Regulation(EU)No 37/2010 of 22 December 2009 on pharmacologically active substances and their classification regarding maximum residue limits in foodstuffs of animal origin[R]. Official Journal of the European Union, 2010.
|
| [6] |
王丽平. 典型外源抗生素在土壤中的转归及其与土壤微生物多样性的相互作用和机理研究[D]. 杭州: 浙江大学, 2008. WANG Li-ping. The fate of typical exterior-source antibiotics in soils and their interaction with microbial diversity[D]. Hangzhou: Zhejiang University, 2018. |
| [7] |
Grenni P, Ancona V, Caraccioloa A B. Ecological effects of antibiotics on natural ecosystems: A review[J]. Microchemical Journal, 2018, 136: 25-39. DOI:10.1016/j.microc.2017.02.006 |
| [8] |
迟荪琳, 王卫中, 徐卫红, 等. 四环素类抗生素对不同蔬菜生长的影响及其富集转运特征[J]. 环境科学, 2018, 39(2): 935-943. CHI Sun-lin, WANG Wei-zhong, XU Wei-hong, et al. Effects of tetracycline antibiotics on growth and characteristics of enrichment and transformation in two vegetables[J]. Environmental Science, 2018, 39(2): 935-943. |
| [9] |
Wei R C, He T, Zhang S G, et al. Occurrence of seventeen veterinary antibiotics and resistant bacterias in manure-fertilized vegetable farm soil in four provinces of China[J]. Chemosphere, 2019, 215: 234-240. DOI:10.1016/j.chemosphere.2018.09.152 |
| [10] |
Cao J, Wang C, Dou Z X, et al. Hyphospheric impacts of earthworms and arbuscular mycorrhizal fungus on soil bacterial community to promote oxytetracycline degradation[J]. Journal of Hazardous Materials, 2017, 341: 346-354. |
| [11] |
Sun Y, Zhao L X, Li X J, et al. Stimulation of earthworms(Eisenia fetida)on soil microbial communities to promote metolachlor degradation[J]. Environmental Pollution, 2019, 248: 219-228. DOI:10.1016/j.envpol.2019.01.058 |
| [12] |
Hernandez-Castellanos B, Ortiz-Ceballos A, Martinez-Hernandez S, et al. Removal of benzo(a)pyrene from soil using an endogeic earthworm pontoscolex corethrurus(Muller, 1857)[J]. Applied Soil Ecology, 2013, 70: 62-69. DOI:10.1016/j.apsoil.2013.04.009 |
| [13] |
Rodriguez-Campos J, Dendooven L, Alvarez-Bernal D, et al. Potential of earthworms to accelerate removal of organic contaminants from soil: A review[J]. Applied Soil Ecology, 2014, 79: 10-25. DOI:10.1016/j.apsoil.2014.02.010 |
| [14] |
Pu Q, Wang H T, Pan T, et al. Enhanced removal of ciprofloxacin and reduction of antibiotic resistance genes by earthworm Metaphire vulgaris in soil[J]. Science of the Total Environment, 2020, 742: 140409. DOI:10.1016/j.scitotenv.2020.140409 |
| [15] |
Cui G, Bhat S A, Li W, et al. Gut digestion of earthworms significantly attenuates cell-free and -associated antibiotic resistance genes in excess activated sludge by affecting bacterial profiles[J]. Science of the Total Environment, 2019, 691: 644-653. DOI:10.1016/j.scitotenv.2019.07.177 |
| [16] |
罗舒文, 甄珍, 李文清, 等. 两种生态型蚯蚓对四环素污染土壤中酶活性和细菌群落结构的影响[J]. 农业环境科学学报, 2020, 39(2): 321-330. LUO Shu-wen, ZHEN Zhen, LI Wen-qing, et al. Ecological effects of two earthworms on the enzymic activity and bacterial community structure in tetracycline-contaminated soil[J]. Journal of Agro-Environment Science, 2020, 39(2): 321-330. |
| [17] |
孟明辉, 贺泽英, 徐亚平, 等. QuEChERS方法结合高效液相色谱-串联质谱法同时测定土壤中20种抗生素[J]. 农业环境科学学报, 2017, 36(8): 1672-1679. MENG Ming-hui, HE Ze-ying, XU Ya-ping, et al. Simultaneous extraction and determination of antibiotics in soils using a QuEChERS-based method and liquid chromatography-tandem mass spectrometry[J]. Journal of Agro-Environment Science, 2017, 36(8): 1672-1679. |
| [18] |
蒲生彦, 王宇, 陈文英, 等. 植物根际土壤酶对重金属污染的响应机制研究综述[J]. 生态毒理学报, 2020, 15(4): 11-20. PU Sheng-yan, WANG Yu, CHEN Wen-ying, et al. Review on the mechanism of plant rhizosphere soil enzyme response to heavy metal pollution[J]. Asian Journal of Ecotoxicology, 2020, 15(4): 11-20. |
| [19] |
Liu B, Li Y X, Zhang X L, et al. Effects of chlortetracycline on soil microbial communities: Comparisons of enzyme activities to the functional diversity via Biolog EcoPlatesTM[J]. European Journal of Soil Biology, 2015, 68: 69-76. DOI:10.1016/j.ejsobi.2015.01.002 |
| [20] |
高原, 关连珠, 宋丹, 等. 外源金霉素在土壤中的残留特点及对土壤酶活性的影响[J]. 北方园艺, 2018(10): 42-44. GAO Yuan, GUAN Lian-zhu, SONG Dan, et al. Residues characteristics of exogenous aureomycin in soil and effect of that on soil enzyme activity[J]. Northern Horticulture, 2018(10): 42-44. |
| [21] |
Martinez J L. Environmental pollution by antibiotics and by antibiotic resistance determinants[J]. Environmental Pollution, 2009, 157(11): 2893-2902. DOI:10.1016/j.envpol.2009.05.051 |
| [22] |
Yang R, Xia X M, Wang J H, et al. Dose and time-dependent response of single and combined artificial contamination of sulfamethazine and copper on soil enzymatic activities[J]. Chemosphere, 2020, 250: 126161. DOI:10.1016/j.chemosphere.2020.126161 |
| [23] |
Hao Y Q, Zhao L X, Sun Y, et al. Enhancement effect of earthworm (Eisenia fetida)on acetochlor biodegradation in soil and possible mechanisms[J]. Environmental Pollution, 2018, 242: 728-737. DOI:10.1016/j.envpol.2018.07.029 |
| [24] |
Lin Z, Li X M, Li Y T, et al. Enhancement effect of two ecological earthworm species(Eisenia foetida and Amynthas robustus E. Perrier) on removal and degradation processes of soil DDT[J]. Journal of Environmental Monitoring, 2012, 14(6): 1551-1558. DOI:10.1039/c2em30160a |
| [25] |
Dong L X, Gao J, Xie X J, et al. DNA damage and biochemical toxicity of antibiotics in soil on the earthworm Eisenia fetida[J]. Chemosphere, 2012, 89: 44-51. DOI:10.1016/j.chemosphere.2012.04.010 |
| [26] |
Araujo Y, Luizo F J, Barros E, et al. Effect of earthworm addition on soil nitrogen availability, microbial biomass and litter decomposition in mesocosms[J]. Biology and Fertility of Soils, 2004, 39(3): 146-152. DOI:10.1007/s00374-003-0696-0 |
| [27] |
马建辉, 叶旭红, 韩昌东, 等. 膜下滴灌不同灌水控制下限对设施土壤团聚体养分、酶活性和球囊霉素含量的影响[J]. 应用生态学报, 2018, 29(8): 2713-2720. MA Jian-hui, YE Xu-hong, HAN Chang-dong, et al. Effects of different low limits of irrigation on nutrients, enzyme activity and glomalin-related soil protein in soil aggregates of drip irrigation under plastic film[J]. Chinese Journal of Applied Ecology, 2018, 29(8): 2713-2720. |
| [28] |
Zhang C, Zhou B, Wu J L, et al. Application of earthworms on soil remediation in southern China[J]. Biodiversity Science, 2018, 26(10): 1091-1102. DOI:10.17520/biods.2018151 |
| [29] |
Margesin R, Walder G, Schinner F. The impact of hydrocarbon remediation(diesel oil and polycyclic aromatic hydrocarbons)on enzyme activities and microbial properties of soil[J]. Acta Biotechnologica, 2010, 20(3/4): 313-333. |
| [30] |
耿玉清, 白翠霞, 赵广亮, 等. 土壤磷酸酶活性及其与有机磷组分的相关性[J]. 北京林业大学学报, 2008, 30(增刊2): 139-142. GENG Yu-qing, BAI Cui-xia, ZHAO Guang-liang, et al. Soil phosphatase activity and its correlation with composition of organic phosphorus[J]. Journal of Beijing Forestry University, 2008, 30(Suppl 2): 139-142. |
| [31] |
唐劲驰, 周波, 黎健龙, 等. 蚯蚓生物有机培肥技术(FBO)对茶园土壤微生物特征及酶活性的影响[J]. 茶叶科学, 2016, 36: 45-51. TANG Jin-chi, ZHOU Bo, LI Jian-long, et al. Effects of earthworm bio-organic fertilization technology on soil microbial characteristics and enzyme activities of tea plants[J]. Journal of Tea Science, 2016, 36: 45-51. DOI:10.3969/j.issn.1000-369X.2016.01.006 |
| [32] |
Fang H, Han L, Cui Y, et al. Changes in soil microbial community structure and function associated with degradation and resistance of carbendazim and chlortetracycline during repeated treatments[J]. Science of the Total Environment, 2016, 572: 1203-1212. DOI:10.1016/j.scitotenv.2016.08.038 |
| [33] |
Cleary D W, Bishop A H, Zhang L H, et al. Long-term antibiotic exposure in soil is associated with changes in microbial community structure and prevalence of class 1 integrons[J]. FEMS Microbiology Ecology, 2016, 92(10): fiw159. DOI:10.1093/femsec/fiw159 |
| [34] |
Leclercq S O, Wang C, Sui Z H, et al. A multiplayer game: Species of clostridium, acinetobacter, and pseudomonas are responsible for the persistence of antibiotic resistance genes in manure-treated soils[J]. Environmental Microbiology, 2016, 18(10): 3494-3508. DOI:10.1111/1462-2920.13337 |
| [35] |
Li D, Qi R, Yang M, et al. Bacterial community characteristics under long-term antibiotic selection pressures[J]. Water Research, 2011, 45(18): 6063-6073. DOI:10.1016/j.watres.2011.09.002 |
| [36] |
Huang K, Xia H, Wu Y, et al. Effects of earthworms on the fate of tetracycline and fluoroquinolone resistance genes of sewage sludge during vermicomposting[J]. Bioresour Technology, 2018, 259: 32-39. DOI:10.1016/j.biortech.2018.03.021 |
| [37] |
冯晓娟, 冼萍, 唐海芳, 等. 固定化微生物脱氮途径及微生物学机理研究[J]. 环境工程, 2017, 35(增刊): 246-250, 255. FENG Xiao-juan, XIAN Ping, TANG Hai-fang, et al. Research of innobilized microbal denitrification pathway and microbillogy mechanism[J]. Environmental Engineering, 2017, 35(Suppl): 246-250, 255. |
| [38] |
刘雯雯. 喀斯特植被恢复不同阶段土壤微生物组成及氮磷土壤酶对生境响应[D]. 贵阳: 贵州大学, 2019. LIU Wen-wen. Soil microbial composition and response of nitrogen and phosphorus soil enzymes to habitat in different stages of karst vegetation restoration[D]. Guiyang: Guizhou University, 2019. |
| [39] |
董炜华, 殷秀琴, 辛树权. 赤子爱胜蚓对不同猪粪和秸秆的分解作用[J]. 生态学杂志, 2012, 31(12): 3109-3115. DONG Wei-hua, YIN Xiu-qin, XIN Shu-quan. Roles of Eisenia foetida in decomposing different kinds pig dung and crop straw[J]. Chinese Journal of Ecology, 2012, 31(12): 3109-3115. |
| [40] |
邵元虎, 张卫信, 刘胜杰, 等. 土壤动物多样性及其生态功能[J]. 生态学报, 2015, 35(20): 6614-6625. SHAO Yuan-hu, ZHANG Wei-xin, LIU Sheng-jie, et al. Diversity and function of soil fauna[J]. Acta Ecologica Sinica, 2015, 35(20): 6614-6625. |
| [41] |
Chávez-Romero Y, Navarro-NoyabSilvia E Y, Sarria-Guzmána Y, et al. 16S metagenomics reveals changes in the soil bacterial community driven by soil organic C, N-fertilizer and tillage-crop residue management[J]. Soil and Tillage Research, 2016, 159: 1-8. DOI:10.1016/j.still.2016.01.007 |
| [42] |
Kumar S, Chaudhuri S, Maiti S K, et al. Soil dehydrogenase enzyme activity in natural and mine soil: A review[J]. Middle East Journal of Scientific Research, 2013, 13(7): 898-906. |
| [43] |
张晨, 张丽红, 李亚宁, 等. 典型磺胺类抗生素对土壤脱氢酶和过氧化氢酶活性的影响[J]. 安全与环境学报, 2018, 18: 326-329. ZHANG Chen, ZHANG Li-hong, LI Ya-ning, et al. Impact of the typical sulfonamides on the enzyme activities of the soil[J]. Journal of Safety and Environment, 2018, 18: 326-329. |
| [44] |
Tran N H, Urase T, Ngo H H, et al. Insight into metabolic and cometabolic activities of autotrophic and heterotrophic microorganisms in the biodegradation of emerging trace organic contaminants[J]. Bioresource Technology, 2013, 146: 721-731. DOI:10.1016/j.biortech.2013.07.083 |
| [45] |
Liang Y M, He X Y, Liang S C, et al. Community structure analysis of soil ammonia oxidizers during vegetation restoration in southwest China[J]. Journal Basic of Microbiology, 2014, 54(3): 180-189. DOI:10.1002/jobm.201300217 |
| [46] |
Sun Y, Zhao L X, Li X J, et al. Response of soil bacterial and fungal community structure succession to earthworm addition for bioremediation of metolachlor[J]. Ecotoxicology and Environmental Safety, 2019, 189: 109926. |
| [47] |
曹佳. 蚯蚓和菌根真菌促进土霉素降解及其修复污染土壤的协同机制[D]. 北京: 中国农业大学, 2018. CAO Jia. Cooperation between earthworm and AM fungion the degradation and remediation of oxytetracycline in soil[D]. Beijing: China Agricultural University, 2018. |
| [48] |
杨浩, 杨晓妮, 张国珍, 等. 窖水中微生物降解污染物的关键细菌[J]. 环境科学, 2019, 39(10): 4766-4777. YANG Hao, YANG Xiao-ni, ZHANG Guo-zhen, et al. Key bacteria for the microbial degradation of pollutants in cellar water[J]. Environmental Science, 2019, 39(10): 4766-4777. |
 2021, Vol. 40
2021, Vol. 40