2. 云南省土壤固碳与污染控制重点实验室, 昆明 650500
2. Yunnan Key Laboratory of Carbon Sequestration and Pollution Controlling, Kunming 650500, China
秸秆类农业废弃物因产量大、经济价值低, 其处理处置问题一直受到农业、环境人员的广泛关注。生物炭技术为这些农业废弃物的处置提供了有效的解决途径。生物炭通常是由生物质热解产生的, 具有丰富的孔隙结构和较大的表面积, 吸附能力强且来源丰富。生物炭是由秸秆类废弃物转化成的具有良好经济效益的环境功能性材料, 在提高土壤碳库[1]、改善土壤质量[2-3]和减缓温室气体排放[4]等方面发挥着重要作用。
生物炭本身的稳定性较高, 但在应用过程中, 由于外部环境作用而使其理化性质发生改变[4-6]。因制备生物炭的方法、原料、温度, 以及土壤理化性质[7-9] (pH、有机质含量等)的不同, 生物炭氧化降解的难易程度会显著不同。陆海楠等[10]用秸秆制备生物炭, 发现裂解温度越低, 生物炭理化性质越容易发生变化。生物炭理化性质的变化, 会造成其环境功效的改变, 如氧化作用使生物炭对双酚A的吸附能力降低[11], 冻融作用会降低生物炭对Cu2+的固定能力[12]而提高对氨氮的去除作用。更重要的是, 生物炭结构的破坏使原本稳定的碳释放进入大气[13], 造成其固碳作用减弱。因此, 系统理解生物炭的化学氧化稳定性是预测其碳封存潜力、提高土壤肥力和控制污染物行为的关键环节[2, 14-15]。以往研究发现, 生物炭稳定性与其中碳的结构类型有关。陈温福等[16]认为芳香族结构和脂肪族结构含量高的生物炭具有更高的生物化学稳定性和热稳定性。除此之外, 矿物灰分也对生物炭稳定性有较大影响。顾博文等[17]发现生物质中的矿物成分在相应生物炭化学氧化过程中可表现出催化效应, 这源于矿物对生物炭具有引发晶格缺陷的作用, 使其更易被破坏。与之相反, Yang等[18]认为内源灰分可以保护生物炭免受氧化剂的氧化, 但外源含铁矿物对生物炭稳定性的影响因生物质种类而不同。由此可见, 碳结构种类和矿物含量在生物炭稳定性中可能拥有不同的贡献, 且矿物本身对生物炭稳定性的作用未有定论, 相关研究仍需进一步开展。
本实验拟采用玉米秸秆和小麦秸秆为原料, 分别于200℃和500℃的缺氧限氧条件下制备生物炭, 探究其热稳定性; 利用NaClO、H2O2和KMnO4三种氧化剂分别对其抗氧化性进行试验, 探究生物炭原料、制备温度等对生物炭稳定性的影响, 确定碳结构类型和矿物灰分与生物炭稳定性的关联, 为秸秆类生物炭在实际应用中稳定性的评判提供数据支持。
1 材料与方法 1.1 生物炭的制备本实验选择云南种植广泛的玉米秸秆和小麦秸秆为制备生物炭的原材料。将秸秆切至1 cm长, 置于70~80℃烘箱干燥后, 采用限氧升温炭化法[19]分别在200℃和500℃下于马弗炉内热解4 h, 冷却后研磨, 过60目筛后装于棕色瓶中待用。200℃下样品炭化程度较低, 不是严格意义上的生物炭, 但为比较温度对生物炭理化性质的影响, 本文将200℃下制备的样品称为200-BC, 相应500℃下制备的样品称为500-BC。
1.2 生物炭理化性质分析元素含量测定:称取2 mg样品包于专用锡箔纸中, 通过元素分析仪(Vario MICRO CUBE, 德国)测定C、H、N、S、O的含量。
木质素和纤维素含量测定:取1 g样品置于100 mL碘瓶中, 用浓酸水解法测定木质素和纤维素的含量[20]。
灰分测定:马弗炉升温燃烧法[21]。
红外表征:通过红外光谱仪(Varian 640-IR, 美国), 采用KBr压片法[22]对样品进行红外表征。样品和KBr粉末按照1:700的比例混合磨匀后进行压片, 在4000~400 cm-1波长范围内以8 cm-1精度扫描20次, 获得傅里叶红外光谱。
1.3 生物炭热稳定性实验通过热重分析仪(TGMSDTA851, 瑞士)对样品进行差热-热重分析[23]。取2~3 mg样品置于坩埚中, 在20 mL·min-1空气流中以10℃·min-1的加热速率升温到1300℃, 绘制差热-热重图。
1.4 生物炭氧化降解实验用6%(质量浓度) NaClO(pH=8)[4], 30% H2O2(pH=4)[24]和5 mg·mL-1 KMnO4(pH=7)[25]三种氧化剂对生物炭进行为期28 d的氧化。生物炭和原样的C含量为N0(g·kg-1), 按照250 mg C换算样品应称取的质量为M0(mg)。
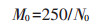
|
(1) |
向样品瓶中分别加入上述三种氧化剂3 mL, 将其置于摇床中(25℃, 120 r·min-1)振荡, 每日离心后以3 mL新鲜的氧化剂置换样品上清液。选取其中第7、14、21、28 d的生物质和生物炭样品, 用去离子水洗涤后冷干48 h, 称量样品质量。通过氧化前后样品的质量变化, 以C含量降低量作为生物炭抗氧化性的评价指标。氧化前后C的损失率W(%)为:
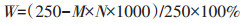
|
(2) |
式中:M为氧化后样品质量, mg; N为氧化后样品中的C含量, g·kg-1。
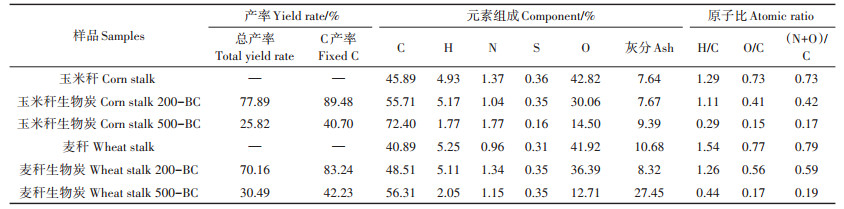
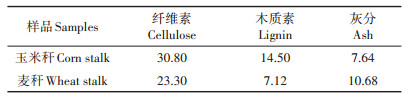
2 结果与讨论 2.1 生物炭的理化性质分析生物炭的元素分析(表 1)显示, 随着热解温度的升高, 玉米秆和麦秆生物炭的产率均逐渐减低。在热解过程中, 原样中各种有机组分不断损失, 生物炭中的灰分含量随温度的升高而增加。O元素和H元素含量随着制备温度的升高而降低, 这是因为在热解过程中, 碳链发生脱羧基、脱氧、脱水反应; 同时, 饱和脂肪烃变为不饱和芳香烃, C含量相对升高[26]。如表 1所示, 玉米秆和麦秆经500℃热解后, 生物炭的C含量分别从45.89%和40.89%升高到了72.4%和56.31%。在200℃下制备的玉米秆和麦秆生物炭灰分含量没有显著区别, 分别为7.67%和8.32%。而对C产率而言, 200℃下制备的玉米秆生物炭(89.48%)比麦秆生物炭(83.24%)高6个百分点, 这与玉米秆中较高的木质素含量有关[27](表 2):木质素、纤维素在200℃时大部分尚未裂解, 因此两者含量越高, 生物炭的C产率越高。在热解温度为500℃时, 木质素、纤维素大部分裂解, 所以木质素、纤维素含量较高的玉米秆在500℃时制备的生物炭的C产率(40.70%)比麦秆生物炭(42.23%)低约2个百分点, 而玉米秆500℃时的灰分含量(9.39%)比麦秆(27.45%)低约18个百分点, 说明此时灰分对生物炭的产率起主导作用。
|
|
表 1 生物炭的元素含量 Table 1 Element contents of biochars |
|
|
表 2 玉米秆和麦秆的木质素和纤维素含量(%) Table 2 Lignin and cellulose contents of corn stalk and wheat stalk(%) |
此外, 随着热解温度升高, 玉米秆和麦秆生物炭的H/C原子比、O/C原子比和极性指数[(N+O)/C]均逐渐降低, 说明生物炭的芳香性增强, 极性减弱。一方面是因为碳化过程产生了更多的芳香性结构, 另一方面是极性表面官能团脱氢、脱氧[26, 28-29]。对于原料不同的两种生物炭而言, 玉米秆及其制备生物炭的H/C原子比、O/C原子比和极性指数[(N+O)/C]均低于麦秆及其制备的生物炭, 因为玉米秆木质素及纤维素含量高, 碳结构更为致密, 其制备的生物炭芳香化程度更高, 其热稳定性可能更高[10]。
通过红外谱图(图 1)分析发现, 随热解温度的升高, 脂肪链-CH2-(2927 cm-1和2856 cm-1)基本消失, 含氧官能团如C=O(1634 cm-1)、-OH(3436 cm-1)和C-O-C(1057 cm-1)的峰显著降低, 其中C-O-C主要存在于纤维素、半纤维素的主链上[10], 说明在500℃时, 秸秆的纤维素、半纤维素损失较多, 芳香族化合物相对保留下来, 这与元素分析中的H/C表现出一致的现象, 说明生物炭的制备是"软碳质"到"硬碳质"的过程, 较高温度制备的生物炭可能具有较高的稳定性[30]。
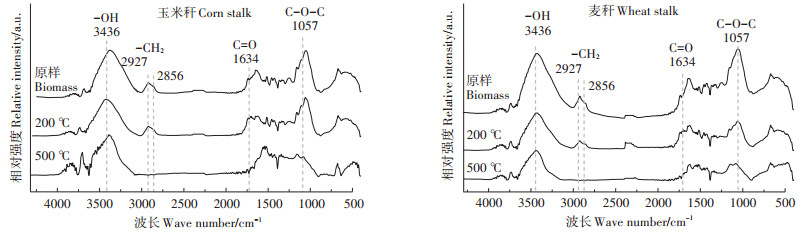
|
图 1 玉米秆、麦秆生物炭及原样的红外光谱图 Figure 1 FT-IR spectra of different biochars, corn stalk and wheat stalk |
生物炭及其原样的差热-热重分析显示(图 2), 玉米秆与麦秆生物炭的热解过程基本一致, 主要包括三个阶段:室温~250℃阶段主要是生物质中水分的损失, 失重率约为2%;250~500℃阶段纤维素、半纤维素及部分木质素发生热解, 生成大量的挥发物、少量的焦油和炭; 高于500℃阶段主要是剩余木质素的热解, 其过程十分缓慢且热解后主要生成炭[31]。500℃后热失重曲线及热解速率曲线趋于平缓, 失重几乎没有明显变化, 说明生物炭已基本炭化完全。与200℃制备的生物炭和原样相比, 500℃下制备的生物炭的热失重平台向右移动:玉米秸秆失重温度由200℃左右提高为生物炭的300℃左右, 麦秆失重温度由200℃左右提高为生物炭的350℃左右, 说明500℃下制备的生物炭的热稳定性较前两者更高。且500℃下制备的玉米秆生物炭有机组分热重残余量(11.6%)高于麦秆生物炭(6.6%), 说明玉米秆生物炭热稳定性比麦秆生物炭更高。结合生物质热解DTA曲线, 半纤维素的热解主要发生在250~410℃, 纤维素的热解主要发生在350~500℃[32], 可能是玉米秆中较高含量的纤维素(表 2)赋予了其较高的热稳定性。
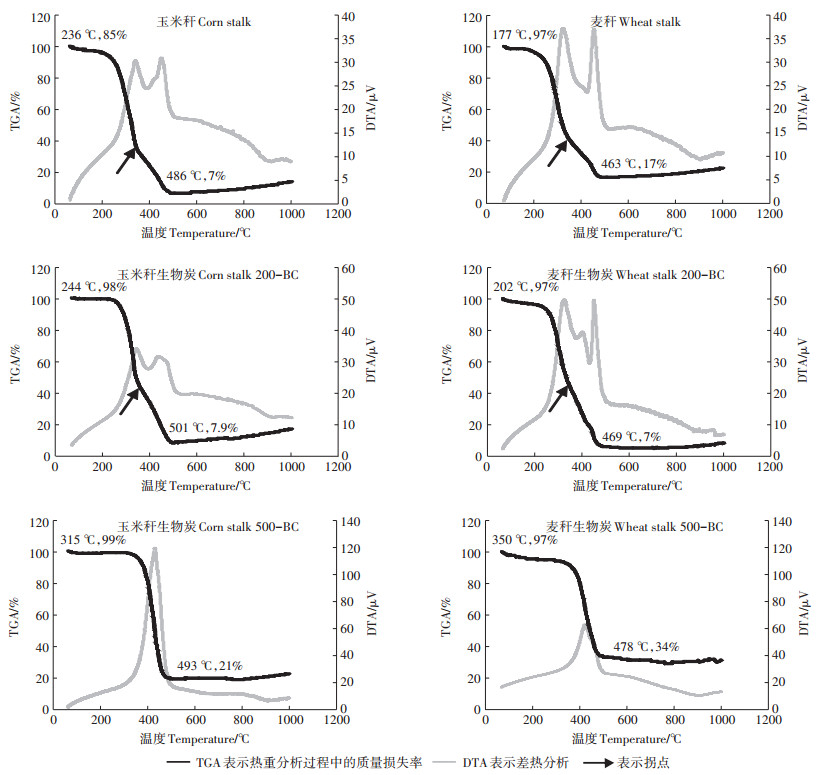
|
图 2 玉米秆、麦秆生物炭及原样的差热-热重图 Figure 2 TGA/DTA analysis of biochars, corn stalk and wheat stalk |
通过NaClO氧化动力学试验可以发现, 在为期28 d的氧化过程中, 相同温度下制备的两种生物炭的抗氧化能力未表现出明显差异(图 3)。不同温度下制备的秸秆类生物炭的最终C损失率都较高(高于70%), 玉米秆和麦秆生物炭抗氧化性规律表现为500-BC > 原样 > 200-BC。NaClO对不同温度制备的生物炭的氧化程度不同, 可能归因于它们的纤维素含量不同。原样的高木质素、纤维素使其表现出一定的抗氧化性。然而, 200℃下制备的生物炭的部分纤维素开始分解, 细胞壁被破坏, 而没有形成在较高温度时才具有的石墨C结构, 很容易被氧化, 表现为最弱的抗氧化能力[24]。在500℃或以上的高温制备生物炭时, 木质素可形成石墨C结构, 结构更加致密, 因此较高温度下制备的秸秆生物炭也更为稳定。
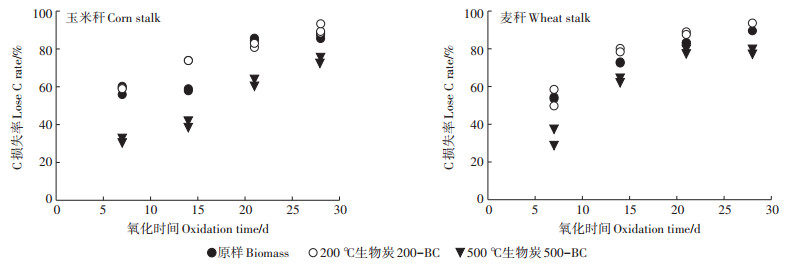
|
图 3 NaClO对玉米秆、麦秆生物炭及原样的氧化动力学 Figure 3 Oxidation kinetics of biochars, corn stalk and wheat stalk by NaClO |
通过H2O2氧化动力学试验发现, 在为期28 d的氧化过程中, 相同温度下制备的两种生物炭的抗氧化能力也未表现出明显差异(图 4)。不同温度下制备的生物炭的抗氧化性表现为与NaClO氧化体系中一致的结果:500-BC > 原样 > 200-BC。此外, 对比两个体系可以发现, H2O2氧化体系的C损失率均远低于NaClO氧化体系, 说明秸秆类生物炭对H2O2具有较高的抗氧化能力。H2O2主要通过·OH自由基对有机质进行氧化[33], 有研究[34-35]指出·OH自由基可与无定型芳香C反应, 把木质素等有机质分解为小分子有机酸, 如乙酸、草酸、丙二酸及苯甲酸等[36]。因此, 以致密芳香C为主的500-BC的抗氧化性高于以无定形芳香C为主的200-BC。此外, ·OH自由基与无定型芳香C的反应速度比其与脂肪族C的反应速度快, 因此, 原样中小分子(C5~C8)的脂肪族C比无定型芳香C抗降解能力更强[37], 总体表现为200℃下制备的生物炭的抗氧化能力最弱, 由此可见生物炭的氧化稳定性与热稳定性并非有相同的变化规律。
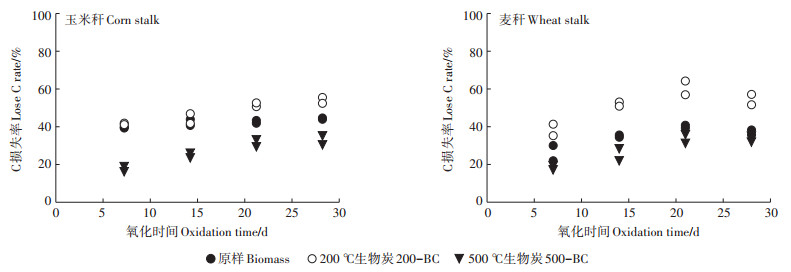
|
图 4 H2O2对玉米秆、麦秆生物炭及原样的氧化动力学 Figure 4 Oxidation kinetics of biochars, corn stalk and wheat stalk by H2O2 |
通过KMnO4氧化动力学结果可以发现(图 5), 在为期28 d的氧化过程中, 同一温度下制备的生物炭, 玉米秆生物炭的抗氧化能力略低于麦秆生物炭, 且玉米秆的抗氧化能力也低于麦秆, 表明生物炭的抗氧化能力不仅与高木质素含量有关, 同时还受到矿物保护的影响[18], 木质素和纤维素含量低、灰分含量高的麦秆及其生物炭的化学稳定性更强(表 1)。不同温度下制备的玉米秆和麦秆生物炭抗氧化性表现一致: 500-BC > 200-BC > 原样。此外, 与之前两种氧化剂相比, 秸秆类生物炭对KMnO4的抗氧化性更强。一方面是因为中性条件下KMnO4的氧化性较弱, 氧化反应主要使醚键断裂[38]。另一方面, 在氧化过程中可产生一部分二氧化锰沉淀, 且随着制备温度的增加, 制备的生物炭中的草酸盐增加(草酸盐可以和KMnO4反应产生更多的Mn2+), 进而反应产生更多的沉淀, 使氧化后出现质量增加的现象(图 6)。KMnO4为中性氧化试剂, 其还原产物一般为二氧化锰, KMnO4溶入水中为弱碱性。二价锰离子在碱性或者中性溶液中被KMnO4氧化, 生成二氧化锰的褐色沉淀[39], 导致氧化后质量增加的现象。
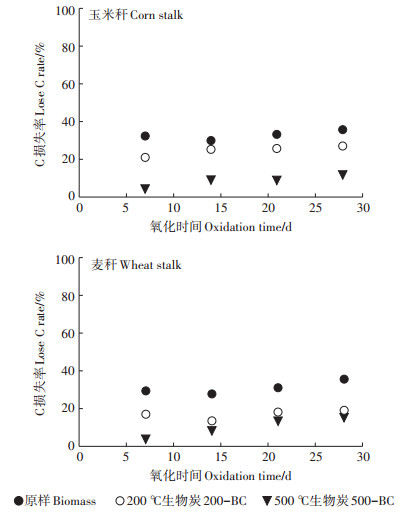
|
图 5 KMnO4对玉米秆、麦秆生物炭及原样的氧化动力学 Figure 5 Oxidation kinetics of biochars, corn stalk and wheat stalk by KMnO4 |
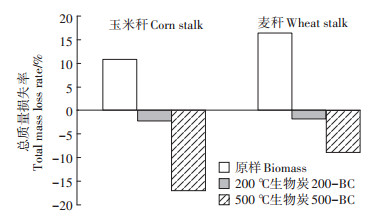
|
图 6 KMnO4氧化过程中的总质量损失率 Figure 6 Total mass loss rate in process of oxidation by KMnO4 |
2KMnO4+3MnSO4+2H2O=K2SO4+5MnO2↓+2H2SO4
KMnO4也可以和草酸发生反应, 生成更多Mn2+:
2KMnO4+5C2H2O4+3H2SO4=K2SO4+2MnSO4+ 10CO2↑+8H2O
3 结论(1) 本研究制备的生物炭, 因原料及制备温度的不同, 表现出了不同的热稳定性。对于同种原料而言, 生物炭的制备温度越高, 热稳定性越高; 相同温度下, 因玉米秸秆较小麦秸秆所含的木质素和纤维素的量更高, 即含碳量高, 所制备的生物炭芳香化程度高, 热稳定性更高。
(2) 玉米秆和麦秆生物炭在三种氧化体系中的稳定性均表现为NaClO < H2O2 < KMnO4。对于同种原料而言, 其氧化稳定性与热稳定性并非具有相同变化规律:500℃下制备的生物炭表现出较高抗氧化能力, 但原样和200℃下制备的生物炭化学稳定性的强弱因氧化体系而不同。相同温度下制备的两种生物炭, 其抗氧化性在NaClO和H2O2氧化体系中未表现出明显差别, 在KMnO4体系中, 因受矿物保护的作用, 麦秆及其生物炭的抗氧化性高于玉米秆及其生物炭。
| [1] |
Ippolito J A, Laird D A, Busscher W J. Environmental benefits of biochar[J]. Journal of Environmental Quality, 2012, 41(4): 967-972. |
| [2] |
Spokas K A. Review of the stability of biochar in soils:Predictability of O:C molar ratios[J]. Carbon Management, 2010, 1(2): 289-303. DOI:10.4155/cmt.10.32 |
| [3] |
方明, 任天志, 赖欣, 等. 花生壳生物炭对潮土和红壤理化性质和温室气体排放的影响[J]. 农业环境科学学报, 2018, 37(6): 1300-1310. FANG Ming, REN Tian-zhi, LAI Xin, et al. Effects of peanut shell biochar on physico-chemical properties and greenhouse gas emission in fluvo-aquic soil and red soil[J]. Journal of Agro-Environment Science, 2018, 37(6): 1300-1310. |
| [4] |
Mikutta R, Kleber M, Torn M S, et al. Stabilization of soil organic matter:Association with minerals or chemical recalcitrance?[J]. Biogeochemistry, 2006, 77(1): 25-56. DOI:10.1007/s10533-005-0712-6 |
| [5] |
林庆毅, 姜存仓, 张梦阳. 生物炭老化后理化性质及微观结构的表征[J]. 环境化学, 2017, 36(10): 2107-2114. LIN Qing-yi, JIANG Cun-cang, ZHANG Meng-yang. Characterization of the physical and chemical structures of biochar under simulated aging condition[J]. Environmental Chemistry, 2017, 36(10): 2107-2114. DOI:10.7524/j.issn.0254-6108.2017021703 |
| [6] |
Fang S E, Tsang D C W, Zhou F, et al. Stabilization of cationic and anionic metal species in contaminated soils using sludge-derived biochar[J]. Chemosphere, 2016, 149: 263-271. DOI:10.1016/j.chemosphere.2016.01.060 |
| [7] |
Ameloot N, Graber E R, Fga V, et al. Interactions between biochar stability and soil organisms:Review and research needs[J]. European Journal of Soil Science, 2013, 64(4): 379-390. |
| [8] |
Lehmann J. A handful of carbon[J]. Nature, 2007, 447(7141): 143-144. DOI:10.1038/447143a |
| [9] |
邓金环, 郜礼阳, 周皖婉, 等. 不同温度制备香根草生物炭对Cd的吸附特性与机制[J]. 农业环境科学学报, 2018, 37(2): 340-349. DENG Jin-huan, GAO Li-yang, ZHOU Wan-wan, et al. Adsorption characteristics and mechanisms of Cd2+ in biochar derived from vetiver grass under different pyrolysis temperatures[J]. Journal of Agro-Environment Science, 2018, 37(2): 340-349. |
| [10] |
陆海楠, 胡学玉, 刘红伟. 不同裂解条件对生物炭稳定性的影响[J]. 环境科学与技术, 2013, 36(8): 11-14. LU Hai-nan, HU Xue-yu, LIU Hong-wei. Influence of pyrolysis conditions on stability of biochar[J]. Environmental Science and Technology, 2013, 36(8): 11-14. DOI:10.3969/j.issn.1003-6504.2013.08.003 |
| [11] |
文方园, 陈建, 田路萍, 等. 过氧化氢氧化对生物炭表面性质的改变及其对双酚A吸附的影响[J]. 生态毒理学报, 2016, 11(2): 628-635. WEN Fang-yuan, CEHN Jian, TIAN Lu-ping, et al. Chemical oxidation of biochars and the impact on bisphenol A sorption[J]. Asian Journal of Ecotoxicology, 2016, 11(2): 628-635. |
| [12] |
申磊, 荆延德, 鞠文亮, 等. 施加不同种类生物质炭及冻融交替后土壤吸附Cu(Ⅱ)的变化[J]. 土壤通报, 2017, 48(4): 975-981. SHEN Lei, JING Yan-de, JU Wen-liang, et al. Changes of soil adsorption of Cu(Ⅱ) after the application of different kinds of biochar and freeze-thawing[J]. Chinese Journal of Soil Science, 2017, 48(4): 975-981. |
| [13] |
Zhao R, Coles N, Wu J. Carbon mineralization following additions of fresh and aged biochar to an infertile soil[J]. Catena, 2015, 125: 183-189. DOI:10.1016/j.catena.2014.10.026 |
| [14] |
Li F, Cao X, Zhao L, et al. Effects of mineral additives on biochar formation:Carbon retention, stability, and properties[J]. Environmental Science & Technology, 2014, 48(19): 11211-11217. |
| [15] |
Woolf D, Amonette J E, Streetperrott F A, et al. Sustainable biochar to mitigate global climate change[J]. Nature Communications, 2010, 1(5): 56. |
| [16] |
陈温福, 张伟明, 孟军. 生物炭与农业环境研究回顾与展望[J]. 农业环境科学学报, 2014, 33(5): 821-828. CHEN Wen-fu, ZHANG Wei-ming, MENG Jun. Biochar and agroecological environment:Review and prospect[J]. Journal of Agro-Environment Science, 2014, 33(5): 821-828. |
| [17] |
顾博文, 曹心德, 赵玲, 等. 生物质内源矿物对热解过程及生物炭稳定性的影响[J]. 农业环境科学学报, 2017, 36(3): 591-597. GU Bo-wen, CAO Xin-de, ZHAO Ling, et al. Influence of inherent minerals on biomass pyrolysis and carbon stability in biochar[J]. Journal of Agro-Environment Science, 2017, 36(3): 591-597. |
| [18] |
Yang Y, Sun K, Han L, et al. Effect of minerals on the stability of biochar[J]. Chemosphere, 2018, 204: 310-317. DOI:10.1016/j.chemosphere.2018.04.057 |
| [19] |
Chun Y, Sheng G, Chiou C T, et al. Compositions and sorptive properties of crop residue-derived chars[J]. Environmental Science & Technology, 2004, 38(17): 4649-4655. |
| [20] |
薛惠琴, 杭怡琼, 陈谊. 稻草秸秆中木质素、纤维素测定方法的研讨[J]. 上海畜牧兽医通讯, 2001(2): 15. XUE Hui-qin, HANG Yi-qiong, CHEN Yi. Study on determination methods of lignin and cellulose in wheat straw[J]. Shanghai Journal of Animal Husbandry and Veterinary Medicine, 2001(2): 15. DOI:10.3969/j.issn.1000-7725.2001.02.005 |
| [21] |
Brodowski S, Amelung W, Haumaier L, et al. Morphological and chemical properties of black carbon in physical soil fractions as revealed by scanning electron microscopy and energy-dispersive X-ray spectroscopy[J]. Geoderma, 2005, 128(1): 116-129. |
| [22] |
Fornara D A, Tilman D. Plant functional composition influences rates of soil carbon and nitrogen accumulation[J]. Journal of Ecology, 2008, 96(2): 314-322. DOI:10.1111/jec.2008.96.issue-2 |
| [23] |
王刚, 李文, 薛钦昭, 等. 生物质化学组分在空气和合成气下的热重行为研究[J]. 燃料化学学报, 2009, 37(2): 170-176. WANG Gang, LI Wen, XUE Qin-zhao, et al. Thermogravimetric behaviors of biomass' chemical components under air or syngas[J]. Journal of Fuel Chemistry and Technology, 2009, 37(2): 170-176. DOI:10.3969/j.issn.0253-2409.2009.02.009 |
| [24] |
Han L, Ro K S, Wang Y, et al. Oxidation resistance of biochars as a function of feedstock and pyrolysis condition[J]. Science of the Total Environment, 2017, 616/617: 335-344. |
| [25] |
Bavel B V. Comparison of Fenton's reagent and ozone oxidation of polycyclic aromatic hydrocarbons in aged contaminated soils[J]. Journal of Soils & Sediments, 2006, 6(4): 208-214. |
| [26] |
Singh B, Singh B P, Cowie A L, et al. Characterisation and evaluation of biochars for their application as a soil amendment[J]. Soil Research, 2010, 48(7): 516-525. DOI:10.1071/SR10058 |
| [27] |
徐佳, 刘荣厚. 不同慢速热裂解工艺条件下棉花秸秆生物炭的理化特性分析[J]. 上海交通大学学报(农业科学版), 2017, 35(2): 19-24. XU Jia, LIU Rong-hou. Physicochemical properties of cotton stalk biochar under different slow pyrolysis conditions[J]. Journal of Shanghai Jiaotong University (Agricultural Science), 2017, 35(2): 19-24. DOI:10.3969/J.ISSN.1671-9964.2017.02.004 |
| [28] |
Chen B, Zhou D, Zhu L. Transitional adsorption and partition of nonpolar and polar aromatic contaminants by biochars of pine needles with different pyrolytic temperatures[J]. Environmental Science & Technology, 2008, 42(14): 5137-5143. |
| [29] |
Uchimiya M, Lima I M, Klasson K T, et al. Immobilization of heavy metal ions(CuⅡ, CdⅡ, NiⅡ, and PbⅡ)by broiler litter-derived biochars in water and soil[J]. Journal of Agricultural and Food Chemistry, 2010, 58(9): 5538-5544. DOI:10.1021/jf9044217 |
| [30] |
Chen B, Chen Z. Sorption of naphthalene and 1-naphthol by biochars of orange peels with different pyrolytic temperatures[J]. Chemosphere, 2009, 76(1): 127-133. DOI:10.1016/j.chemosphere.2009.02.004 |
| [31] |
刘朝霞, 牛文娟, 楚合营, 等. 秸秆热解工艺优化与生物炭理化特性分析[J]. 农业工程学报, 2018, 34(5): 196-203. LIU Zhao-xia, NIU Wen-juan, CHU He-ying, et al. Process optimization for straws pyrolysis and analysis of biochar physiochemical properties[J]. Transactions of the Chinese Society of Agricultural Engineering, 2018, 34(5): 196-203. |
| [32] |
朱恂, 李刚, 冯云鹏, 等. 重庆地区7种生物质的成分分析及热重实验[J]. 重庆大学学报(自然科学版), 2006, 29(8): 44-48. ZHU Xun, LI Gang, FENG Yun-peng, et al. Thermogravimetric experiments and component analysis of biomass in Chongqing[J]. Journal of Chongqing University(Natural Science Edition), 2006, 29(8): 44-48. |
| [33] |
Mikutta R, Kleber M, Kaiser K, et al. Review:Organic matter removal from soils using hydrogen peroxide, sodium hypochlorite, and disodium peroxodisulfate[J]. Soil Science Society of America Journal, 2005, 69(1): 120-135. DOI:10.2136/sssaj2005.0120 |
| [34] |
Xiang Q, Lee Y Y. Oxidative cracking of precipitated hardwood lignin by hydrogen peroxide[J]. Applied Biochemistry & Biotechnology, 2000, 84(1-9): 153-162. |
| [35] |
Goldstone J V, Pullin M J, Bertilsson S, et al. Reactions of hydroxyl radical with humic substances:Bleaching, mineralization, and production of bioavailable carbon substrates[J]. Environmental Science & Technology, 2002, 36(3): 364-372. |
| [36] |
傅晓燕, 栾连军, 朱炜, 等. 双氧水降解残留农药效果及对苦参有效成分的影响[J]. 中国中药杂志, 2007, 32(20): 2098-2102. FU Xiao-yan, LUAN Lian-jun, ZHU Wei, et al. Influence of H2O2 on degradation of residual pesticides and constituents in radix sophorae flavescentis[J]. China Journal of Chinese Materia Medica, 2007, 32(20): 2098-2102. DOI:10.3321/j.issn:1001-5302.2007.20.003 |
| [37] |
Jin J, Sun K, Wang Z, et al. Effects of chemical oxidation on phenanthrene sorption by grass- and manure-derived biochars[J]. Science of the Total Environment, 2017, 598: 789-796. DOI:10.1016/j.scitotenv.2017.04.160 |
| [38] |
余伟光, 黎吉辉, 王敦, 等. 香蕉茎秆生物炭的制备及其对铜离子的吸附特性[J]. 化工进展, 2017, 36(4): 1499-1505. YU Wei-guang, LI Ji-hui, WANG Dun, et al. The preparation of biochar from pre-oxidation of banana stem and its adsorption of Cu2+[J]. Chemical Industry and Engineering Progress, 2017, 36(4): 1499-1505. |
| [39] |
许可, 贲伟伟, 强志民. 高锰酸钾氧化降解水中微量有机污染物的研究进展[J]. 环境化学, 2017, 36(1): 16-26. XU Ke, BEN Wei-wei, QIANG Zhi-min. Oxidative degradation of micro-organic pollutants by potassium permanganate in water:A review[J]. Environmental Chemistry, 2017, 36(1): 16-26. |
 2019, Vol. 38
2019, Vol. 38