2. 湖南省湘潭市农业科学研究所, 湖南 湘潭 411134
2. Xiangtan Agricultural Science Research Institute, Xiangtan 411134, China
为了降低土壤污染给农产品质量安全带来的风险,许多发达国家和地区普遍采用土壤污染风险管理思路,对于污染农田一般采用休耕的方式解决。我国耕地资源有限,因此采用了对农用地进行分类管理来保障农业生产环境安全和农产品质量安全的策略。对于生物有效性较低的重金属如铬、铜、镍等,按照《土壤环境质量农用地土壤风险管控标准(试行)》(GB 15618—2018)对耕地质量进行分类,能有效降低农产品的质量安全风险。但对于水溶性强、生物活性较高的重金属镉(Cd),用简单的土壤污染标准无法保障农产品的质量安全。特别是在我国南方降雨频繁、水网复杂的酸性土壤地区,水稻根际土壤中Cd含量受到多种因素的影响,经常处于动态变化之中。因此,在根际土壤总Cd含量不变的盆栽试验中,土壤Cd污染程度总是和稻米中的Cd含量高度正相关[1-2]。但是,在田间自然条件下,土壤Cd污染程度与稻米中的Cd含量没有密切的线性相关,同一田块中生产的稻米,Cd含量在早稻和晚稻之间表现出很大的差异[3-5]。
水稻根茎叶等营养器官的细胞壁中能固定大量的Cd,因而能缓解Cd对水稻正常代谢过程所产生的毒性效应[6-8]。而动物和人体器官中不具备植物细胞壁这样的大分子结构,因此通过食物摄入的Cd优先汇聚到肾脏和肝脏等解毒器官中[9-10]。根据Cd对肾脏的损伤程度,WHO制定了每月每公斤体质量的人体Cd的最大摄入限量为25 μg[11-12]。参照这个标准,世界各国推导出主要食物的Cd限量标准。欧美人均消费的稻米数量较少,所以确定的稻米Cd限制标准为0.4 mg·kg-1,土壤Cd限值一般为0.8~3.5 mg·kg-1[13]。我国南方人均大米食用量为326.65 g·d-1[12],确定的稻米Cd限制标准为0.2 mg·kg-1,南方酸性土壤的Cd污染临界值为0.3~0.4 mg·kg-1、中性土壤为0.6 mg ·kg-1、碱性土壤为0.8 mg·kg-1(GB 15618—2018)。土壤Cd污染程度与稻米Cd污染不一致的现象屡屡发生,但对造成这种现象的原因不甚明了。
耕层土壤是受人类活动干扰最大、干湿交替最频繁的土壤。取样时间、取样位点和方式对耕层土壤Cd含量和氧化还原电位都有极显著的影响,测定值的差异可以高达5倍以上[3, 14-15]。一些农艺措施如施用生石灰和碱性肥料等能改变土壤中Cd的生物有效性,进而影响稻米Cd含量[16-19]。而另一些农艺措施如改变播种方式、喷施叶面肥、喷灌等措施能使稻米Cd含量下降30%以上[20-25]。此外,通过种植低积累品种提高根茎叶对Cd的拦截能力也能降低稻米中的Cd含量[26-28]。显然,许多影响稻米Cd含量的因素并不会对耕层土壤的Cd含量产生影响。因此,单纯依据土壤中的Cd总量进行耕地质量评价,很难保证土壤污染程度与稻米污染程度的一致性。
在自然环境中,海拔高度是影响雨水流向和流速的关键因素,许多水溶性元素也会随着水流而变化[15, 29-30]。因此,本研究选择平原、岗地和丘陵构成的水稻产区,以稻米Cd含量不超标为核心目标,对影响稻米和耕层Cd变化的主要自然因素进行分析,从中筛选能够降低稻米安全风险的可靠指标,为耕地的合理分类提供依据。
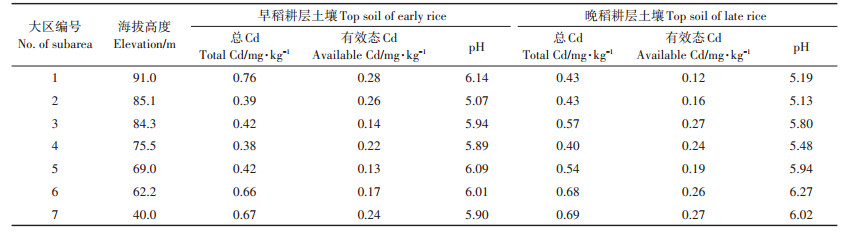
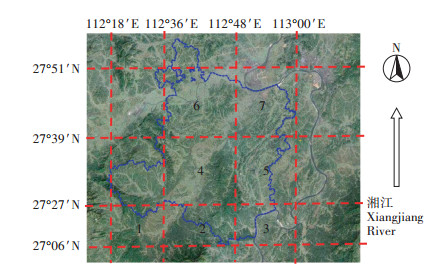
1 材料与方法 1.1 试验材料与取样点设置湘潭县(27°06′~28°05′N,112°18′~113°03′E)位于湖南省中部偏东,湘江下游西岸,地貌轮廓为西北、西南、东南部三面高,中部和东北部低。最高处海拔755.1 m,最低为湘江沿岸,海拔仅33.2 m,相对高差为721.9 m,地势比降为10%,造成平原、岗地、丘陵、山地4种地貌俱备,以平原(39.5%)和岗地(35.2%)为主。县境中部沿涓水、北部沿涟水形成肥沃的河谷平原,东北由湘江、涓水、涟水汇注,形成湘潭盆地,是主要的双季稻生产区。根据地势高度和湘江流向,将湘潭县分成7个大区(图 1),它们的平均海拔高度、耕层土壤Cd含量和pH值如表 1所示。2015年以村镇为基础,在早稻和晚稻成熟期采集水稻植株样品的同时,收集根层(0~20 cm)土壤样品,每个田块取5点混合。共采集到有效早稻样点1160个、晚稻样点1520个。
|
海拔高度从1区到7区依次降低 The elevation decreases from subarea 1 to subarea 7 图 1 湖南省湘潭县地势和取样分区 Figure 1 Topography and sampling area of Xiangtan County Hunan Province |
|
|
表 1 湘潭县7个大区的海拔高度和耕层土壤Cd含量 Table 1 Elevation and Cd content in top soil of 7 subarea in Xiangtan County |
根据2015年样品的检测结果,在图 1的4、5、6、7区域中,2018年选择有代表性的4个乡镇,每个乡镇选50个试验点,分别收获一季稻和晚稻的植株及同田耕层土壤样品。同时,根据每个自然村的地形地貌,在等高线上随机取5~10个田块,每个田块选5~6个点,用土钻分别采集0~20、20~40、40~60 cm的土壤样品,同一田块的分层土样混合,用于测定不同土层中的Cd含量。为了减少根系年龄和粗细度对Cd含量的影响,只收集离茎基部3 cm以内的粗根,用于测定根系的Cd含量;同时,把与最上层根系相连的茎基部(主要是压缩的蘖节)分割出来,用于测定茎基部的Cd含量。
1.2 测定方法按照国家标准(GB/T 17141—1997)规定程序对土样进行消煮:将待测土壤样品自然风干,用四分法将土样磨碎,过100目筛。准确称取0.25 g土样置于消煮管中,加10 mL HNO3+4 mL HF浸泡过夜,之后用消解仪ED 54于120 ℃下加热0.5 h,150 ℃下加热3 h,赶酸后定容,测定土壤Cd总量。另取1.00 g样品,加1.0 mol·L-1的MgCl2 8 mL,在25 ℃下连续振荡1 h,再离心15 min,取出上清液;再向残余物中加水4 mL,离心15 min,取出上清液过滤后定容,测定土壤中的有效态Cd含量。
按照食品安全国家标准(GB 5009.12—2017)规定程序对根系及籽粒进行消煮:准确称取0.3 g根系或0.5 g籽粒于消煮管中,加7 mL HNO3浸泡过夜,用消解仪ED 54于110 ℃下加热1.5 h,待其冷却后加入1 mL H2O2,继续加热2.5 h,赶酸后定容,用于测定Cd含量。
用ICP-MS测定样品中的Cd浓度,再换算成样品中的Cd含量。
1.3 数据分析对土壤和植物样品测定数据完整的早稻、晚稻和一季稻样点,采用Microsoft Excel进行相关数据的计算、统计与作图。新复极差法(Duncan′s)作多重比较和差异显著性检验。
2 结果与分析 2.1 土壤Cd含量对早稻和晚稻Cd含量分布频率的影响土壤中容易被植物利用的有效态Cd约占土壤Cd总量的35.9%,有效态Cd与Cd总量显著正相关(r=0.677,P < 0.01,图 2A)。但有效态Cd在不同土壤样点中的变幅非常大,土壤Cd含量越高,有效态Cd的离散状态越严重。例如,早稻耕层土壤的Cd含量为0.50 mg·kg-1时,有效态Cd的变幅为0.07~0.16 mg· kg-1,当土壤的Cd含量为1.50 mg·kg-1时,有效态Cd的变幅为0.11~1.22 mg·kg-1。如果以土壤Cd含量为依据,按照0.10 mg·kg-1的间距进行分组,各组土壤Cd含量的平均值与对应的有效态Cd的平均值高度线性相关(r=0.952,P < 0.01,图 2B)。平均值掩盖了样本间的离散程度,所以,根据平均值计算的相关系数显著高于样本测定值之间的相关系数。

|
图 2 土壤Cd含量与稻米Cd含量的相关性分析 Figure 2 Relationship between Cd content in soil and that in rice |
土壤Cd含量与早稻的稻米Cd含量(图 2C)和晚稻的稻米Cd含量(图 2D)表现为非线性相关。如果把土壤Cd以0.3 mg·kg-1的间距分成0~0.3、0.3~0.6、0.6~ 0.9、0.9~2.5 mg·kg-1 4组,把稻米Cd以0.2 mg·kg-1的间距分成0~0.2、0.2~0.4、0.4~0.6、0.6~0.8和 > 0.8 mg·kg-1 5组,就会发现,随着土壤Cd含量的增加,早稻稻米Cd < 0.2 mg·kg-1的组分所占的比例为24.2%~29.0%,基本保持在相同水平;0.2~0.4 mg·kg-1的组分所占的比例从41.1%下降到17.9%;0.4~0.6 mg·kg-1的组分所占的比例从22.1%下降到14.1%;而0.6~0.8 mg·kg-1和 > 0.8 mg·kg-1的组分所占的比例大幅度增加(图 2E)。晚稻稻米Cd < 0.2 mg·kg-1的组分所占的比例为27.3%~ 34.4%;0.2~0.4 mg·kg-1的组分所占的比例从30.4%下降到14.2%;0.4~0.6 mg·kg-1的组分和0.6~0.8 mg·kg-1的组分所占的比例分别稳定在14.5%~18.0%和7.0%~ 9.9%的范围内;只有 > 0.8 mg·kg-1的组分所占的比例大幅度增加(图 2F)。当土壤Cd含量相同时,晚稻中高Cd含量的稻米(Cd > 0.8 mg·kg-1)所占的比例明显高于早稻。
对266个田块中的早稻和晚稻样品进行对比,发现当早稻耕层土壤Cd < 0.7 mg·kg-1时,到了晚稻收获季节,同一地点耕层土壤的Cd含量一般会上升0.1~ 0.2 mg·kg-1;当早稻耕层土壤Cd > 0.8 mg·kg-1时,晚稻耕层土壤的Cd含量一般会下降0.1~1.1 mg·kg-1。早稻和晚稻的根际土壤Cd含量之间无显著的线性相关(图 2G),早稻和晚稻的稻米Cd含量之间也无显著的线性相关(图 2H)。在大多数试验点,晚稻Cd含量比早稻高0.1~0.3 mg·kg-1;在晚稻根际土的Cd含量大幅度下降的试验点,晚稻中的Cd含量也大幅度下降。
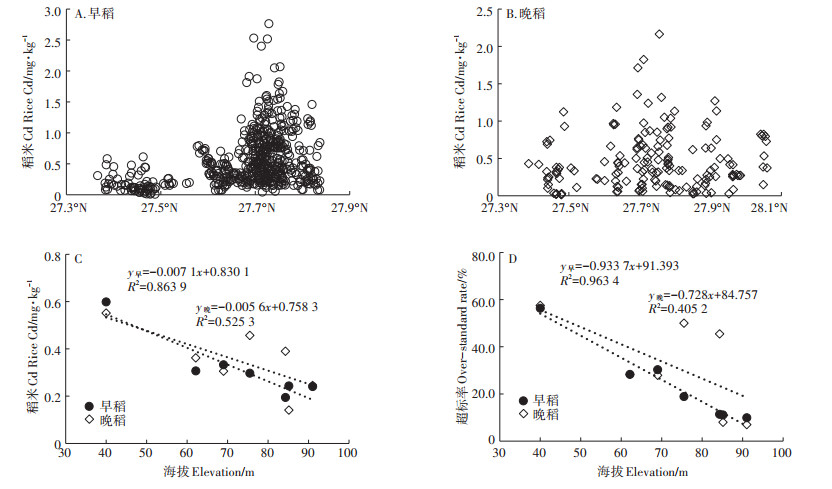
2.2 海拔高度对早稻和晚稻Cd含量的影响湘潭县境中部沿涓水、北部沿涟水形成肥沃的河谷平原,湘江、涓水和涟水在东北部汇注形成的湘潭盆地是主要的双季稻生产区。以经度(112°18′~113° 00′E)和纬度(27°06′~27°51′N)为依据,参照地形地貌和水稻生产面积,把湘潭县的耕地分成7大水稻产区(图 1)。1区(27°06′ ~27°27′ N)受高山的影响,水稻种植面积小,样点数也少。在经度相同(112°36′~ 113°00′E)的其他6大主产区中,随着纬度的北移,早稻稻米中的Cd含量明显上升,特别是临近湘江的湘潭盆地(27°36′ ~27°48′ N),高Cd稻米出现的频率急剧增加(图 3A)。晚稻稻米随纬度增加的趋势更加明显(图 3B)。这7个区域的稻米Cd含量和它们的海拔高度平均值呈明显的负相关,其中早稻的稻米Cd含量与海拔高度的相关系数高达0.929(P < 0.01,图 3C)。随着海拔高度的下降,稻米Cd含量超过0.4 mg·kg-1的样本数明显增加,稻米Cd超标率和海拔高度呈明显的负相关,其中早稻的稻米Cd超标率与海拔高度的线性相关达到1%的极显著水平,r=- 0.982(图 3D)。在平均海拔高度为55 m的湘江沿岸(第7区),早稻和晚稻的稻米Cd超标率分别为56.3%和57.5%。而海拔高度大于85 m的岗地(第1区和第2区),早稻和晚稻的稻米Cd超标率都在11%以内。
|
图 3 海拔高度对早稻和晚稻Cd的影响 Figure 3 Effect of elevation on Cd content in early and late rice |
海拔高度对土壤pH无明显影响(表 1),但对晚稻耕层土壤Cd含量和有效态Cd含量有明显的影响。在高海拔地区(91 m),晚稻耕层土壤中的Cd含量和有效态Cd含量都显著低于早稻,降幅超过50%(图 4)。而在其他地区,晚稻耕层土壤中的Cd含量和有效态Cd含量大多高于早稻。海拔最低的湘潭盆地(平均海拔40 m),早稻和晚稻耕层土壤中有效态Cd含量明显高于相邻的高海拔地区(平均海拔62~76 m)。
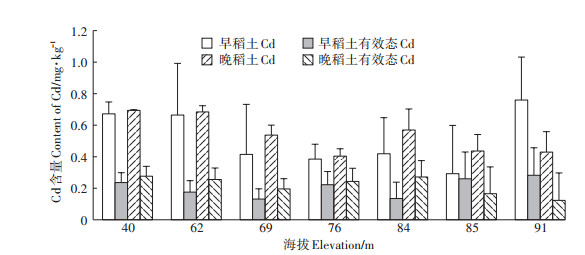
|
图 4 海拔高度对早稻和晚稻耕层土壤总Cd及有效态Cd含量的影响 Figure 4 Effect of elevation on the content of total Cd and available Cd in soil of early and late rice |
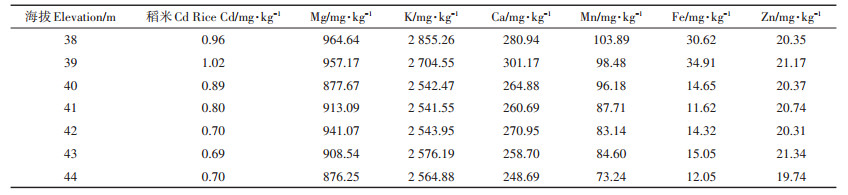
为了验证海拔高度与稻米Cd含量的关系,2018年在湘潭盆地(第7区)内沿等高线对一季稻产区的150个田块进行密集取样,分析结果表明,海拔高度与稻米Cd含量显著负相关(r=0.852,P < 0.05),特别是当海拔高度超过40 m以后,海拔每升高1 m,稻米Cd含量约下降0.1 mg·kg-1。在检测的6个必需元素中,Mg、K、Zn的含量几乎不受海拔高度的影响,但Ca、Mn、Fe的含量都随着海拔的升高而下降。其中海拔高度与稻米Mn含量的负相关达到极显著水平(r=-0.973,P < 0.01),见表 2。
|
|
表 2 海拔高度对稻米Cd及营养元素含量的影响 Table 2 Effect of elevation on the content of Cd and nutrients in rice |
海拔高度对土壤Cd含量的影响因土层深度的变化而变化。对39个晚稻田块的土壤进行分层取样分析,发现海拔高度与深层土壤(40~60 cm)的Cd含量显著负相关(r =0.684,P < 0.05),特别是当海拔低于40 m时,深层土壤中的Cd含量随着海拔的下降急剧升高(图 5A)。在海拔高于40 m的稻田中,深层土壤中的Cd含量比较稳定,一般为0.15~0.25 mg·kg-1。中层土壤(20~40 cm)中的Cd含量主要受深层土壤Cd含量的影响,二者之间的线性相关达到1%的极显著水平,r=0.830(图 5B)。耕层土壤(0~20 cm)中的Cd含量随着海拔的升高也呈现下降趋势,但Cd含量的波动比较大。特别是在海拔低于50 m的一些稻田中,耕层土壤的Cd含量比深层土壤的Cd含量高2~5倍。表层土壤Cd含量较高的试验点,中层土壤的Cd含量也较高。说明农艺措施或大气沉降等因素对耕层土壤的Cd积累有显著影响。
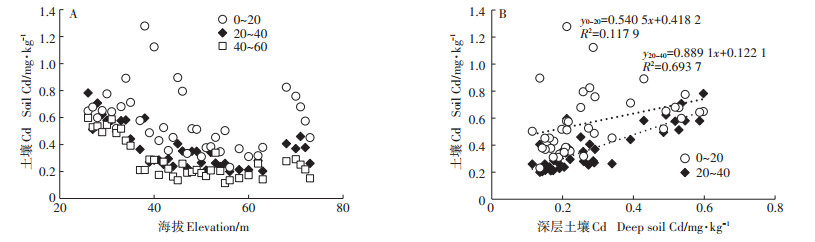
|
图 5 海拔高度和土层深度对耕层土壤Cd含量的影响 Figure 5 Influence of elevation and soil depth on the Cd content of top soil |
耕层土壤中的Cd和其他营养元素一起,通过自由空间的扩散和根系细胞膜的主动吸收,进入到根系维管束中,进而向地上部转运。与水稻根系相连的茎秆基部是叶片、分蘖和新根共生的主要部位,茎秆基部蘖节的Cd含量直接决定着上部营养器官和稻谷中的Cd含量。对165个晚稻样品进行分析的结果表明,土壤Cd与根系Cd和茎基部的Cd含量没有密切的线性相关(图 6A和图 6B)。但根系和茎基部的Cd含量与稻谷中的Cd显著正相关(图 6C和图 6D)。
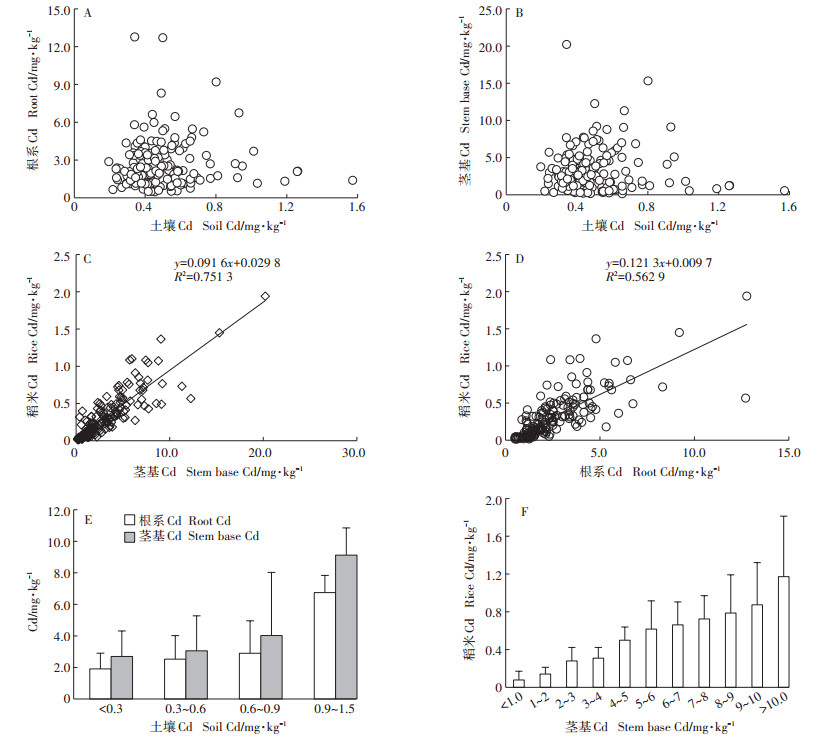
|
图 6 耕层土壤Cd含量对根茎Cd含量的影响 Figure 6 Influence of Cd content in surface soil on the Cd content in roots and stem base parts |
按照耕层土壤Cd含量,把土壤分成不同的组别,再分析各组内根系和茎基Cd含量的平均值,结果发现,当土壤Cd含量在0.9 mg·kg-1以内时,随着土壤Cd含量的增加,根系和茎基Cd含量呈现缓慢增长的趋势;当土壤Cd含量超过0.9 mg·kg-1以后,根系和茎基Cd含量急剧增加。在土壤Cd含量相同的情况下,茎基的Cd含量明显高于根系,不同样本间茎基Cd含量的标准误差明显小于根系(图 6E)。按照茎基Cd含量1.0 mg·kg-1的间距对样本进行分组,发现当茎基Cd < 4.0 mg·kg-1时,稻谷Cd含量几乎都在0.4 mg·kg-1以下;当茎基Cd > 9.0 mg·kg-1时,稻谷Cd含量几乎都在0.8 mg·kg-1以上(图 6F)。
3 讨论 3.1 影响耕层土壤Cd含量波动的主要因素2014年以来,原农业部和财政部启动了“湖南长株潭地区重金属污染耕地修复及农作物种植结构调整试点”专项,对农田重金属污染治理工作开展联合攻关和协同创新。随着大量田间试验的展开,人们发现,农田耕层土壤中的Cd含量与稻米Cd含量的相关程度并不高[3-5],大气沉降、有机肥等农业投入品成为耕层土壤Cd污染的主要来源[31-32],这给以土壤Cd污染程度为依据划分水稻安全生产区的策略提出了新的挑战。为此,本研究以村镇为基础,在县域范围内进行密集布点,对耕层土壤和稻谷Cd含量分季节进行分析和比对,发现深层土壤(40~60 cm)和中层土壤(20~40 cm)的Cd含量呈高度正相关,Cd含量在不同点位间和相邻乡镇间的差异都很小。但受中层和深层土壤Cd含量、水稻生长季节、纬度和海拔高度以及其他农事活动的影响,耕层土壤的Cd含量波动很大。中层和深层土壤的Cd含量反映了成土母质中Cd的本底值,生长季节、纬度和海拔高度可能都是通过影响稻田淹水时间,影响了耕层土壤的Cd含量和生物活性。在高海拔地区(平均海拔91 m),经过夏季雨水的淋洗,晚稻耕层土壤中的Cd含量和有效态Cd含量比早稻耕层土下降了50%。水流向低海拔地区汇聚的同时,把水溶性Cd也带到了稻田中,致使低海拔地区耕层土壤中有效态Cd含量明显高于相邻的高海拔地区。
3.2 影响稻米Cd含量的关键因素土壤Cd污染是引起稻米Cd污染的重要因素,但不是唯一的决定性因素。在长期的自然进化过程中,水稻的根茎叶组织进化出识别必需元素和有害元素的特殊功能,能够把大量的Cd固定在营养器官中[6],水稻根系和穗下节分别将80%以上和75%以上的Cd转化为难溶态[7],从而限制了Cd从茎叶向稻米中的迁移。本研究发现,土壤的总Cd含量、有效态Cd含量和稻米Cd含量之间没有密切的线性相关,而是呈离散分布状态;同一地点晚稻和早稻的稻米Cd含量之间也没有显著的线性相关。相反,海拔高度与稻米中的Cd含量以及Ca、Mn、Fe的含量表现出显著的负相关。参照《土壤环境质量农用地土壤风险管控标准(试行)》(GB 15618—2018)中的二级评价标准,按照Cd含量把耕层土壤分成不同的组别,发现在清洁、轻度、中度和重度污染土壤中,稻米Cd含量小于0.2 mg·kg-1的合格稻米所占的比例稳定在24.5%~34.4%之间,不因土壤污染程度的变化而波动;但随着土壤Cd污染的加重,稻米Cd含量介于0.2~0.4 mg·kg-1的组分所占的比例急剧下降,高Cd稻米(Cd > 0.8 mg· kg-1)所占的比例急剧增加(图 2)。所以,以土壤污染程度为依据划分轻度污染、中度污染和重度污染区的方法,并不能保证安全区生产出Cd含量低于0.2 mg· kg-1的稻米,但却使这些区域中能够生产合格稻米的农田失去了发挥生产作用的机会。
土壤中的Cd能否进入水稻根系,不仅受Cd离子浓度的影响,还受其他金属离子浓度和电化学平衡系统的影响[33-35]。只有土壤中的Cd进入根系细胞以后,才成为具有生物活性的Cd。根系细胞中的Cd汇聚到维管束中,首先遇到蘖节的拦截和筛选,经过11~ 16节地上茎叶的层层拦截,只有极少数的Cd通过穗轴进入到稻米中[6]。本研究发现,根系和基部茎节(以蘖节为主)的Cd含量是稻米Cd含量的8.2~10.9倍,它们之间表现出高度的线性相关,稻米与茎基部Cd含量的相关系数更高。说明通过根系和蘖节筛查的Cd离子,会按照相对固定的比例转运到稻米中。因此,只有提高根系和茎基部的拦截能力,才能有效控制稻米中的Cd含量,而控制土壤中的Cd含量,只能有效降低高Cd稻米所占的比例,对提高稻米合格率的作用并不大。
3.3 以根茎Cd含量为依据进行水稻安全生产区划的可行性为了降低土壤污染给农产品质量安全带来的风险,我国先后颁发了《土壤环境质量标准》《农用地分等定级规程》《食用农产品产地环境质量评价标准》等技术标准,试图通过对耕地质量进行分类来降低农产品的质量安全风险。考虑到土壤重金属污染与农产品重金属污染程度的不一致性,2018年颁布实施的《土壤环境质量农用地土壤风险管控标准(试行)》(GB 15618—2018)中,在界定土壤Cd污染风险筛选值的基础上,又设置了土壤Cd污染风险管控值,二者之间相差5倍。对于土壤Cd污染值介于风险值和管控值之间的农田如何管理?早稻和晚稻的耕层土壤Cd含量和稻米Cd含量差异很大,划分安全生产区时应以早稻为依据还是以晚稻为依据?如何排除海拔高度、土壤环境质量、作物类型、生态环境等因素对安全生产区划分的干扰?这些问题都缺乏有效的数据支撑。本研究发现,中层和深层土壤(20~60 cm)的Cd含量在相邻乡镇和不同季节都比较稳定,而耕层土壤(0~20 cm)的Cd含量受多种因素的影响,是一个波动性很大的变量。耕层土壤中的Cd既可以进行上下方向的垂直移动,也可以通过径流进行横向移动,要直接监控它们的动态变化比较困难,但水稻根系中的Cd积累量能间接反映耕层土壤有效态Cd的变化。
植物根系是吸收水分和各种离子、保持植物养分平衡的第一道屏障,主要通过细胞壁间隙构成的质外体(即自由空间)、胞间连丝构成的共质体途径来完成吸收过程[36-38]。Cd2+和许多金属离子如K+、Ca2+、Mn2+、Zn2+等进入根系的过程非常相似,都符合MichaelisMenten方程[39-40],说明通过根系内的自由空间以及细胞膜上的非选择性阳离子通道进行的扩散运动是离子进入根系细胞的主要方式。根系内皮层细胞上形成的凯氏带虽然能有效抑制水分和溶质通过自由扩散进入维管束,但根冠区、分生区和伸长区的内皮层细胞并未形成完善的凯氏带[41]。因此,根系中的Cd积累主要取决于被动吸收过程,受根际环境中Cd离子浓度和蒸腾拉力的影响较大,受品种间主动运输差异的影响较小。与水稻根系相连的茎秆基部,有7~ 13个节间不伸长的蘖节,是长分蘖和新根的主要部位。叶、分蘖及根的输导组织都在茎基部的蘖节内会合,对光合产物、营养元素、有害元素等各种成分进行再分配。本研究发现,当土壤Cd含量为0.19~1.60 mg·kg-1时,绝大多数根系和茎基部的Cd含量分别在6.0 mg·kg-1和10.0 mg·kg-1以下,对应的稻米Cd含量在1.1 mg·kg-1以下。根系的再生能力强,在水稻生长过程中,不断地有新根发育,老根中的Cd含量明显高于新根。取样时只收集离茎基部3 cm以内的粗根,可以有效减少根系的取样误差。和根系相比,茎基部易于采样和分割,且Cd浓度高、取样误差小。水稻根系和茎基部的Cd含量反映了水稻整个生长发育过程中Cd的吸收累积状态,能更客观全面地反映水稻根际环境中Cd的活性状态。当茎基部的Cd含量小于4.0 mg·kg-1时,稻米Cd含量超过0.4 mg·kg-1的样品只占8.85%。以根系或茎基部的Cd含量为依据进行分类,能保证稻米Cd含量的合格率达到90%以上。
4 结论(1)耕层土壤的Cd含量容易受海拔高度、水稻生长季节和深层土壤Cd含量的影响,低海拔地区的土壤Cd含量显著高于高海拔地区,耕层土壤Cd含量(0.22~1.78 mg·kg-1)显著高于深层土壤(0.11~0.60 mg·kg-1)。以耕层土壤Cd含量为依据对水稻产区进行分类,不能有效控制稻米Cd超标风险。
(2)耕层土壤Cd总量和有效态Cd含量高度线性相关,但对低Cd稻米(Cd≤0.2 mg·kg-1)的分布频率没有显著影响。随着土壤Cd含量的增加,中Cd稻米(0.2 mg·kg-1 < Cd≤0.4 mg·kg-1)的分布频率显著下降,高Cd稻米(Cd > 0.8 mg·kg-1)的发生率显著增加,导致稻米的超标风险急剧增加。
(3)在海拔高度为26~90 m的平原和岗地,稻米Cd含量和产地的海拔高度显著负相关,其中早稻Cd含量与海拔高度的相关系数高达-0.929(P < 0.01);低海拔地区耕层土壤中的有效态Cd含量明显高于相邻的高海拔地区。
(4)根系和茎基部的Cd含量与稻米的Cd含量显著正相关,当茎基Cd含量小于4.0 mg·kg-1时,稻米Cd超过0.4 mg·kg-1的样点数为8.8%,稻米Cd平均值为0.2 mg·kg-1。当茎基Cd含量大于9.0 mg·kg-1时,稻米Cd含量几乎都在0.8 mg·kg-1以上。以茎基Cd含量为依据进行稻田分类,能有效降低稻米Cd超标的风险。
| [1] |
居学海, 张长波, 宋正国, 等. 水稻籽粒发育过程中各器官镉积累量的变化及其与基因型和土壤镉水平的关系[J]. 植物生理学报, 2014, 50(5): 634-640. JU Xue-hai, ZHANG Chang-bo, SONG Zheng-guo, et al. Changes in cadmium accumulation in rice organs during grain development and their relationship with genotype and cadmium levels in soil[J]. Plant Physiology Journal, 2014, 50(5): 634-640. |
| [2] |
易亚科, 周志波, 陈光辉. 土壤酸碱度对水稻生长及稻米镉含量的影响[J]. 农业环境科学学报, 2017, 36(3): 428-436. YI Ya-ke, ZHOU Zhi-bo, CHEN Guang-hui. Effects of soil pH on growth and grain cadmium content in rice[J]. Journal of Agro-Environment Science, 2017, 36(3): 428-436. |
| [3] |
Liu Y, Zhang C, Zhao Y, et al. Effects of growing seasons and genotypes on the accumulation of cadmium and mineral nutrients in rice grown in cadmium contaminated soil[J]. Science of the Total Environment, 2017, 579: 1282-1288. DOI:10.1016/j.scitotenv.2016.11.115 |
| [4] |
Du Y, Hu X F, Wu X H, et al. Affects of mining activities on Cd pollution to the paddy soils and rice grain in Hunan Province, central south China[J]. Environ Monit Assess, 2013, 185: 9843-9856. DOI:10.1007/s10661-013-3296-y |
| [5] |
彭华, 戴金鹏, 纪雄辉, 等. 稻田土壤与稻米中的镉含量关系初探[J]. 湖南农业科学, 2013(7): 68-72. PENG Hua, DAI Jin-peng, JI Xiong-hui, et al. Correlation between cadmium content in paddy soil and in rice[J]. Hunan Agricultural Sciences, 2013(7): 68-72. DOI:10.3969/j.issn.1006-060X.2013.07.020 |
| [6] |
刘仲齐, 张长波, 黄永春. 水稻各器官镉阻控功能的研究进展[J]. 农业环境科学学报, 2019, 38(4): 721-727. LIU Zhong-qi, ZHANG Chang-bo, HUANG Yong-chun. Research advance on the functions of rice organs in cadmium inhibition:A review[J]. Journal of Agro-Environment Science, 2019, 38(4): 721-727. |
| [7] |
Xue W, Zhang C, Wang P, et al. Rice vegetative organs alleviate cadmium toxicity by altering the chemical forms of cadmium and increasing the ratio of calcium to manganese[J]. Ecotoxicology and Environmental Safety, 2019, 184: 109640. DOI:10.1016/j.ecoenv.2019.109640 |
| [8] |
Ma J, Zhang X, Wang L. Synergistic effects between[Si-hemicellulose matrix] ligands and Zn ions in inhibiting Cd ion uptake in rice(Oryza sativa)cells[J]. Planta, 2017, 245(5): 965-976. DOI:10.1007/s00425-017-2655-2 |
| [9] |
Järup L, Åkesson A. Current status of cadmium as an environmental health problem[J]. Toxicology and Applied Pharmacology, 2009, 238(3): 201-208. DOI:10.1016/j.taap.2009.04.020 |
| [10] |
Zhao D, Juhasz A L, Luo J, et al. Mineral dietary supplement to decrease cadmium relative bioavailability in rice based on a mouse bioassay[J]. Environ Sci Technol, 2017, 51: 12123-12130. DOI:10.1021/acs.est.7b02993 |
| [11] |
World Health Organization(WHO). Joint FAO/WHO Expert committee on food Additives[S]. Seventy-third Meeting, Geneva. Summary and Conclusions. ECFA/73/SC. Food and Agriculture Organization of the United Nations, WHO, Geneva, 2010.
|
| [12] |
Yuan X, Wang J, Shang Y, et al. Health risk assessment of cadmium via dietary intake by adults in China[J]. J Sci Food Agric, 2014, 94(2): 373-380. DOI:10.1002/jsfa.6394 |
| [13] |
赵晓军, 陆泗进, 许人骥, 等. 土壤重金属镉标准值差异比较研究与建议[J]. 环境科学, 2014, 35(4): 1491-1497. ZHAO Xiao-jun, LU Si-jin, XU Ren-ji, et al. Soil heavy-metal cadmium standard limit and range of background value research[J]. Environmental Science, 2014, 35(4): 1491-1497. |
| [14] |
Sunjog K, Kolarević S, Kračun-Kolarević M, et al. Seasonal variation in metal concentration in various tissues of the European chub(Squalius cephalus L.)[J]. Environmental Science and Pollution Research, 2019, 26: 9232-9243. DOI:10.1007/s11356-019-04274-3 |
| [15] |
Yang F, An F, Ma H, et al. Variations on soil salinity and sodicity and its driving factors analysis under microtopography in different hydrological conditions[J]. Water, 2016, 8(6): 227. DOI:10.3390/w8060227 |
| [16] |
Lee H H, Owens V N, Park S, et al. Adsorption and precipitation of cadmium affected by chemical form and addition rate of phosphate in soils having different levels of cadmium[J]. Chemosphere, 2018, 206: 369-375. DOI:10.1016/j.chemosphere.2018.04.176 |
| [17] |
Wu Y, Zhou H, Zou Z, et al. A three-year in-situ study on the persistence of a combined amendment(limestone+sepiolite)for remedying paddy soil polluted with heavy metals[J]. Ecotoxicology and Environmental Safety, 2016, 130: 163-170. DOI:10.1016/j.ecoenv.2016.04.018 |
| [18] |
Zhao Y, Zhang C, Wang C, et al. Increasing phosphate inhibits cadmium uptake in plants and promotes synthesis of amino acids in grains of rice[J]. Environmental Pollution, 2020, 257: 113496. DOI:10.1016/j.envpol.2019.113496 |
| [19] |
张庆沛, 李冰, 王昌全, 等. 秸秆还田配施无机改良剂对稻田土壤镉赋存形态及生物有效性的影响[J]. 农业环境科学学报, 2016, 35(12): 2345-2352. ZHANG Qing-pei, LI Bing, WANG Chang-quan, et al. Effects of combined application of straw and inorganic amendments on cadmium speciation and bioavailability in paddy soil[J]. Journal of Agro-Environment Science, 2016, 35(12): 2345-2352. DOI:10.11654/jaes.2016-0553 |
| [20] |
韩潇潇, 任兴华, 王培培, 等. 叶面喷施锌离子对水稻各器官镉积累特性的影响[J]. 农业环境科学学报, 2019, 38(8): 1809-1817. HAN Xiao-xiao, REN Xing-hua, WANG Pei-pei, et al. Effects of foliar application with zinc on the characteristics of cadmium accumulation in organs of rice plants[J]. Journal of Agro-Environment Science, 2019, 38(8): 1809-1817. |
| [21] |
张烁, 陆仲烟, 唐琦, 等. 水稻叶面调理剂的降Cd效果及其对营养元素转运的影响[J]. 农业环境科学学报, 2018, 37(11): 2507-2513. ZHANG Shuo, LU Zhong-yan, TANG Qi, et al. Effects of foliar modulators on cadmium accumulation and transport of nutrient elements in rice[J]. Journal of Agro-Environment Science, 2018, 37(11): 2507-2513. DOI:10.11654/jaes.2018-0864 |
| [22] |
杨晓荣, 黄永春, 刘仲齐, 等. 叶面喷施二巯基丁二酸对晚稻籽粒镉及矿质元素含量的影响[J]. 农业环境科学学报, 2019, 38(8): 1802-1808. YANG Xiao-rong, HUANG Yong-chun, LIU Zhong-qi, et al. Foliar application of DMSA:Effects on Cd and other mineral elements in rice grains[J]. Journal of Agro-Environment Science, 2019, 38(8): 1802-1808. |
| [23] |
Chen R, Zhang C, Zhao Y, et al. Foliar application with nano-silicon reduced cadmium accumulation in grains by inhibiting cadmium translocation in rice plants[J]. Environ Sci Pollut Res, 2018, 25: 2361-2368. DOI:10.1007/s11356-017-0681-z |
| [24] |
Deng X, Yang Y, Zeng H, et al. Variations in iron plaque, root morphology and metal bioavailability response to seedling establishment methods and their impacts on Cd and Pb accumulation and translocation in rice(Oryza sativa L.)[J]. Journal of Hazardous Materials, 2020, 384: 121343. DOI:10.1016/j.jhazmat.2019.121343 |
| [25] |
Spanu A, Valente M, Langasco I, et al. Sprinkler irrigation is effective in reducing cadmium concentration in rice(Oryza sativa L.)grain:A new twist on an old tale?[J]. Science of the Total Environment, 2018, 628/629: 1567-1581. DOI:10.1016/j.scitotenv.2018.02.157 |
| [26] |
Tang L, Mao B, Li Y, et al. Knockout of OsNramp5 using the CRISPR/Cas9 system produces low Cd-accumulating indica rice without compromising yield[J]. Sci Rep, 2017, 7: 14438. DOI:10.1038/s41598-017-14832-9 |
| [27] |
Yuan K, Wang C, Zhang C, et al. Rice grains alleviate cadmium toxicity by expending glutamate and increasing manganese in the cadmium contaminated farmland[J]. Environmental Pollution, 2020, 262: 114236. DOI:10.1016/j.envpol.2020.114236 |
| [28] |
Zhang H, Zhang X, Li T, et al. Variation of cadmium uptake, translocation among rice lines and detecting for potential cadmium-safe cultivars[J]. Environ Earth Sci, 2014, 71: 277-286. DOI:10.1007/s12665-013-2431-y |
| [29] |
Zhang Q, Chen H F, Huang D Y, et al. Water managements limit heavy metal accumulation in rice:Dual effects of iron-plaque formation and microbial communities[J]. Science of the Total Environment, 2019, 687: 790-799. DOI:10.1016/j.scitotenv.2019.06.044 |
| [30] |
Shimojima E, Tamagawa I, Horiuchi M, et al. Observation of water and solute movement in a saline, bare soil, groundwater seepage area, Western Australia. Part 2. Annual water and solute balances[J]. Soil Research, 2016, 54(1): 78-93. |
| [31] |
Cai L, Wang Q, Wen H, et al. Heavy metals in agricultural soils from a typical township in Guangdong Province, China:Occurrences and spatial distribution[J]. Ecotoxicology and Environmental Safety, 2019, 168: 184-191. DOI:10.1016/j.ecoenv.2018.10.092 |
| [32] |
Peng H, Chen Y, Weng L, et al. Comparisons of heavy metal input inventory in agricultural soils in north and south China:A review[J]. Science of the Total Environment, 2019, 660: 776-786. DOI:10.1016/j.scitotenv.2019.01.066 |
| [33] |
Sarwar N, Saifullah, Malhi S S, et al. Role of mineral nutrition in minimizing cadmium accumulation by plants[J]. J Sci Food Agric, 2010, 90(6): 925-937. |
| [34] |
Shahid M, Shukla A K, Bhattacharyya P, et al. Micronutrients(Fe, Mn, Zn and Cu)balance under long-term application of fertilizer and manure in a tropical rice-rice system[J]. J Soils Sediments, 2016, 16(3): 737-747. DOI:10.1007/s11368-015-1272-6 |
| [35] |
Sterckeman T, Redjala T, Morel J L. Influence of exposure solution composition and of plant cadmium content on root cadmium shortterm uptake[J]. Environmental and Experimental Botany, 2011, 74: 131-139. DOI:10.1016/j.envexpbot.2011.05.010 |
| [36] |
Barberon M, Geldner N. Radial transport of nutrients:The plant root as a polarized epithelium[J]. Plant Physiol, 2014, 166(2): 528-537. DOI:10.1104/pp.114.246124 |
| [37] |
Benitez-Alfonso Y. Symplastic intercellular transport from a developmental perspective[J]. J Exp Bot, 2014, 65(7): 1857-1863. DOI:10.1093/jxb/eru067 |
| [38] |
Zelazny E, Vert G. Plant nutrition:Root transporters on the move[J]. Plant Physiol, 2014, 166(2): 500-508. DOI:10.1104/pp.114.244475 |
| [39] |
Degryse F, Shahbazi A, Verheyen L, et al. Diffusion limitations in root uptake of cadmium and zinc, but not nickel, and resulting bias in the Michaelis constant[J]. Plant Physiol, 2012, 160(2): 1097-1109. DOI:10.1104/pp.112.202200 |
| [40] |
Zhao Y, Zhang S, Wen N, et al. Modeling uptake of cadmium from solution outside of root to cell wall of shoot in rice seedling[J]. Plant Growth Regulation, 2017, 82: 11-20. DOI:10.1007/s10725-016-0233-4 |
| [41] |
Robbins N E, Trontin C, Duan L, et al. Beyond the barrier:Communication in the root through the endodermis[J]. Plant Physiol, 2014, 166(2): 551-559. DOI:10.1104/pp.114.244871 |
 2020, Vol. 39
2020, Vol. 39